博文
肝脏昼夜节律驱动的进食行为  精选
精选
|
肝迷走神经介导了昼夜节律紊乱对小鼠摄食量的影响
所有生命王国中都进化出了时间机制,以预测光环境的日常变化并优化营养获取的机会。在哺乳动物中,位于下丘脑视交叉上核的中央昼夜节律钟与外部光线同步。然而,身体中的其他细胞、组织和器官也有它们自己的昼夜节律钟。例如,肝脏有一个分子钟,它可以通过喂食-禁食周期来调整。光调节的视交叉上核与食物调节的肝脏之间的不同步会带来不利的健康后果,包括心血管疾病或2型糖尿病的风险增加;然而,这些时钟如何变得不同步仍然未知。在本刊第673页,Woodie等人报告了一种从肝脏到大脑的神经连接,它传递不同步信号,驱动进食行为、体重维持和能量代谢的改变。这揭示了一个潜在的治疗靶点,以减轻昼夜节律紊乱的代谢影响。
哺乳动物的昼夜节律由启动转录-翻译反馈循环的线索设定,涉及激活因子[如BMAL1(基本螺旋-环-螺旋ARNT样蛋白1)]和抑制因子[如REV-ERBs(逆转c-erbAa)]。成年小鼠肝细胞中核心钟组件REV-ERBα和REV-ERBβ的缺失会破坏基因表达和肝功能的昼夜变化(2)。然而,这些核心钟组件的缺失如何影响肝脏和大脑之间的不同步尚不清楚。为了研究这种关系,Woodie等人在小鼠肝细胞中删除了REV-ERBα和REV-ERBβ。这导致了在一个仍然保持光同步的有节律的动物体内的无节律肝脏。具有无节律肝脏的动物在整个白天(夜间活动小鼠的休息期)以及整个24小时内吃得更多(见图)。食物摄入受一个复杂的中枢神经系统调控,主要涉及位于大脑基部的下丘脑中心。特别是下丘脑弓状核,它在控制食物摄入方面起着关键作用(3)。事实上,在肝脏细胞中缺乏REV-ERBα和REV-ERBβ的小鼠中,下丘脑弓状核的昼夜节律组织被破坏,证实了这个重要的进食中心的节律性活动需要一个有节律的肝脏。
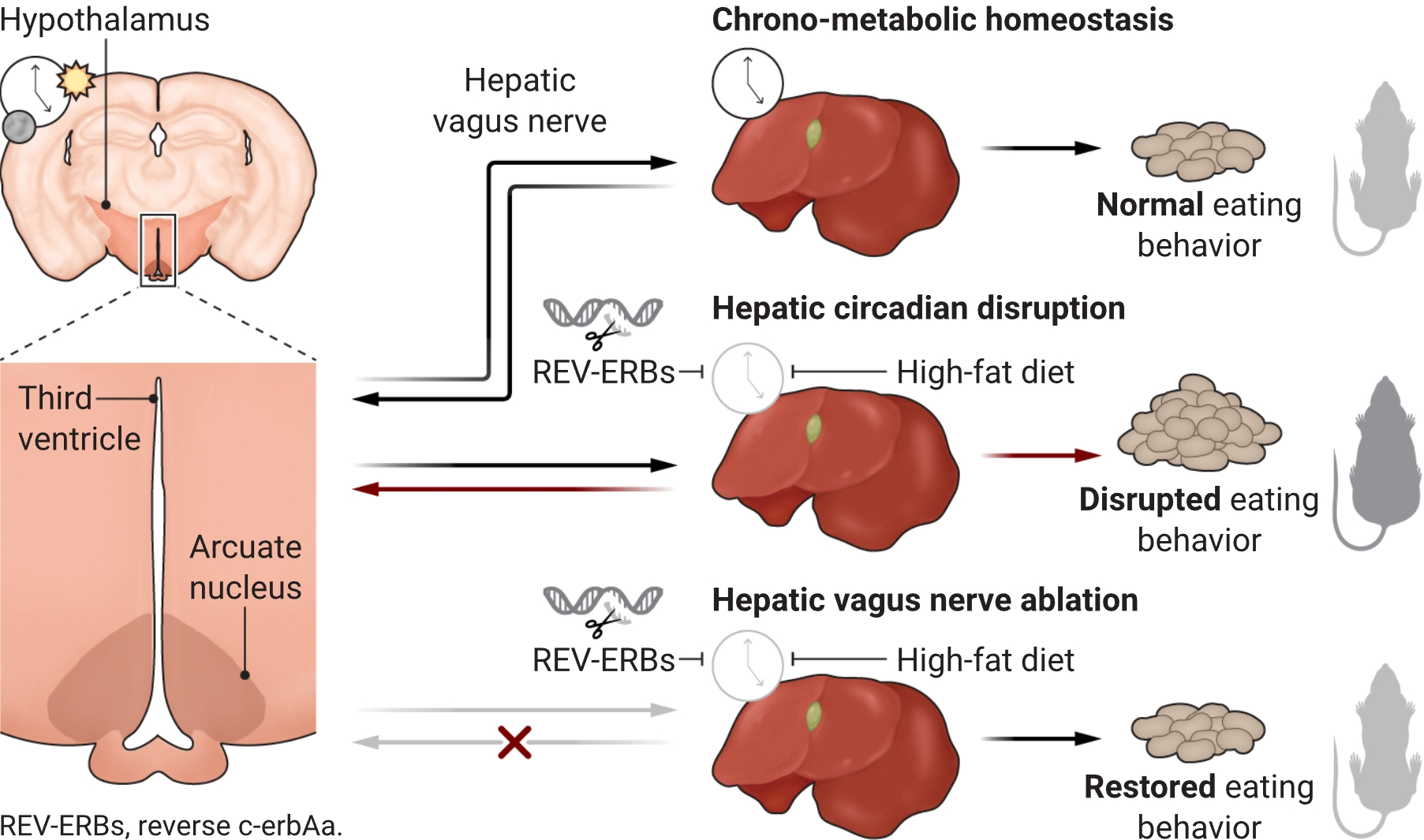
肝脏昼夜振荡编程进食行为
通过遗传或高脂饮食诱导的肥胖破坏肝脏昼夜振荡器,扰乱了弓状脑喂食中心的节律,并导致肥胖。切断来自肝脏的迷走传入纤维恢复进食行为并防止肥胖。
中央代谢电路受众多内分泌和神经输入的调控。迷走神经的公共肝支是一个双向通信高速公路,介于大脑和肝脏之间,调节许多食物摄入和代谢方面。该区域的纤维将有关肝脏功能的信息传输到大脑(4)。为了确定向弓状核传导节律数据的途径,Woodie等人切断了具有破坏性肝脏昼夜钟的小鼠的肝迷走神经分支。断开肝脏与迷走神经的联系挽救了过度进食(贪吃)表型,意味着失调的肝脏通过迷走神经主动干扰弓状核。REV-ERBs在肝脏中调节广泛的目标基因范围,除了维持昼夜振荡外。因此,测试了BMAL1昼夜钟基因,其在小鼠肝脏中的删除也破坏了日常食物摄入。
外科切断肝迷走神经分支中断了双向通信——从肝脏到大脑以及相反方向。为了专门评估传入纤维的作用,Woodie等人采用了选择性神经元消融方法(一种Cre依赖性caspase病毒)在下鼻甲神经节,这是传入迷走细胞体的中心。这种干预保留了来自大脑的传出信号,阻止了由于肝脏时钟破坏导致的过度进食和肥胖表型。这一发现支持了假说,即传入迷走信号是失调肝脏时钟的关键中介。这也强调了肝脏-大脑轴的重要性,该轴需要完整的肝迷走神经,这一途径已被证明在控制诸如葡萄糖稳态等代谢功能方面至关重要(5,6)。
人类肥胖的增加及其伴随的心血管代谢疾病负担与高度可口的食物的可用性以及由于现代生活方式和环境因素(包括日常生活中不合时宜的照明增加)导致的睡眠模式和昼夜节律的破坏有关。高脂饮食和饮食诱导的肥胖破坏了肝脏时钟和日常进食行为的节律(7,8)。营养素对细胞钟有强大而迅速的影响,甚至在达到肥胖之前(9)。Woodie等人用高脂饮食挑战正常小鼠以破坏肝脏时钟。如预期的那样,这种饮食增加了体重,打乱了喂食的节奏分布(在休息期间摄入更多卡路里),并改变了肝脏钟基因的表达。值得注意的是,横切肝迷走神经分支减少了卡路里摄入量至动物活跃期间观察到的水平,减少了总体卡路里摄入量,并防止了肥胖的发展。这项干预为实验观察到的时间限制喂食在小鼠中以及时间限制进食在人群中的有益效果提供了机制解释(10)。
值得注意的是,高脂饮食下的小鼠食物摄入模式类似于肝脏时钟破坏的动物所见的模式。饮食诱导的肥胖导致肝脏昼夜节律的破坏,表明作用机制的趋同。注意力集中在通过使用食物定时或昼夜幅度增强来恢复肝脏的节律性,这两者都可以预防肥胖和心血管代谢疾病。Woodie等人发现的暗示是,昼夜节律紊乱的肝脏向弓状核发送信号,驱动无序的进食,这一回路解释了普遍的人类昼夜节律和睡眠干扰(如轮班工作)所见到的肥胖现象。识别这一途径打开了逆转人类肥胖流行病的机会。此类干预措施包括新的营养、手术和药理策略。迷走神经已成为管理体重的治疗靶标(11,12)。然而,神经调节方法,如植入式电刺激器,效果不一,长期后果值得商榷。此外,手术方法
https://blog.sciencenet.cn/blog-41174-1459353.html
上一篇:干燥综合征患者氢疗案例【台湾】
下一篇:无药可用,早诊断何用?