博文
氢负离子固态电解质高容量可逆储氢
||
将氢气以固态形式储存,有助于规避高压气罐带来的安全隐患。然而,由于缺乏可在低温下工作的高性能材料,该方法的广泛应用受到了限制。广濑(Hirose)等人研究了氢负离子介导的电化学储氢,并从钡-钙-钠氢化物伪三元体系中发现了一种极具潜力的氢负离子传导固态电解质(参见奥黑尔(O’Hayre)与海尔(Haile)撰写的《展望》文章)。这种电解质具备出色的电化学稳定性,能与多种金属氢化物电极灵活匹配;而使用该电解质和氢化镁电极构建的镁-氢电池,在相对较低的90°C温度下,展现出2030毫安时/克的高可逆容量。——杰克·黄(Jack Huang)
High-capacity, reversible hydrogen storage using H–-conducting solid electrolytes | Science
摘要
固体中的氢吸附与脱附是电池和储氢器件中的关键反应。然而,传统基于高容量材料的热力学储氢与电化学储氢,面临着氢脱附温度高、电解质不稳定等问题。本研究探索了氢负离子(H⁻)驱动的电化学储氢,并开发出一种反α-AgI型固态电解质(钡-钙-钠)Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅,该电解质具有优异的氢负离子导电性和电化学稳定性。此电解质可与氢化钛、氢化镁(MgH₂)等多种金属-氢电极兼容,能够实现低温下的高容量可逆储氢。具体而言,作为储氢器件的Mg-H₂电池(反应式为Mg + H₂ ⇌ MgH₂),在90°C下实现了2030毫安时/克的可逆容量,为安全高效的氢-电转换及储氢器件提供了新方案。
氢气因储量丰富、分子量小,被视为理想的能源载体。然而,将氢气以液态形式储存在高压气罐中存在诸多挑战[1],其中最主要的问题是严重的安全隐患。为实现氢气的安全固态储存,研究人员已通过热力学或电化学方法对储氢合金展开了大量探索。在这些方法中,热力学储氢是最具代表性的技术,但该技术的应用受制于高容量材料的可得性——这类材料需能在适宜的低温下有效储存或释放氢气:例如,LaNi₅虽能在室温附近工作,但其储氢容量较低(仅1.4重量%)[2]。与之相反,MgH₂、LiH、LiBH₄等轻元素金属氢化物虽理论储氢容量较高,却存在有效容量低、工作温度高(>300°C)的问题[3]。
另一方面,电化学储氢依靠外部电压,通过质子(H⁺)或氢负离子(H⁻,即氢的阴离子形态)实现氢气的储存与释放。在基于质子的电化学储氢中,碱性或酸性水溶液被用作电解质,为质子进出储氢材料提供通道[4-6]。该方法已应用于镍-金属氢化物(MH)电池的电极反应中;但存在反应动力学缓慢、高容量材料(如MgH₂)因电极腐蚀和在电解质中溶解而导致容量不可逆损失等缺陷[7]。
1985年,哈金斯(Huggins)等人提出了基于氢负离子的电化学储氢概念:他们尝试使用溶解有H⁻的离子液体电解质,将氢负离子嵌入金属中[8]。但由于该技术需在高温(>300°C)下运行[9],这一研究方向未得到进一步推进。近年来,氢负离子传导固态电解质被视为电化学储氢的替代介质,相关研究逐步开展[10,11]。氢负离子具有低电荷密度、适中离子半径(r≈1.4埃)[12]和高极化率(α≈1.8埃³)[13]的特点,因此具备高迁移率优势。然而,已报道的固态氢负离子导体性能尚不足以满足氢化物电池等基于氢负离子的电化学器件需求。例如,La₂LiHO₃电解质的离子导电性较低,导致电池需在300°C的高温下运行,而高温会引发副反应,进而造成可逆性差、放电容量低等问题[10]。近期有研究报道,LaH₃基氢化物和氧氢化物在室温下的离子电导率可达10⁻⁴~10⁻²西门子/厘米[11,14-16]。但以LaHₓ和La₀.₈Sr₀.₂H₂.₈₋₂ₓOₓ为电解质的Ti-TiH₂非对称电池,仅能实现414毫安时/克和1120毫安时/克的低可逆放电容量,这可能是由于运行过程中电解质发生还原反应所致。
本研究通过探索BaH₂-CaH₂-NaH伪三元体系的组成空间,开发出一种具有高电化学稳定性和离子导电性的新型氢负离子导体。与LaH₃等其他金属氢化物相比,CaH₂和BaH₂作为端元组分,具有更低的反应电位(相对于Ti/TiH₂电极,电位分别为-0.113V和-0.006V),因此电化学稳定性更强(表S1;详见补充说明1);而选择NaH作为第三种端元组分,则是为了调节金属与氢的比例。尽管BaH₂和CaH₂均为正交钙钛矿型结构(空间群Pnma),但对于组成为Ba₁₋ₓ₋ᵧCaₓNaᵧH₂₋ᵧ(其中0.25≤x≤0.9,0.05≤y≤0.375)的样品,其X射线衍射(XRD)图谱显示,该组成具有体心立方(bcc)骨架,空间群为Im3m(图1A及图S1A、B)。图1B将Im3m相的形成范围叠加在BaH₂-CaH₂-NaH三元相图上,结果表明,形成该相需要三种阳离子共同存在,且阴离子/阳离子比(MXₙ中的n)需满足1.625≤n<2。这些组分的实验离子电导率显著较高(50°C时σ≈10⁻⁵西门子/厘米),其中Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的电导率最高,可达4.8×10⁻⁵西门子/厘米(图1C)。透射电子显微镜(TEM)图像(图S2A)显示,Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的颗粒尺寸约为400纳米。能量色散X射线(EDX)光谱(图S2B-D)证实,实验测得的组分与名义比例(Ba:Ca:Na=0.51:0.37:0.12及0.5:0.35:0.15)一致。

图1 BaH₂-CaH₂-NaH体系的结构分析
(A)BaH₂(蓝色)与Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅(红色)的XRD图谱。(B)BaH₂-CaH₂-NaH体系中立方相Im3m(红色圆圈)与正交相Pnma(蓝色三角形)的形成相图。Arb. u.表示任意单位。(C)BaH₂-CaH₂-NaH伪三元体系在50°C下离子电导率(σ)对数的热图。(D)Ba₀.₅Ca₀.₃₅Na₀.₁₅D₁.₈₅的精修晶体结构。绿色、蓝色、黄色和灰色球体分别代表Ba、Ca、Na和D原子。(E)M(Ba₀.₅Ca₀.₃₅Na₀.₁₅)与DM₆八面体中D(6b)和DM₄四面体中D(12d)的配位关系。(F)通过MPNN-MD模拟(600K)获得的4×4×4超胞中氢的概率密度三维等值面图。黄色部分为1×10⁻⁴埃⁻³的等值面;晶格截面上的热图显示概率密度范围为1×10⁻⁴~5×10⁻³埃⁻³。(G)MPNN-MD模拟获得的z=0.5截面处氢概率密度的等高线图。o和t分别表示八面体(6b)和四面体(12d)位点;概率密度以对数尺度(10⁻²~10⁻⁵埃⁻³)呈现,等高线图间隔为0.5个对数单位。(H、I)MPNN-MD模拟(400K)获得的氢迁移轨迹。氢原子用白-红色梯度表示,颜色变化对应模拟时间(Δt)的推移。
研究采用中子衍射法确定结构中的氢原子位置,并对样品进行氘化处理,以避免轻氢的非相干散射产生背景噪声。图1D为通过中子衍射数据的里特维尔德(Rietveld)精修得到的Ba₀.₅Ca₀.₃₅Na₀.₁₅D₁.₈₅晶体结构(里特维尔德精修结果详见图S1C、D及表S2)。在该结构中,Ba、Ca、Na原子随机占据体心位点(2a),而D原子则占据两个不同的位点(12d和6b),分别对应DM₄四面体和DM₆八面体(M=Ba₀.₅Ca₀.₃₅Na₀.₁₅)的中心(图1E)。采用氘原子同时占据12d位点(占有率=0.1651(3))和6b位点(占有率=0.2865(6))的结构模型,可对实验数据进行良好拟合(加权谱图R因子Rwp=1.6%)。因此,Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅被证实具有反α-AgI型结构,这是超离子导体的典型结构[17]。
为全面分析扩散路径,研究采用消息传递神经网络(MPNN)势函数进行分子动力学(MD)模拟(图S3A、B)。该方法可实现较长的模拟时间(1纳秒)和较低的温度范围(300~700K)(图S3C、D),与实验电导率测量的温度范围接近。从MD轨迹获得的氢概率密度(图1F、G)表明,氢原子不仅占据体心立方骨架中的四面体位点(对应α-AgI中的银位点),还占据八面体位点,这与中子里特维尔德分析结果一致。对MD轨迹中跳跃事件的分析与可视化显示,氢负离子传导发生在共面的四面体和八面体位点之间(图1H、I),从而形成三维传导路径。模拟结果显示,298K和400K下的离子电导率分别为2.6×10⁻³西门子/厘米和4.3×10⁻²西门子/厘米(图S3E),这表明反α-AgI型骨架适用于氢负离子传导。
Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的电化学性能
Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅在25°C下的奈奎斯特图(图2A插图)显示,高频区域存在两个半圆,分别对应体相电阻和晶界电阻。25°C下,该电解质的体相离子电导率和总离子电导率分别为3.9×10⁻⁵西门子/厘米和2.1×10⁻⁵西门子/厘米。图2A为Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅体相和总离子电导率的阿伦尼乌斯图,对应的活化能分别为49(2)千焦/摩尔和48.2(6)千焦/摩尔。通过直流(DC)极化测量估算的电子电导率为1.3×10⁻⁹西门子/厘米(图S4),比交流(AC)阻抗测量得到的总电导率低四个数量级。此外,采用Mo|TiH₂+Ti+SE+AB|LaHₓ|SE|LaHₓ|TiH₂+Ti+SE+AB|Mo电池(其中SE为Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅固态电解质,AB为乙炔黑)测量的直流电导率为2.2×10⁻⁵西门子/厘米,与交流电导率值高度吻合(图S5)。LaHₓ是一种氢负离子-电子混合导体,在室温下的氢负离子电导率为0.03西门子/厘米,电子电导率为2西门子/厘米[11,18]。这些结果表明,Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅为纯氢负离子传导。
研究还进行了变温核磁共振(NMR)测量(图S6),结果显示,与室温(298K)相比,高温(343K)下谱线显著变窄,这表明材料中氢的迁移率增强。实验测得的体相电导率比模拟值低1~2个数量级(图S3E)。考虑到机械化学合成样品的结晶度较低(相对密度为90%),通过改进Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的合成与致密化工艺,有望进一步提高其电导率。图2B将Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的阿伦尼乌斯图与代表性氢负离子导体和质子导体[10,11,14,15,19-32]进行了对比,结果表明,Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的离子电导率高于钙钛矿型BaH₂、钙钛矿型Sr₀.₉₂₅Na₀.₀₇₅LiH₂.₉₂₅等典型氢负离子导体[22,27],也高于基于氧化物和无机固体酸的质子导体(如BaCeO₃和CsH₂AsO₄[20,28])。Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的优异导电性源于高极化率阳离子构成的体心立方骨架。事实上,已有研究报道反α-AgI型氟离子(F⁻)和氧离子(O²⁻)导体具有高阴离子电导率:例如,Rb₀.₅Pb₀.₅F₁.₅和Pb₂/₃K₁/₃F₅/₃的氟离子电导率分别为室温下1.4×10⁻⁵西门子/厘米和247°C下4×10⁻¹西门子/厘米[33-35];Bi₀.₆₂Pb₀.₃₈O₁.₃₁和Bi₀.₇₅Ba₀.₂₅O₁.₃₇₅的氧离子电导率分别为600°C下~10⁻¹西门子/厘米和400°C下~10⁻³西门子/厘米[36,37]。
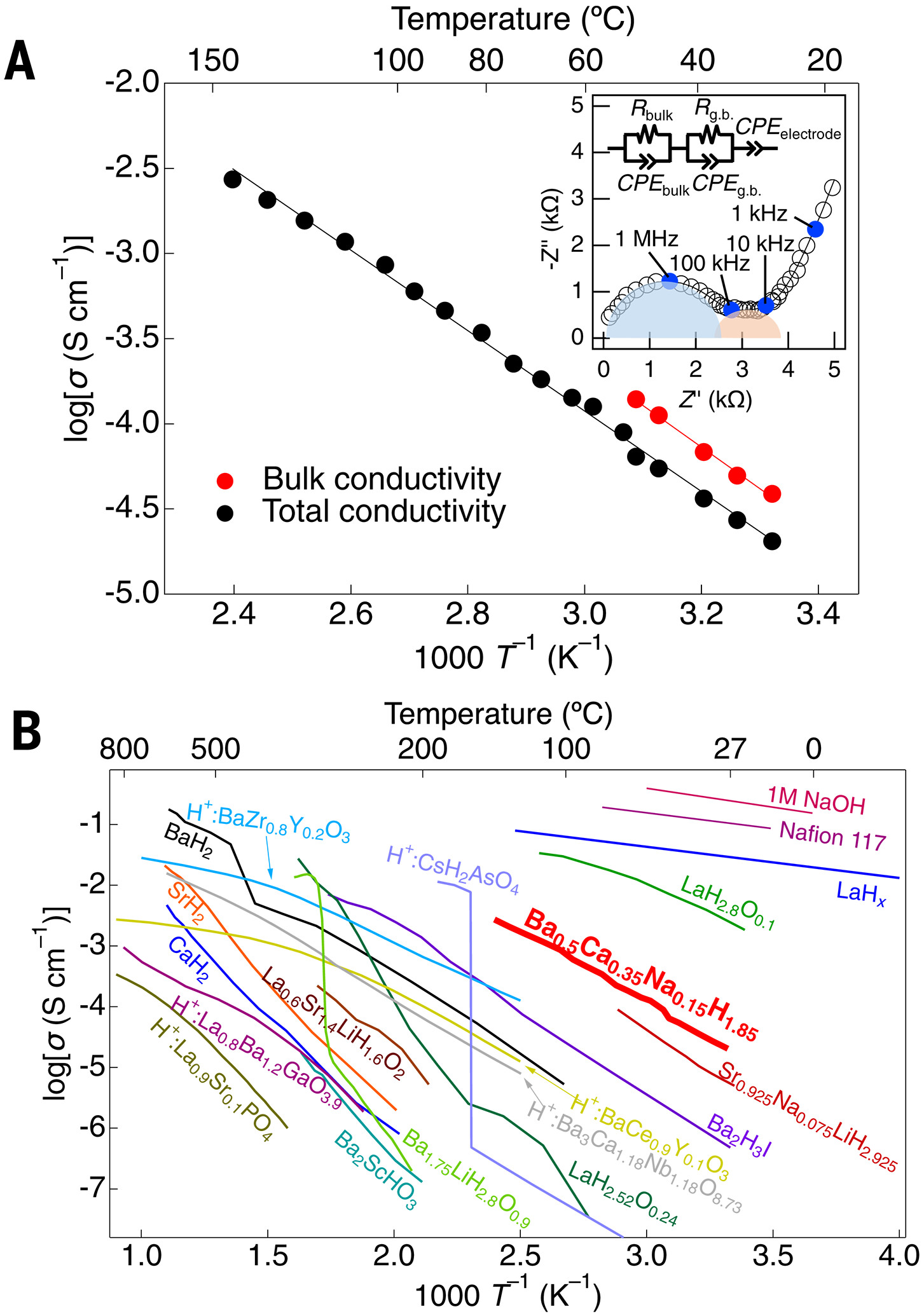
图2 Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的离子电导率
(A)冷压成型Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的离子电导率阿伦尼乌斯图。红色圆圈和黑色圆圈分别代表体相电导率与总电导率(体相+晶界)。插图展示了25°C下测得的奈奎斯特图及用于拟合的等效电路模型,黑色圆圈和黑色曲线分别代表实验数据与拟合曲线,蓝色半圆和橙色半圆分别对应体相电阻与晶界(g.b.)电阻的R//CPE(R为电阻,CPE为常相位元件)组件。(B)Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅与已报道的质子导体及氢负离子导体的离子电导率阿伦尼乌斯图[10,11,14,15,19-32]。T⁻¹表示温度的倒数。
采用线性扫描伏安法,在60°C下对(–)Mo|TiH₂+Ti+SE+AB|SE|Mo(+)电池进行测试,评估该固态电解质的电化学稳定窗口。结果显示,相对于Ti/TiH₂电极,其稳定窗口范围为–0.13~0.53 V(图3A)。相对于Ti/TiH₂,该电解质具有–0.13 V的低还原电位,这可能是因为Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅中主要含有抗还原性的Ba和Ca,而这种特性是其与Ti电极兼容的必要条件。在氧化反应方面,当电位高于Ti/TiH₂ 0.7 V时,可检测到氢气释放;原位质谱H₂信号监测(图S7)也证实了这一现象。H₂信号强度与施加电流密度呈正相关,表明氢气释放源于氢负离子的氧化反应(H⁻→1/2H₂ + e⁻)。
随后,采用该领域常用的(–)Mo|TiH₂+Ti+SE+AB|SE|TiH₂+SE+AB|Mo(+)非对称电池结构[10,11,16],探究Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅作为固态电解质的电化学性能。Ti–TiH₂电池可实现可逆充放电,在60°C下经过10次循环后,其容量仍能达到理论容量(1075 mAh/g)的84%以上(图3B)。非原位X射线衍射(XRD)测试证实,TiH₂的反应分为两步:第一步是具有面心立方金属晶格的δ-TiH₂₋ₓ(0≤x≤0.5)发生单相反应;第二步是具有六方最密堆积金属晶格的δ-TiH₁.₅与α-Ti发生两相反应(图S8A~D)。这是首次证实全固态电池可同时具备高容量与高可逆性的研究。值得注意的是,此前基于LaH₃基电解质的全固态电池,从未报道过如此高容量、高可逆性的性能[11,16]。

图3 Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的电化学稳定性及基于该电解质的全固态电池中金属氢化物的电化学储氢性能
(A)60°C下(–)Mo|TiH₂+Ti+SE+AB|SE|Mo(+)电池的线性扫描伏安图。红色曲线和黑色曲线分别代表实验数据与拟合曲线,垂直实线标注出稳定电位窗口范围。(B)60°C下(–)TiH₂+Ti+SE+AB|SE|TiH₂+SE+AB(+)电池的充放电曲线。n表示转移的电子数。(C)(–)TiH₂+Ti+SE+AB|SE|MHₓ+SE+AB(+)(MHₓ为金属氢化物)全固态电池的首次放电曲线:NaAlH₄电极测试温度为90°C,LaHₓ电极测试温度为100°C,其他电极测试温度为60°C。(D)90°C下(–)TiH₂+Ti+SE+AB|SE|MgH₂+SE+VGCF(+)(VGCF为气相生长碳纤维)电池的充放电曲线。
储氢材料筛选
我们进一步研究了全固态电池中多种金属氢化物的电化学氢化与脱氢反应。首先,通过基于密度泛函理论的热力学计算,评估各金属氢化物的反应电位与理论容量(表S1);随后,对与该固态电解质稳定窗口(–0.13≤E≤0.53 V)兼容的电极(TiH₂、MgH₂、NaAlH₄、LiAlH₄、NaBH₄、NaH、LaHₓ、VHₓ)进行实验测试(图S9)。图3C展示了以Ti–TiH₂为负极时,各金属氢化物正极的放电曲线;表S3汇总了各金属氢化物的放电性能。其中,MgH₂–Ti与NaAlH₄–Ti(正–负极)电池的容量接近理论值,NaAlH₄–Ti的详细性能见补充说明2。
在90°C下,MgH₂电极呈现一步可逆充放电反应,容量高达1800 mAh/g(超过其2037 mAh/g理论容量的88%),对应两步电子转移反应(图3D)。放电后,MgH₂脱氢生成Mg;后续充电时,Mg可重新氢化生成MgH₂,这表明MgH₂与Mg之间发生了两相反应(图S10)。此外,在25°C下,MgH₂仍可进行充放电反应,放电容量可达855~1220 mAh/g(图S11)。
Mg–H₂电池的电化学储氢性能
鉴于MgH₂电极具有良好的可逆性与高容量(图S12),我们构建了基于Mg–H₂电池的氢负离子驱动储氢器件:以Mg和H₂气体分别作为负极与正极的活性物质,电池结构为(–)MgH₂+SE+AB|SE|LaHₓ+SE+AB|SUS-mesh|H₂(+)(SUS-mesh为不锈钢网集流体)(图4A),工作温度为90°C。选择LaHₓ作为正极电催化剂,是因其具备优异的氢交换能力[11]及出色的氢负离子导电性与电子导电性。
该电池的开路电压为0.12 V,与相对于Mg/MgH₂的理论反应电位0.186 V几乎一致(详见补充说明1)。在90°C下经过5次循环后,Mg–H₂电池的容量仍能达到MgH₂的理论容量(约2030 mAh/g)(图4B)。MgH₂(s)→Mg(s)+H₂(g)的脱氢反应在电池电压约为0.3 V时启动;放电(吸氢)过程在0 V和–0.1 V处呈现两个平台,后续放电则在–0.2 V平台进行。
图4C展示了首次循环过程中MgH₂电极的非原位XRD图谱:充电时,MgH₂脱氢,导致XRD图谱中MgH₂特征峰消失、金属Mg特征峰出现;放电时,金属Mg吸氢,导致Mg特征峰消失、MgH₂特征峰重新出现。值得注意的是,在90°C、氢分压=0.2 MPa的条件下,Mg(s)+H₂(g)→MgH₂(s)的吸氢反应在热力学上是自发的。
对照实验表明,氢气可通过固态电解质渗透,进而实现Mg的氢化:将充电(脱氢后)的电池置于90°C的H₂气氛中,通过热化学氢化反应可生成MgH₂(详见补充说明S3及图S13)。横截面扫描电子显微镜图像显示,固态电解质层内部存在空隙(图S14),这是导致氢气渗透的原因。目前冷压成型电解质的相对密度为85%~90%,需通过热压等方法进一步优化致密性,以最大限度降低渗透效应[22,26,38]。
在真空条件下运行的全固态电池中,已证实氢负离子可电化学嵌入Mg中(图3及图S10)。但一旦电池内充满H₂气体,即使在温和条件下(90°C、=0.2 MPa),H₂仍可渗透过固态电解质并与Mg反应生成MgH₂。因此,该电池的放电机制同时涉及氢负离子直接嵌入与电化学氢泵作用。这些结果表明,氢气可从MgH₂电极电化学释放,并通过电化学或热化学方式被Mg电极吸收。
图4D对比了氢负离子驱动型电池中MgH₂的工作温度与储氢容量,以及已报道的热驱动型与质子驱动型电化学储氢数据[7,39]。与热力学驱动型和质子驱动型储氢不同,MgH₂电极在氢负离子驱动型储氢中表现优异:成本低、可逆性好,且在温和温度下(90°C时为7.7 wt%)即可实现高储氢容量。基于这些独特特性,氢负离子驱动型储氢器件在氢气与电能的储存和利用方面具有广阔前景。
对于实际应用而言,有必要对比热驱动储氢与电化学储氢在实际器件结构中的总能量平衡及质量储氢密度。尽管在详细假设下进行严格模拟超出了本研究的范围,但简化分析表明,通过器件层面的改进(如降低过电位、减小固态电解质厚度、提高复合电极中活性物质的占比),电化学储氢的性能有望优于热驱动储氢(详见补充说明S4)。
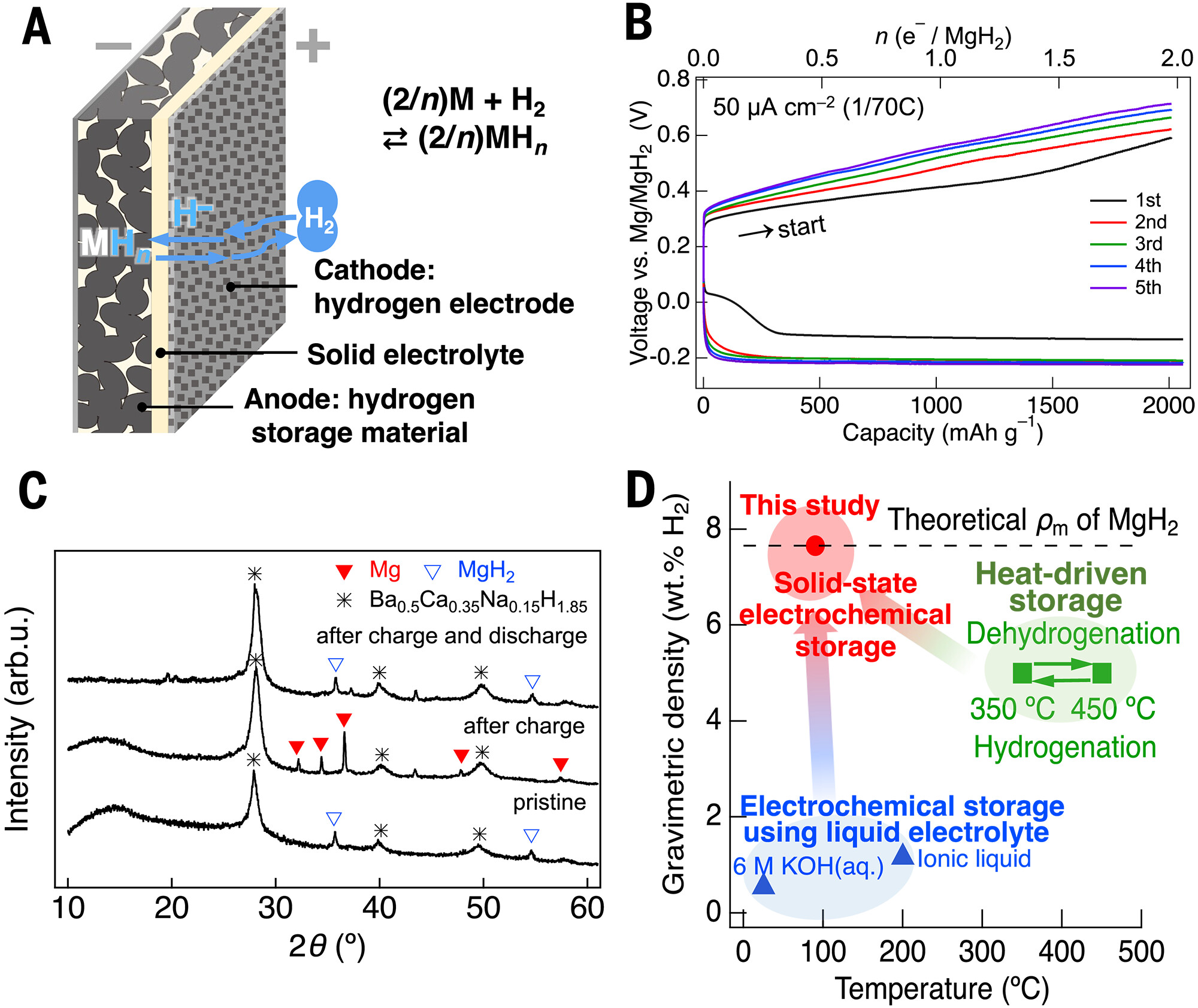
图4 基于Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅的金属–H₂电池中Mg金属电极的电化学储氢性能
(A)金属–H₂电池结构示意图。(B)90°C下(–)Mo|MgH₂+SE+AB|SE|LaHₓ+SE+AB|SUS-mesh|H₂(+)电池的恒电流吸氢/脱氢曲线。红色曲线和蓝色曲线分别代表脱氢反应与吸氢反应;充电过程在真空条件下进行,放电过程在0.2 MPa H₂气氛下进行。(C)MgH₂复合电极在充放电前后的非原位XRD图谱。电化学测试在90°C下进行,采用(–)Mo|MgH₂+SE+AB|SE|LaHₓ+SE+AB|SUS-mesh|H₂(+)电池结构。(D)MgH₂的实验质量储氢密度(ρₘ)随温度的变化曲线,绿色方块代表热驱动储氢密度,虚线代表理论储氢密度;蓝色三角形代表采用液态及离子液体电解质的电化学储氢数据[7];红色圆圈代表Mg–H₂电池在90°C下的储氢容量。
新型反α-AgI型氢负离子导体Ba₀.₅Ca₀.₃₅Na₀.₁₅H₁.₈₅具有高离子电导率与良好的电化学稳定性。以该电解质构建的MgH₂–Ti全固态电池,可实现高可逆容量的充放电运行;此外,该固态电解质还能使Mg–H₂储氢电池在90°C的低工作温度下,实现2030 mAh/g的高可逆容量。这些性能是传统热驱动方法或液态电解质无法实现的,为开发适用于能源载体的高效储氢系统奠定了基础。
https://blog.sciencenet.cn/blog-41174-1502859.html
上一篇:纳米气泡热酸稳定性研究
下一篇:超声驱动的铋 - 钌异质结用于肿瘤水分解气体治疗