博文
镁材料释放氢气碱化组织对骨折后康复过程的影响
||
- 氢气(H₂)和碱性pH环境主要在骨质疏松性骨折早期愈合阶段于植入物 - 骨折部位周围产生。
- 氢气(H₂)和碱性pH环境可增加骨膜细胞增殖,而镁离子(Mg²⁺)在体外股骨中主要增强细胞外基质(ECM)形成和细胞黏附。
- 氢气(H₂)、碱性pH环境和镁离子(Mg²⁺)各自对镁髓内钉(Mg - IMN)组的骨再生改善有贡献。
- 氢气(H₂)、碱性pH环境和镁离子(Mg²⁺)在骨再生过程中激活感觉神经,同时抑制肾上腺素能信号传导。
本研究来自香港中文大学等多家单位合作的研究。
摘要
可生物降解镁(Mg)植入物通常提供临时骨折固定并促进骨再生。然而,镁降解产生的镁离子(Mg²⁺)、氢气(H₂)和氢氧根离子(OH⁻)在促进骨折愈合方面的确切作用尚未完全明确。在此我们研究了镁髓内钉(Mg - IMN)在体内的降解情况,揭示了在早期阶段骨折部位周围会产生这些降解产物。批量RNA测序表明,氢气(H₂)和碱性pH环境可增加骨膜细胞增殖,而镁离子(Mg²⁺)在体外股骨中可能主要增强细胞外基质形成和细胞黏附。体内研究进一步显示,氢气(H₂)、镁离子(Mg²⁺)和碱性pH环境各自对镁髓内钉(Mg - IMN)组的骨再生增强产生相当的效果。从机制上讲,降解产物提高了感觉神经降钙素基因相关肽(CGRP)水平,同时抑制了新生骨中的肾上腺素能因子。氢气(H₂)和镁离子(Mg²⁺),而非碱性pH环境,可增加降钙素基因相关肽(CGRP)合成并抑制肾上腺素能受体。我们的研究结果首次阐明,镁髓内钉(Mg - IMN)产生的镁离子(Mg²⁺)、氢气(H₂)和碱性pH环境通过骨骼内感受调节以不同且协同的方式加速骨再生。这些发现可能会促进对镁髓内钉(Mg - IMN)在骨折修复甚至其他骨疾病中的生物学功能的理解。
Graphical abstract
1. 引言
肌肉骨骼疾病是全球主要的公共健康问题,尤其是骨质疏松性骨折,给医疗保健和社会经济系统带来了沉重负担[1,2]。骨质疏松症是一种以骨量低和微结构退化为特征的骨骼疾病,全球有超过2亿人受其影响,导致骨折易感性增加和死亡率上升[3,4]。传统的骨科固定植入物通常由不锈钢或钛等永久性金属制成,存在诸如应力屏蔽效应等缺点,这会阻碍骨愈合,且往往需要额外的手术[5]。近年来,基于镁(Mg)的植入物因其优越的生物相容性、合适的杨氏模量以及良好的成骨和血管生成特性,在骨科应用中受到了关注[6,7,8,9]。我们的团队开发了一种新型含镁髓内钉(Mg-IMN),在促进骨质疏松性骨折[10]、非典型股骨骨折[11]和严重骨缺损[12]的愈合方面显示出了良好的效果。然而,现有的关于镁基植入物的研究主要集中在纯镁金属或其合金的整体生物学效应上,忽视了镁通过阳极和阴极反应降解产生的副产物镁离子(Mg²⁺)、氢气(H₂)和氢氧根离子(OH⁻)(局部碱性pH环境)的降解过程:Mg + 2H₂O → Mg²⁺ + 2OH⁻ + H₂[13]。镁植入物在体内的降解情况仍有待系统研究。镁离子对人体的许多生理功能至关重要,约60%的镁储存在骨骼中,对骨形成和再生有重要贡献[14,15]。自2007年以来,氢气因其选择性抗氧化特性在医学研究中受到关注[16],它可以减轻氧化应激,并可能有助于预防骨质疏松症中的骨质流失[17]。此外,氢氧根离子产生的碱性环境与增强骨形成有关[18],可以对抗通常抑制骨生长和促进骨吸收的酸性条件[19]。尽管这些物质各自有其益处,但对于镁离子、氢气和碱性环境对镁基植入物增强骨再生的单独或协同作用知之甚少。骨组织中有丰富的感觉神经和交感神经,它们在调节骨代谢、周转和骨折愈合方面起着关键作用[20,21,22]。感觉神经在成骨活性高的部位尤为丰富[23],会产生降钙素基因相关肽(CGRP),这是一种具有成骨作用的肽,可被Mg-IMN激活[10,24]。相反,交感神经元的刺激或感觉神经的去神经支配会通过改变骨形成和吸收率对骨重塑动态产生不利影响[25,26]。值得注意的是,研究表明,在骨代谢中,感觉神经活动可能与交感神经活动在功能上相互作用,因为感觉神经去神经支配的效果与交感神经功能亢进的效果非常相似[23]。此外,背根神经节(DRG)感觉神经元已被发现可抑制脂肪组织中的局部交感神经功能[27]。尽管有这些发现,但镁基植入物的交感神经调节作用及其降解产物的骨骼内感受调节作用尚未确定。鉴于镁的降解会释放镁离子、氢气并产生碱性环境,我们假设这些降解产物通过调节使用Mg-IMN进行骨折固定时的感觉神经和交感神经,以不同但协同的方式促进骨质疏松性骨折的愈合。在此,我们对植入骨折股骨中的镁的降解情况进行了表征,并探索了其降解产物的具体作用。此外,我们首次揭示了感觉信号的激活和交感信号的抑制,这有助于Mg-IMN固定的骨折骨加速再生,突出了镁离子、氢气和碱性环境在骨折愈合过程中的可比贡献。2. 材料与方法2.1. 动物本研究使用的大鼠和小鼠来自香港中文大学实验动物服务中心。动物饲养在12小时光照-黑暗循环的受控环境中,可自由获取水和标准啮齿动物饲料。本研究中进行的所有动物实验程序均遵循香港中文大学动物实验伦理委员会批准的实验室动物护理和使用原则(参考编号:22/048/MIS-5-C和22/092/MIS-5-C)。对于每个实验,将年龄匹配的雌性动物随机分配到各实验组。2.2. 骨质疏松大鼠单侧闭合性骨折模型的建立选用24周龄的雌性Sprague Dawley(SD)大鼠,按照我们已成熟的方案建立卵巢切除(OVX)诱导的骨质疏松模型和闭合性股骨骨折模型[10,11]。我们设计并制造了策略性的Mg-IMN,如先前所述[10]。Mg-IMN在其中间1厘米处有三排共十八个交错的孔,一根超纯(99.99%)镁圆柱棒(直径0.7毫米,长1.5厘米)插入其空心核心。传统的不锈钢髓内钉(SS-IMN)作为对照。将灭菌后的IMN沿骨折股骨的轴线垂直插入。术后连续三天给予0.05毫克/千克/天的镇痛剂进行术后镇痛。2.3. 骨质疏松小鼠单侧闭合性骨折模型的建立选用12周龄的雌性C57BL/6小鼠,按照先前描述的方法建立标准的OVX诱导的骨质疏松模型和闭合性股骨骨折模型[11]。小鼠随机分为三组:Mg-IMN组、SS-IMN(不锈钢髓内钉)组和SS-IMN + H₂组。将灭菌后的Mg-IMN或SS-IMN沿骨折股骨的轴线插入。在温暖的条件下提供苏醒护理,并连续三天皮下注射镇痛剂进行术后镇痛。使用氢气水发生器(NB-T71A,上海纳米气泡技术有限公司,中国)制备富氢水(HRW),同时按设计始终提供自由获取的自来水,骨折后腹腔注射富氢盐水(HRS)两周。2.4. 大鼠股骨远端植入IMN模型的建立
选用20周龄的雌性SD大鼠(每组n = 4)建立股骨远端植入模型。简要来说,麻醉后在右膝处做纵向切口,将髌骨脱位以暴露股骨髁。用18G针头(直径1.27毫米)从股骨远端的髌股沟沿股骨干轴线创建一个通道。随后,将Mg-IMN、SS-IMN、Mg(OH)₂-IMN、MgCl₂-IMN和NaOH-IMN植入股骨远端的通道中。按照前文所述提供苏醒护理。制备过程如下:首先,我们用环氧乙烷对盐粉和不锈钢针(中间有三排十八个交错的孔,与Mg-IMN相同)进行灭菌,将灭菌后的空心不锈钢针放入装有灭菌粉末的离心管中,连续滚动12小时,以确保完全填充。其次,我们用铝箔密封针管壁并将其直立放置。然后,我们用细针沿针管腔垂直挤压粉末,在此过程中不断补充灭菌粉末。所得的IMN(直径0.7毫米,长1.5厘米)分别填充压缩的Mg(OH)₂、MgCl₂和NaOH,组装成Mg(OH)₂-IMN、MgCl₂-IMN和NaOH-IMN。所有操作均在层流罩的无菌环境中进行。 2.5. 氢气和pH值的微传感器测量
选取植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)3天至15天的闭合性骨折骨质疏松大鼠,用于氢气和pH值的测量。利用高灵敏度微传感器以及尖端直径为50 - 100μm的微电极,在微剖面分析系统(丹麦优尼森斯公司(Unisense A/S))上测量氢气和pH值的微观分布情况[28]。通过注射1000单位肝素(西格玛公司(Sigma),H3393)进行肝素化处理后,从心脏取血以测量氢气浓度。暴露股骨后,按顺序从骨膜、骨痂表面再到骨痂内部,依次检测氢气含量,检测从骨膜开始向中心进行。用1.0毫米的电钻在股骨上钻一个孔,测量骨髓中的氢气浓度。随后再钻第二个孔,以便将pH微电极和参比电极安装在显微操作器上,并记录相应数值。
2.6. 镁髓内钉的扫描电子显微镜/能谱分析
将厚的、经研磨的甲基丙烯酸甲酯(MMA)切片进行抛光处理,并溅射镀上一层约10.0nm厚的金-钯膜,以便使用钨灯丝电子和低真空二次电子的泰思肯探测器(TESCAN VEGA3,捷克斯洛伐克)对镁髓内钉表面进行扫描电子显微镜(SEM)成像,并通过能谱分析(EDS)进行元素分析。进行能谱映射分析、能谱线分析以及元素组成百分比分析,通过将镁(Mg)、钙(Ca)、磷(P)、氧(O)、碳(C)和铁(Fe)设定为目标元素,对其相应强度进行半定量测量。采用线扫描模式从纵向和横向对镁髓内钉表面进行分析。此外,对设计时间点上靠近孔洞及屏蔽区域的感兴趣区域(ROI)进行统计分析。
2.7. 免疫组织化学和组织形态计量学
对于骨组织的免疫组织化学分析,将大鼠或小鼠的股骨取出,用4%多聚甲醛固定3天。在室温下用12.5%乙二胺四乙酸(EDTA)对股骨进行脱钙处理,然后按照标准流程制备厚度为5μm的切片用于免疫组织化学染色。具体步骤如下:样本先进行脱蜡和水化处理,接着使用3%过氧化氢甲醇溶液处理20分钟以猝灭内源性过氧化物酶活性。然后将样本置于95°C的10mM温热柠檬酸盐缓冲液中处理20分钟以进行抗原修复。用含有1%牛血清白蛋白(BSA,赛默飞世尔科技公司(Thermo Fisher Scientific),美国)、5%胎牛血清(FBS,赛默飞世尔科技公司,美国)、0.3M甘氨酸和0.3%曲拉通X - 100的封闭液封闭非特异性结合位点1小时。随后将样本在4°C下与以下一抗孵育过夜:抗成骨相关转录因子(osterix,ab209484,艾博抗(Abcam),1:200)、抗Runt相关转录因子2(Runx2,ab192256,艾博抗,1:200)、抗增殖细胞核抗原(Ki67,ab16667,艾博抗,1:200)、抗牙本质基质蛋白1(DMP1,PA5 - 120492,赛默飞世尔科技公司,美国,1:200)、抗降钙素基因相关肽(CGRP,ab47027,艾博抗,1:200)、抗P物质(SP,PA5 - 75165,赛默飞世尔科技公司,1:200)、抗去甲肾上腺素(NE,ab8887,艾博抗,1:600)、抗酪氨酸羟化酶(TH,ab137869,艾博抗,1:300)、抗α1肾上腺素能受体(ADRA1,PA1 - 047,赛默飞世尔科技公司,1:200)、抗α2肾上腺素能受体(ADRA2,赛默飞世尔科技公司,PA1 - 048,1:200)、抗β1肾上腺素能受体(ADRB1,赛默飞世尔科技公司,PA5 - 95742,1:200)、抗β2肾上腺素能受体(ADRB2,艾博抗,ab182136,1:200)、抗β3肾上腺素能受体(ADRB3,艾博抗,ab94506,1:200)。同时设置仅用封闭液孵育的玻片作为阴性对照。随后,用磷酸盐缓冲液(PBS)洗去未结合的一抗,将样本与辣根过氧化物酶偶联的二抗(山羊抗兔IgG H&L辣根过氧化物酶,艾博抗,ab6721,1:400)在室温下孵育1小时。接着用二氨基联苯胺/辣根过氧化物酶(DAB/HRP)显色系统(ab80436,艾博抗)孵育5分钟以检测免疫活性,然后用苏木精复染。染色后的切片经脱水、封片后,在光学显微镜(徕卡Q500MC,徕卡剑桥有限公司,英国剑桥)下观察。
对于骨组织形态计量学分析,将大鼠或小鼠的股骨取出,用4%多聚甲醛固定3天。然后在室温下用12.5%乙二胺四乙酸(EDTA)对其进行脱钙处理,并按照制造商的说明,使用苏木精和伊红(H&E)(西格玛奥德里奇公司(Sigma - Aldrich),H9627和199540)以及抗酒石酸酸性磷酸酶(TRAP)(西格玛奥德里奇公司,387A)对厚度为5μm的切片进行染色。用0.05%固绿进行复染。
2.8. 显微计算机断层扫描分析
小心地从骨折股骨中取出镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN),然后按照先前报道的方法[10],使用显微计算机断层扫描(μCT40,瑞士思康医疗公司(Scanco Medical),布鲁蒂塞伦(Brüttisellen))以每体素0.5μm的分辨率对样本进行扫描。扫描范围设定为3.0mm(286层切片),将骨折线巧妙地对准扫描范围的中心点。利用标准化阈值(骨折后2周阈值大于150)识别矿化组织,使用低通高斯滤波器(西格玛值 = 1.2,支持度 = 2)进行三维重建。
对于大鼠股骨远端植入样本,按照常规流程[10],在对样本进行显微计算机断层扫描(μCT40,瑞士思康医疗公司,布鲁蒂塞伦)之前,小心地取出植入物。扫描范围设定为3.0mm,对于骨干中部分析设置285层切片,每体素分辨率为17.5μm。对选定的二维图像应用预定的标准化强度阈值(大于165)来识别矿化骨组织。利用低通高斯滤波器(西格玛值 = 1.2,支持度 = 2)对矿化组织进行三维重建。形态计量学参数包括骨体积与组织体积之比(BV/TV)、骨矿物质密度(BMD)、极惯性矩(ρMOI)。
2.9. 酶联免疫吸附测定
将取自大鼠一侧的背根神经节(DRG)分别浸泡在富氢培养基(HRM)、碱性pH值8.5培养基以及10mM镁离子(Mg²⁺)培养基中。对于另一侧,取与处理组相同数量的背根神经节作为对照组,浸泡在添加了B - 27™添加剂(10889038,赛默飞世尔科技公司)、20ng/ml神经生长因子(NGF,N2513,西格玛奥德里奇公司)、10⁻⁵M氟脱氧尿苷(F0503,西格玛奥德里奇公司)、10⁻⁵M尿苷(U3003,西格玛奥德里奇公司)、1%青霉素-链霉素-新霉素(PSN)抗生素混合物(15640055,赛默飞世尔科技公司)以及蛋白质稳定剂(0.2%聚乙烯吡咯烷酮、0.05%叠氮化钠,均来自西格玛奥德里奇公司)的神经基础培养基(Neurobasal™ plus,A3582901,赛默飞世尔科技公司)中。收集培养上清液用于酶联免疫吸附测定(ELISA)分析。按照各制造商提供的ELISA试剂盒说明书,使用每份样本100μl的上清液,通过降钙素基因相关肽(CGRP)ELISA试剂盒(迈博斯生物(MyBioSource),MBS727982)和P物质(SP)ELISA试剂盒(迈博斯生物,MBS728320)检测降钙素基因相关肽和P物质的浓度。
2.10. 冷冻切片样本制备
按照我们已成熟的流程[10]分离并收集SD大鼠的背根神经节(DRG)。然后用4%多聚甲醛固定24小时,在30%蔗糖溶液中脱水,并包埋在最佳切割温度(OCT,4583,樱花精机(Sakura Finetek),美国加利福尼亚州托兰斯市)包埋介质中。使用徕卡冷冻切片机制作厚度为8μm的冷冻切片,用于免疫荧光染色。
2.11. 免疫荧光
将冷冻切片玻片在室温下解冻10分钟,用磷酸盐缓冲液(PBS)进行水化,然后用含1%牛血清白蛋白(BSA,赛默飞世尔科技公司,美国)、5%胎牛血清(FBS,赛默飞世尔科技公司,美国)、0.3M甘氨酸和0.3%曲拉通X - 100的磷酸盐缓冲液(PBS)封闭1小时,接着在4°C下与抗降钙素基因相关肽(CGRP,ab47027,艾博抗,1:150)和抗P物质(SP,PA5 - 75165,赛默飞世尔科技公司,1:150)的一抗孵育过夜。然后,用磷酸盐缓冲液(PBS)将样本洗涤三次,并与荧光偶联的二抗(ab150077,艾博抗,1:400)孵育1小时,随后再用磷酸盐缓冲液(PBS)洗涤三次。最后用含4',6 - 二脒基 - 2 - 苯基吲哚(DAPI)的封片剂(ProLong™ gold抗荧光淬灭封片剂含DNA染色剂DAPI,P36941,赛默飞世尔科技公司)封片。使用荧光显微镜(徕卡Q500MC,徕卡剑桥有限公司,英国剑桥)采集图像。
2.12. RNA测序
从在富氢培养基(HRM)、碱性pH值8.5培养基以及10mM镁离子(Mg²⁺)培养基(α - MEM,12571063,赛默飞世尔科技公司)中于37°C孵育24小时的股骨上分离并刮取骨膜,然后在添加了10%胎牛血清和1mg/ml I型胶原酶(SCR103,西格玛奥德里奇公司)的α - MEM培养基中,于含5%二氧化碳的37°C培养箱中酶解过夜。将细胞通过70μm尼龙滤网(康宁猎鹰(Corning Falcon))过滤,随后以1000转/分钟的转速离心5分钟,裂解后提取RNA。收集骨折后9天的骨质疏松大鼠股骨骨痂。使用Trizol试剂和PureLink RNA小提试剂盒(12183018A,生命技术公司(Life Technologies))提取总RNA。将合格的RNA送至华大基因健康(香港)公司(https://www.hkbgi.com/)构建文库并进行测序。测序数据分析由汤姆博士(华大基因健康,香港)完成。对所有显著差异表达基因(DEGs)绘制火山图,对排名靠前的差异表达基因绘制热图,进行基因本体(GO)富集分析以及京都基因与基因组百科全书(KEGG)通路富集分析。差异表达基因设定为|log₂倍数变化| > 0且p < 0.05,对于每组,将来自4只不同大鼠的骨痂合并为一个样本进行批量RNA测序。
2.13. 统计分析
所有实验的定量数据均取自每组的样本。数值数据以均值±标准差的形式呈现。两组间的比较采用双侧、非配对的学生t检验进行分析。当进行多组比较时,则采用方差分析(ANOVA)并结合相应的事后检验。统计分析使用GraphPad Prism软件(9.4.1版本,美国加利福尼亚州圣地亚哥市)进行。p < 0.05被视为具有统计学显著性,其中n代表动物数量。*p < 0.05、**p < 0.01以及***p < 0.001被认为差异显著。
3. 结果
3.1. 体内植入骨质疏松性骨折股骨的镁髓内钉(Mg-IMN)中镁部分的时空降解情况
对骨折部位周围的血液及组织(包括骨膜、外周骨痂、中央骨痂以及骨髓)中的氢气浓度进行了测量。利用高灵敏度微传感器和微电极(图1A),我们观察到在镁髓内钉组中,骨折后3天至12天能检测到氢气信号,而在第15天则检测不到信号(图1B)。就空间分布而言,释放出的氢气主要集中在骨膜、外周骨痂、中央骨痂以及骨髓中,但在循环血液中未检测到(图1C)。在骨折线附近氢气浓度升高尤为明显,骨髓中氢气浓度在第3天达到峰值,为220 μmol/L,骨痂中在第3天达到40 μmol/L,随后在第9天出现第二个峰值(骨髓中为400 μmol/L,骨痂中为40 μmol/L)(图1D)。值得注意的是,在同一大鼠植入镁髓内钉的非骨折部位或骨折股骨的对侧未检测到氢气信号(图1B - E),这表明在骨折后15天内,骨折线附近骨 - 植入物界面周围的氢气水平呈现局部性升高。
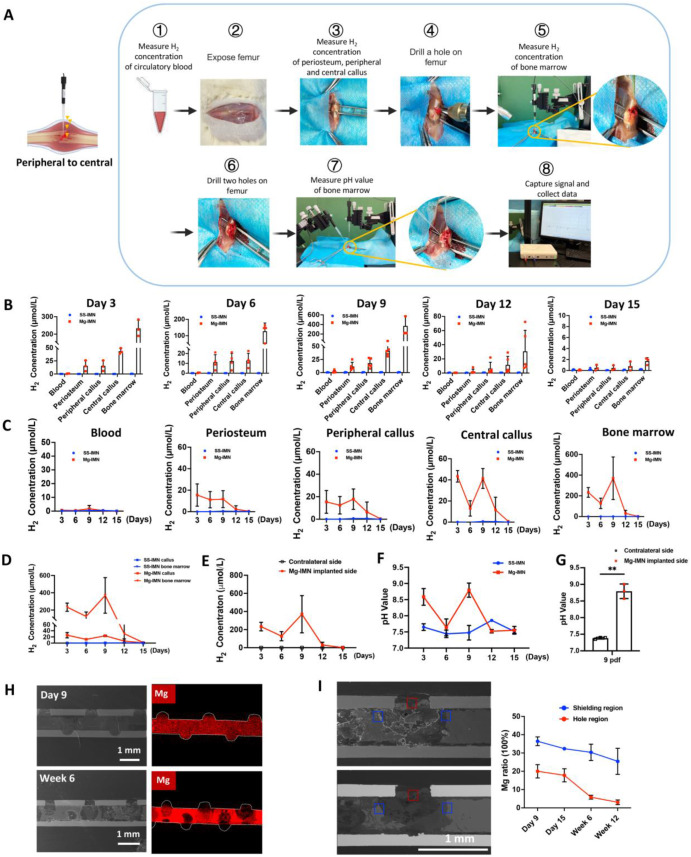
图1. 体内植入骨质疏松性骨折股骨的镁髓内钉(Mg-IMN)的时空降解情况。(A)循环血液及组织中氢气和pH值检测流程示意图。植入镁髓内钉(Mg-IMN)和不锈钢髓内钉(SS-IMN)的骨质疏松性大鼠股骨骨折间隙周围血液及包括骨膜、外周骨痂、中央骨痂和骨髓在内的组织在骨折后3天、6天、9天、12天和15天的氢气浓度(B、C)。每组有3 - 5只大鼠。植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)的骨折股骨(D)以及对侧股骨(E)在骨折后3天、6天、9天、12天和15天的骨痂(骨膜、外周骨痂和中央骨痂的平均值)及骨髓的氢气浓度。每组有3 - 5只大鼠。植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)的大鼠骨折股骨骨髓在骨折后3天、6天、9天、12天和15天的pH值(F)以及植入镁髓内钉的骨折股骨及其对侧股骨在骨折后9天的pH值(G)。数据以均值±标准差形式呈现。每组n = 3。**,p < 0.01,表示同一大鼠植入镁髓内钉侧与对侧的显著差异。(H)镁髓内钉在9天和6周时的能谱分析(EDS)。比例尺,1.0毫米。镁髓内钉在6周时的线性能谱分析及化学成分测定。比例尺,1毫米。(I)在骨折股骨中植入镁髓内钉后9天、15天、6周和12周时,镁髓内钉在孔洞区域(红色矩形)和屏蔽区域(蓝色矩形)的元素组成百分比。每个时间点每组有7 - 11个感兴趣区域(ROIs)。
我们还测量了骨折部位骨髓中的pH值。在镁髓内钉组中,pH值变化与氢气浓度变化情况相似(图1F),在第3天变为碱性(pH值8.5),第6天缓冲至7.5,第9天再次达到pH值8.5的峰值,此后维持中性。相反,不锈钢髓内钉组在骨折后12天呈现中性至略碱性的pH值(pH值7.8)。用镁髓内钉固定的骨折股骨的骨髓pH值在第9天明显呈碱性(pH值8.5),而对侧股骨则保持在pH值7.4左右(图1G),这表明在植入物周围组织附近形成了局部碱性环境,但并未影响整体pH值(液体的总体酸碱度)。
最初,将一根高纯度镁金属棒(纯度99.99%)插入空心髓内针中。扫描电子显微镜(SEM)显示,在骨折愈合早期阶段镁发生降解,镁元素扩散到髓内钉(IMN)的孔洞区域(图1H)。元素组成百分比分析表明,骨折后9天和15天孔洞区域的镁含量显著增加至20%,在6周和12周时稳定在3%左右(图1I),这表明在骨折愈合早期镁含量显著增加,而在后期则明显减少。
总体而言,这些数据表明,镁金属在植入骨折股骨后会发生降解,从而在骨质疏松性骨折愈合的早期阶段导致局部氢气产生、形成碱性pH环境以及镁离子(Mg²⁺)水平升高。
3.2. 三种镁降解产物对体外股骨的单独生物学效应
对氢气、碱性pH环境以及镁离子(Mg²⁺)在体外对骨再生的直接影响进行了研究。骨膜由外层纤维层和内层成骨层组成,富含间充质细胞和成骨祖细胞[29]。对用饱和富氢培养基(HRM)、碱性pH值8.5培养基以及10 mM镁离子(Mg²⁺)培养基处理24小时的分离大鼠股骨进行组织学分析,结果显示氢气和碱性pH处理使大鼠股骨内层成骨层变厚(图2A)。氢气和碱性pH处理均增加了增殖标志物Ki67在骨膜成骨层中的表达[30]。镁离子(Mg²⁺)处理并未显著增加Ki67的表达(图2A)。此外,所有这些处理都增强了对成骨细胞分化[31]和骨细胞功能[32]至关重要的Runt相关转录因子2(Runx2)和牙本质基质蛋白1(DMP1)的表达(图2A),这表明它们在体外对骨再生和成骨具有潜在影响。 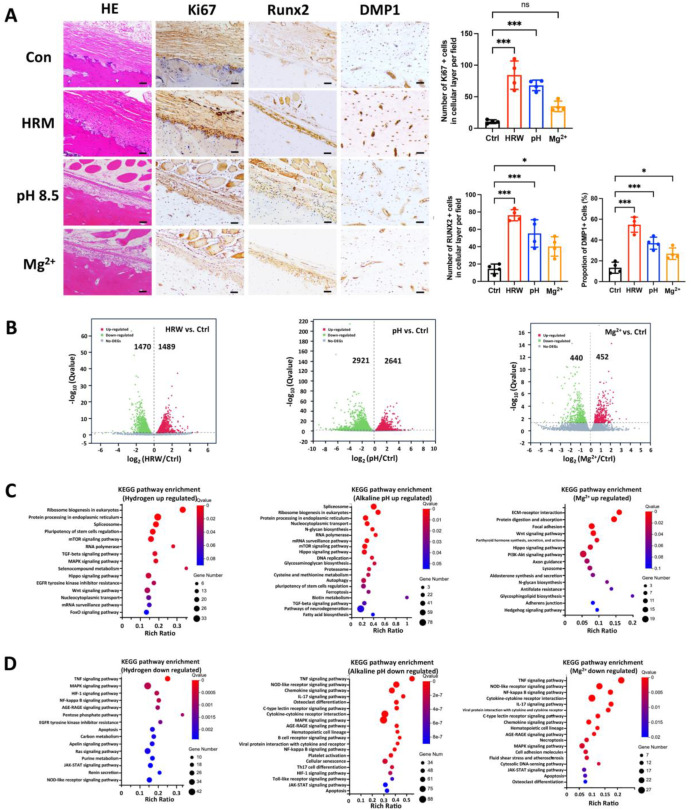
图2. 镁降解产物(氢气、碱性pH值、镁离子)对体外骨再生的单独作用。(A)大鼠股骨在富氢培养基(HRM)、碱性pH值8.5培养基以及10 mM镁离子(Mg²⁺)培养基中浸泡24小时后的苏木精 - 伊红(H&E)染色及Ki67、Runt相关转录因子2(Runx2)、牙本质基质蛋白1(DMP1)的免疫组织化学染色。(右侧为)每视野骨膜细胞层中Ki67阳性细胞数量、每视野骨膜细胞层中Runx2阳性细胞数量以及股骨皮质骨中DMP1阳性细胞比例的定量分析。*p < 0.05,**p < 0.01,***p < 0.001,ns表示无显著性差异,采用单因素方差分析结合图基(Tukey)事后检验进行分析。数据以均值±标准差形式呈现。每组n = 4只动物。比例尺,50 μm。(B - D)对体外在富氢培养基(HRM)、碱性pH值8.5培养基以及10 mM镁离子(Mg²⁺)培养基中处理24小时的大鼠股骨骨膜进行RNA测序。差异表达基因(DEGs)设定为|log₂倍数变化| > 0且p < 0.05,将来自4只大鼠的骨膜合并为一个样本进行批量RNA测序,每组分析8 - 12只大鼠。(B)富氢培养基(HRM)、碱性pH值8.5以及10 mM镁离子(Mg²⁺)处理24小时的差异表达基因的火山图。富氢培养基(HRM)、碱性pH值8.5以及10 mM镁离子(Mg²⁺)处理24小时的上调(C)和下调(D)差异基因的京都基因与基因组百科全书(KEGG)通路富集分析。
为进一步探究这些降解产物对骨再生影响的潜在机制,对体外在富氢培养基(HRW)、碱性pH值8.5以及10 mM镁离子(Mg²⁺)培养基中浸泡24小时的大鼠股骨骨膜进行了RNA测序分析。分析结果显示存在显著的差异表达基因(DEGs):富氢培养基(HRW)处理后有1489个基因上调,1470个基因下调;pH值8.5处理后有2641个基因上调,2921个基因下调;10 mM镁离子(Mg²⁺)处理后有440个基因上调,452个基因下调(图2B)。利用京都基因与基因组百科全书(KEGG)进行通路分析发现,与干细胞多能性、哺乳动物雷帕霉素靶蛋白(mTOR)信号通路、转化生长因子 - β(TGF - β)信号通路以及河马(Hippo)信号通路相关的通路,以及诸如核糖体生物发生和蛋白质加工等细胞基本功能相关通路,在氢气和碱性pH处理时均呈现上调富集。镁离子(Mg²⁺)处理上调了细胞外基质 - 受体相互作用、蛋白质消化吸收以及黏着斑通路相关的通路(图2C)。此外,所有处理下调的差异表达基因都与炎症、免疫以及凋亡相关通路有关(图2D)。这些研究结果表明,来自镁的三种降解产物在体外对股骨骨膜中的基因调控发挥着不同且可能具有协同作用的影响,且不存在全身性神经调节作用。具体而言,通过RNA测序分析可知,氢气和碱性pH值可能主要增强与干细胞多能性调控相关的通路,而镁离子(Mg²⁺)可能促进与细胞外基质相互作用和黏着斑相关的通路。不过,这仍有待进一步验证。
3.3. 镁髓内钉(Mg-IMN)降解产物对体内骨再生增强的贡献
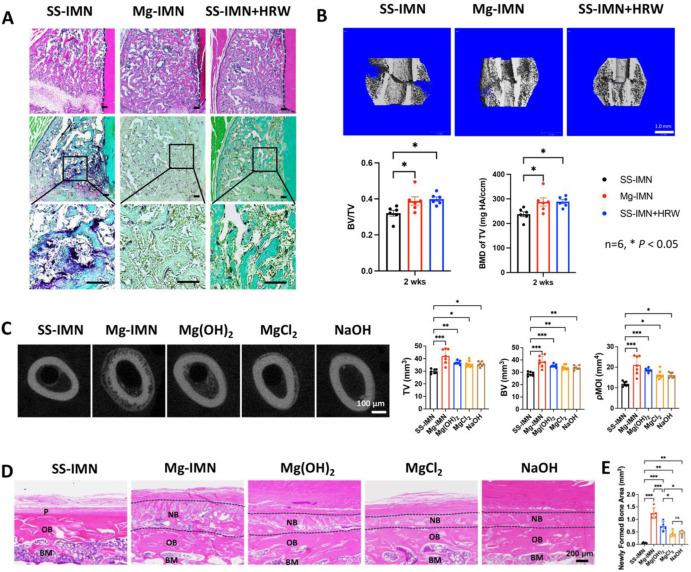
进一步在体内研究了镁降解产物对骨再生的单独及联合作用。首先,通过腹腔注射富氢盐水(HRS)以及饮用富氢水(HRW)这两种常用的氢气给予方法[33]补充氢气,可加速骨质疏松性骨折的愈合。镁髓内钉(Mg-IMN)组和不锈钢髓内钉(SS - IMN) + 富氢水(HRW)组均表现出纤维组织形成减少、软骨和钙化新骨形成增加,以及抗酒石酸酸性磷酸酶(TRAP)阳性细胞减少,这意味着骨吸收减少(图3A)。显微计算机断层扫描(Micro - CT)分析进一步显示,与不锈钢髓内钉(SS - IMN)组相比,在2周时这些组的骨体积(BV)/组织体积(TV)比值更高,骨矿物质密度(BMD)也有所增加(图3B),这表明氢气在镁髓内钉(Mg - IMN)植入组的骨质疏松性骨折早期愈合中发挥着有益作用。
 .
.
图3. 镁髓内钉(Mg-IMN)降解产物对增强骨再生的贡献。(A)不锈钢髓内钉(SS-IMN)组、镁髓内钉(Mg-IMN)组以及不锈钢髓内钉 + 富氢水(HRW)组在骨折2周时骨质疏松性骨折骨痂的代表性苏木精 - 伊红(H&E)染色和抗酒石酸酸性磷酸酶(TRAP)染色。比例尺,100 μm。(B)不锈钢髓内钉(SS-IMN)组、镁髓内钉(Mg-IMN)组以及不锈钢髓内钉 + 富氢水(HRW)组在骨折2周时骨质疏松性骨折骨痂的代表性显微计算机断层扫描(Micro-CT)图像及骨体积(BV)/组织体积(TV)比值、骨矿物质密度(BMD)的测量结果(下方)。*p < 0.05,采用单因素方差分析结合图基(Tukey)事后检验进行分析。数据以均值±标准差形式呈现。每组n = 6只动物。比例尺,1.0毫米。(C)在大鼠股骨远端植入不锈钢髓内钉(SS-IMN)、镁髓内钉(Mg-IMN)、氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)、氢氧化钠髓内钉(NaOH-IMN)2周后,新生骨的骨体积(BV)、组织体积(TV)、极惯性矩(ρMOI)的代表性显微计算机断层扫描(Micro-CT)图像及测量结果(右侧)。*p < 0.05,**p < 0.01,***p < 0.001,采用单因素方差分析结合图基(Tukey)事后检验进行分析。数据为均值±标准差形式。每组n = 7只动物。比例尺,100 μm。(D)在大鼠股骨远端植入不锈钢髓内钉(SS-IMN)、镁髓内钉(Mg-IMN)、氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)、氢氧化钠髓内钉(NaOH-IMN)2周后,股骨外周皮质新生骨的代表性苏木精 - 伊红(H&E)染色。(E)在大鼠股骨远端植入不锈钢髓内钉(SS-IMN)、镁髓内钉(Mg-IMN)、氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)、氢氧化钠髓内钉(NaOH-IMN)2周后,股骨外周皮质新生骨面积的测量结果。P:骨膜;NB:新生骨;OB:旧骨;BM:骨髓。比例尺,200 μm。*p < 0.05,**p < 0.01,***p < 0.001,采用单因素方差分析结合图基(Tukey)事后检验进行分析。数据为均值±标准差形式。每组n = 5只动物。
考虑到腹腔注射富氢盐水(HRS)和口服富氢水(HRW)可能产生的全身性影响,我们排除了氢气的影响,以便聚焦于镁降解产物的特定作用。将包含氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)、氢氧化钠髓内钉(NaOH-IMN)在内的含压缩盐的髓内钉,以及不锈钢髓内钉(SS-IMN)和镁髓内钉(Mg-IMN)植入大鼠股骨远端。显微计算机断层扫描(Micro-CT)测量结果证实了所有处理组均有促成骨作用,与对照组相比,其总骨体积(TV)、高矿化骨体积(BV)以及极惯性矩(ρMOI)均显著增加(图3C)。由于降解产物的单独或联合作用,在股骨外周皮质的新生骨中观察到了差异(图3D)。值得注意的是,镁髓内钉(Mg-IMN)使得股骨远端外周皮质有大量新骨形成,而氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)和氢氧化钠髓内钉(NaOH-IMN)相较于镁髓内钉(Mg-IMN),新生骨面积更小(图3E),这凸显了这三种降解产物在促进骨形成方面的重要作用。
3.4. 镁髓内钉(Mg-IMN)通过抑制肾上腺素能信号传导加速骨质疏松性骨折早期愈合过程
对镁髓内钉(Mg-IMN)在骨质疏松性骨折早期愈合过程(骨折后3天、6天、9天、12天、15天)中的作用进行了探究。镁髓内钉(Mg-IMN)组在第3天就显示出明显的肉芽组织堆积,而不锈钢髓内钉(SS-IMN)组则呈现出碎片化的骨组织,且肉芽组织极少(图4A)。到第6天,与不锈钢髓内钉(SS-IMN)组相比,镁髓内钉(Mg-IMN)组出现了更大面积的软骨形成以及众多未成熟的编织小梁骨病灶。从第9天到第15天,镁髓内钉(Mg-IMN)植入后显示出骨痂成熟度增加,有更成熟的类骨质基质、小梁骨样结构以及骨痂替代现象,并且观察到早期重塑迹象,即板层骨分散在编织骨之间(图4A)。相比之下,不锈钢髓内钉(SS-IMN)组类似的成熟和重塑过程有所延迟,大约在第15天才变得明显(图4A)。第15天的抗酒石酸酸性磷酸酶(TRAP)染色证实,与不锈钢髓内钉(SS-IMN)组相比,镁髓内钉(Mg-IMN)组骨痂中的破骨细胞活性更强(图4A)。免疫组织化学进一步显示,在第9天,镁髓内钉(Mg-IMN)组中成骨关键标志物Sp7(成骨相关转录因子,Osterix)和Runt相关转录因子2(Runx2)的表达上调(图4C),这表明镁髓内钉(Mg-IMN)比不锈钢髓内钉(SS-IMN)大约提前3天加速了成骨过程。此外,在第3天于软骨痂中观察到的小空隙到第15天逐渐消失,这表明可能有气体产生并扩散到了周围组织中。这些研究结果共同表明,镁髓内钉(Mg-IMN)植入通过在骨折部位周围产生并扩散氢气,加速了骨质疏松性骨折的早期再生过程。
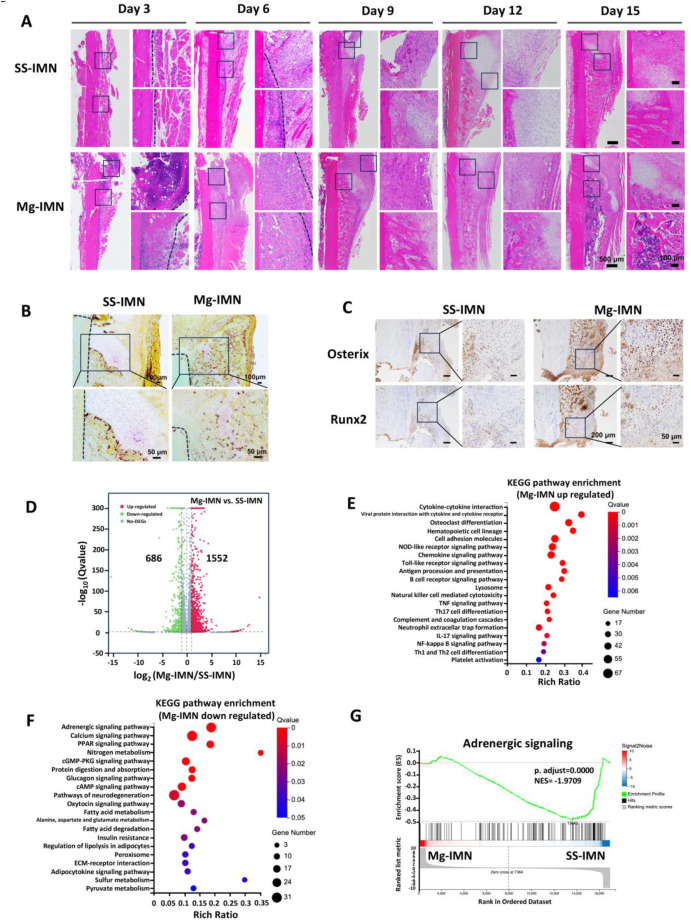
图4. 镁髓内钉(Mg-IMN)通过肾上腺素能信号传导加速骨质疏松性骨折早期愈合。(A)骨折后3天、6天、9天、12天和15天,植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)的骨质疏松性大鼠股骨骨折部位的代表性苏木精 - 伊红(H&E)染色。比例尺,500 μm(主图),100 μm(放大图)。剩余样本取自进行氢气和pH值检测后的样本。(B)镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)处理15天后骨痂的代表性抗酒石酸酸性磷酸酶(TRAP)染色图像。比例尺,100 μm(主图),50 μm(放大图)。(C)骨折后9天,植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)的骨折愈合骨痂处成骨相关转录因子(Osterix,Sp7)和Runt相关转录因子2(Runx2)的代表性免疫组织化学染色图像。比例尺,200 μm(主图),50 μm(放大图)。(D - G)骨折后9天,植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)的大鼠骨折股骨骨痂的RNA测序。差异表达基因(DEGs)设定为|log₂倍数变化| > 0且p < 0.05,将4个独立的骨痂合并进行RNA测序。差异表达基因(DEGs)的火山图(D)、镁髓内钉(Mg-IMN)上调差异表达基因的京都基因与基因组百科全书(KEGG)通路富集分析(E)、镁髓内钉(Mg-IMN)下调差异表达基因的京都基因与基因组百科全书(KEGG)通路富集分析(F)以及肾上腺素能信号通路的基因集富集分析(GSEA)(G),展示镁髓内钉(Mg-IMN)组与不锈钢髓内钉(SS-IMN)组之间的情况。
通过对大鼠骨痂进行批量RNA测序分析,进一步探究了镁髓内钉(Mg-IMN)加速骨折再生过程早期阶段的潜在调控机制。降解情况显示,骨折部位周围的氢气浓度和pH值在第9天达到峰值,与此同时,在植入镁髓内钉(Mg-IMN)后成骨标志物成骨相关转录因子(Osterix,Sp7)和Runt相关转录因子2(Runx2)表达上调(图4C)。因此,对骨折后9天的骨痂组织进行了RNA测序。火山图显示了镁髓内钉(Mg-IMN)的主导作用,即有1552个差异表达基因(DEGs)上调,686个差异表达基因下调(图4D)。对镁髓内钉(Mg-IMN)上调基因进行的京都基因与基因组百科全书(KEGG)分析显示,细胞因子 - 细胞因子相互作用、破骨细胞分化、造血细胞谱系以及细胞黏附信号通路等相关条目显著富集(图4E)。此外,涉及 toll样受体信号通路、B细胞受体信号通路、中性粒细胞胞外陷阱形成、白细胞介素 - 17信号通路、辅助性T细胞1(Th1)和辅助性T细胞2(Th2)细胞分化的免疫反应也得到了富集。在富集程度排名前五的信号通路条目中,筛选出了趋化因子配体6(Cxcl6)、趋化因子配体6(Ccl6)、血小板因子4(Pf4)、整合素αM(Itgam)、整合素β2(Itgb2)、肌联蛋白(Tnn)、成纤维细胞生长因子7(Fgf7)、成纤维细胞生长因子受体1(Fgfr1)、Ⅰ型胶原蛋白α1链(Col1a1)、Ⅻ型胶原蛋白α1链(Col12a1)、骨形态发生蛋白2(BMP2)、骨形态发生蛋白4(BMP4)和骨形态发生蛋白7(BMP7)。值得注意的是,通过对镁髓内钉(Mg-IMN)下调基因进行的京都基因与基因组百科全书(KEGG)分析,肾上腺素能信号通路是富集程度最显著的条目(图4F)。以140个肾上腺素能依赖基因作为一个基因集进行基因集富集分析(GSEA),证实了在镁髓内钉(Mg-IMN)负调控的基因中,肾上腺素能依赖基因有很强的富集,标准化富集分数(NES)为 - 1.9709,校正p值为0.000(图4G)。此外,与肾上腺素能信号传导相关的蛋白磷酸酶1调节亚基1A(Ppp1r1a)、兰尼碱受体2(Ryr2)、α1肾上腺素能受体(Adra1a)、钠通道β4亚基(Scn4b)、钙通道γ5亚基(Cacng5)等基因的表达被镁髓内钉(Mg-IMN)下调,这些可能是调节肾上腺素能信号传导的潜在靶点。
这些研究结果表明,镁髓内钉(Mg-IMN)可能通过抑制肾上腺素能信号通路,在骨质疏松性骨折愈合的早期阶段增强了骨质疏松性骨再生。
3.5. 镁髓内钉(Mg-IMN)对骨折愈合的感觉神经和交感神经调节作用
感觉神经和交感神经在调节骨再生和骨折愈合方面起着关键作用[34]。降钙素基因相关肽(CGRP)是一种重要的成骨肽,镁髓内钉(Mg-IMN)植入可诱导降钙素基因相关肽释放并加速骨愈合[10]。通过免疫组织化学分析进一步验证了感觉神经和交感神经对骨调节的作用。结果显示,在骨折部位周围组织以及形成钙化骨痂的成骨细胞中,降钙素基因相关肽(CGRP)的表达显著增加,尤其是在骨折后的早期阶段。相比之下,植入不锈钢髓内钉(SS-IMN)的部位降钙素基因相关肽(CGRP)表达要低得多(图5A)。此外,镁髓内钉(Mg-IMN)处理抑制了去甲肾上腺素(NE)的表达,去甲肾上腺素是交感神经系统的一种关键神经递质,在骨代谢中与降钙素基因相关肽(CGRP)起着相反的作用[20],在纤维组织、软骨以及新形成的骨痂中均有体现,而不锈钢髓内钉(SS-IMN)组中则观察到较高水平的去甲肾上腺素(图5B)。这种抑制作用伴随着酪氨酸羟化酶(TH)水平的降低,酪氨酸羟化酶是儿茶酚胺合成中的限速酶,在骨内的交感神经纤维中大量表达[20](图5C,图S1,S2)。镁髓内钉(Mg-IMN)还下调了肾上腺素能受体,特别是在骨折间隙周围新生组织和骨折后12天的骨痂中的β1肾上腺素能受体(ADRB1)、β2肾上腺素能受体(ADRB2)(图5D),这表明在骨愈合过程中对交感神经系统存在潜在的调节作用。总体而言,镁髓内钉(Mg-IMN)可能通过同时激活感觉神经降钙素基因相关肽(CGRP)通路并抑制交感神经信号传导,加速了骨折早期愈合过程。 .
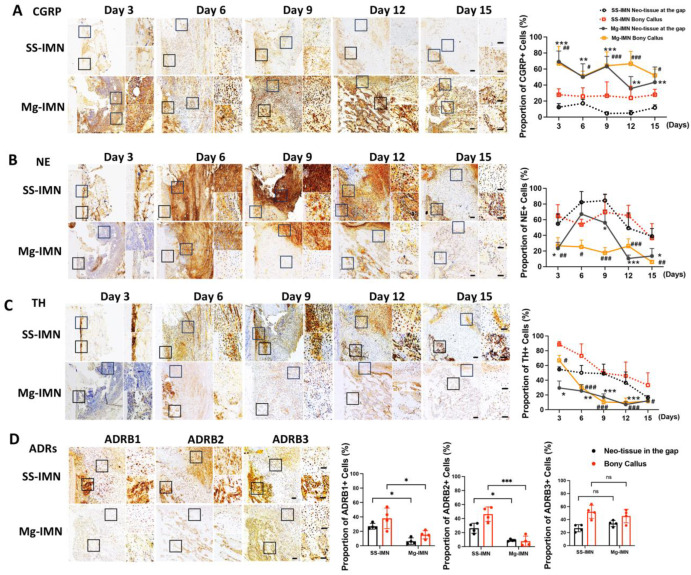
图5. 镁髓内钉(Mg-IMN)对骨再生的感觉神经与交感神经调节作用。在骨质疏松性骨折愈合早期阶段,骨折后3天、6天、9天、12天和15天,植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)的骨折间隙及骨痂处新生组织中降钙素基因相关肽(CGRP)(A)、去甲肾上腺素(NE)(B)和酪氨酸羟化酶(TH)(C)的免疫组织化学染色。(右侧为)骨折间隙及骨痂处新生组织中降钙素基因相关肽(CGRP)、去甲肾上腺素(NE)和酪氨酸羟化酶(TH)阳性细胞比例的定量分析。采用双因素方差分析结合图基(Tukey)事后检验,*p < 0.05,**p < 0.01,***p < 0.001,表示镁髓内钉(Mg-IMN)骨折间隙处新生组织与不锈钢髓内钉(SS-IMN)骨折间隙处新生组织的比较。#p < 0.05,##p < 0.01,###p < 0.001,表示镁髓内钉(Mg-IMN)骨痂与不锈钢髓内钉(SS-IMN)骨痂的比较。(D)在骨质疏松性骨折愈合早期阶段,骨折后12天,植入镁髓内钉(Mg-IMN)或不锈钢髓内钉(SS-IMN)的骨折间隙及骨痂处新生组织中肾上腺素能受体的免疫组织化学染色。(右侧为)骨折间隙及骨痂处新生组织中β1肾上腺素能受体(ADRB1)、β2肾上腺素能受体(ADRB2)、β3肾上腺素能受体(ADRB3)阳性细胞比例的定量分析。*p < 0.05,**p < 0.01,***p < 0.001,ns表示无显著性差异,采用单因素方差分析结合图基(Tukey)事后检验进行分析。文中所有数据均以均值±标准差形式呈现。每组n = 3 - 4只动物。比例尺,100 μm(主图),50 μm(放大图)。剩余样本取自进行氢气和pH值检测后的样本。
3.6. 镁降解产物在体外及体内对背根神经节(DRG)中降钙素基因相关肽(CGRP)的影响
镁髓内钉(Mg-IMN)植入可刺激局部感觉神经纤维释放降钙素基因相关肽(CGRP),进而诱导成骨作用[10]。我们研究了镁髓内钉(Mg-IMN)的三种降解产物在体外及体内如何影响背根神经节(DRG)中的降钙素基因相关肽(CGRP)。观察发现,将分离的背根神经节(DRG)浸泡在富氢培养基(HRM)中2小时,可显著降低背根神经节(DRG)中降钙素基因相关肽(CGRP)的表达(图6A)。同样,当背根神经节(DRG)暴露于碱性逐渐增强的环境(pH值从7.4到9.0)中1小时(图6B)和2小时(图6C)时,降钙素基因相关肽(CGRP)的表达逐渐降低。这些结果表明,氢气和碱性pH环境均能在相对较短的时间内刺激背根神经节(DRG)释放降钙素基因相关肽(CGRP)。通过酶联免疫吸附测定(ELISA)分析,对用富氢培养基(HRM)、碱性pH值8.5以及10 mM镁离子(Mg²⁺)处理2小时的大鼠背根神经节(DRG)培养上清液中的降钙素基因相关肽(CGRP)和P物质(SP)含量进行测量,进一步证实了上述结果。富氢培养基(HRM)处理使培养上清液中的降钙素基因相关肽(CGRP)水平显著升高至约300 pg/ml,pH值8.5处理使降钙素基因相关肽(CGRP)水平达到60 pg/ml。然而,在体外短时间内,2小时的镁离子(Mg²⁺)处理对背根神经节(DRG)释放降钙素基因相关肽(CGRP)并无显著影响,且未涉及全身性神经调节作用(图6D)。我们还比较了来自同一只大鼠相同数量背根神经节(DRG)中的降钙素基因相关肽(CGRP)含量,将一侧用于处理,另一侧作为对照,证实了经富氢水(HRW)处理后,降钙素基因相关肽(CGRP)(处理后的背根神经节与未处理的背根神经节相比)水平升高约10倍,经碱性pH值8.5处理后升高2 - 4倍。同样,2小时的镁离子(Mg²⁺)处理几乎没有影响(图6E)。值得注意的是,这些处理对P物质(SP)水平并无影响(图6F),这表明在调节降钙素基因相关肽(CGRP)释放通路方面具有特异性。
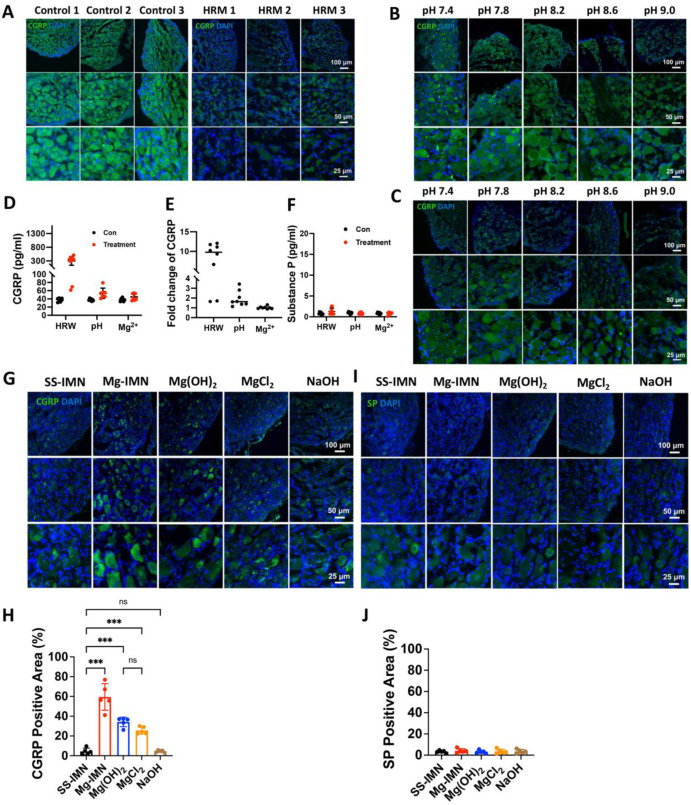
图6. 降解产物在体外及体内对背根神经节(DRG)中降钙素基因相关肽(CGRP)的影响。(A)在富氢培养基(HRM)中浸泡2小时的背根神经节(DRG)中降钙素基因相关肽(CGRP)的免疫荧光染色。大鼠背根神经节(DRG)浸泡在碱性pH值8.5培养基中1小时(B)和2小时(C)时降钙素基因相关肽(CGRP)表达的免疫荧光染色。(D)体外条件下,用富氢培养基(HRM)、碱性pH值8.5以及10 mM镁离子(Mg²⁺)处理2小时的培养基培养上清液中以及未处理的背根神经节(DRG)组(体外)的降钙素基因相关肽(CGRP)含量。(E)来自同一只大鼠经处理和未处理样本中相同数量背根神经节(DRG)的培养上清液中降钙素基因相关肽(CGRP)水平的倍数变化,以及(F)经处理和未处理的背根神经节(DRG)培养上清液中P物质(SP)的含量。数据以均值±标准差形式呈现,每组n = 8。对在大鼠股骨远端植入不锈钢髓内钉(SS-IMN)、镁髓内钉(Mg-IMN)、氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)或氢氧化钠髓内钉(NaOH-IMN)2周后的胸3 - 胸5(T3 - T5)背根神经节(DRG)中降钙素基因相关肽(CGRP)(G)、P物质(SP)(I)进行免疫荧光染色,并分析降钙素基因相关肽(CGRP)阳性区域比例(H)和P物质(SP)阳性区域比例(J)。*p < 0.05,**p < 0.01,***p < 0.001,ns表示无显著性差异,采用单因素方差分析结合图基(Tukey)事后检验进行分析,每组n = 5只动物。比例尺,100 μm(主图),50 μm和25 μm(放大图)。数据以均值±标准差形式呈现。
在此,通过分别将不锈钢髓内钉(SS-IMN)、镁髓内钉(Mg-IMN)、氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)和氢氧化钠髓内钉(NaOH-IMN)植入大鼠股骨远端,对降解产物在体内对背根神经节(DRG)中降钙素基因相关肽(CGRP)的影响进行了研究。对在股骨远端植入镁髓内钉(Mg-IMN)、氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)的大鼠的腰3 - 腰5(L3 - L5)背根神经节(DRG)进行免疫荧光检测,结果显示降钙素基因相关肽(CGRP)合成及突触小泡积聚显著增加(图6G和H)。相反,所有组别的P物质(SP)水平均未受影响(图6I和J)。值得注意的是,包括氢氧化镁髓内钉(Mg(OH)₂-IMN)和氯化镁髓内钉(MgCl₂-IMN)在内的镁离子(Mg²⁺)处理导致降钙素基因相关肽(CGRP)突触小泡有适度增加,而单独的碱性pH环境对降钙素基因相关肽(CGRP)合成几乎没有影响(图6H)。这些结果表明,镁髓内钉(Mg-IMN)诱导的背根神经节(DRG)中降钙素基因相关肽(CGRP)合成增强主要源于镁离子(Mg²⁺)和氢气(H₂),而非单独的碱性pH环境。
3.7. 镁降解产物在体内对骨再生的局部感觉神经和交感神经调节作用
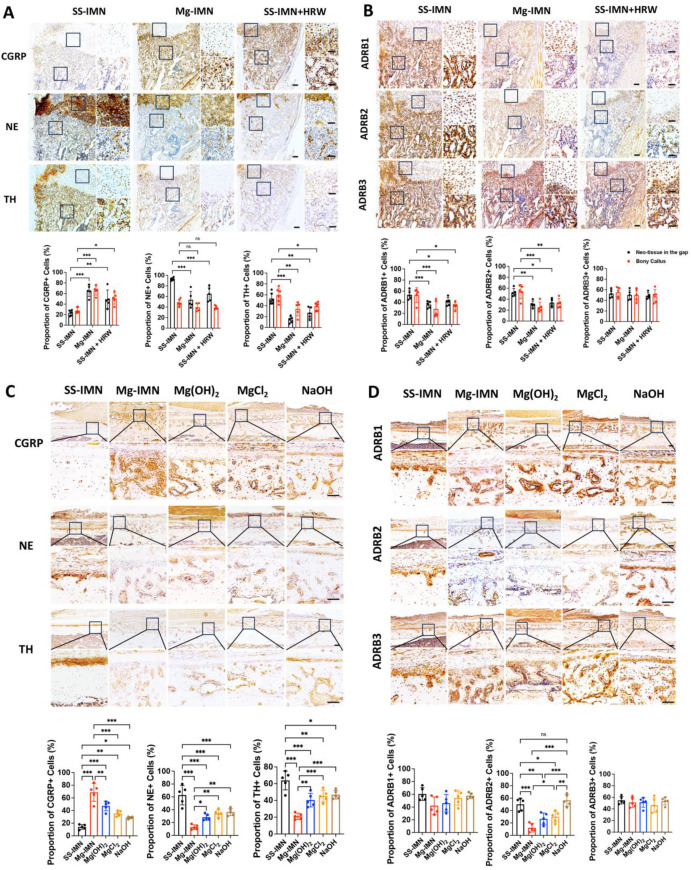
对局部感觉神经和交感神经对新生骨的调节作用进行了研究。研究发现,补充氢气可增加骨折间隙周围新生组织和硬骨痂中感觉神经的降钙素基因相关肽(CGRP)表达(图7A)。同时,骨折间隙处新生组织中肾上腺素能的去甲肾上腺素(NE)表达、骨折线附近新生组织及骨痂中的酪氨酸羟化酶(TH)(图7A)以及肾上腺素能受体β1(ADRB1)和β2(ADRB2)(图7B)表达均显著降低。这些研究结果表明,补充氢气时所观察到的骨再生增强现象可能是由局部感觉神经和交感神经抑制通路所介导的。
.
图7. 镁髓内钉(Mg-IMN)降解产物对骨再生的感觉神经与交感神经调节作用。不锈钢髓内钉(SS-IMN)组、镁髓内钉(Mg-IMN)组以及不锈钢髓内钉 + 富氢水(HRW)组在骨质疏松性骨折愈合2周时骨痂中降钙素基因相关肽(CGRP)、去甲肾上腺素(NE)和酪氨酸羟化酶(TH)(A)、肾上腺素能受体(B)的免疫组织化学染色。(下方为)新生组织和骨痂中降钙素基因相关肽(CGRP)、去甲肾上腺素(NE)、酪氨酸羟化酶(TH)、β1肾上腺素能受体(ADRB1)、β2肾上腺素能受体(ADRB2)和β3肾上腺素能受体(ADRB3)阳性细胞比例的定量分析。*p < 0.05,**p < 0.01,***p < 0.001,ns表示无显著性差异,采用单因素方差分析结合图基(Tukey)事后检验进行分析,每组n = 5只动物。比例尺,100 μm(主图),50 μm(放大图)。在大鼠股骨远端植入不锈钢髓内钉(SS-IMN)、镁髓内钉(Mg-IMN)、氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)、氢氧化钠髓内钉(NaOH-IMN)2周后,股骨外周皮质新生骨中降钙素基因相关肽(CGRP)、去甲肾上腺素(NE)和酪氨酸羟化酶(TH)(C)、肾上腺素能受体(D)的免疫组织化学染色。(下方为)股骨外周皮质新生骨中降钙素基因相关肽(CGRP)、去甲肾上腺素(NE)、酪氨酸羟化酶(TH)、β1肾上腺素能受体(ADRB1)、β2肾上腺素能受体(ADRB2)和β3肾上腺素能受体(ADRB3)阳性细胞比例的定量分析。*p < 0.05,**p < 0.01,***p < 0.001,ns表示无显著性差异,采用单因素方差分析结合图基(Tukey)事后检验进行分析,每组n = 5只动物。比例尺,200 μm(主图),50 μm(放大图)。文中所有数据均以均值±标准差形式呈现。
当排除氢气以观察其他降解产物对局部感觉神经和交感神经调节的影响时,数据显示,与对照组相比,股骨外周皮质新生骨中降钙素基因相关肽(CGRP)的表达显著增加(图7C)。此外,不锈钢髓内钉(SS-IMN)组中肾上腺素能的去甲肾上腺素(NE)和酪氨酸羟化酶(TH)的高表达被降解产物显著抑制(图7C)。氢氧化镁髓内钉(Mg(OH)₂-IMN)、氯化镁髓内钉(MgCl₂-IMN)和氢氧化钠髓内钉(NaOH-IMN)对这些神经递质也有部分抑制作用,尽管相较于镁髓内钉(Mg-IMN)程度稍弱(图7C)。关于肾上腺素能受体,镁髓内钉(Mg-IMN)可使股骨外周皮质新生骨中的β2肾上腺素能受体(ADRB2)显著下调,氢氧化镁髓内钉(Mg(OH)₂-IMN)和氯化镁髓内钉(MgCl₂-IMN)次之,而氢氧化钠髓内钉(NaOH-IMN)则不受影响(图7D)。这些研究结果表明,镁的降解产物可激活局部感觉神经,同时通过减少向局部骨组织释放神经递质(尤其是通过对β2肾上腺素能受体(ADRB2)的作用)来抑制交感神经调节,不过其作用程度比镁髓内钉(Mg-IMN)弱,而单独的碱性pH环境并不影响肾上腺素能受体。
4. 讨论
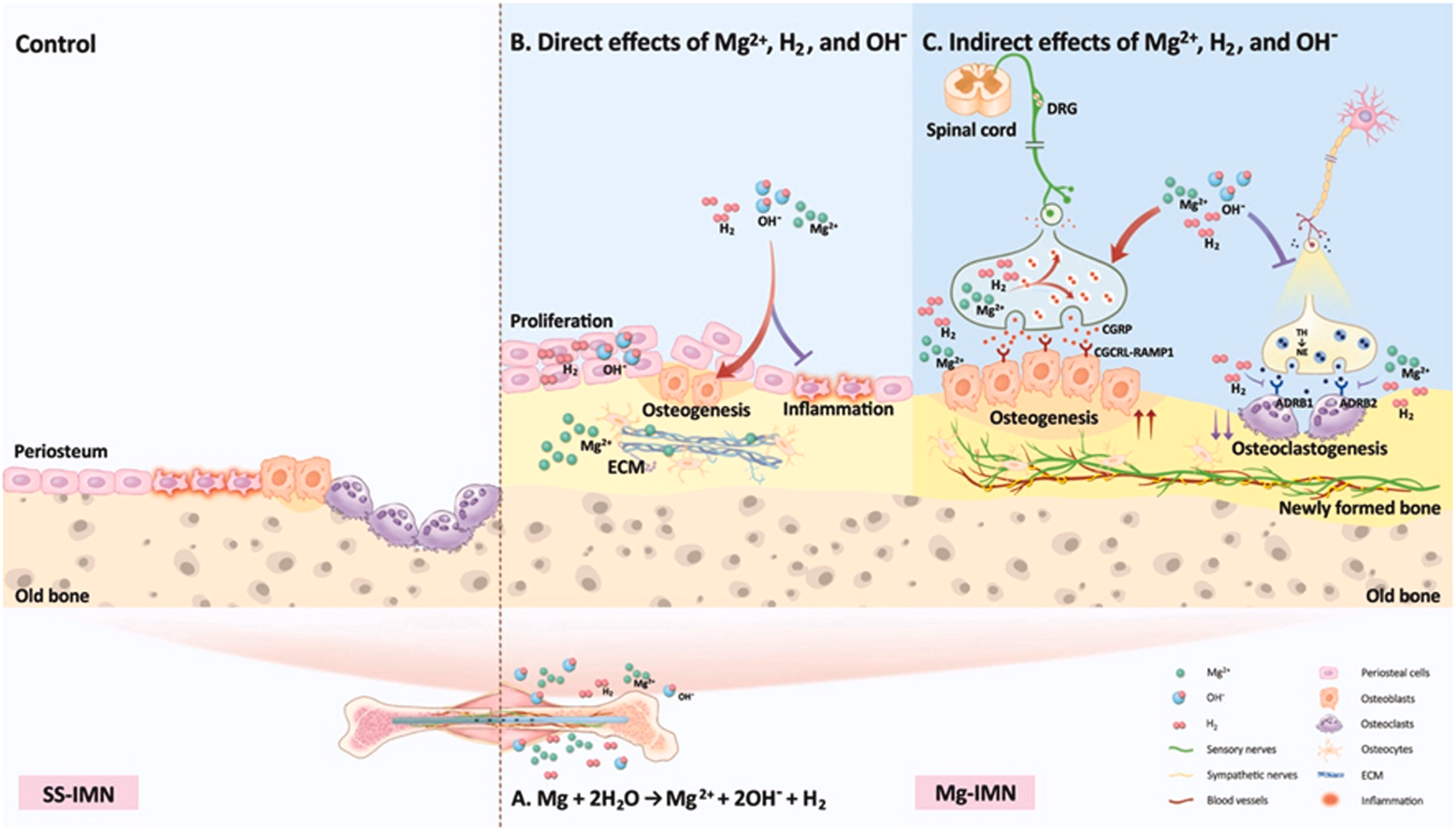
基于镁的植入物因在促进成骨和血管生成从而增强骨再生方面具有巨大潜力而受到越来越多的关注[35,36,37,38]。近期的研究主要聚焦于镁离子(Mg²⁺)在骨再生中的作用。然而,镁的降解不仅会导致镁离子(Mg²⁺)增多,还会产生氢气(H₂)和氢氧根离子(OH⁻),后者会形成局部碱性环境。但这三种镁降解产物在骨折修复过程中的相互作用或影响仍不清楚。在本研究中,我们对植入骨质疏松性骨折股骨中的镁植入物的时空降解情况进行了研究,结果表明在镁髓内钉(Mg-IMN)植入后,主要在骨质疏松性骨折愈合的早期阶段会产生镁离子(Mg²⁺)、氢气(H₂)和氢氧根离子(OH⁻)。此外,我们还发现了一种此前未被发现的感觉神经激活和交感神经抑制机制,该机制调控着镁髓内钉(Mg-IMN)对骨质疏松性骨折早期愈合的促进作用,镁离子(Mg²⁺)、氢气(H₂)和碱性pH环境各自发挥着相当的且具有协同性的作用(图8)。因此,镁髓内钉(Mg-IMN)在临床上应用于加速骨再生方面具有很大的潜力。
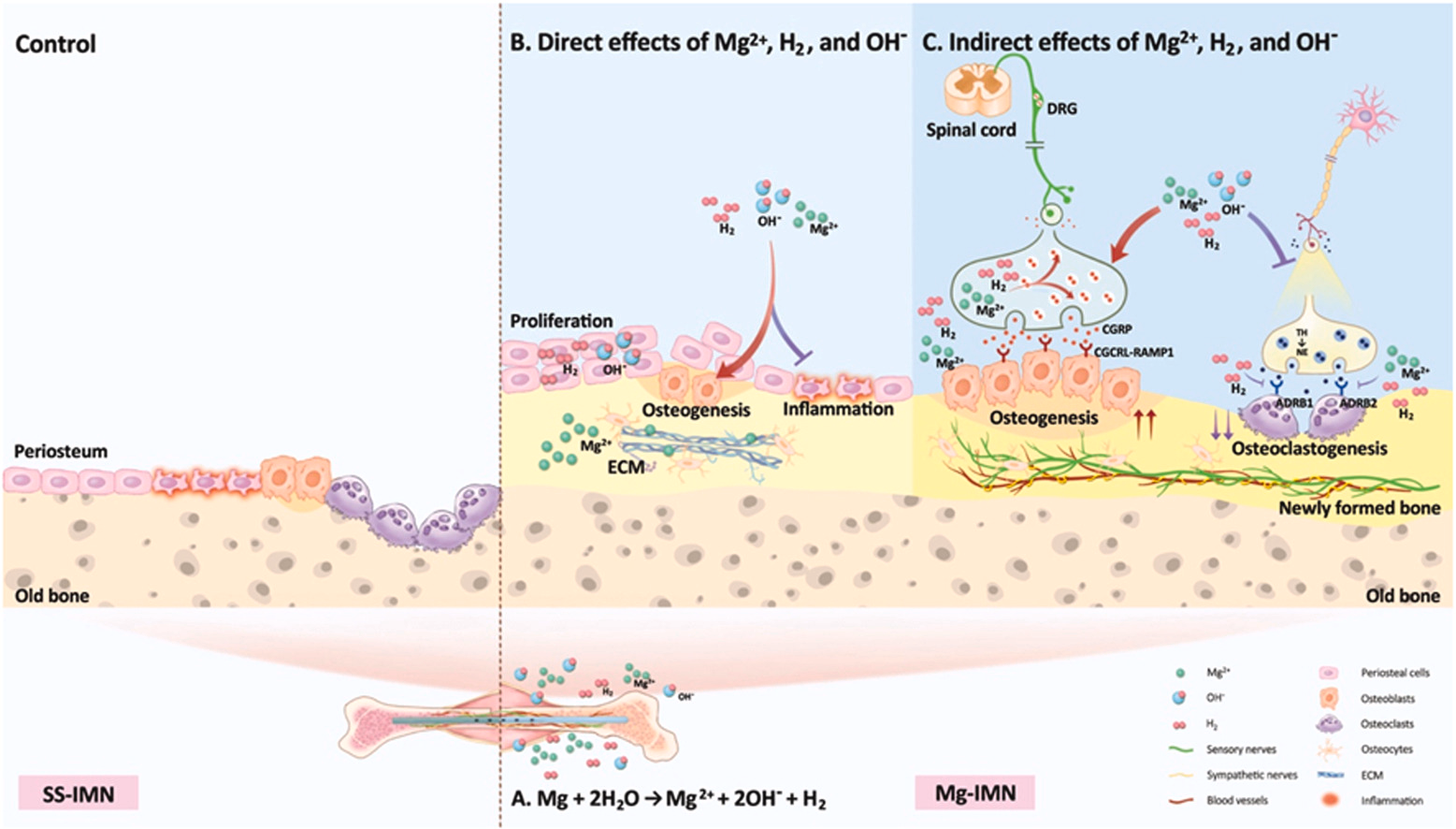
图8. 展示可生物降解镁释放的镁离子(Mg²⁺)、氢气(H₂)和氢氧根离子(OH⁻)对骨再生的不同及协同作用示意图。(A)在骨质疏松性骨折早期愈合阶段,镁髓内钉(Mg-IMN)的植入使镁离子(Mg²⁺)、氢气(H₂)和氢氧根离子(OH⁻)释放到骨折部位周围组织中。(B)这三种降解产物直接促进成骨并减轻炎症。具体而言,氢气(H₂)和氢氧根离子(OH⁻)(其营造出碱性pH环境)可促进细胞增殖,而镁离子(Mg²⁺)可能主要改善细胞外基质(ECM)。(C)当植入镁髓内钉(Mg-IMN)时,镁离子(Mg²⁺)、氢气(H₂)和氢氧根离子(OH⁻)对改善骨再生有着相当的贡献。这一过程涉及感觉通路的激活和交感神经信号传导的抑制。值得注意的是,镁离子(Mg²⁺)和氢气(H₂),而非氢氧根离子(OH⁻),可增加降钙素基因相关肽(CGRP)的合成并抑制肾上腺素能受体。 4.1. 植入骨折股骨的可生物降解镁的降解情况我们这项研究的一个主要贡献在于,我们系统地检测了体内镁的降解情况,并揭示了植入骨质疏松性骨折股骨的镁髓内钉(Mg-IMN)的时空降解情况。植入后,根据阳极和阴极反应Mg + 2H₂O → Mg²⁺ + 2OH⁻ + H₂ [13,39],会产生镁离子(Mg²⁺)、氢气(H₂)和碱性pH环境。植入物界面处降解产物的浓度比整体浓度更为重要[40]。在本研究中,我们观察到在骨折后15天内,尤其是在植入物界面周围存在氢气(H₂)、碱性pH环境以及镁离子(Mg²⁺)浓度升高的情况。氢气(H₂)和碱性pH值呈现出特定的时间变化模式,在体内骨折后3天和9天出现双峰现象。第一个峰值出现在第3天,此时这些降解产物能够不受阻碍地扩散到周围的血肿和骨髓中。第二个峰值的出现是由于骨折间隙周围组织逐渐再生,使得氢气(H₂)在骨痂和骨髓中逐渐达到饱和状态。此后,镁髓内钉(Mg-IMN)几乎停止降解,仅有少量氢气(H₂)产生,碱性pH值恢复至中性。 先前的研究将降解产物的快速突发式释放与体积相关问题联系起来[41,42],而我们的研究观察到从髓内钉(IMN)的孔洞区域到屏蔽区域呈现出缓慢的坑蚀模式。此外,本研究中镁的总体积相对较小(对于直径为0.7毫米、长度为1.5厘米的棒材,大约为10毫克),即便在植入后6周和12周,大部分仍未降解,这比镁螺钉的情况要小得多,在体内,镁螺钉周围骨髓腔血浆中的镁离子(Mg²⁺)浓度在浸泡72小时后,仅从0.95 mM升高到1.07 mM(在生理浓度范围0.65 - 1.05 mM内)[43],因为镁浓度不存在健康风险的临界阈值是3.5 mM [44]。此外,我们发现骨髓中氢气(H₂)浓度在第9天达到峰值,约为300 μM,远低于液体环境中0.8 mM/1.6 ppm的饱和氢气浓度[45],且不足以形成气泡。而且,在我们的实验过程中,在骨折部位未观察到肿胀、出血或气腔的情况,部分原因是氢气(H₂)是小分子,具有高渗透性,扩散和吸收能力强[46],并且由于气体大部分被周围组织吸收,未观察到对骨愈合安全性有不良影响[47,48]。植入物 - 骨界面处的pH值在很大程度上取决于含镁植入物的腐蚀速率,其往往呈碱性,范围在8.0到8.5之间,而整体pH值接近体内酸碱平衡所维持的生理pH值[40]。与这一发现相符的是,我们的研究表明,在骨质疏松性骨折早期愈合期间,骨折线附近的pH值保持在碱性范围,为7.5到8.5之间。局部碱化会触发体液中钙离子(Ca²⁺)和磷酸根离子(PO₄³⁻)的沉淀,形成类羟基磷灰石腐蚀产物,并在金属表面形成一层保护层[49],这可能也是降解过程减缓的一个原因。 4.2. 镁金属产生的三种产物在体外及体内对骨再生的单独及协同生物学效应另一个主要发现是,镁髓内钉(Mg-IMN)产生的三种镁降解产物对骨再生具有单独及协同的生物学效应。先前的研究与我们的发现相符,即氢气(H₂)可促进自主干细胞早期增殖和组织再生[33,50],增强成骨作用[51],并抑制破骨细胞分化[52]。细胞外基质(ECM)成分,包括胶原蛋白,已知可支持干细胞迁移并为祖细胞提供支架[53],我们的RNA测序数据分析很好地支持了镁离子(Mg²⁺)可上调参与细胞外基质相互作用和细胞黏附通路的基因这一观点。此外,碱性pH环境可作为一种触发因素,刺激再生和愈合过程以重建功能化环境[54],促进胶原蛋白的合成与交联,促进羟基磷灰石形成[55],诱导成骨细胞分化,并抑制破骨细胞活性[56,57]。这些因素共同为骨愈合和再生创造了有利的微环境。此外,由这三种降解产物下调的差异表达基因(DEGs)在与炎症抑制、免疫或凋亡相关通路的相关条目上显著富集。我们的研究强化了镁离子(Mg²⁺)对炎症和免疫调节至关重要这一观点[58,59,60,61]。此外,氢气(H₂)对细胞保护具有抗氧化、抗凋亡和抗炎活性[33,62]。与pH值在8.0 - 8.5的碱化倾向于抑制炎性小体激活,而pH值在6.0 - 7.0的酸化是引发先天性免疫从而导致炎症的危险信号这一研究结果相符[63]。总体而言,我们的研究强调了这些镁髓内钉(Mg-IMN)降解产物在体外骨愈合和再生中的多重作用。 通过体内研究进一步探究了这三种降解产物的作用及贡献率。我们目前的研究首次全面揭示了镁髓内钉(Mg-IMN)对骨折后早期愈合过程的影响及调控情况,而早期阶段对于骨折成功愈合起着决定性作用[64]。先前对镁髓内钉(Mg-IMN)影响骨质疏松性骨折愈合的研究是从骨折后2周开始到12周及以后进行考察的[10]。我们的研究结果表明,植入骨折股骨的镁髓内钉(Mg-IMN)主要在植入后的最初2周内发生降解。骨折愈合早期阶段的特点是存在低氧、低pH值以及钠离子(Na⁺)、钾离子(K⁺)离子水平不平衡等情况[64],由于氢气(H₂)可减轻慢性间歇性缺氧中的活性氧(ROS)水平[65],在纯镁降解过程中会出现碱性pH环境和镁离子(Mg²⁺)浓度升高的情况[13],而且镁离子(Mg²⁺)已被研究证实具有增强骨形成和成骨的能力[10,26]。因此,镁植入物可促进骨再生,但这种反应不应仅仅归因于镁离子(Mg²⁺),氢气(H₂)和碱性环境的作用也不应被忽视。我们的研究结果显示,通过口服饮用富氢水(HRW)和腹腔注射富氢盐水(HRS)(这是常用的氢气给予方法[33],使其成为临床上便捷的选择)对小鼠进行处理,可显著加速骨质疏松性骨折的愈合。与其他几项先前的研究也报道了氢气(H₂)对骨再生的影响相符,氢气(H₂)通过消除氧化应激有助于预防骨质疏松症中的骨质流失[17],增强斑马鱼胚胎的成骨作用[51],防止破骨细胞分化[52],并通过减轻自噬加速骨折愈合[66]。值得注意的是,在本研究中,腹腔注射和口服饮用富氢水(HRW)不仅产生局部作用,还会产生全身性影响[33],在排除氢气(H₂)的影响后,植入大鼠股骨远端的氯化镁髓内钉(MgCl₂-IMN)和氢氧化钠髓内钉(NaOH-IMN)在股骨外周皮质都形成了大量新骨,尽管其骨再生效果不如镁髓内钉(Mg-IMN)。饮用碱性水已被证明可改善绝经后骨质疏松女性的脊柱骨矿物质密度(BMD)[67],氢氧化镁(Mg(OH)₂)可增强成骨细胞活性和骨形成[68]。我们的研究证实,镁髓内钉(Mg-IMN)促进骨再生加速可相当程度地归因于三种降解产物:局部产生的氢气(H₂)、碱性pH环境以及升高的镁离子(Mg²⁺)。为了更深入地了解它们对骨愈合的影响,有必要控制来自镁髓内钉(Mg-IMN)的降解产物的等效剂量以进行进一步研究。
4.3. 骨再生过程中降解产物对感觉神经的激活作用
骨再生是一个涉及神经依赖机制的复杂过程,骨膜和骨小梁区域密布着从脊髓背根神经节(DRG)延伸而来的感觉神经纤维,它们影响着骨代谢和生长[34,69]。镁髓内钉(Mg-IMN)在骨折愈合早期显著增加了骨痂中感觉神经的降钙素基因相关肽(CGRP)表达,这与先前的研究结果相符,即镁金属植入后,细胞外镁离子(Mg²⁺)浓度升高,诱导背根神经节(DRG)内细胞内三磷酸腺苷(ATP)升高以及降钙素基因相关肽(CGRP)囊泡聚集,从而加速了骨再生[10,26]。在体外短期处理且无全身性神经调节的情况下,镁离子(Mg²⁺)对背根神经节(DRG)的降钙素基因相关肽(CGRP)释放影响极小,这表明镁离子(Mg²⁺)需要完整的感觉神经通路,因为先前的研究证实,镁离子(Mg²⁺)内流增加可显著增强体内背根神经节(DRG)的降钙素基因相关肽(CGRP)释放[10]。通过酶联免疫吸附测定(ELISA)分析发现,用富氢培养基(HRM)处理2小时的大鼠背根神经节(DRG)培养上清液中降钙素基因相关肽(CGRP)含量有所增加。而在体内,富氢水(HRW)增加了骨折间隙周围新生组织和硬骨痂中的感觉神经降钙素基因相关肽(CGRP)表达,这表明氢气(H₂)在降钙素基因相关肽(CGRP)调节中起着关键作用,它不仅刺激背根神经节(DRG)释放降钙素基因相关肽(CGRP),而且使更多的降钙素基因相关肽(CGRP)与局部组织结合以加速骨再生。
在体内,单独给予氢气(H₂)、镁离子(Mg²⁺)和碱性pH环境均显著增加了新生骨中的局部感觉神经活动。有意思的是,在体内,镁离子(Mg²⁺)和氢气(H₂),而非单独的碱性pH环境,促进了大鼠背根神经节(DRG)中降钙素基因相关肽(CGRP)的合成及囊泡积聚。这与一项研究结果相符,该研究表明含10%氯化镁(MgCl₂)的粉末通过骨骼内感受回路促进骨形成,同时伴有小鼠体内降钙素基因相关肽(CGRP)阳性神经纤维的出芽和分支生长[26]。关于氢气(H₂)和碱性pH环境对骨骼内感受调节作用的研究有限,然而,有几项研究指出,氢气(H₂)发挥神经保护、抗神经炎症作用,缓解神经性疼痛及神经系统紊乱,主要是基于其抗氧化和抗凋亡特性[70,71,72]。镁离子(Mg²⁺)通过镁离子转运体或通道(如,镁离子转运蛋白1(MAGT1)和瞬时受体电位通道M7(TRPM7))刺激局部感觉神经纤维[10,73]。同样,氢气(H₂)可能也有特定的转运体或通道,以及对碱性敏感的通道。氢气(H₂)在人体内的具体作用靶点仍相对缺乏深入研究。
4.4. 骨再生过程中降解产物对交感神经的抑制作用
本研究的另一个新发现是,我们确定了镁髓内钉(Mg-IMN)及其降解产物可能通过同时抑制交感神经元活动来促进骨再生。在感觉神经去神经支配模型中,交感神经张力会增加[74],交感神经的去甲肾上腺素(NE)和酪氨酸羟化酶(TH)属于分解代谢因子[25,75]。感觉通路与交感神经调节在机制上如何相互作用仍有待确定,特别是考虑到感觉神经元通过对交感神经起到制动作用来调节骨再生时[76,77]。在我们的研究中,镁髓内钉(Mg-IMN)显著抑制了新生组织中的肾上腺素能去甲肾上腺素(NE)和酪氨酸羟化酶(TH),这种抑制作用在降解产物镁离子(Mg²⁺)、氢气(H₂)和碱性pH环境中也能部分观察到。镁离子(Mg²⁺)通过显著的降钙素基因相关肽(CGRP)活性促进新骨形成,同时抑制交感神经[10,26],这与我们的研究结果相符。最近,氢气(吸入1.3%氢气 + 21%氧气 + 77.7%氮气,每天1小时)通过抑制过度活跃的交感神经系统并增强副交感神经系统的活动,改善了自主神经失衡状况[78]。此外,细胞外酸化是产生疼痛的病理状况下的一个常见特征,细胞外氢离子(H⁺)被视为酪氨酸羟化酶(TH)激活的一个新信号[79],尽管目前缺乏将氢气(H₂)和碱性pH环境与骨再生过程中交感神经调节直接关联起来的证据。
交感神经末梢释放的去甲肾上腺素(NE)作用于α - 和β - 肾上腺素能受体(ADRs)来调节成骨细胞和破骨细胞的活动[34,80,81],全身性破坏α - 肾上腺素受体对骨组织几乎没有影响[82]。我们的研究结果证实,镁髓内钉(Mg-IMN)抑制了骨质疏松性骨折骨痂中的β1肾上腺素能受体(ADRB1)和β2肾上腺素能受体(ADRB2)。镁离子(Mg²⁺)主要靶向抑制β2肾上腺素能受体(ADRB2),这与另一项研究结果相符[26]。暴露于氢气(H₂)环境下会导致β1肾上腺素能受体(ADRB1)和β2肾上腺素能受体(ADRB2)表达受到抑制。然而,似乎单独的碱性pH环境对任何肾上腺素能受体(ADRs)都没有直接影响,可能会间接抑制交感神经递质,这或许是因为对不同肾上腺素能受体(ADRs)的偏好有所不同[83]。总体而言,镁髓内钉(Mg-IMN)及其降解产物促进骨再生加速似乎是通过同时抑制交感神经信号传导来介导的,与镁髓内钉(Mg-IMN)相比,降解产物各自的调节作用不太显著,这进一步强化了镁髓内钉(Mg-IMN)为促进骨愈合提供了一种综合性方法的观点。
4.5. 局限性
考虑到镁在体液中的降解过程较为复杂,会受到溶液化学参数以及金属与生物分子之间相互作用的影响,这是本研究存在的一个局限性。精确控制降解产物以及使其剂量与镁髓内钉(Mg-IMN)的降解情况相匹配,对于准确理解它们的作用至关重要,但在体内骨愈合过程中要实现这一点颇具挑战性。本研究传达的信息未涵盖骨质疏松性骨折愈合后期超过2周的时间点,这也是一个局限所在。还需要进一步研究来解决关于大型动物或患有病变组织的患者体内镁降解的最终去向这一未解答的问题,并阐明神经递质在神经 - 骨相互作用中如何调节宿主与镁髓内钉(Mg-IMN)联合作用的动力学及作用程度。
5. 结论
综上所述,本研究表明,在将镁髓内钉(Mg-IMN)植入骨质疏松性骨折股骨后,系统地检测了其降解情况,发现在骨折后15天内的早期愈合阶段,主要在骨折间隙周围会产生镁离子(Mg²⁺)、氢气(H₂)和碱性pH环境。这些因素单独及协同地促进了骨形成,对于镁髓内钉(Mg-IMN)加速骨再生的作用,各自大约贡献了三分之一的力量。我们已经确定了在镁髓内钉(Mg-IMN)加速骨折早期愈合过程中感觉神经激活以及同时抑制交感神经的调节机制。这一机制似乎是由氢气(H₂)、镁离子(Mg²⁺)和碱性pH环境的产生所介导的,它们共同促进了骨再生。发现镁髓内钉(Mg-IMN)的三种降解产物通过骨骼内感受作用对骨再生产生影响,这能够巩固我们目前对镁髓内钉(Mg-IMN)加速骨再生潜在机制的理解,并有益于其临床应用,例如我们早期的一项临床研究,使用可生物降解的镁螺钉固定骨瓣,以有效治疗股骨头坏死(ONFH),因为镁离子(Mg²⁺)、氢气(H₂)和碱性pH环境是针对糖皮质激素诱导的股骨头坏死(ONFH)潜在病理的三个有益因素。
https://blog.sciencenet.cn/blog-41174-1466477.html
上一篇:如何确保只有死亡的细胞才会破裂
下一篇:NIH科学家们观察到低密度脂蛋白和受体结合过程