博文
黏性困境:细菌如何推动结肠癌的发展  精选
精选
|
黏性困境:细菌如何推动结肠癌的发展
一些细菌可以引发与结肠癌相关的突变。对于使这些细菌能够附着在宿主细胞上的表面粘附蛋白的洞察,指出了可能导致肿瘤形成的步骤可能会被阻止。
细菌可以通过损害宿主DNA和诱导促进癌症基因的特定突变来促成结肠癌的发展1。Jans等人在《自然》杂志上发表的报告中2,描述了细菌对宿主细胞的粘附如何使某些菌株特别危险。这些发现为识别致癌细菌和提供制定预防策略的目标开辟了新天地。
大肠杆菌是肠道中最普遍且研究最深入的细菌种类之一3。2006年,有报告称特定的大肠杆菌菌株可以产生一种名为colibactin的分子,该分子可以损害人类DNA4。与健康个体相比,这些能产生colibactin的大肠杆菌菌株在患有结肠肿瘤或可能发展成肿瘤的异常细胞(称为前体病变)的人中检测到的频率更高5-7。与此一致的是,研究表明八分之一的结肠肿瘤暴露于colibactin之下,并且这种暴露与疾病的早期发病有关8。
然而,并非所有能产生colibactin的大肠杆菌菌株在诱导突变的潜力方面都是平等的。例如,常用的有益细菌治疗剂——益生菌E. coli Nissle 1917(EcN)菌株,与其他能产生colibactin的大肠杆菌菌株相比,造成的DNA损害显著较少8,9。随着早发性结肠癌的增加10,理解特定的colibactin产生型大肠杆菌何时以及如何影响人类基因组,以及是否可以预防由此产生的遗传毒性损伤将是至关重要的。
Jans及其同事通过研究细菌与小鼠结肠表面的细胞结合如何放大colibactin引起的DNA损伤和癌症起始,提供了与这些问题相关的重要见解。作者专注于使细菌能够附着在宿主细胞上的细菌粘附素蛋白FimH和FmlH,并鉴定出大肠杆菌菌株之间的微妙差异。尽管作为益生菌的EcN菌株和一个与人结肠癌有关的大肠杆菌菌株(11G5)都产生了相似水平的colibactin,但他们各自版本的FimH中仅三个氨基酸残基的差异导致了小鼠结肠癌模型中的截然不同的结果(图1)。作者报告说,EcN附着在保护结肠表面的粘液层上,而11G5则牢固地附着在结肠细胞上,甚至侵入它们和结肠的底层组织。因此,与被EcN定植的小鼠相比,被11G5菌株定植的小鼠的DNA损伤和随后的癌症发展显著增加。
Colibactin-driven colon cancer requires adhesin-mediated epithelial binding | Nature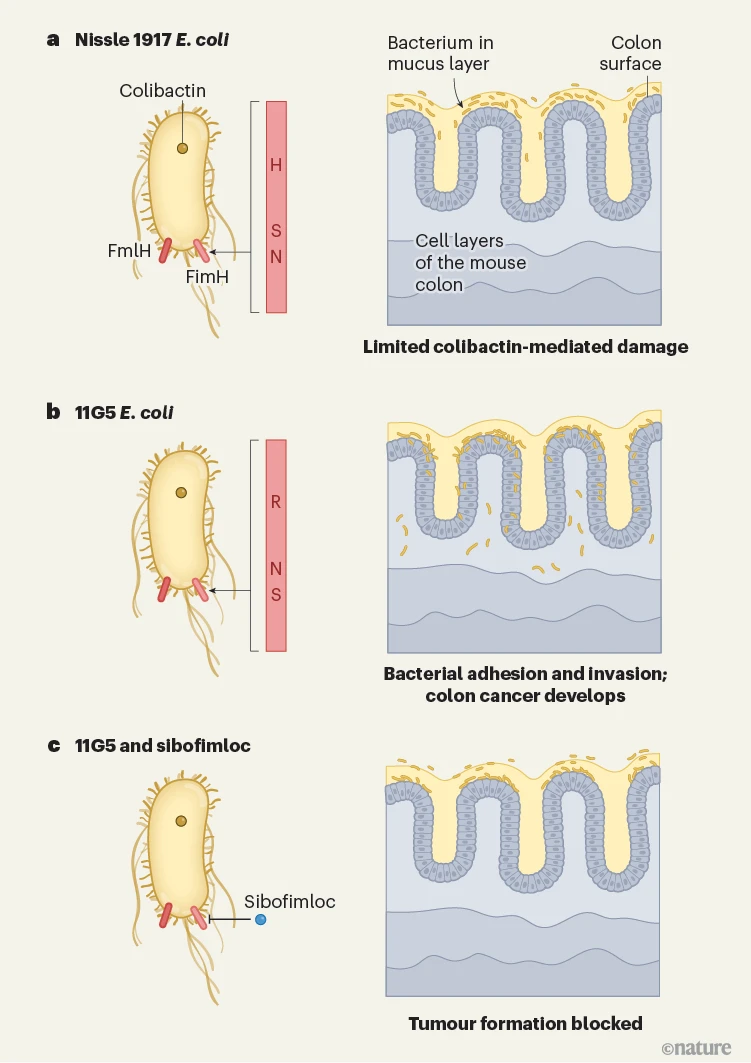
图1 | 细菌如何与宿主细胞结合影响患结肠癌的风险。某些大肠杆菌菌株通过从微生物到哺乳动物细胞转移促进突变的分子colibactin与结肠癌的发展有关。Jans等人2报道,细菌细胞表面需要有FmlH和FimH蛋白,以便在附着过程中粘附在宿主细胞上。a, b, E. coli Nissle 1917菌株没有穿透覆盖结肠表面的细胞的粘液层,因此造成的DNA损伤很小,没有肿瘤形成。这种细菌上的FimH蛋白与从患有结肠癌的人分离出的11G5大肠杆菌菌株上的FimH蛋白仅由三个氨基酸残基不同(红色竖线)。不同的残基用单字母代码表示氨基酸:H,组氨酸;N天冬酰胺;R精氨酸;S丝氨酸。Jans等人报道,11G5菌株可以穿过粘液层,然后附着并侵入小鼠的宿主细胞,驱动肿瘤形成。c, 用临床批准的FimH抑制剂sibofimloc处理小鼠可以阻断11G5菌株的促肿瘤活动。
作者通过体外实验进一步验证了11G5中发现的三个氨基酸变体的FimH的关键作用。通过在菌株之间交换粘附素版本,Jans及其同事展示了与EcN变体相比,11G5 FimH变体在宿主细胞中的附着和致突变性显著增加。
这项研究还展示了两种粘附素在人类细胞上结合的目标结构的分布,报告了在某些特定类型的肠细胞上这类目标的富集情况引人关注。虽然大多数调查细菌入侵的实验都是在体外培养的均匀(同质)癌细胞样本上进行的,但使用更生理系统的进一步研究——如3D模型的肠细胞,即所谓的肠器官样结构——将有助于确定大肠杆菌附着和侵入宿主细胞的目标细胞。这样的工作也将使得对细菌附着所需的特定目标结构的更详细研究成为可能,以及它们在癌症起始中的作用。
已经确定了细菌通过FimH粘附是colibactin介导的致突变性的前提,作者测试了一种临床批准的FimH抑制剂,称为sibofimloc。令人惊讶的是,用这种化合物处理可以阻断11G5菌株的粘附和致突变活性,导致小鼠肿瘤形成显著减少。这些发现突出了未来可能的临床研究方向——调查使用sibofimloc或其他靶向细菌粘附的化合物,以干扰依赖粘附的致突变性细菌的作用。然而,理解细菌在人群中的致突变活性的确切时间和背景对于为不同人群设计有针对性的预防策略将是至关重要的。
了解细菌如何进入结肠表面以及致突变性大肠杆菌的致突变活性是如何受到宿主遗传学、饮食、药物摄入和其他宿主肠道微生物相互作用的影响,将是重要的。作者提出了一个值得进一步研究的有趣观察结果,即任何单一的致突变性大肠杆菌菌株在其小鼠模型中都不足以强烈诱导肿瘤形成,而复杂的肠道微生物群落则增强了这类细菌的促肿瘤效应。鉴于之前的研究展示了大肠杆菌如何与其他细菌种类(如特定菌株的脆弱拟杆菌)相互作用,以访问结肠表面的细胞7,这一点尤其有趣。
与此一致的是,癌症研究中的细菌致突变性研究不应仅限于大肠杆菌。在患有炎症性肠病的个体中,引人关注的研究表明,大量细菌种类能够通过各种小分子和酶损伤DNA11。阐明细菌粘附到宿主细胞的原理如何适用于这些不同类型的细菌和致突变因子将是全面应对细菌驱动的突变所必需的。
这项研究对临床具有重要意义,是评估益生菌EcN菌株所带来致突变风险的关键一步。由于EcN粘附素中的三个氨基酸残基差异与其大大降低的致突变活性相关联,作者正确地指出,EcN菌株可能通过突变或从其他细菌获得横向基因转移的危险粘附变体。这样的结果将使任何产生colibactin的菌株比之前更具致突变性。
随着对肠道微生物与癌症之间联系的研究加速进行,整合癌症基因组分析、微生物学和流行病学数据有望进一步弥合知识差距,推动益生菌安全性评估和针对肠道微生物进行癌症预防的临床发展。
https://blog.sciencenet.cn/blog-41174-1458953.html
上一篇:干燥综合征患者氢疗案例【台湾】
下一篇:这名科学家培养病毒自己治疗乳腺癌,引发伦理争议