博文
内源性氢气和结肠炎的关系研究
||
炎症性肠病(IBD)是一种慢性疾病,其特点是反复发作和缓解,即使在症状解决后也有很高的复发率。IBD诊断的主要方法是内窥镜检查;然而,这种方法昂贵、侵入性强,且连续使用不便。因此,需要更方便和非侵入性的IBD诊断方法。在这项研究中,我们旨在确定用于肠道炎症发展的生物气体标记物。使用右旋糖酐硫酸钠(DSS)诱导的结肠炎小鼠模型,分析了五种生物气体,以确定肠道炎症发展的预测标记物。此外,还评估了气体成分变化、肠道微生物群和炎症标记物之间的相关性。发现氢气(H2)水平与脂质素-2(LCN2)水平呈负相关,LCN2是一种肠道炎症生物标记物,以及由于DSS诱导的结肠炎导致的体重减轻。此外,属于Rikenellaceae和Akkermansiaceae家族的肠道微生物与LCN2水平和体重减轻呈正相关,而Tannerellaceae的丰度与LCN2水平和体重减轻呈负相关,并且与H2水平呈正相关。这项研究为IBD诊断提供了新的见解;生物气体中的H2水平是肠道炎症的潜在生物标记物,特定肠道微生物与H2水平变化有关。
炎症性肠病(IBD),包括溃疡性结肠炎(UC)和克罗恩病(CD),是一种通过遗传、免疫、环境和微生物因素之间的复杂相互作用而发展的慢性炎症性疾病。IBD的发病率在全球范围内增加,对健康、社会和经济构成了重大负担。可以想象,在病程中较早地进行干预,可能在无症状阶段更为有效,有助于重置失调的免疫通路和其他推动疾病从临床前到临床阶段的病理过程。然而,IBD的特点是反复发作和缓解阶段,即使在症状解决后也有很高的复发率,这使得预测其复发变得困难。
内窥镜检查是监测IBD患者的金标准;然而,这种方法耗时、昂贵且侵入性强。此外,内窥镜评分的可重复性差,高度依赖于内镜医师的经验。因此,迫切需要确定更可靠的非侵入性替代生物标记物并建立测量方法,以减少患者负担和成本。
几种生物样本,如血清和粪便炎症标记物、血清抗体和呼出气,已作为生物标记物引起了注意。临床上使用了血清C反应蛋白(CRP)、红细胞沉降率(ESR)、抗酿酒酵母菌抗体(ASCA)、核周型抗中性粒细胞胞浆抗体(pANCA)和粪便钙卫蛋白。除了这些与炎症相关的生物标记物外,鉴于易于快速测量、允许重复采样以及分析的非侵入性,呼吸气体也可以成为潜在的生物标记物。先前的研究已经证明了IBD与呼出气之间的关系。例如,UC患者和IBD患者的呼吸中乙烷和戊烷浓度显著高于健康个体。此外,机器学习已被用于根据挥发性有机化合物(VOCs)区分健康对照组、活动期CD患者和缓解期患者。因此,呼吸分析可能是诊断IBD的实用策略。然而,大多数研究只关注容易量化的大分子量挥发性化合物,而对于其他分子,包括低分子量化合物,则没有那么多评估。此外,人类研究在年龄、饮食因素以及抗生素和其他药物使用史上存在异质性。因此,IBD病理学对呼出气的影响尚不清楚。此外,大多数研究集中在活动期IBD患者上,将这些呼吸气体用作IBD发展或复发的可能预测生物标记物的潜力尚未完全阐明。
下一代测序和宏基因组分析技术的进步表明,肠道微生物群作为一种环境因素,与IBD发病机制密切相关。多项研究记录了IBD患者与健康个体之间肠道微生物群组成、多样性和代谢产物的差异。一些源自肠道微生物群的代谢产物被宿主吸收,通过血液到达血-肺屏障,并通过气道迅速以呼出气的形式排出,而其他代谢产物则以粪便和尿液的形式从体内排出。因此,生物样本,如呼出气、粪便、尿液和汗液,反映了肠道微生物群的多样性和代谢,从而反映了人体内发生的异常炎症过程。
在这项研究中,使用右旋糖酐硫酸钠(DSS)诱导的结肠炎小鼠模型来确定肠道炎症发展的预测生物气体标记物。在实验性结肠炎的发展过程中,连续分析了五种生物气体成分的变化,即氢气(H2)、氨气(NH3)、硫化氢(H2S)、甲硫醇(CH3SH)和乙硫醇(C2H5SH)。此外,检查了肠道微生物群的组成和随时间变化的炎症标记物,以评估生物气体成分变化、肠道微生物群和炎症标记物之间的相关性。
结果
测定生物源气体的设置
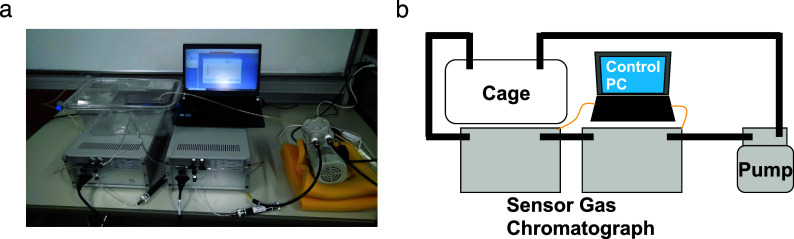
使用安装在由隔膜泵通风的空气流线中的传感器气相色谱仪取样和测量笼中的生物源气体H2、NH3、H2S、CH3SH和C2H5SH(图1a,b)。气体浓度的采样率取决于每次测量气柱和气体传感器时刷新时间,平均采样率为10点/小时。所采样的气体浓度反映了小鼠的呼吸和皮肤气体以及来自粪便的气体。
图1. (a) 呼吸采样系统的照片和 (b) 示意图。笼子里的空气通过泵循环。使用传感器气相色谱仪在循环路径中测量氢气(H2)、氨气(NH3)、硫化氢(H2S)、甲硫醇(CH3SH)和乙硫醇(C2H5SH)的浓度。传感器气相色谱仪由气体柱和金属氧化物半导体气体传感器组成,能够进行选择性和灵敏的气体传感。
氢气波动与肠道炎症相关联
为了检查DSS诱导的结肠炎中的炎症水平与生物气体成分变化之间的相关性,首先监测了15天内体重和粪便脂质素-2(LCN2)水平的变化。所有小鼠都用DSS或作为阴性对照的右旋糖酐(一种DSS类似物)处理(见图2a)。在用DSS处理的小鼠中,从第5天开始体重减轻,并在第9天恢复(见图2b)。粪便LCN2水平逐渐增加,在第7天达到峰值,并保持高水平直到第15天(见图2c)。相反,在使用右旋糖酐处理的小鼠中,15天内体重没有明显变化,并且粪便LCN2水平未改变(见图2d, e)。这些结果表明,DSS而不是右旋糖酐,导致了体重减轻和粪便炎症标志物水平的增加。
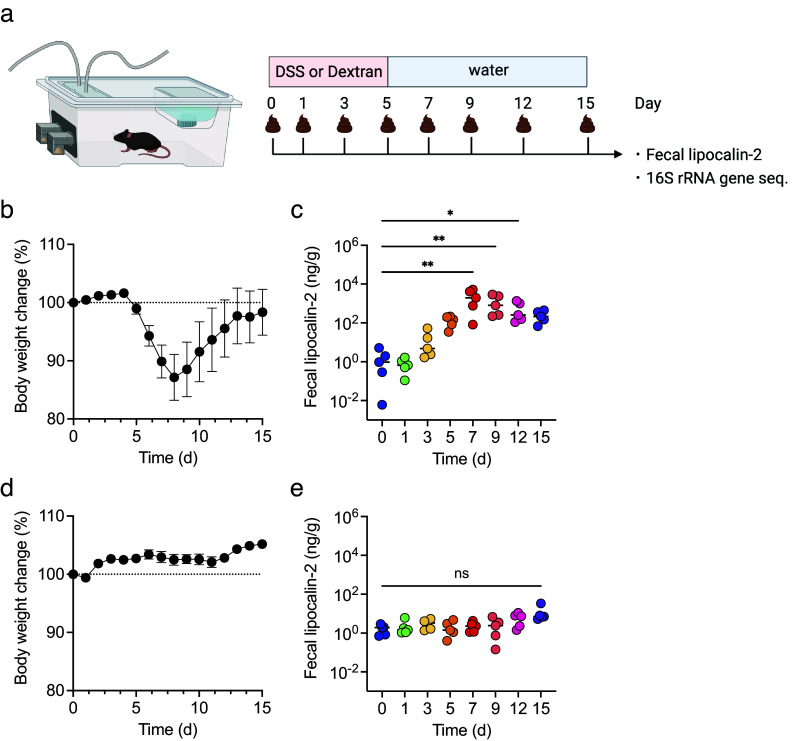
图 2.小鼠用硫酸葡聚糖钠(DSS)或葡聚糖处理5天,并监测15天(n=5)。(a)实验设计。(b和d) DSS处理的小鼠(b)或葡聚糖处理的小鼠(d)体重变化。(c和e)在DSS处理的小鼠(c)或葡聚糖处理的小鼠(e)中,第0、1、3、5、7、9、12和15天的粪便脂质素-2 (LCN2)水平。Friedman测试用于(c)和(e)。*p<0.05; **p<0.01; ***p<0.001; ns., 不显著。所有实验均独立进行三次。
接下来,研究了实验性结肠炎诱导期间生物气体水平的变化。在DSS处理的小鼠中,H2水平最初短暂增加,从第4天开始减少,在第7至8天之间进一步下降,然后从第8天开始逐渐增加。相反,葡聚糖处理的小鼠中的H2水平在第1天显示出类似的短暂峰值,但继续波动并呈现相同的峰值形状(图3a)。同样,氢浓度的标准差从第1天开始逐渐减小,在第6-8天达到最低点,然后在DSS处理的小鼠中开始增加(补充图1a)。相比之下,在葡聚糖处理的小鼠中,H2的标准差表现出周期性的波动和相似的峰值形状(补充图1b)。这种趋势与平均值的行为相似,但对于标准差而言,变化更为明显。在DSS处理的小鼠中,NH3水平保持高且稳定直到第5天,然后开始下降。在第5天后停止DSS治疗后,NH3水平迅速下降。从第8天开始,NH3水平增加,然后随着水平的降低而继续波动。相反,在葡聚糖处理的小鼠中,NH3水平增加到第3天并保持稳定(图3b)。考虑到DSS处理后硫化合物水平的变化,H2S、CH3SH和C2H5SH的水平从第10天开始缓慢增加(图3c-e)。此外,CH3SH和C2H5SH水平在第6至9天之间下降(图3d, e)。关于葡聚糖处理后的硫化合物水平,C2H5SH在2至5天之间保持稳定,有短暂的增加和减少。
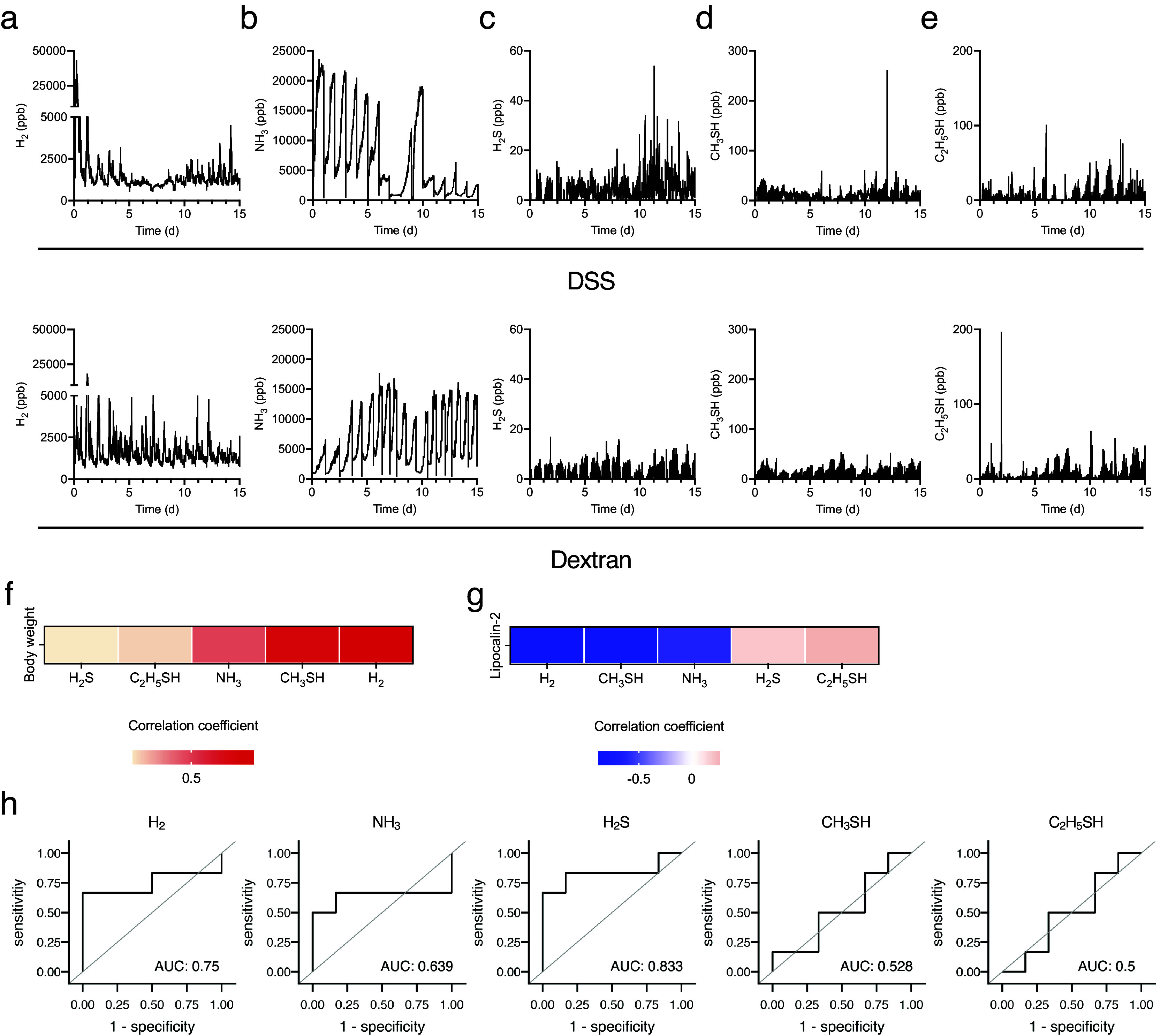
图 3.使用图1中介绍的仪器检测了5种生物气体,持续15天。(a–e) (a) H2、(b) NH3、(c) H2S、(d) CH3SH和(e) C2H5SH 15天的动力学。(f和g)平均体重变化(f)或粪便LCN2水平(g)与几种生物气体之间的相关性热图。(h)每种气体在诊断结肠炎发展时的接收者操作特征(ROC)曲线。粪便脂质素-2水平的常用对数(base 10)截止值为1.1。所有实验均独立进行三次。
进一步分析生物气体与结肠炎表型之间的相关性,包括体重变化和粪便LCN2水平的变化。由于气体水平代表五只小鼠的总和,因此使用每只小鼠24小时的气体平均水平和每只小鼠的粪便LCN2水平来分析相关性。H2水平与LCN2水平负相关最强,与体重正相关(图3f, g)。CH3SH水平也与LCN2水平负相关(图3g)。此外,绘制了接收者操作特征(ROC)曲线,以评估每种气体检测实验性结肠炎发展的能力。设定粪便脂质素-2水平的常用对数(以10为底)截止值为1.1。ROC分析显示,H2S(AUC: 0.833)和H2(AUC: 0.75)的ROC曲线下面积(AUC)较高,表明这些气体可以作为实验性结肠炎的预测标志物。总的来说,这些结果表明H2是与DSS诱导的结肠炎的结果和发展强烈相关的气体。
Rikenellaceae和Akkermansiaceae的相对丰度与实验性结肠炎的结果水平和H2水平密切相关
检查了肠道微生物群的变化,发现在结肠炎发展过程中观察到的ASVs和α多样性逐渐减少(图4a)。β多样性从第0天到第1天迅速变化,并在此后逐渐改变(图4b)。从第3天(粪便LCN2水平开始增加)到第7天(粪便LCN2水平达到峰值),Akkermansiaceae、Erysipelotrichaceae和Rikenellaceae的相对丰度逐渐增加,而Tannerellaceae的相对丰度从第3天到第7天减少(图4c, d)。
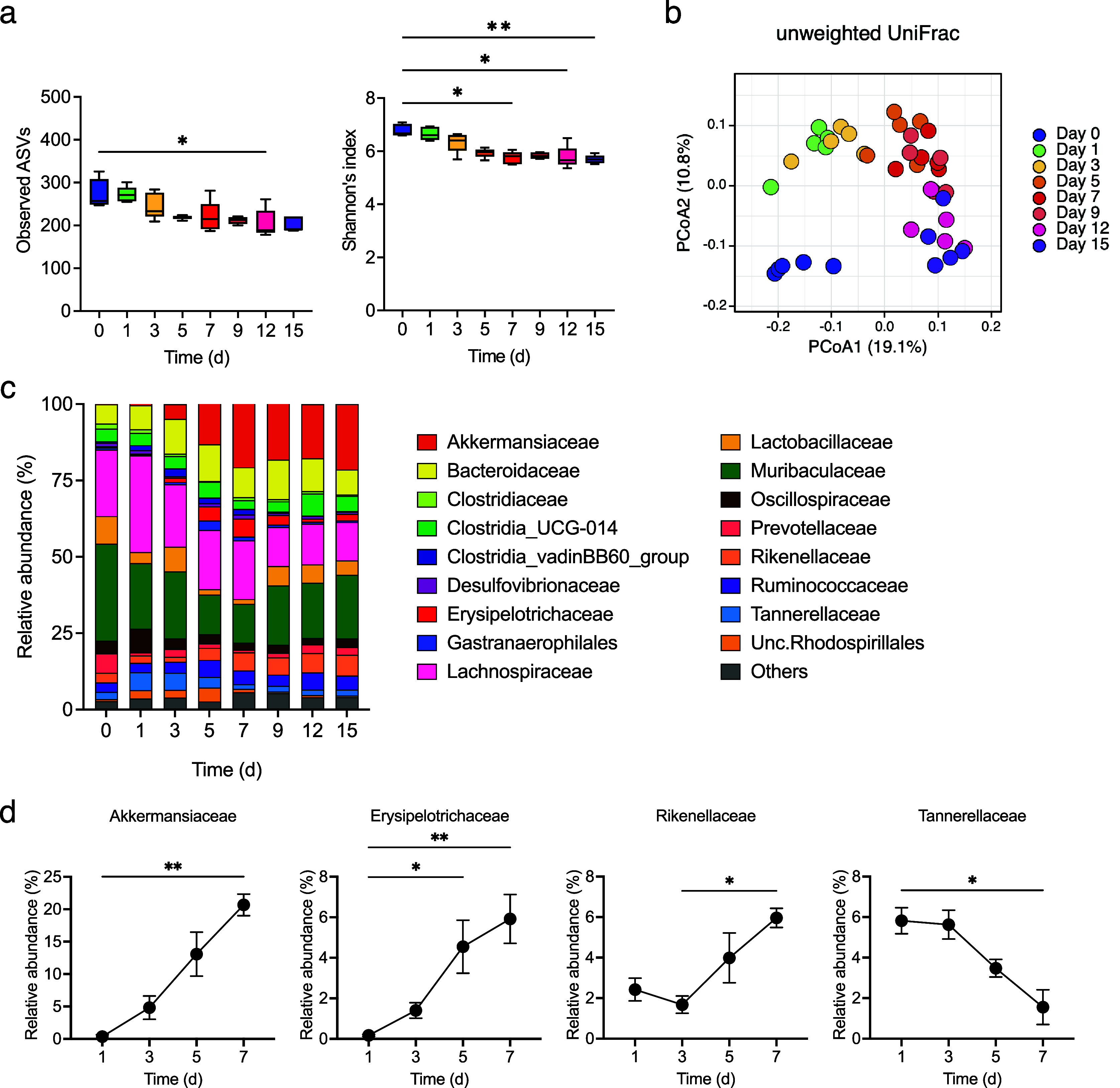
图4.(a) 不同时间点的观察到的扩增子序列变异体(ASVs)(左面板)和α多样性(右面板),箱线图显示中位数、四分位范围和1.5四分位范围。(b) 所有样本在所有时间点的β多样性。根据图中的图例显示了不同时间点的未加权UniFrac距离矩阵的主坐标分析(PCoA)。(c) DSS处理的小鼠粪便样本中ASVs的平均相对丰度。在第0、1、3、5、7、9、12和15天进行分析。颜色对应于每个细菌家族。(d) DSS处理的小鼠在第1、3、5和7天粪便中Akkermansiaceae、Erysipelotrichaceae、Rikenellaceae和Tannerellaceae的平均相对丰度。在(a)和(d)中使用Friedman检验。* p < 0.05; ** p < 0.01; *** p < 0.001; ns., 不显著。所有实验均独立进行三次。
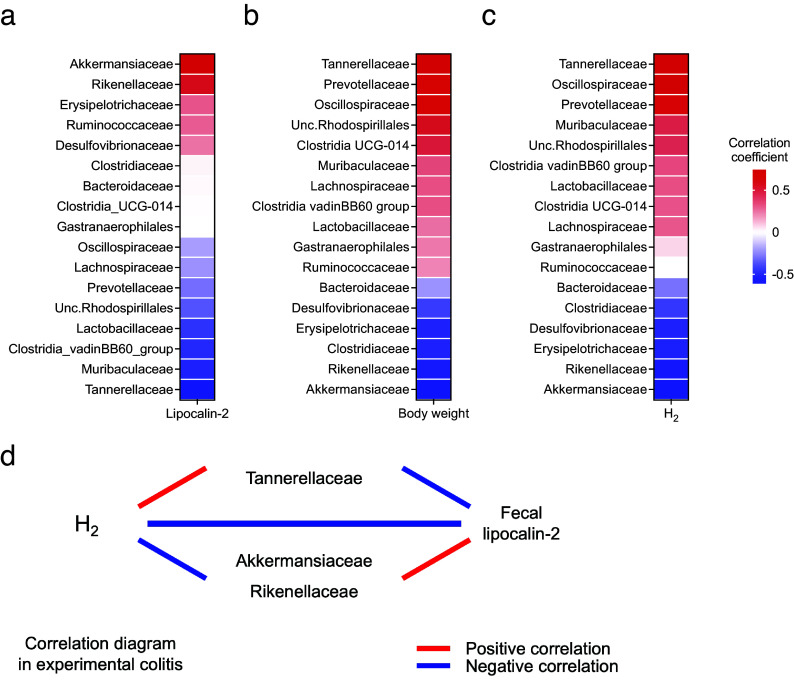
接下来,评估了肠道微生物群变化与结肠炎表型和H2水平的相关性。Akkermansiaceae和Rikenellaceae的相对丰度与LCN2水平正相关,与体重变化负相关。相反,Tannerellaceae的相对丰度与LCN2水平负相关,与体重变化正相关(图5a, b)。此外,Tannerellaceae和Oscillospiraceae的相对丰度与H2水平正相关;Tannerellaceae显示出与H2水平最正的相关性。相比之下,Akkermansiaceae和Rikenellaceae的相对丰度与H2水平负相关(图5c)。这些结果表明,Tannerellaceae的相对丰度与H2水平和体重正相关,与LCN2负相关。然而,Akkermansiaceae和Rikenellaceae的相对丰度与H2水平和LCN2水平分别负相关和正相关(图5d)。
图5. (a) 平均H2水平与几种肠道微生物家族相对丰度之间的相关性热力图。(b-c) 粪便LCN2水平或体重变化与几种肠道微生物家族相对丰度之间的相关性热力图。(d) H2水平、LCN2水平和细菌之间关系的示意图,显示了在(a-c)中的热力图中具有高或低相关系数的关系。
讨论
在本研究中,测量了DSS诱导结肠炎期间五种低分子量生物气体、体重减轻、粪便LCN2水平和肠道菌群组成的变化,发现H2水平与结肠炎结果的相关性最强。此外,某些肠道细菌的相对丰度与结肠炎病理和H2水平变化相关。
考虑到DSS代谢可能通过肠道菌群而非结肠炎表型影响生物气体水平,右旋糖酐被用作DSS处理的阴性对照。在给予DSS和右旋糖酐后立即观察到H2水平的短暂且迅速增加。因此,这种变化可能是由于肠道菌群消耗右旋糖酐所致,这两种化合物都拥有这种特性。NH3水平在给予DSS和右旋糖酐期间持续增加,并在每24小时开盖测量时立即下降。这种下降可能是由于开盖时笼内的NH3积累所致。尽管笼内的生物气体通过空气过滤器循环,但NH3可能在笼内积累直到盖子打开。ROC分析显示H2S的AUC最高。H2S不仅是人类产生的气体,也是肠道中硫酸盐还原菌(SRB)产生的气体。实际上,患有UC的患者粪便样本中发现SRB活性更高,H2S水平也更高。因此,除了H2之外,H2S也可能是预测结肠炎发展的另一种生物标志物。
在实验性结肠炎发展过程中,Tannerellaceae的相对丰度随着结肠炎严重程度的增加而减少,这与报告IBD患者中Tannerellaceae相对丰度较低的趋势一致。此外,Tannerellaceae的丰度与H2水平正相关。属于Tannerellaceae家族的Parabacteroides能够产生氢气。最近的一项研究报告显示,提高肠道中的H2水平可以通过改善肠道屏障功能来缓解DSS诱导的结肠炎症状。除了H2作为IBD潜在治疗剂外,本研究还展示了其作为IBD生物标志物的潜力。
此外,Akkermansiaceae和Rikenellaceae的相对丰度随着结肠炎严重程度的增加而增加并随后稳定下来,尽管在IBD患者中Akkermansiaceae的相对丰度减少。然而,在小鼠研究中,Akkermansiaceae与结肠炎之间的关联仍存在争议。Akkermansia参与了炎症和抗炎效应,例如通过短链脂肪酸生产诱导Treg细胞或通过粘液降解引发炎症反应。在结肠炎加重时观察到Akkermansia相对丰度的增加,表明这种细菌可能参与结肠炎的发展。然而,鉴于Akkermansia与结肠炎之间复杂的相互作用,有必要详细分析肠道菌群并确定细菌的特征。
在本研究中,使用小鼠模型从实验性结肠炎开始到症状消退期间连续测量与体重、LCN2水平和肠道菌群组成相关的生物气体成分。然而,与临床研究相比,本研究的样本量较小。此外,尽管检测呼出气体成分作为临床上的生物标志物是可取的,但重要的是要注意本研究中测量的是生物气体,其成分是各种因素的综合产物,包括小鼠呼出的气体、排气和粪便。所有这些因素都受到肠道菌群的影响。此外,H2和CO2作为肠道细菌的次级代谢产物,通过呼出的气体和排气排出体外,这些代谢产物和粪便强烈反映了肠道菌群的变化。这些结果表明,DSS给药引起的生物气体成分变化可能是由肠道菌群引起的。因此,未来我们将建立一个能够仅连续测量呼出气体成分的实验模型。
总之,本研究建立了实验性结肠炎严重程度与H2水平之间的负相关关系,这可能通过肠道细菌介导。本研究非常有价值,因为它关注的是低分子量呼出气体成分,表明H2作为IBD生物标志物的潜在实用价值。
材料和方法
小鼠
无特定病原的C57BL/6J雄性小鼠(6周龄)购自Sankyo Labo Service Corporation Inc.(东京,日本)。所有小鼠均饲养于Keio University Faculty of Pharmacy, Tokyo,并以常规饲料(CE2;CLEA Japan, Inc., Tokyo, Japan)和自来水维持。小鼠接受12小时光照/12小时黑暗周期。实验获得Keio University伦理委员会批准。
生物气体测量
使用隔膜泵DAP-15(ULVAC KIKO)进行连接笼子和传感器气相色谱仪之间的气流线通风。使用传感器气相色谱仪ODNA-P3-C(Nissha FIS)测量H2和NH3浓度。该传感器气相色谱仪包括气体采样器、气柱和半导体气体传感器。采样气体通过气柱分离,并进行高度选择性气体检测。H2和NH3的检测限(LOD)为1000 ppb。使用传感器气相色谱仪ODSA-P3-A(Nissha FIS)测量H2S、CH3SH和C2H5SH浓度。H2S、CH3SH和C2H5SH的LOD分别为2 ppb、5 ppb和5 ppb。还计算了氢气浓度的标准偏差。
DSS或右旋糖酐处理
DSS(MW: 36–50 kDa)(MP Biomedicals, Chiba, Japan)和右旋糖酐(TCI, Tokyo, Japan)分别溶于蒸馏水中至2%(w/v),然后使用Stericup(ø = 0.22 μm)(Merck, Darmstadt, Deutschland)过滤。所有小鼠均接受2% DSS或右旋糖酐溶液处理5天。随后在第5天,用自来水替换DSS或右旋糖酐。每天监测体重、食物和水摄入量。为了测量粪便LCN2水平和分析粪便菌群组成,使用16S核糖体RNA基因扩增子测序,收集第0、1、3、5、7、9、12和15天的粪便。
https://blog.sciencenet.cn/blog-41174-1452135.html
上一篇:氢气对人类脂肪组织的直接效应研究
下一篇:一个人工智能数小时内提出4000个新颖研究想法!!