博文
多道天然防线阻断乳腺癌发生  精选
精选
|
在过去的几年里,越来越多的DNA测序研究突显了癌症发展的复杂性。这些结果强调了研究健康组织的遗传景观以了解疾病如何在细胞层面产生的必要性。Ciwinska等人在《自然》杂志上撰文,揭示了健康小鼠乳腺中发生的保护机制,以对抗具有癌症促进(致癌)突变的细胞生长。令人惊讶的是,致癌突变在乳腺和其他健康组织中非常常见。
Ciwinska和同事比较了带有荧光标记的小鼠细胞的命运,这些细胞被设计携带与乳腺癌相关的基因(如Brca1和Trp53)中的致癌突变,与没有这类突变的细胞的命运进行了对比。他们在乳腺中检测到各种机制在起作用,以阻止癌症的发生。随着时间的推移,携带Brca1和Trp53突变的小鼠发展出了与人类乳腺癌相似的乳腺肿瘤,这种乳腺癌与BRCA1基因的突变有关。然而,许多携带致癌突变的细胞在乳腺导管区域扩散,但没有形成肿瘤,类似于一群携带与癌症无关的突变(中性突变)的细胞可以通过一个称为场殖民的过程在乳腺上皮细胞(上皮)中扩散。
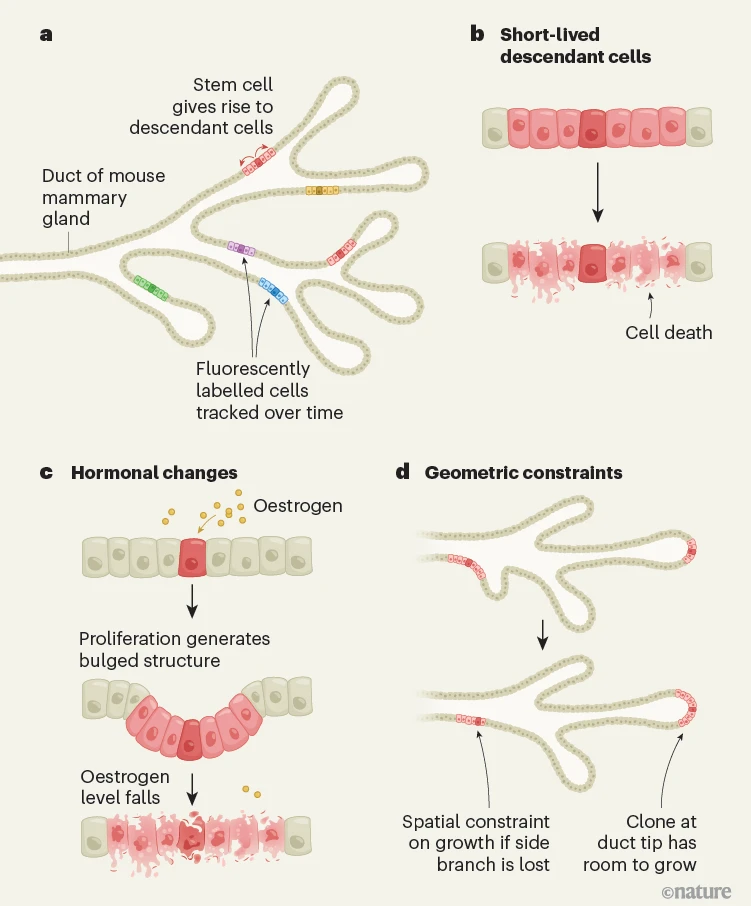
图1 | 保护乳腺免受肿瘤形成的机制。健康的乳腺组织中常见的致癌突变很少导致肿瘤的形成。a,为了研究潜在机制,Ciwinska等人研究了被设计为在乳腺导管中用荧光标记细胞以追踪随时间变化的干细胞及其后代群体(克隆)的小鼠。作者研究了携带Brca1和Trp53基因中致癌突变的标记细胞群体,以及具有中性突变(不促进癌症的突变)的野生型细胞群体。作者发现了三种阻碍肿瘤形成的机制。b,大多数后代细胞,包括那些带有有害突变的细胞,很快就死亡了,防止了进一步的有害突变积累。c,动情周期中雌激素水平的周期性变化导致细胞增殖,随后是包括干细胞在内的凸起结构的细胞死亡。d,乳腺导管的线性、带状结构限制了大多数标记细胞的生长。例如,动态变化如侧枝的丢失可能导致标记细胞的丢失。位于导管末端分支的细胞,其中空间限制较少,有更高的机会存活下来,获得进一步的突变并变成癌细胞。
小鼠乳腺上皮包含各种细胞群,包括长寿干细胞(乳腺干细胞和上皮祖细胞)及其短命后代。通过追踪同一谱系(克隆)产生的细胞群的大小和数量,以及随时间与中性或致癌突变相关联的细胞群,Ciwinska等人描述了乳腺中的一个保护级别。研究人员发现,大多数短命克隆,包括那些带有致癌突变的克隆,其后代细胞在几个月内就会死亡。然而,少数携带致癌突变的克隆持续存在,这表明这些是长寿的干细胞衍生克隆,已经在整个乳腺上皮中扩散。
然而,乳腺中的干细胞动力学比其他健康组织更为复杂。在大多数成年组织中,细胞群通过自我更新和分化的循环被替换,干细胞克隆的数量通过随机细胞丢失和替换的过程增加(扩展),导致可预测的干细胞命运和平均克隆大小模式。
但是,在乳腺中,激素调节对干细胞动力学有直接影响。激素水平在动情周期(在非人类哺乳动物中观察到,包括小鼠)和月经周期(在人类中)中波动,特别是雌激素在排卵前达到峰值,如果未怀孕则在周期中达到最低水平。雌激素可以促进细胞分裂和乳腺上皮细胞的增殖,导致乳腺导管的延长和称为腺泡的结构发芽。因此,研究这些周期性变化对携带致癌突变细胞增殖的影响是一个引人入胜的研究领域。
Ciwinska等人发现,乳腺中个体克隆大小的大幅度变化遵循对数正态分布,这意味着大小差异很大,但大多数克隆都很小,只有少数几个较大。这种模式通常出现在细胞生长或丢失相互关联的过程中。使用监测细胞分裂的技术(增殖测定和活体显微镜),作者观察到乳腺导管网络如何经历导管的侧枝的局部形成和丢失,这与乳腺干细胞的周期性更替一致,并与每只小鼠的动情周期的不同阶段相关。该小组生成的数学模型估计,每个干细胞仅支持几个非再生祖细胞,与许多克隆的早期丢失一致。
一些突变克隆偶然存活并超出干细胞单位扩张,形成跨越导管上皮网络大部分区域的连贯的突变细胞场。这种扩张使组织易于发生肿瘤转化。
然而,导管中细胞的线性、带状组织最终限制了进一步的克隆扩张。这种结构限制了突变细胞扩散的空间,并将它们限制在一个狭窄的区域内,这使得这些克隆更难于胜过邻近细胞并殖民上皮的更大区域。由动情周期介导的侧枝更替充当几何约束,进一步限制了突变克隆的扩张能力,从而提供了另一层保护,防止突变细胞不受控制地殖民。
Ciwinska及其同事的发现表明,在获得中性或致癌突变后,来自干细胞区的存活克隆经历了有限的短期传播,主要限于干细胞后代细胞。然而,动情周期的影响驱动了快速的克隆扩张并增加了对肿瘤形成的敏感性,突出了激素影响和组织动力学在乳腺癌易感性中的关键作用。
从临床角度来看,这一发现强调了早期检测携带致癌突变的克隆以及监测其在月经周期中的扩张趋势的重要性,特别是在高风险个体中。将当前的激素概况与从血液中脱落的癌细胞的DNA中检测到的致癌突变相结合,称为循环肿瘤DNA,或可能从乳腺乳汁中脱落的细胞中,可能会提高风险评估并改善治疗结果。
此外,Ciwinska及其同事的研究结果不仅限于乳腺,还为了解激素调节如何影响其他生殖器官如子宫内膜、子宫和卵巢中的克隆动力学提供了见解。作者的研究强调了致癌突变与周期性雌激素水平之间的相互作用——这是在这些组织中起关键作用的一个因素。
然而,将这些发现从小鼠模型转移到人类乳腺组织需要考虑几个关键差异。关键是,小鼠和人类的乳腺结构存在显著差异。小鼠乳腺相对简单,由分支导管系统组成,没有广泛的称为小叶腺泡结构的成分。相比之下,人类乳腺组织更复杂,具有分化成产奶细胞的小叶和腺泡。激素调节和动情或月经周期在小鼠和人类之间也有很大差异,因为小鼠动情周期中的雌激素波动不如人类那么明显。孕酮水平的差异也可能影响突变克隆的细胞动力学。
因此,在人类研究中验证这些观察结果是至关重要的。未来,将组织收集时的激素周期数据与通过基因组测序等技术在乳腺组织样本中检测到的致癌克隆的存在和行为结合起来,将有助于随时间描述这些克隆并提供关于它们转化为肿瘤潜力的见解。
https://blog.sciencenet.cn/blog-41174-1450020.html
上一篇:氢气多功能医学效应 2024年英学位论文第一章
下一篇:抑郁症大脑的特征性改变