博文
氢气用于体外气体交换设备抗炎症【天造地设】
||
一般论文很少用这种夸张的词汇,但这里使用了: A Match Made in Heaven?
这种词,说明研究者对这种效应的神奇的感叹。

体外先导研究发现氢气与体外气体交换的天造地设匹配
体外循环(ECC)经常以多种形式实施,例如血液透析、心肺旁路、体外膜氧合(ECMO)等。接受此类治疗的患者常常遭受慢性炎症的困扰,这本质上伴随着氧化应激。然而,ECC治疗本身也负责维持或促进炎症。基于这些理由,设计了一项体外研究,以调查氢气(H2)在ECC环境中对抗促炎因子的治疗潜力。五个小型ECMO回路和一个小型试管(对照组)用来自健康成人捐献者的肝素化血液(n = 7)进行灌注。其中三个ECMO系统注入了脂多糖(LPS),其中一个还额外用氢气气体混合物处理。6小时后,抽取样本评估特定生物标志物(MCP-1, MPO, MDA-a, TRX1, 和IL-6)。初步结果表明六个系统之间存在逐渐的氧化和炎症反应。循环触发了炎症和血液损伤,但LPS在这一结果中的惊人影响是无可争议的。因此,氢气的补救潜力立即显现出来,因为氢气处理的回路中生物标志物的浓度倾向于较低。未来的研究应该具有明确的目标(例如,氢气给药的剂量/持续时间/周期),以确定患者治疗的最佳方案。
1. 引言
人工器官一词指的是能够部分或完全复制人类器官功能的设备和疗法。通常,这些构成长期、可植入的解决方案,而在其他情况下,它们只能实施一段时间或间歇性会话。肺、肾和肝的设备和治疗属于最后一类,这需要对血液进行体外处理。患有上述任何一个器官功能障碍的患者也经常受到局部或全身性炎症和/或氧化应激的困扰,这通常由体外治疗加重。
最近,COVID-19大流行的爆发使得体外膜氧合(ECMO)的使用激增,使得研究接受治疗患者的氧化/炎症现象变得极为相关。根据Millar等人的研究,将ECMO应用于危重病患者与全身性炎症反应有关,这可能导致器官损伤和功能障碍[7]。这种反应的特征是在ECMO的前2小时内血浆中炎症细胞因子(如TNF-α和IL-8)浓度迅速增加,可能是由于肠道中预先形成的储存释放所致。通过将患者的血液暴露于ECMO回路的非内皮化表面,进一步加剧了炎症反应,这激活了先天免疫系统,可能导致炎症和器官损伤。
研究表明,氢气具有抗炎特性,可以提高泛化炎症模型中的生存率和减少器官损伤。这对于可能导致过度全身性炎症反应的ECMO治疗尤其相关。氢气作为急救和重症监护医学中治疗剂的潜力已由Sano等人在2017年展示,而其作为抗氧化剂在血液透析中的持续应用则始于2009年。此外,由于其抗炎和抗氧化能力,它已被推荐用于治疗各种全身性疾病。在机械通气(MV)支持期间加入2%的氢气补充剂可在治疗后2小时降低通气引起的炎症反应和上皮细胞凋亡水平。同样,在接受ECMO和MV的同时用氢气治疗的大鼠与安慰剂组相比,在心脏骤停复苏后4小时存活率提高了250%。随着COVID-19的出现,氢气已经作为抗氧化剂和抗炎剂获得了巨大的动力,因此有许多关于其对抗病毒感染副作用有效性的假设。
这些发现表明,氢气在体外循环设置中减轻炎症方面可能发挥重要作用。为了进一步验证这一假设,设计了一项具有临床相关性的体外研究。研究重点放在气体交换期间氢气的影响上,这是继血液透析之后第二种最常见的体外循环方式。来自健康人类捐献者的血液在小型ECMO回路中循环,以观察不同参数(回路组件、病原体引入和氢气治疗)对引发炎症反应的影响。这里传达的初步结果证实了这项研究的可行性,并为未来的详尽体外试验铺平了道路,在这些试验中应进一步调查并明确确定富氢ECMO治疗的具体特性,然后才能进行任何体内应用。
2. 材料和方法
2.1. 捐赠者
由于这从一开始就被视为一项先导研究,并且为了尽量减少误差范围,为选择血液捐赠者设定了一些简单标准:
- 应为健康成人
- 应能够在没有并发症的情况下捐献 > 300 mL 的血液
- 平均红细胞压积 Hct ≥ 42%
- 最近不应经历过急性发热或其他炎症事件
- 不应有任何与血液相关的状况
- 不应有抗凝药物的处方等
基于以上标准,在这个阶段排除了女性捐赠者。该研究是按照《赫尔辛基宣言》进行的,并得到了RWTH亚琛医学院机构伦理委员会的批准(EK 23–234,从2023年7月20日起获得延期批准)。
2.2. 体外炎症
根据上述选择标准,捐赠的血液在进一步处理之前应无任何炎症和氧化。然而,为了本研究的目的,需要人为触发炎症反应。内毒素提供了一种解决方案,它促进促炎细胞因子的分泌[24]。为了确定最佳剂量,将脂多糖(LPS)的滴定溶液引入捐赠的血液样本中。6小时后,通过酶联免疫吸附测定(ELISA)测量每个样本血浆中的白细胞介素6(IL-6)浓度。
2.3. 实验设置
为了检查每一种可能的替代方案,同时在体外测试了六个系统(5×ECMO,1×对照),每个系统服务于不同的目的。三个回路各自注入了250 ng mL−1的LPS以人为触发炎症反应,而其余的则保持未受污染。后者将有助于评估体外循环本身对促炎影响的贡献。
为了便于输送氢气,一个气体交换器模块被附加到一个注入了LPS的系统上。供应的气体混合物大约含有6%的氢气,导致溶解的氢气浓度为100–120 ppb。另外两个回路,其中一个也接受了LPS处理,也被配备了相同的气体交换器,以跟踪由气体交换和此类模块的集成产生的任何后果。自然地,这两个系统接收的气体混合物不含氢气,目的是将血液气体值保持在生理范围内。实施的气体交换器模块具有0.3平方米的有效表面积Aeff和20 mL的启动体积。
所有五个ECMO回路包括一个蠕动泵、3/16”和1/4”管道以及一个由薄硅胶制成的可折叠储液器。对照组设置由一个装满未处理血液的反应管组成,在整个实验期间(texp = 6小时)保持静止。表1总结了每个设置的基本特征及其相应的标签以便区分,而图1描绘了主要的变化。
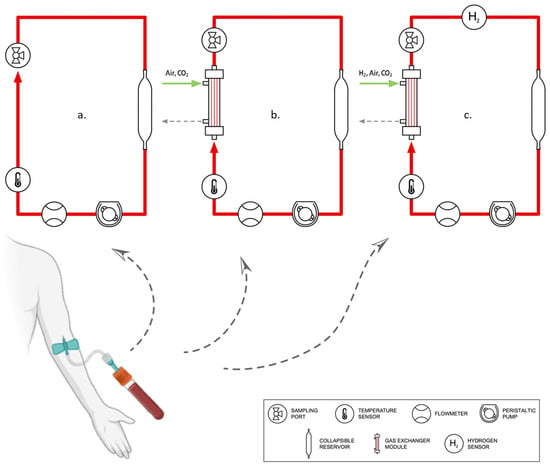
图1. 本研究中使用的回路组的图形说明:a. Ref/LPS,b. Ref*/LPS*,c. LPS*H2。
表1. 本研究中测试的系统及其基本属性的清单。标有星号的设置额外配备了微型气体交换器模块。
2.4. 测试协议
在获得知情同意并解释研究的性质和潜在后果后,从健康男性捐赠者(中位年龄37岁(28, 55))抽取静脉血(约300 mL)。直接在血液容器中注入钠肝素(B. Braun, Melsungen, Germany)作为抗凝剂(10 IU mL−1)。总共进行了七次实验(n = 7)。每次实验中,所有六个系统都用来自单一捐赠者的血液进行预充。
一旦预充完成,ECMO回路以每分钟40 mL的血流速率连续灌注6小时。定期从每个回路中抽取血液样本(200 μL),以确定氧分压(pO2)和二氧化碳分压(pCO2)、血红蛋白(Hb)水平以及其他临床相关血气数据。血气分析仪(Radiometer, Copenhagen, Denmark)协助完成此程序。根据ISO 7199:2016,只调整了碱剩余值,以防止任何可能诱发进一步氧化应激和/或血液损伤的酸中毒/碱中毒现象。
避免血液稀释以保留尽可能多的细胞(平均血红蛋白Hb = 14 g dL−1 ± 0.7)。通过超声波流量计(Transonic, Ithaka, NY, USA)和压力计(CODAN pvb Critical Care Inc, Forstinning, Germany)分别监测血流速率和压力降,而气体供应通过气体流量计(Platon, Vienna, Austria)调节。一个无接触式氢气传感器(Pureron Co. Ltd., Iwaki, Japan)记录了LPS*H2回路中溶解氢的浓度,如图1所证明。
在每次实验结束时,从每个回路中取足够的血液样本(4–5 mL)进行进一步分析,用于多次测量。通过离心(14000×g,5分钟,室温)提取血浆,用于通过测量特定生物标志物的浓度来估计氧化和炎症应激(双重测量)。同样,血浆也用于通过光谱光度测定法(Pharmacia Biotech, Uppsala, Sweden)确定血液损伤。
实验运行时间为6小时,为蛋白质表达和氢与系统中任何活性氧物种(ROS)的反应提供了充足的时间。另一方面,通过关注血液损伤评估协议,避免了红细胞完整性的任何损害。
为了标准化目的,特别是因为回路之间的预充体积差异显著,使用归一化溶血指数(NIH)来估算血液损伤,如方程式(1)[27]所表达。
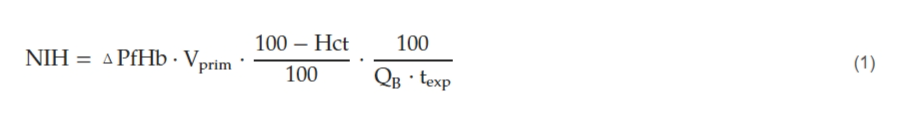
2.5. 炎症和氧化应激的生物标志物
由于本研究的范围不如实际与氧化和炎症反应相关的生物标志物的光谱那样广泛,因此根据相关文献中经常出现的情况,挑选了几个特定的样本[28,29,30,31,32,33,34,35,36]。一个基本参数是包括来自两个池(氧化和炎症)的代表生物标志物,如表2所示。通过ELISA按照制造商的协议(Thermo Fisher Scientific, Waltham, MA, USA)进行生物标志物评估。
统计
使用软件GraphPad Prism版本9.1.1(GraphPad Software, Inc., San Diego, CA, USA)进行统计分析(多变量方差分析—ANOVA),以检查显著性水平p < 0.05。
3. 结果
确定体外研究中LPS的最佳剂量对于实验结果的质量和准确性至关重要。在预试验中,将血液样本暴露于滴定的LPS溶液中以触发炎症反应。图2中呈现的结果指出,可以观察到最大IL-6表达的LPS浓度为250 ng mL−1。
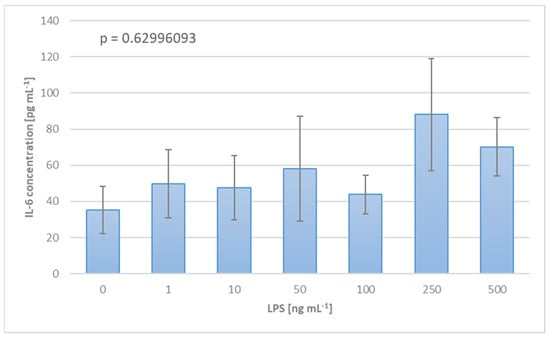
图2. 基于血液对滴定LPS溶液的炎症反应,建立实验协议中LPS最佳剂量的方法,以IL-6浓度表示。
图3显示了每个测试回路的个别血气参数以及气体交换的方面。氧分压及其对应的饱和度如图3a、b所示,揭示了在早期实现稳态时气体交换器模块的重要性。相比之下,Ref和LPS回路仅通过管道壁进行被动气体交换,因此最终值的实现被延迟。同样,二氧化碳在Ref*、LPS*和LPS*H2回路中迅速达到平衡值,如图3c中的分压所示,而非充气回路则通过导管逐渐损失。氢气转移以循环血液中溶解的氢气浓度的形式表示在图3d中。所呈现的图表描绘了平均值,而标准偏差不显著,因此将不予标注。
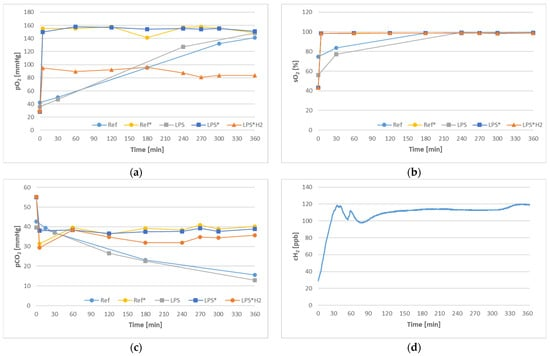
图3. 调查过程中每个回路的气体交换,以氧分压(a)和饱和度(b)、二氧化碳分压(c)和氢浓度(d)表示。
为了进一步评估不同因素(即回路设计、组件选择和测试协议)对实验行为的影响,测量了溶血率并计算了每个回路的标准化溶血指数(NIH)。此外,这一过程实现了机械诱导与生物化学诱导溶血的个别估计,为这些调查的动力学提供了宝贵见解。图4揭示了在这些系统中人为触发炎症反应的显著血液损伤的证据,而在用氢气处理的回路中表现出前所未有的改善。
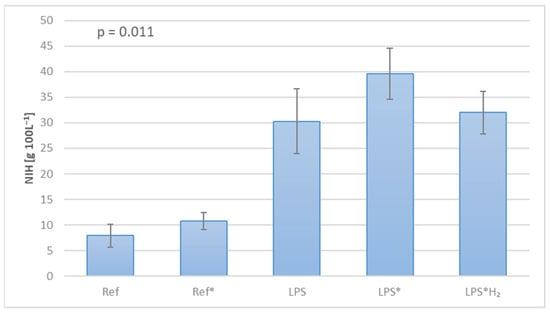
图4.各回路的溶血标准化指数(NIH),作为血液创伤的标志。 图5封装了每个电路中所选生物标记物的表达。MCP-1显示了不同设置之间的差异最小,在其不显著的方差中也很明显(p = 0.2027),使用单向方差分析测量。另一方面,MPO在单向方差分析下的p值最低(1.7024 10−13);然而,这主要是由于除控制系统外,所有电路都大幅增加。除平均值外,这些图表还说明了标准差和显著性水平。TRX1表现出个体测量值之间的差异减少,但也表现出足够的显著性(p = 0.0006)。MDA和,在更大程度上,IL-6最接近每个系统中氧化/炎症反应的理想体现,根据它们的个体处理,表明了高水平的显著性,p值分别为5.5962 10−9和7.0644 10−7。
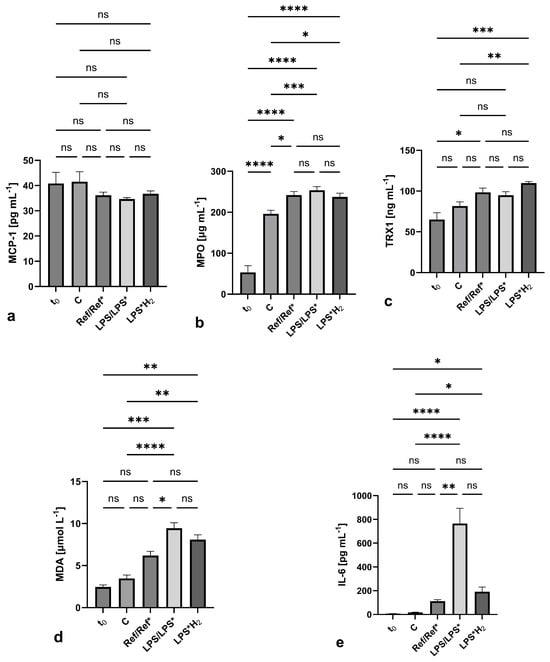
图5. 每个回路中的生物标志物表达:(a) MCP-1,(b) MPO,(c) TRX1,(d) MDA,和 (e) IL-6。每个图表上描绘了平均值、标准差和显著性水平(*: p < 0.1, **: p < 0.01, ***: p < 0.001, ****: p < 0.0001, ns: p > 0.1)。
最后,在整个实验过程中没有观察到血浆泄漏,也没有由于采样而导致的显著体积损失,这一点由恒定的压力下降测量值所证实。
4. 讨论
反应性氧种在许多细胞病理学、疾病和衰老中起作用并由此产生 [37]。ROS的产生或清除失衡会触发氧化应激,这是炎症反应的前兆 [38]。氢气在广泛的场合/疾病中对抗氧化应激和炎症现象被报道为出奇地有效 [14,39,40]。探究氢气在体外气体交换期间的效能是基于与ECMO治疗相关的过度系统炎症响应,以及相关研究稀缺的事实。
这项研究的一个基石从一开始就是循环血液中的人工炎症刺激。LPS由于其实验处理的简单性、可获取性和可比性,成为此目的的理想候选者。在进行任何完整的体外实验之前,确定最合适的工作浓度是必要的。这是通过测量健康人类捐献者的血液样本暴露于不同LPS浓度时的炎症反应来完成的。如图2所示,最高的IL-6表达出现在250 ng mL−1,因此决定进一步使用此LPS浓度进行工作。
只有通过控制的气体交换才能维持生理血气值,如图3所示。尽管非通气回路随时间也能实现超过100 mmHg的pO2值,但这些系统中的pCO2持续下降,远低于动脉值。这种逐渐的气体转移归因于可折叠储器的材料和壁厚(<1 mm);赋予灵活性和可折叠性的相同元素,使得循环血液和周围环境之间的气体扩散得以进行。另一方面,尽管随着时间的推移完全恒定,通过BGA分析来自氢气处理回路的血液样本时记录的pO2值反复发现低于预期。根据血气分析仪的报告,气体交换器上游采集的气体样本在pO2方面也遭受了类似的损失,这引发了错误测量的怀疑。为了阐明这一模糊之处,一个在线pO2气体传感器(FDO2, Pyroscience GmbH, Aachen, Germany)被放置在气体交换器的入口处 [41]。记录的值落在130–140 mmHg的预期范围内,从而证实了在存在氢气的情况下,无论是在血液中还是在气相中,BGA测量不准确的假设。这种情况需要进一步调查,以确定错误的根源,并在任何体内试验之前采取必要措施。
血液中溶解氢的浓度保持相对稳定,如图3d所示,尽管不断向环境中损失,但仍在预期范围内。实际上,由于氢的微小尺寸,氢通过大多数材料逃逸的速率使得必须持续供应气体。目标浓度100-120 ppb是正在进行的相关研究中最常实施浓度的平均值[14]。顺便说一句,专门安装在供氢回路上的氢监测水系统(HWMS)系统地产生了一致的结果,其准确性已通过详尽的试验和传感器重新校准得到验证[41]。
图4强调了血液损伤作为进行气体交换研究时必须考虑的一个关键参数的重要性。鉴于回路的规模小和实验的持续时间,未受污染(无LPS)系统中溶血的程度并不罕见,类似研究证明了这一点[42]。低血量和长时间的实验运行时间,以及体外试验期间缺乏任何生理调节机制,大概是导致LPS注入回路中血液损伤严重加剧的主要原因。尽管如此,记录的溶血率并未以任何方式影响血液的气体交换能力,正如相关图表(图3)中所见证的。最后,氢存在下血液损伤显著减少是一个引人入胜的观察结果,需要进一步分析。
图5提供了氢气抗氧化和抗炎作用的证据,其中记录了每个系统中每个生物标志物的表达。具体来说:
MCP-1水平在整个调查过程中在所有回路中几乎保持不变。这可能表明细胞计数低,当血液来自健康捐献者时,阻碍了对MCP-1表达的任何明显观察。LPS系统中浓度的轻微增加证实了被触发的细胞数量很少。
大多数回路在MPO测量方面显示出朝向对照组浓度的趋势。C系统和Ref/LPS系统之间的浓度差异为氢气的作用留下了一个小范围,类似于MCP-1。不同设置之间的轻微差异指向时间依赖性细胞激活,而不是任何剪切率引起的压力。然而,这些发现可能为体内研究提供线索,其中细胞变异随时间发生,体内激活机制开始起作用,潜在地允许更好地评估氢的功效。TRX1的表达似乎不像MPO那样受到氢气的影响。这与TRX1和MPO分别与抗炎和促炎活动相关的事实相一致。因此,较低的MPO浓度对应于较高的TRX1浓度。
在各个系统中可以观察到不同水平的MDA表达,这表明了时间相关和机械压力的结合。对LPS的炎症反应再次被氢气治疗所对抗,尽管没有达到基线水平。这与Huang的发现一致,其中在经氢气处理的肺部观察到较低的MDA浓度(与经氮气处理的相比)[17,18]。
IL-6:明显受到氢气的抑制。与MDA相反,IL-6的明确强烈抑制为氢气的抗炎作用及其被抑制的特定途径提供了有力的论据,正如已经报道的那样[43]。此外,与MPO一样,IL-6也具有促炎特性,由于它被如此强烈地抑制,抗炎活动可能自然得到加强(即,TRX1)。
最后,尽管气体交换处理回路和“非通气”回路之间的血气数据存在任何差异,但在姐妹系统(例如,Ref–Ref*)中没有发现偏离生物标志物表达的痕迹。
上述一些发现提出了血细胞数量的问题,这与回路的总血量直接相关。自从决定使用人血进行调查以来,这一直是一个障碍,这要求所有组件大幅缩减尺寸。出于同样的原因,从这些调查中省略了回路Ref*H2,特别是因为一些初步测量显示,预计氢气不会与健康血液发生反应。利用医院血库储备(为质量控制目的而留出)来解决无穷无尽的血液供应问题也许是可行的。不幸的是,血袋通常含有柠檬酸盐磷酸葡萄糖(CPD)作为抗凝剂。这与研究设计相冲突,该设计打算使用肝素作为抗凝剂,以尽可能保持结果的临床相关性。
最终,研究的实验结果是非常有希望的,证实了氢气在ECMO设置中的预防作用和治疗潜力,并为未来的研究和随后的医学应用奠定了基础。这项研究的后续工作通过探索几个参数,如:
血液量对生物标志物表达的影响。
更广泛的生物标志物谱系。
氢气浓度对其疗效的影响。
氢气在不同给药模式(例如,连续、间歇或延迟)下的抗氧化和抗炎作用。
此外,招募一个更大的捐献者群体,代表两性以及特定病患群体,将赋予该研究必要的重要性。
未来的研究还应考虑氢气治疗潜力的双重性。有趣的是,硫化氢(H2S)已被证明对免疫细胞有显著影响。它可以调节巨噬细胞的炎症反应,潜在地缓解促炎表型。然而,持续暴露于高水平的H2S可能导致免疫抑制,触发氧化应激、炎症、凋亡和辅助T细胞失衡。另一方面,氢气的使用被发现是对抗辐射引起的免疫功能障碍的保护剂,减少氧化应激和凋亡并调节T细胞平衡 。此外,最常见的ROS之一过氧化氢的超生理水平触发血管收缩、内皮功能障碍、高血压和促炎状态 。因此,过氧化氢可能在ECMO治疗期间对炎症反应有所贡献。氢气给药偶尔出现的矛盾结果以及可能对载体化合物组成的依赖促使进一步研究,以完全理解氢气对细胞功能的影响,这在许多情况下只能通过长期的体内模型来解决。
5. 结论
本研究旨在确定氢气在体外气体交换设置中的治疗潜力。怀着这一目标,组装并使用来自健康人类捐献者的完全肝素化血液在体外测试了多个ECMO回路。研究发现LPS注入的回路中血液损伤增加,而气体交换和血气在生理水平的平衡似乎对炎症结果没有任何特别影响。相反,氢气被证明在对抗氧化和炎症压力方面特别有效,正如各种生物标志物所证明的那样,尽管其在溶血方面的改善作用也是如此。
https://blog.sciencenet.cn/blog-41174-1449118.html
上一篇:氢气多功能医学效应 2024年英学位论文第一章
下一篇:氢气改善插管套囊压迫气道黏膜损伤机制研究