博文
应激大脑如何削弱免疫系统  精选
精选
|
压力过大的大脑如何削弱免疫系统
2024年8月8日
压力导致肠道微生物群失调,进而引发炎症和身体抵御感染能力下降。
作者:Sara Reardon
Stress-sensitive neural circuits change the gut microbiome via duodenal glands: Cell
大脑中杏仁体(以红色显示)的艺术家插图,背景为黑色
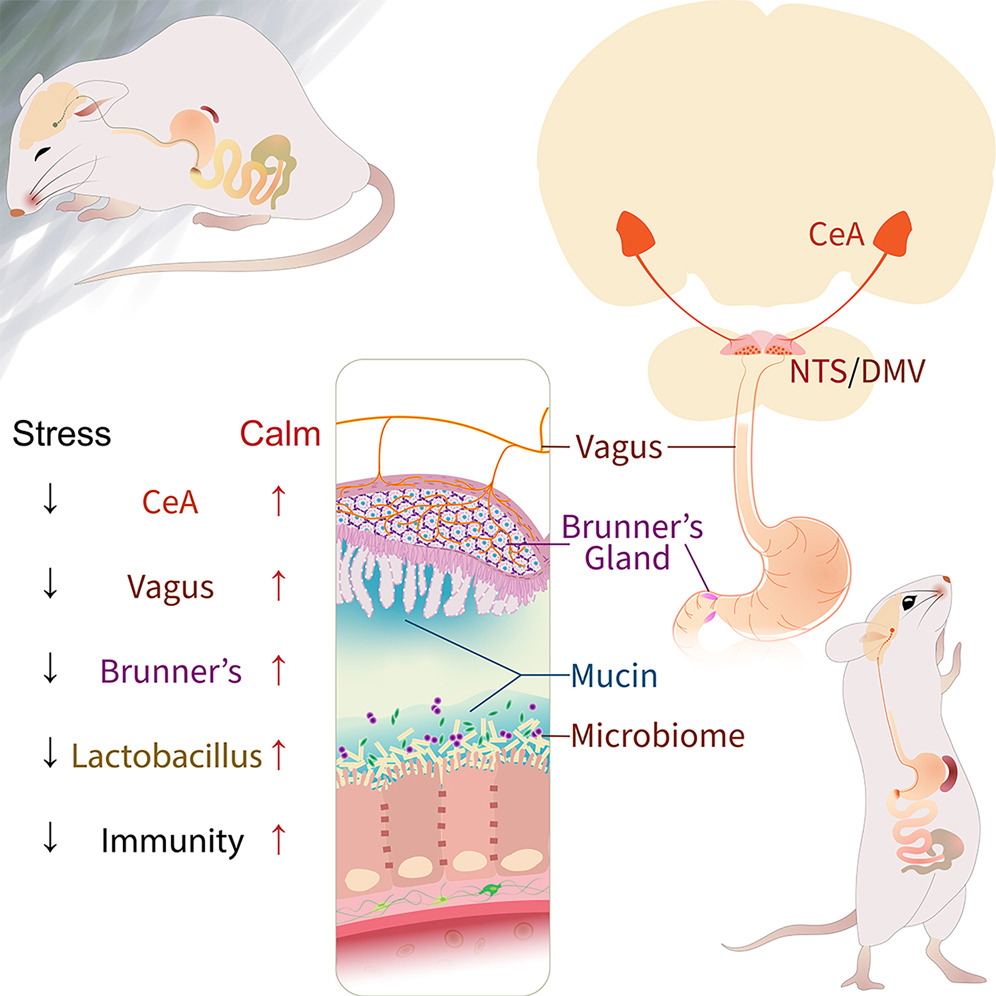
迷走神经将被称为杏仁体的大脑区域(红色;艺术家插图)与肠道中的布伦纳氏腺的神经相连。
据一项针对小鼠的研究显示,压力可能使人感到不适,而肠道中的细菌可能是罪魁祸首。该研究表明,一个处于压力状态的大脑直接关闭了肠道中的特定腺体,影响了肠道细菌及身体的更广泛免疫系统。
爱尔兰科克大学学院的神经科学家John Cryan在评审这项研究时表示:“这是一项技术上的杰作”。关于肠-脑连接的大多数工作都集中在细菌如何影响大脑上,因此Cryan对研究心理状态如何对细菌施加“自上而下”的控制表示欢迎。“这是拼图中真正酷的一部分”,他说。该研究于8月8日在《细胞》杂志上发表。
肠-脑对话
长期以来,研究人员已经知道肠道和大脑之间会相互“交谈”。在压力下,大脑促使释放激素,这些激素可以触发如炎症性肠病等肠道状况。并且,肠道中的某些细菌可以释放化学信号,这些信号会影响大脑和行为。
但是,神经通讯途径却鲜为人知。为了进一步了解,德国蒂宾根马克斯·普朗克生物控制研究所的神经科学家Ivan de Araujo及其同事专注于一种叫做布伦纳氏腺的小器官,这种小器官位于小肠壁中。除了它们产生黏液并含有许多神经元之外,关于这些腺体的知之甚少。
de Araujo的团队发现,移除小鼠的布伦纳氏腺使这些动物更容易受到感染。它还提高了炎症标志物的水平,即大量免疫化学物质和细胞,这些物质和细胞可以损害组织。该团队在人类中看到了类似的效果:从包含布伦纳氏腺的肠道部分切除肿瘤的人比从其他区域切除肿瘤的人拥有更高的白细胞水平——这是炎症的一个标志。
家政细菌
进一步分析显示,从小鼠体内移除布伦纳氏腺消除了存在于小肠中的 Lactobacillus 属细菌。在一个健康的胃肠道中,乳酸杆菌刺激产生蛋白质,这些蛋白质作为细胞间的灌浆,将大部分肠道内容物保持在内部,同时允许某些营养素进入血液。但是当乳酸杆菌消失时,肠道变得‘渗漏’,de Araujo说:“不应该进入血液的东西就这样进去了”。免疫系统攻击这些外来分子,导致没有布伦纳氏腺的小鼠出现炎症和疾病。
研究人员随后检查了这些腺体的神经元。他们发现这些神经元与迷走神经的纤维相连,迷走神经是肠道和大脑之间的通信路径。这些纤维直接通向大脑的杏仁体,杏仁体参与情绪和应激反应。
将具有完整布伦纳氏腺的小鼠置于慢性压力下产生了与移除腺体相同的效果:乳酸杆菌水平下降,炎症增加。这表明压力已经关闭了布伦纳氏腺。
沟通线路
海法以色列理工学院的神经免疫学家Asya Rolls对大脑、布伦纳氏腺、细菌和免疫系统之间的直接联系印象深刻。“这种连接的特异性令人惊叹”,她说。但她警告说,小鼠中的路径可能与人类中的路径不完全相同。
费城宾夕法尼亚大学的微生物学家和神经科学家Christoph Thaiss说:“这篇论文相当鼓舞人心”。他表示,理解连接大脑和肠道的具体路径可以帮助研究人员研究诸如为什么有些人比其他人在应对压力方面更有韧性等问题。
de Araujo表示,这项研究可能对治疗与压力相关的疾病如炎症性肠病有所启示。他的团队现在正在研究慢性压力是否影响婴儿的这一通路,婴儿通过母乳获得他们的 Lactobacillus 。“我们对这些腺体在生命早期对正常发育和免疫功能的重要性感到兴奋”,de Araujo说。
Summary
Negative psychological states impact immunity by altering the gut microbiome. However, the relationship between brain states and microbiome composition remains unclear. We show that Brunner’s glands in the duodenum couple stress-sensitive brain circuits to bacterial homeostasis. Brunner’s glands mediated the enrichment of gut Lactobacillus species in response to vagus nerve stimulation. Cell-specific ablation of the glands markedly suppressed Lactobacilli counts and heightened vulnerability to infection. In the forebrain, we mapped a vagally mediated, polysynaptic circuit connecting the central nucleus of the amygdala to Brunner’s glands. Chronic stress suppressed central amygdala activity and phenocopied the effects of gland lesions. Conversely, excitation of either the central amygdala or parasympathetic vagal neurons activated Brunner’s glands and reversed the effects of stress on the gut microbiome and immunity. The findings revealed a tractable brain-body mechanism linking psychological states to host defense.
https://blog.sciencenet.cn/blog-41174-1445678.html
上一篇:神经元表观遗传和学习记忆的关系
下一篇:血液内年龄蛋白时钟用于老年痴呆等疾病风险预测