博文
氢气的心脏辐射保护作用和miRNA调节【综述】
||
这是欧洲氢医学研究院发起者Jan Slezak教授的一篇综述。发表在《心脏病病理中的环境因子》一本书上。他也是该书的共同编委会成员。他写这个内容名副其实,首先这个内容是他所关注并研究的内容,他过去曾经开展氢气对心脏损伤的保护,氢气对心脏辐射损伤的保护,心脏的辐射损伤机制等多个相关内容的研究。当然小RNA在氢气效应机制方面的工作并不是很多,且多是伴随证据角度的研究,很少从机制上进行探讨。因此从这个角度探讨氢气的辐射防护作用,存在无的放矢的感觉。但无论如何,对这个话题的总结和探讨仍然具有价值。
Regulation of Myocardial MicroRNAs by Molecular Hydrogen Contributes to the Prevention of Radiation-Induced Injury
Environmental Factors in the Pathogenesis of Cardiovascular Diseases
Branislav Kura & Jan Slezak
Part of the book series: Advances in Biochemistry in Health and Disease ((ABHD,volume 30))
辐射代表了一种可能对心脏和血管系统产生负面影响的环境因素。根据剂量和时间,辐射引起的心脏损伤可能会发展,如在先前接受过放疗的长期癌症幸存者中已有详细记录。辐射诱导的氧化应激损伤内皮细胞和心肌细胞。由功能失调的内皮和受损的辐射细胞释放的细胞因子引发的炎症反应激活了防御机制。在后期阶段,心脏通过促进心脏肥大和重塑来响应辐射损伤,以补偿受损的心脏功能,最终导致心力衰竭。微小RNA(miRNAs)是参与调节不同细胞过程的小非编码RNA分子。miRNAs的失调与各种疾病状态有关,包括不良的心脏重塑和毒性。越来越多的研究展示了分子氢在各种疾病中的潜在应用。这种小的非毒性分子是一种有效的抗氧化剂,具有抗炎、抗凋亡和抗纤维化的特性。然而,氢气作用的确切机制仍未完全阐明。现有文献指出miRNAs可能在分子氢的预防效应中起作用,包括辐射引起的心脏损伤。为了证实这些假设,需要进一步的研究,因为这一领域的研究仍处于初期阶段。
引言
人们暴露于自然辐射源以及人造源,例如,诊断成像、癌症治疗的放疗、宇宙射线、核事故等。辐射被认为是一种可能影响生物体健康状态的环境因素,包括心血管系统。辐射引起的心脏损伤(RIHI)在先前接受过放疗的长期癌症幸存者中有详细记录。
RIHI的发病机制主要与活性氧(ROS)和氮物种(RNS)的产生导致的氧化应激、由内皮损伤引起的不同细胞因子的产生以及随后的炎症反应有关。在辐射损伤的后期阶段,发生心脏重塑,主要包括纤维化和肥大的发展,最终导致心力衰竭。在1-4 Gy的辐射剂量下就已出现心血管疾病和炎症的发展,5-8 Gy的剂量可能出现心肌梗死、心绞痛、心包炎和左心室直径减小的情况,而高于8 Gy的剂量会导致心肌纤维化。
最近的研究方向集中在微小RNA(miRNAs),一种小的内源性RNA分子,在各种生理和病理过程中的作用。miRNAs由大约22个核苷酸组成,参与约30%人类蛋白编码基因表达的转录后调控。每个miRNA可以影响几个不同的目标基因的表达,从而调节许多细胞过程,如分化、生长、增殖和凋亡。许多研究证实,miRNAs与心脏辐射损伤相关的病理过程有关,例如,氧化应激、炎症、内皮功能障碍、肥大和纤维化。
氢分子(H2)代表了一个小型且非毒性的分子。H2分子的小型尺寸促进了其通过生物膜到作用位点的传输。越来越多的证据表明,由于H2能够通过选择性消除有毒的ROS和RNS而不影响到具有信号作用的ROS和RNS,因此H2可能成为各种疾病的有效治疗方法。此外,H2还具有抗炎、细胞保护和信号调节作用。已经显示,每天摄入富含氢的水(HRW)6周可以提高接受放疗的肿瘤患者的生活质量,而不影响放疗的抗肿瘤效果。体外和体内实验展示了H2在各种病理条件下的潜在益处,包括辐射引起的损伤。当前的知识指出miRNAs可能参与了H2有益效应的机制,例如,在RIHI、炎症条件、肠道缺血-再灌注(I/R)损伤、脑I/R损伤或哮喘中。
这篇综述旨在总结有关H2辐射防护机制的可用文献,特别强调miRNAs的可能参与,主要关注心血管损伤。
辐射诱导心脏损伤(RIHI)的机制
电离辐射与生物系统的相互作用及其导致RIHI发展的确切机制非常复杂,但仍不完全清楚。RIHI的发病机制主要包括氧化应激和炎症、内皮损伤、线粒体损伤和纤维化(图26.1)[23]。
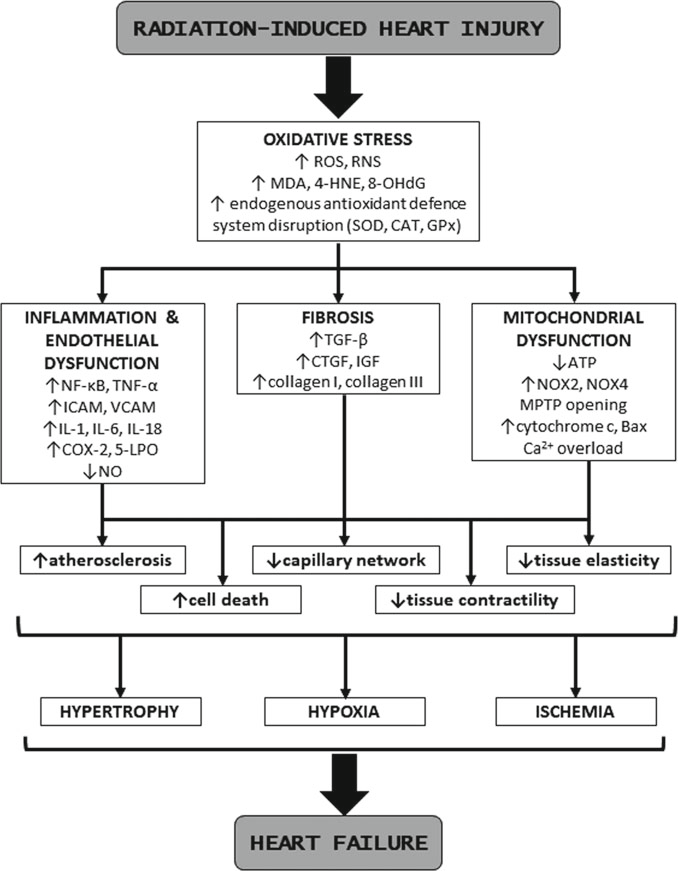
图26.1一个块状流程图。辐射引起的热损伤引发氧化应激,导致炎症、纤维化和线粒体功能障碍。这导致细胞死亡增加和组织弹性降低,进而导致肥大、缺氧和缺血,最终以心力衰竭告终。
辐射诱导心脏损伤中涉及的病理生理机制。ROS—活性氧物种,RNS—活性氮物种,MDA—丙二醛,4-HNE—4-羟基壬烯醛,8-OHdG—8-羟基-2'-脱氧鸟苷,SOD—超氧化物歧化酶,CAT—过氧化氢酶,GPx—谷胱甘肽过氧化物酶,NF-κB—核因子卡帕B,TNF-α—肿瘤坏死因子-alpha,ICAM—细胞间黏附分子,VCAM—血管细胞黏附分子,IL-1—白介素1,IL-6—白介素6,IL-18—白介素18,COX-2—环氧合酶2,5-LPO—5-脂氧合酶,NO—一氧化氮,TGF-β—转化生长因子-beta,CTGF—结缔组织生长因子,IGF—胰岛素样生长因子,ATP—三磷酸腺苷,NOX2—烟酰胺腺嘌呤二核苷酸磷酸氧化酶2,NOX4—烟酰胺腺嘌呤二核苷酸磷酸氧化酶4,MPTP—线粒体通透性转换孔,Bax—Bcl-2相关X蛋白
氧化应激也是许多不同心血管病理的共同原因,包括RIHI,包括在低剂量辐射下 [24]。在辐照后立即,来自辐射束的高能光子可能引起水分子的电离和细胞及膜中的生物大分子如DNA、RNA、蛋白质或脂质的破坏。水占细胞的80%,在吸收辐射后经历放射性分解,随后形成自由基—ROS [12]。ROS不仅与生物大分子迅速反应,它们还可以损害抗氧化剂或编码酶促抗氧化剂的基因,包括谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD),这甚至增加了氧化应激和细胞损伤 [25, 26]。
在辐照诱导的ROS中,由于其高反应性和能够氧化许多细胞组分的能力,羟基自由基(•OH)对组织最为危险。因为心肌细胞膜富含磷脂,所以心肌对电离辐射产生的自由基氧化损伤特别敏感。心肌细胞膜中的脂质过氧化可导致心肌结构损伤和功能受损 [27]。作为细胞膜中脂质过氧化的结果,形成了活性脂质衍生物,例如4-羟基-2-壬烯醛(4-HNE)或丙二醛(MDA)。这两个参数被用作实验目的的脂质过氧化标记物 [28]。辐射诱导的氧化应激还导致线粒体和核DNA的破坏。作为DNA损伤的结果,产生了8-羟基-2'-脱氧鸟苷(8-OHdG),然后将其用作氧化DNA损伤的生物标志物 [29]。此外,辐射可直接导致线粒体呼吸链功能障碍,从而导致三磷酸腺苷(ATP)减少并进一步增加ROS产生,降低抗氧化能力,并诱导凋亡 [28]。
线粒体是心脏肌细胞总体积中占重要比例的细胞器。根据Azimzadeh等人的研究[30],线粒体蛋白是对辐射最敏感的蛋白质群,涉及氧化磷酸化的蛋白质水平增加,包括ATP合成酶、烟酰胺腺嘌呤二核苷酸(NADH)脱氢酶和细胞色素c氧化酶。辐照后,线粒体的功能障碍还导致烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)2和NOX4的增加,这两者是心脏中表达最丰富的,存在于心肌细胞和内皮细胞中,进一步增加了氧化应激[31]。ROS可以诱导线粒体膜通透性转换孔的开放,并导致细胞色素c和其他因子的释放,这些因子可以引发凋亡介导的细胞死亡[32]。据报道,暴露于辐射会导致促凋亡Bcl-2相关X蛋白(Bax)的表达和激活增加,导致其易位并插入线粒体外膜[33]。辐射还可能因内质网与线粒体的密切关联而导致线粒体介导的凋亡。当心肌细胞受到辐照时,内质网释放出过量的钙离子流,这有助于线粒体的通透性[2]。
血管和毛细血管内皮的损伤也是辐射常见的后果。辐射诱导的氧化应激导致核因子卡帕B(NF-κB)的激活。这导致许多与炎症相关的基因激活,包括细胞间粘附分子(ICAM)、血管细胞粘附分子(VCAM)、环氧合酶(COX)-2、5-脂氧合酶(5-LPO),并促进血栓形成[12, 34]。在炎症过程中,巨噬细胞和单核细胞被激活,并持续分泌细胞因子和生长因子,包括肿瘤坏死因子-alpha(TNF-α)、白细胞介素(IL)-1、IL-6、IL-18和单核细胞趋化因子。在大动脉中,单核细胞粘附于受辐照的内皮并迁移至内膜。转变为活化巨噬细胞(泡沫细胞)的单核细胞可能随后启动动脉粥样硬化的过程[35]。超氧阴离子自由基可以与信号分子一氧化氮(NO)相互作用,形成过氧亚硝酸盐(ONOO−),这减少了NO的生物可用性[36]。
内皮功能障碍可能导致动脉粥样硬化、促纤维化和促肥大事件。慢性炎症导致心脏形态及其功能的改变,这不可避免地导致心力衰竭[12]。在许多类型的疾病中观察到基质金属蛋白酶(MMPs)活性增加。MMPs可立即由辐射在内皮细胞中激活,并且可能降解内皮基底膜,允许有效的中性粒细胞和巨噬细胞招募到细胞损伤部位以吞噬组织碎片[37, 38]。近年来,普遍的看法是它们也在电离辐射引起的疾病中发挥作用[39]。观察到MMP-2激活的显著变化,表明MMP-2在辐射影响下的心脏重塑和病理变化中发挥作用。辐照后心脏中也观察到其他变化。辐照导致连接蛋白-43表达显著上调,这是一种负责细胞间通讯的蛋白质[40]。
纤维化伴随着心脏组织和血管辐照后的急性以及晚期表现。这是多重重叠效应的结果,包括炎症、氧化应激和基因表达的慢性变化(38)。ROS可以导致转化生长因子beta(TGF-β)激活、凝血酶产生、血小板激活和促炎信号激活,以促进肌成纤维细胞积累和细胞外基质(ECM)产生[41]。这导致胶原沉积增加、血管壁增厚和管腔狭窄[42, 43]。急性变化与细胞死亡和由此产生的急性期炎症分子的释放有关(例如,血小板衍生生长因子(PDGF)、TGF-β、碱性成纤维细胞生长因子(FGF)、胰岛素样生长因子(IGF)、结缔组织生长因子(CTGF)、IL-4、IL-13、IL-8和甲基接受趋化因子(MCP)),然后在TGF-β的存在下,成纤维细胞、纤维细胞、组织特异性周细胞和肌成纤维细胞被激活分化为成熟的肌成纤维细胞[44, 45]。所有这些过程持续到毛细血管网络减少,导致心肌缺氧。进行性和弥漫性间质纤维化导致组织弹性和收缩力降低以及通过分隔和替换心肌细胞导致的慢性缺氧,导致细胞死亡机制、器官功能障碍和心力衰竭[46]。
辐射后,心肌中心肌细胞的丢失导致代偿性肥大,其特征为左心室壁厚度增加和左心室内径减小。这种肥大被认为是由于氧化应激、TGF-β信号传导以及由环磷酸腺苷(cAMP)激活的交换蛋白(Epac)的增加所致。Epac已被证明能增加细胞内Ca2+流量,激活如Ca2+/钙调蛋白依赖性蛋白激酶II(CaMKII)和钙蛋白酶等肥大信号,并独立于TGF-β介导的纤维化通路诱导胎儿基因重编程[47, 48]。心肌缺血和缺氧、炎症反应、胶原蛋白沉积以及内皮细胞和成纤维细胞的增殖导致组织重塑、心脏纤维化和动脉粥样硬化,这些变化是RIHI的主要终点[49]。
miRNAs在辐射诱导心脏损伤(RIHI)中的作用
miRNAs是调节目标信使RNA稳定性和/或翻译效率的短非编码RNA分子。通过基因表达调控,miRNAs在细胞生长、增殖、分化、凋亡和应激反应等多种细胞过程中扮演重要角色[50]。研究发现miRNAs在不同物种间具有进化保守性,且大多数以组织特异性方式表达[51]。心脏中表达150-200种miRNAs,它们在心脏疾病响应中受到调控[52]。miRNA-1、miRNA-133a、miRNA-208和miRNA-499是在心肌组织中最丰富的miRNAs[53]。
许多研究小组已经探索了特定miRNAs与辐射的细胞反应之间的关联。miRNAs与辐射之间的关系是相互的。一方面,辐射改变了许多miRNAs的表达。另一方面,miRNAs通过参与不同过程来参与生物对辐射的反应。miRNAs对辐射的反应取决于剂量、细胞类型和疾病。此外,辐射调节的miRNAs的变化是暂时的,可能有不同的时间表达模式[11]。
RIHI主要在胸部恶性瘤,特别是左侧乳腺癌的放射治疗后被观察到[41]。Esplugas等人[54]显示,放疗导致乳腺癌妇女血液中miRNA-146a、-155、-221和-222的过度表达。检测到的miRNAs参与了心血管疾病的进展。在另一项研究中,Chałubińska-Fendler等人[55]确定了接受左侧乳腺癌治疗的患者放疗后血清中明显改变的七种miRNAs。辐照后24小时,miRNA-15b-5p、miRNA-22-3p、miRNA-424-5p和miRNA-451a的表达显著下降。辐照上调了人内皮细胞中let-7 g、miRNA-16、miRNA-20a、miRNA-21和miRNA-29c的miRNA表达水平,而miRNA-18a、miRNA-125a、miRNA-127、miRNA-148b、miRNA-189和miRNA-503被下调[56]。
在器官层面,miRNA-1、-21、-208、-133、-29、-199b、-221、-222和-155可能在辐射诱导的心脏病中失调[57]。全身体和部分身体辐照后15天分析小鼠心脏,发现几种miRNAs共同下调,其中最下调的是肌肉特异性miRNA-1、miRNA-133a、miRNA-133b、miRNA-206、miRNA-208a、miRNA-208b和miRNA-499。小鼠心脏中的纤维化通过胶原沉积增加和肌成纤维细胞激活相关基因的过表达来指示,这是在辐照后6个月测量的[58]。
从文献中可以明显看出,miRNAs是复杂辐射反应中的重要参与者。miRNAs通过参与DNA修复、细胞周期检查点、凋亡、自噬和氧化应激等多个途径来调节细胞对辐射的反应。miRNAs与放疗引起的副作用密切相关[59]。
miRNA-1在心脏和骨骼肌中丰富表达。它在心脏发生过程中作为分化和增殖的调节剂[60],并在成年心脏中显示出抗肥大效应[8]。miRNA-1还通过抑制抗凋亡蛋白B细胞淋巴瘤2(Bcl-2)的表达来参与心肌细胞凋亡的调控[61]。在用25 Gy照射纵隔后的辐射大鼠心脏中,发现miRNA-1在6周后下调[13]。同时观察到Cx43的增加,导致心肌细胞间通讯增强[40]。
miRNA-133与miRNA-1从相同的染色体位点转录而来[62]。miRNA-133抑制心脏肥大和心脏纤维化的进展[63]。徐等人[64]发现,miRNA-133通过抑制caspase-9的表达而具有抗凋亡作用。辐射增加了胶原蛋白的合成并导致心肌纤维化重塑。严等人[65]发现,miRNA-133a的过表达可以通过下调CTGF、胶原I和III来缓解辐射诱导的心肌纤维化。同样,杜斯特等人[66]展示了miRNA-133和miRNA-30直接下调CTGF,这是一种关键的促纤维化蛋白,这表明这些miRNAs在控制心肌细胞外基质的结构变化中扮演了重要角色。
miRNA-208a在心脏中表达良好,与心脏肥大和纤维化的发育高度相关[67]。在卡利斯等人的研究[68]中,报道称miRNA-208a的过表达可以诱导心脏重构并调节肥大通路组分的表达,或者它可以诱导心律失常。在放射治疗的肺癌患者中,miRNA-208a上调。辐射诱导的miRNA-208a通过靶向p21并激活蛋白激酶B/哺乳动物雷帕霉素靶蛋白(AKT/mTOR)通路,增加了人肺癌细胞的增殖和放疗抵抗性。miRNA-208a上调了抗凋亡蛋白Bcl-2,同时下调了促凋亡的Bax[69]。
发现miRNA-499水平与心肌损伤有关,主要是急性心肌梗死[70]。已经发现,miRNA-499通过消除钙调神经磷酸酶介导的线粒体相关蛋白-1(Drp1)去磷酸化和减少线粒体分裂,从而抑制了细胞死亡的线粒体途径[71]。
已经证明,辐照后miRNA-21的生成增加[22]。miRNA-21直接靶向并下调SOD3,并通过减少TNF-α的表达间接降低SOD2水平,从而导致超氧水平增加[72]。在早期研究之一中,显示电离辐射在人体成纤维细胞中诱导了miRNA-21的表达[73]。在暴露于胸部辐照的大鼠心肌中,miRNA-21上调被显示为调节细胞外基质蛋白和蛋白激酶C(PKC)信号传导,这可能影响由连接蛋白43(Cx43)介导的电耦合[40]。来自大鼠的实验数据显示,8 Gy的全身辐照导致心脏纤维化,这与miRNA-21上调有关[74]。miRNA-21通过调节不同的信号通路促进纤维化的发展,例如,TGF-β[75]。哈利米等人[76]调查了乳腺癌患者血清中miRNA 21水平的变化。放疗前miRNA-21水平与健康志愿者相当,并在放疗后显著增加。
miRNA-29家族成员是心脏纤维化的抑制剂,在心肌细胞损伤后的心脏重塑中发挥主要作用[9]。miRNA-29b靶向涉及细胞外基质(ECM)的不同基因,如纤维连接蛋白、胶原和MMPs[77]。在小鼠接受单次辐照剂量于指定的纵隔和颈部区域(包括心脏和大血管)后,miRNA-29b在辐照动脉中被下调。miRNA-29b靶向pentraxin-3和二肽基肽酶4,它们调节炎症和基质蛋白结合[78]。在另一项研究中,发现在胸部放疗后的肺癌患者血浆样本中循环miRNA-29a水平下降。miRNA-29a水平的下降与使用的放疗剂量有关[79]。根据范·鲁伊等人的观点[9],miRNA-29似乎被TGF-β下调,TGF-β是心脏纤维化的调节因子。
miRNA-15家族主要参与纤维化的调控。多个miRNA-15家族成员靶向不同蛋白以抑制TGF-β通路[80]。库拉等人[13]证明了在辐照大鼠心脏中miRNA-15b被下调。在另一项研究中,辐照后细胞内miRNA-15b水平与SIRT4基因表达上调同时降低[81]。
单磷酸腺苷激活蛋白激酶(AMPK)是调节能量代谢、细胞命运和氧化应激信号传导的关键信号分子,在包括心肌细胞在内的不同细胞中发挥作用[82]。使用20 Gy的单剂量全心脏辐照显著抑制了小鼠心脏中miRNA-223-3p的表达。通过激活AMPK,miRNA-223-3p模拟物显著改善了辐射诱导心脏病小鼠的凋亡、氧化损伤和心脏功能障碍[83]。已经证明,miRNA-223-3p与心血管病的多个病理过程或特征相关,包括动脉粥样硬化、血管或心肌重塑、血小板反应异常和心肌缺血[84]。
miRNA-34家族,包括miRNA-34a/b/c,在调节心肌生理和病理过程中发挥重要作用[85]。刘等人[86]发现,辐射可在幼年和成年小鼠的许多器官中诱导miRNA-34a的产生。研究表明,在暴露于辐射的人类心肌细胞中,miRNA-34a的表达上调。它在辐射反应中扮演着不同的角色,如调节ROS和炎症产生。通过靶向SIRT1,抑制miRNA‑34a可防止辐射引起的心肌细胞衰老[87]。在放疗中,辐射增加了44名乳腺癌妇女血清中的miRNA-34a水平[88]。
在心脏病和动脉粥样硬化背景下被广泛研究的miRNA-30c,也被报告在辐射诱导的凋亡以及整个生物体的存活中发挥关键作用[89]。miRNA-221/222在血管平滑肌细胞和内皮细胞中高度表达。心肌miRNA-221/222表达的减少与心衰患者严重的心脏纤维化有关[90]。作者发现,miRNA-221/222家族可能靶向TGF-β信号通路中的几个基因。放射治疗导致乳腺癌患者血液中miRNA-221/222的上调[54]。刘等人[91]发现,用6 Gy剂量照射骨髓间充质干细胞时,miRNA-22的过表达加速了辐射诱导的线粒体ROS积累,并减弱了辐射激活的细胞自噬,从而促进了凋亡。选择性心脏辐照在大鼠中诱导了心肌中促肥大miRNA-212的过表达[92]。
H2的辐射防护潜力
H2是宇宙中最丰富、最轻的元素。由于其小尺寸,H2能通过细胞膜扩散进入胞浆、线粒体甚至细胞核,在那里发挥作用[93]。当H2与空气混合浓度在4%到75%之间时具有爆炸性,但其有益效果已在1%到4%的浓度下显现出来,因此以这样低的浓度施用H2被认为是安全的[94]。至今尚未描述施用H2后的毒性效应[95]。H2最常见的给药方式是通过吸入、饮用富氢水(HRW)或注射含有H2的生理溶液。也可以通过富氢浴、含H2的眼药水或增加小肠细菌产生的H2量来应用H2[96]。HRW可以通过在高压下将H2气体溶解在水中或在水中溶解产氢片剂至室温下的1.6 ppm或0.8 mM的浓度来制备[97]。
研究发现,H2可通过多种机制有效减轻辐射对细胞和器官的损害[98]。Ohsawa等人首次描述了H2的选择抗氧化性质[93]。他们发现,H2可以有选择地清除⋅OH和ONOO−,但不影响其他具有生理功能的ROS。在辐照后的小鼠心脏中证明了H2的抗氧化性质,其中辐照前摄入HRW显示出心脏保护效果,通过增加内源性抗氧化剂的水平,减少了心肌中的氧化应激标志物MDA和8-OHdG[99]。Yu和Zheng[100]展示了在自发性高血压大鼠(SHR)中使用富氢盐水(HRS)治疗减轻了氧化应激,恢复了包括GPx、GST、CAT和SOD在内的抗氧化酶活性,抑制了NADPH氧化酶活性,并在大鼠左心室下调了NOX2和NOX4的表达。Xie等人[101]揭示,H2气体通过直接消除⋅OH自由基以及激活核因子红细胞2相关因子2/血红素加氧酶1(Nrf2/HO‑1)信号通路来保护心肌细胞免受缺血引起的心肌损伤。
炎症在辐射引起的损伤发展中起着主要作用。Gharib等人的研究首次证明了H2的抗炎作用[102]。在他们的研究中,向患有慢性肝炎症的大鼠提供H2气体降低了循环中的TNF-α水平。在另一项研究中,HRS治疗抑制了包括IL-1β、IL-6、TNF-α和MCP-1在内的促炎细胞因子,并通过防止IκBα降解来抑制左心室中SHR的NF-κB激活[100]。在另一项研究中,Wang等人[103]观察到注射HRS通过抑制c-Jun N末端蛋白激酶(JNK)和NF-κB的激活,从而抑制了大鼠大脑中的炎症。LeBaron等人的另一项研究[104]表明,饮用HRW 24周可降低代谢综合征患者的炎症标志物TNF-α、IL-6和C反应蛋白(CRP)。根据Li等人的研究[105],以盐水形式给予的H2治疗抑制了肝脏的I/R损伤。H2给药后,作者注意到肝细胞凋亡减少、炎症细胞因子形成受抑、以及具有抗炎和细胞保护作用的HO-1和SIRT1的表达诱导。
心脏纤维化被认为是辐射暴露的主要晚期心脏副作用[106]。已经证明,HRS通过抑制TGF-β信号通路减轻了SHR的心肌纤维化[107]。体内H2治疗被证明能够抑制小鼠辐射引起的肺损伤,减轻氧化应激和随后的长期肺纤维化损伤[108]。Nie等人[109]证明,对大鼠给予2% H2治疗28天对心肌梗死引起的心脏重塑和纤维化有效。在这项研究中,H2治疗改善了心脏功能并减少了心脏纤维化区域,抑制了胶原蛋白I和III的沉积,并下调了TGF-β、平滑肌α-肌动蛋白(α-SMA)在心肌梗死诱导的大鼠中的表达。在另一项不同的研究中,Lu等人[110]观察到H2抑制了磷酸酶和张力蛋白同源物(PTEN)/AKT/mTOR途径的激活,并缓解了腹膜纤维化。
心脏肥大作为补偿机制发展,以补偿辐射后心肌细胞的损失[92]。在体外模型中,富含H2的培养基通过下调IL-6和激活Janus激酶/信号转导和转录激活因子3(JAK/STAT3)信号通路,有效减少了心肌细胞肥大,导致不良心脏重塑和细胞炎症反应的减轻[111]。其他实验研究报告称,在使用HRS的大鼠模型中,经过H2治疗后心脏和心房重量显著减少[100, 111]。H2吸入(在14天内每天4小时2%)对左旋甲状腺素诱导的肥大心脏有保护作用,通过抑制心脏NOX2、血管紧张素II型1受体、肌浆网Ca2+-ATP酶(SERCA2)、磷酸化磷酸肌醇和α-肌球蛋白重链蛋白的表达[112]。
辐射可以损害线粒体功能并改变电子传递链复合物的活性,导致心肌细胞凋亡[113]。HRS治疗通过恢复电子传递链酶活性、抑制ROS形成和增强SHR左心室中的ATP产生来保护线粒体功能[100]。Gvozdjáková等人[114]证明,饮用HRW刺激了大鼠心脏线粒体电子呼吸链的功能,并通过复合物I和复合物II底物增加了ATP产生的水平。同样,大鼠血浆、心肌组织和线粒体中的辅酶Q9水平增加,而HRW给药后血浆中的MDA水平降低。根据Li等人[115]的研究,HRS减弱了异氟醚诱导的caspase-3激活、ROS积累、线粒体通透性转换孔的开放、线粒体膜电位降低和细胞ATP水平的降低。使用肠隐窝上皮细胞系(IEC-6细胞系)进行的体外实验显示,富含H2的培养基显著抑制了ROS的形成,维持了细胞活力并抑制了细胞凋亡。这种保护作用可能是由于阻断了线粒体凋亡途径,因为H2处理阻止了线粒体去极化、细胞色素c释放以及caspase-3、caspase-9和多聚(ADP-核糖)聚合酶(PARP)的活性。此外,H2处理还阻断了B细胞淋巴瘤-特大(Bcl-xl)和Bcl-2表达的减少以及Bax蛋白表达的增加[116]。
通过调节miRNAs预防辐射引起的心脏损伤(RIHI)
由于miRNAs已被显示与心脏辐射损伤相关的病理过程有关,可以假设H2的辐射防护效应至少部分可能由miRNAs的调控介导。现有文献提供了这一领域的一些见解(表26.1),但研究仍处于初级阶段。
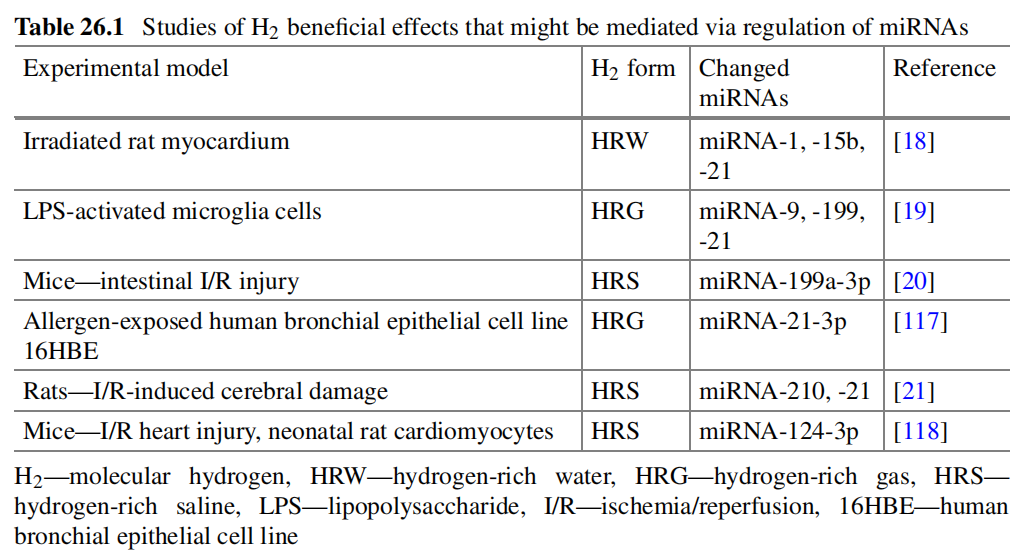
表26.1 通过调节miRNAs介导的H2有益效果的研究
Kura等人[18]调查了H2对大鼠心肌在纵隔区单剂量10Gy辐射后的抗氧化和抗炎作用。H2有效地降低了受辐射大鼠心肌中的MDA和TNF-α。该研究揭示了H2对辐射诱导的心脏损伤的保护作用可能是通过调节miRNA-1、-15b和-21介导的。
Liu等人[19]探讨了H2在调节miRNA表达和信号调节活动中的潜在机制。结果表明,miRNA-9、miRNA-199和miRNA-21在H2对脂多糖(LPS)激活的小胶质细胞的抗炎调控中扮演重要角色。
在小鼠肠道I/R损伤模型中评估了miRNAs在H2保护效应中的潜在影响[20]。HRS预处理减轻了I/R诱导的损伤和上皮细胞凋亡。总体而言,HRS给药后肠道中有64个miRNAs显著改变。其中主要是miRNA-199a-3p由I/R大幅增高,但被HRS减少。在IEC-6细胞上的体外实验确认,miRNA-199a-3p可能参与了HRS的抗凋亡机制,有助于其保护肠道免受I/R损伤。
Zhang等人[117]的研究旨在调查H2对哮喘发病机理的影响。他们展示了H2通过调节不同的细胞因子有效抑制过敏原诱导的哮喘。在暴露于过敏原后的人支气管上皮细胞系16HBE中进行的miRNA分析显示,H2逆转了过敏原引起的miRNA表达变化。miRNA-21-3p上调超过1.4倍,这种上调完全被H2气体抑制。
Li等人[21]分析了HRS对I/R诱导的脑损伤的影响。与未经HRS处理的I/R动物相比,接受HRS治疗的大鼠受到的伤害较轻。在再灌注后24小时和96小时,I/R组海马中的miRNA-210和miRNA-21表达显著增加,而经HRS处理的组中这些表达显著降低。测量结果证实,NF-κB和miRNAs表达的变化与I/R损伤的程度相关。
HRS治疗减轻了缺血诱导的凋亡性细胞死亡,并在I/R过程中增加了细胞活力,而沉默miRNA-124-3p的表达消除了这种保护效应。calpain1被确定为miRNA-124-3p的直接靶点。HRS通过miRNA-124-3p减少calpain1的表达来减轻心肌细胞凋亡[118]。
从已进行的研究中获得的证据表明,miRNAs可能涉及H2保护效应的机制,如在不同实验模型(心脏、肠道、肺、脑)中所展示的,包括辐射诱导的损伤。检测到的miRNAs主要参与纤维化(miRNA-21、-15b、-210)和肥大(miRNA-1、-199a、-124)过程。需要进一步的研究以扩展该领域的知识。
结论
积累的临床证据表明,辐射暴露增加了心血管功能障碍的风险,例如在放射治疗治疗的癌症幸存者或核事故幸存者中已有记录。许多实验证明了H2对不同疾病模型的预防和治疗效果,包括辐射诱导的损伤。特别是H2的抗氧化、抗炎和细胞保护作用对其辐射防护作用很重要。然而,确切的机制尚未完全阐明。当前的研究已经表明,miRNAs可以影响细胞对辐射的反应所涉及的机制和途径。根据现有文献,H2改变了不同miRNAs的表达,这些miRNAs可能涉及H2作用的辐射防护机制。需要在这一领域进行更多研究,以获得更多知识并将H2的可能应用推向由辐射引起的病理状态。
https://blog.sciencenet.cn/blog-41174-1445091.html
上一篇:睡不好影响大脑细胞连接方式
下一篇:医生对男女病人的区别对待《PNAS》