博文
抑制IL-11信号通路延长哺乳动物的健康寿命和寿命《自然》  精选
精选
|
抑制IL-11信号通路延长哺乳动物的健康寿命和寿命
Widjaja, A.A., Lim, WW., Viswanathan, S. et al. Inhibition of IL-11 signalling extends mammalian health span and lifespan. Nature (2024).
Inhibition of IL-11 signalling extends mammalian healthspan and lifespan | Nature
对于健康寿命和寿命而言,ERK、AMPK和mTORC1是关键的通路,而炎症则是极其重要的中心标志物。在这里,我们研究了IL-11,一种属于IL-6家族的促炎性细胞因子,是否对与年龄相关的疾病和寿命产生负面影响。随着小鼠年龄的增长,IL-11在各种细胞类型和组织中上调,以调节ERK–AMPK–mTORC1轴,从而调节细胞、组织和生物体层面的衰老病变。删除IL-11或IL-11ra1可以防止老年时期的代谢下降、多病共存和虚弱。给75周龄的小鼠施用抗IL-11治疗25周,可以改善代谢和肌肉功能,减少衰老生物标志物和跨性别的虚弱。在寿命研究中,遗传删除IL-11平均将小鼠的寿命延长了24.9%。从75周龄开始使用抗IL-11治疗直到死亡,将雄性小鼠的中位寿命延长了22.5%,雌性小鼠延长了25%。这些结果共同证明了促炎性因子IL-11在哺乳动物的健康寿命和寿命中的作用。我们认为,目前正处于早期临床试验阶段的针对纤维化肺疾病的抗IL-11疗法,可能提供一个转化机会来确定IL-11抑制对老年人衰老病变的影响。
前言
调节寿命的主要信号机制包括ERK、STK11(也称为LKB1)、AMPK、mTORC1和IGF1–胰岛素模块。这些通路在老年时共同受到干扰,激活衰老的标志,包括线粒体功能障碍、炎症和细胞衰老。在老年生物中,AMPK–mTORC1轴对代谢健康尤为重要,在脂肪组织中有显著影响,而且通过治疗性抑制mTOR可延长小鼠的寿命。
迄今为止的衰老研究主要集中在寿命延长上,特别是在酵母、蠕虫和果蝇中,但寿命延长并不一定反映更长的健康寿命。需要综合研究来确定干预措施对健康寿命和寿命的影响。实验室小鼠特别适合进行此类实验,因为对人类福祉和功能重要的衰老病变在小鼠中很明显,且小鼠的寿命研究已有很好的建立。
慢性无菌炎症对衰老病变的重要性越来越被认识到,而炎症本身是衰老的一个中心标志。简而言之,衰老与一个功能失调的适应性免疫系统相关,其特点是免疫衰老和胸腺退化以及如IL-6等先天免疫基因的不适当激活。促炎性信号因子NF-κB和JAK–STAT3特别涉及衰老,JAK抑制剂可以缓解与年龄相关的功能障碍。
我们提出,IL-11,一个促炎性和促纤维化的IL-6家族成员,可能会促进与年龄相关的病变并缩短寿命。这一前提基于研究表明IL-11可以激活ERK–mTORC1和/或JAK–STAT3,观察到IL-11在老年人中上调,以及IL-11越来越多地被认为在衰老的一个标志——衰老中有作用。在这里,我们使用了一系列遗传学和药理学方法,测试了IL-11信号通路对小鼠健康寿命和寿命有负面影响的假设。
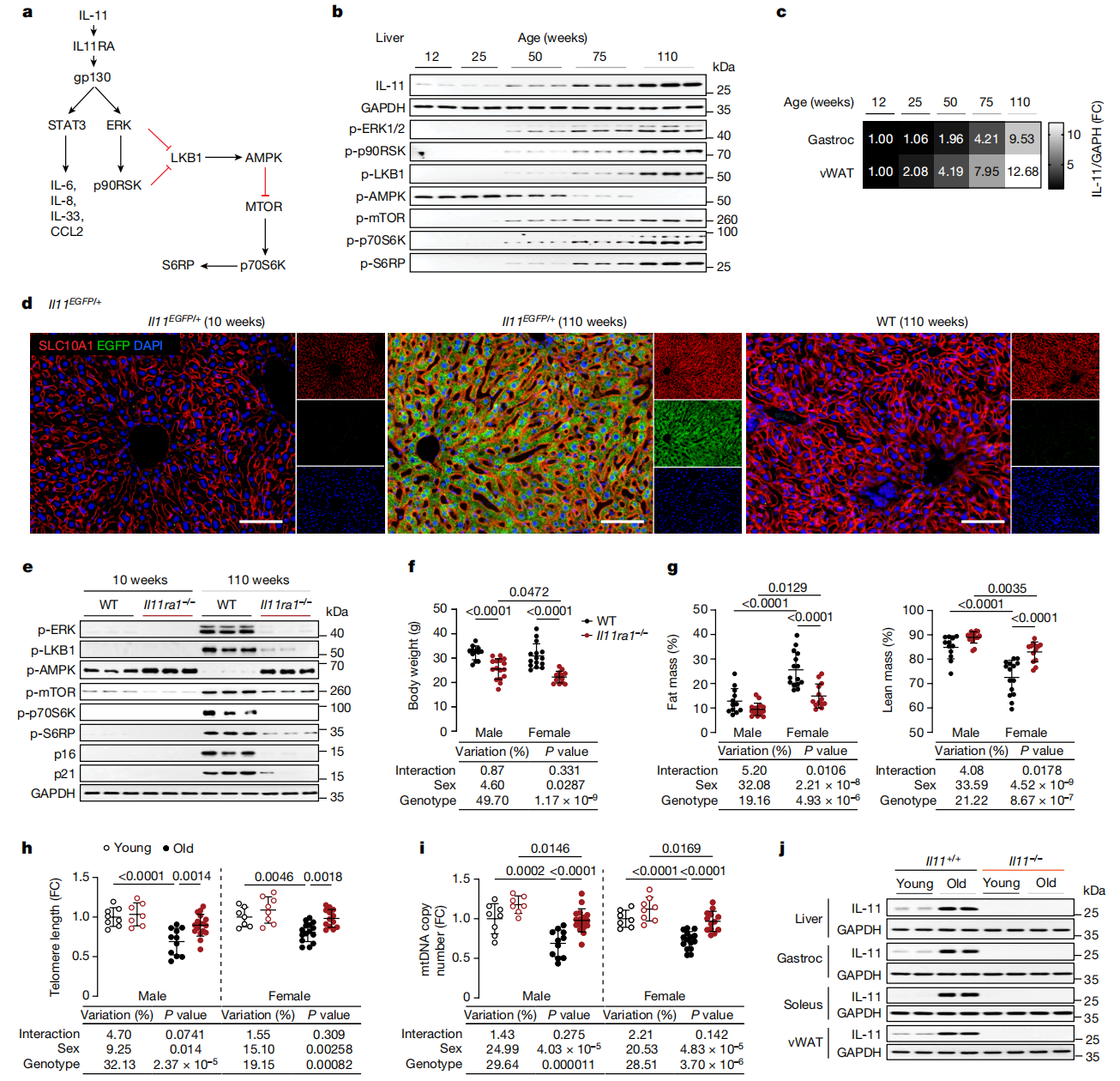
图1:IL-11–ERK–mTORC1信号模块在衰老中上调,与衰老和代谢下降相关联。
IL-11随着年龄的增长而上调
我们在小鼠的肝脏、内脏性腺白色脂肪组织(vWAT)和骨骼肌(腓肠肌)中确定了IL-11的表达,这揭示了在所有组织中IL-11的渐进性上调(图1b、c及扩展数据图1a、b)。随着年龄的增长,肝脏和肌肉中出现了ERK-p90RSK的渐进性激活、LKB1-AMPK的失活以及mTOR-p70S6K的激活,这些构成了一个IL-11信号模块(图1b及扩展数据图1c)。在两岁的雄性和雌性小鼠的肝脏、vWAT和骨骼肌中确认了IL-11的上调(扩展数据图1d)。
为了确定老龄小鼠中表达IL-11的细胞类型,我们查询了Tabula Muris Senis28,但未能得到信息,可能是因为IL-11的表达水平较低,而且IL-11主要受到翻译调控。为了更好地识别老龄小鼠组织中表达IL-11的细胞,我们对来自老年IL-11-EGFP报告小鼠的组织进行了免疫组化分析。在两岁的IL-11-EGFP小鼠中,IL-11在实质细胞(肝脏中的肝细胞、vWAT中的脂肪细胞和骨骼肌中的肌细胞)中明显,也在各种组织的基质细胞、上皮细胞和内皮细胞中看到,以及在骨骼肌中的神经中看到(图1d及扩展数据图1e-g)。因此,随着年龄的增长,IL-11在不同的组织中的多种细胞类型中表达。
IL-11与衰老相关
为了进一步探索IL-11上调与老龄小鼠组织中ERK-mTOR激活之间的关系,我们研究了十周大和两岁大的IL-11ra1−/−小鼠及其野生型同窝对照。在肝脏、vWAT和腓肠肌提取物的免疫印迹中,老年野生型小鼠显示出增加的磷酸化(p)-ERK和p-p90RSK,增加的p-LKB1导致减少的p-AMPK,以及增加的p-mTOR、p-p70S6K和p-S6RP水平(图1e及扩展数据图2a-c)。老年野生型小鼠的组织中典型衰老标志物p16Inka4和p21Waf1/Cip1的水平增加。相比之下,这些不同激酶和S6RP的磷酸化状态,以及p16和p21的水平,在老年IL-11ra1−/−小鼠与年轻野生型小鼠之间相似(图1e及扩展数据图2a-c)。
删除IL-11ra1改善代谢
与野生型同窝对照相比,两岁的IL-11ra1−/−小鼠体重较轻(图1f),而且雌性IL-11ra1−/−小鼠脂肪量减少,瘦肉量增加(图1g)。两种性别的IL-11ra1−/−小鼠的核心体温略高于野生型对照(扩展数据图2d)。两种性别的老龄IL-11ra1−/−小鼠的vWAT指数(vWAT重量标准化为体重)较低,腓肠肌指数增加(扩展数据图2e)。基因型之间的肝指数相似,而在IL-11ra1−/−小鼠中肝脏甘油三酯水平较低(扩展数据图2e、f)。
血清胆固醇和甘油三酯水平在老龄野生型小鼠中比在IL-11ra1−/−同窝对照中更高(扩展数据图2g,h)。两种性别的老龄IL-11ra1−/−小鼠的肝脏显示出促炎基因(Ccl2、Ccl5、Tnf和Il1b)和脂肪酸合成基因(Acc、Fasn和Srebp1c)表达减少(扩展数据图2i,j)。血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平,肝细胞损伤的标志物,在老龄野生型小鼠中增加,但在老龄IL-11ra1−/−小鼠中未增加(扩展数据图2k,l)。
我们评估了端粒长度和线粒体DNA(mtDNA)拷贝数——与生物学年龄相关的生物标志物1,32——并在肝脏和腓肠肌中发现,这些表型在老龄IL-11ra1−/−小鼠的组织中得到显著保存(图1h,i及扩展数据图2m,n)。
IL-11诱导人类细胞衰老
IL-11与衰老有关——因此我们探索了IL-11对在老年小鼠中发现表达IL-11的相应人类细胞类型直接效应的影响(图1d及扩展数据图1e-g)。用IL-11刺激人类成纤维细胞或肝细胞激活了ERK-mTOR,增加了p16和p21的水平,并减少了PCNA和cyclin D1的表达,这种效应被U0126或雷帕霉素阻止(扩展数据图3a,b)。IL-11刺激的成纤维细胞上清液中,衰老相关分泌表型因子的数量增加,这种增加被U0126或雷帕霉素抑制(扩展数据图3c,d)。在肝细胞上清液中对mTORC1依赖性衰老相关分泌表型因子(IL-6、IL-8、LIF、VEGFA、HGF、CCL2、CXCL1、CXCL5、CXCL6和CCL2033)进行更深入的分析显示,大多数这些蛋白受到IL-11刺激的ERK和mTORC1依赖性调控(扩展数据图3e-g)。
衰老细胞的积累有助于衰老病变。我们通过连续传代人类成纤维细胞,并用中和性IL-11RA抗体(X209)或IgG对照29,34来模拟复制性衰老。我们观察到传代依赖性的ERK-mTORC1、NF-κB和STAT3的磷酸化,以及衰老标志物的增加——这些效应依赖于IL-11,有自分泌和旁分泌作用的证据(扩展数据图4a-d)。端粒长度和mtDNA拷贝数在早期传代(第4代(P4))细胞和X209处理的晚期传代(P14)细胞之间相似,而在IgG处理的P14细胞中这些表型减少(扩展数据图4e,f)。基础代谢呼吸在IgG处理的P14成纤维细胞中受损,而X209处理的P14细胞与P4成纤维细胞相似(扩展数据图4g,i)。
在雌性小鼠中删除IL-11
为了支持在混合C57BL6/129遗传背景上的IL-11ra1删除小鼠中生成的数据30,并更深入地剖析与年龄相关的影响,我们研究了年轻(3个月大)和老年(2岁大)的雌性小鼠,这些小鼠在C57BL6/J背景上删除了IL-11(IL-11−/−)31。
免疫印迹确认了在这一额外品系的老龄中IL-11在各组织的上调(图1m)。老年雌性IL-11−/−小鼠体重和脂肪量较低,且保持了瘦肉量(图2a-c)。老年雌性IL-11−/−小鼠的虚弱评分15低于老年野生型小鼠,且它们的体温略有升高(图2d及扩展数据图5a)。较低的虚弱评分主要是由震颤、毛发颜色丧失、步态障碍和前庭功能障碍的改善所驱动(补充表1)。与年龄匹配的对照组相比,年轻和老年IL-11−/−小鼠的肌肉力量均有所提高(这是一些其他表型观察到的现象)(图2e及扩展数据图5b)。
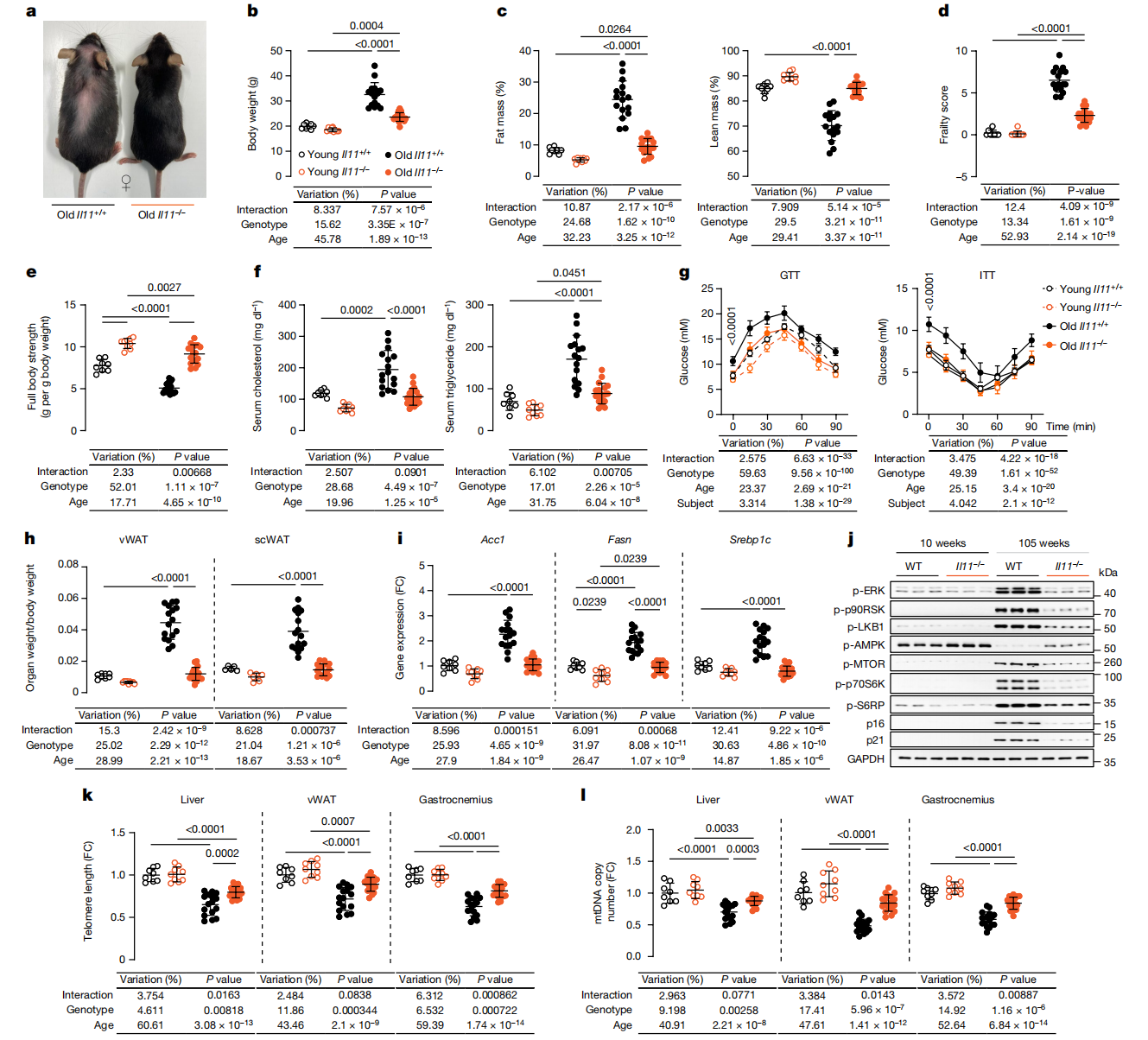
图2:雌性IL-11删除小鼠免受与年龄相关的肥胖、虚弱和代谢下降的影响。
a,105周龄的雌性野生型和IL-11−/−小鼠的代表性照片。b-g,体重(b)、脂肪和瘦体重百分比(按体重标准化)、虚弱评分(d)、全身抓握力(e)、血清胆固醇和甘油三酯(f)以及GTT和ITT(g)在年轻(12周龄)和老年(105周龄)的雌性野生型和IL-11−/−小鼠中的情况。h-j,vWAT和scWAT重量指数(h)、相对vWAT mRNA表达水平Acc1、Fasn和Srebp1c(i)以及显示ERK1/2、p90RSK、LKB1、AMPK、mTOR、p70S6K和S6RP的激活状态以及p16、p21和GAPDH蛋白表达水平的免疫印迹(j)。每组n=6。各自总蛋白的免疫印迹显示在扩展数据图5k中。k,l,年轻和老年雌性野生型和IL-11−/−小鼠vWAT中的端粒长度和mtDNA拷贝数(l)。b-i,k-l,数据为平均值±标准差(年轻野生型,n=8;年轻IL-11−/−,n=9;老年野生型,n=16;老年IL-11−/−,n=18;除h(scWAT):年轻野生型,n=5;年轻IL-11−/−,n=7;老年野生型和IL-11−/−,n=16)。采用Sidak修正的双向方差分析(b-f、h、i、k、l);采用Sidak修正(h)的双向重复测量方差分析。凝胶源数据见补充图1。
雷帕霉素慢性抑制mTORC1可由于间接抑制mTORC235而导致葡萄糖耐受不良。因此,更充分地评估IL-11抑制对老年小鼠肝功能、代谢和葡萄糖利用的影响是很重要的。随着野生型小鼠年龄的增长,血清AST、ALT、胆固醇和甘油三酯均升高,而老年IL-11−/−小鼠则共同减轻(图2f和扩展数据图5c,d)。老年IL-11−/−小鼠的糖耐量试验(GTT)和胰岛素耐受性试验(ITT)与年轻野生型小鼠相似,而老年野生型小鼠的GTT和ITT表现出损伤(图2g和扩展数据图5e,f)。与同等的野生型小鼠相比,年轻和年老的IL-11−/−小鼠的指数骨骼肌质量更大(扩展数据图5g)。
与年老的野生型对照组相比,年老的IL-11−/−小鼠的肝脏质量指数和肝脏甘油三酯含量均有所降低(扩展数据图。5h,i)。在老年IL-11−/−小鼠中,指数化的vWAT和腹股沟皮下白色脂肪组织(scWAT)质量减少,而棕色脂肪组织(BAT)质量没有变化(图2h和扩展数据图5j)。为了研究脂肪新生生成在老年组织中的潜在作用,我们分析了vWAT中脂肪酸合成基因的表达,发现它们在老年野生型小鼠中的表达随着年龄的增长而增加,而在老年IL-11−/−小鼠中没有增加(图2i)。与IL-11ra1−/−小鼠相似(扩展数据图2b,c),在老年IL-11−/−小鼠的vWAT和腓肠肌中,ERK-mTORC1轴的激活和衰老标志物的上调得到了缓解(图2j和扩展数据图5k,l)。在老年野生型小鼠的vWAT小鼠中,促炎基因的表达增加,而在老年IL-11−/−小鼠中没有增加(扩展数据图5m)。
老年野生型小鼠肝脏、骨骼肌和vWAT中的端粒长度和mtDNA含量降低,而IL-11缺失可减弱这些影响(图2k,l)。在老年野生型小鼠中,血清IL-6水平升高,而在老年IL-11−/−小鼠中没有升高(扩展数据图2n)。
在雄性小鼠中IL-11的缺失
在老年雄性IL-11−/−小鼠中,身体习惯、体重、脂肪质量、瘦质量和虚弱评分(由震颤、被毛状况和皮毛损失驱动)的有害变化被减轻,体温轻度升高(扩展数据图6a-e和补充表2)。与年龄匹配的野生型对照组相比,年轻和年老的IL-11−/−小鼠的肌力都更高,如雌性小鼠(扩展数据图6f)。老年IL-11−/−小鼠的GTT和ITT谱与年轻小鼠相似,而老年野生型对照小鼠的ITT谱受损(扩展数据图6g)。
代谢笼分析显示,与老年野生型小鼠相比,老年IL-11−/−小鼠的呼吸交换比(RER)总体上更高(扩展数据图6h)。经过一段时间的禁食后,重新喂食导致老年IL-11−/−小鼠的RER增加更多,这与更好的代谢灵活性一致(扩展数据图6h)。尽管老年IL-11−/−小鼠比野生型对照更瘦、体重更轻,但它们摄入的食物更多,且运动活动水平相似(扩展数据图6h)。通过炸弹热量计排除了IL-11−/−小鼠的能量丢失性肠病(扩展数据图6i)。
在老年野生型小鼠的肌肉中明显出现了肌肉减少症,而在老年IL-11−/−小鼠中这一效应不那么明显,后者即使在年轻时也表现出更大的肌肉质量指数,如雌性小鼠所见(扩展数据图6j,k)。两种基因型小鼠之间的肝脏重量指数相似(扩展数据图6l)。对于雌性小鼠来说,或许与老年雄性小鼠中IL-11功能丧失相关的最显著有益差异表现在vWAT质量上,而BAT质量在不同基因型和年龄间相似(扩展数据图6m)。一个偶然发现是,老年雄性小鼠中经常出现的精囊扩大现象,在老年野生型小鼠中比老年IL-11−/−小鼠更为常见(野生型:15只中有11只,IL-11−/−:14只中有1只;P=0.0003)(补充表2)。
对老年雄性小鼠进行抗IL-11治疗
研究遗传性功能缺失对健康跨度和/或寿命的影响应通过仅在晚年进行干预来补充,以识别从年轻动物延续到老年的表型并具有转化相关性。这与当前研究相关,其中一些有益的IL-11功能缺失效应(如增加的肌肉质量和力量)甚至在年轻的IL-11删除小鼠中也是明显的(图2和扩展数据图6)。为了实现这一目标,我们给老年小鼠施用了中和性IL-11抗体(X203)或IgG对照,并研究了健康跨度指数(图3a)。
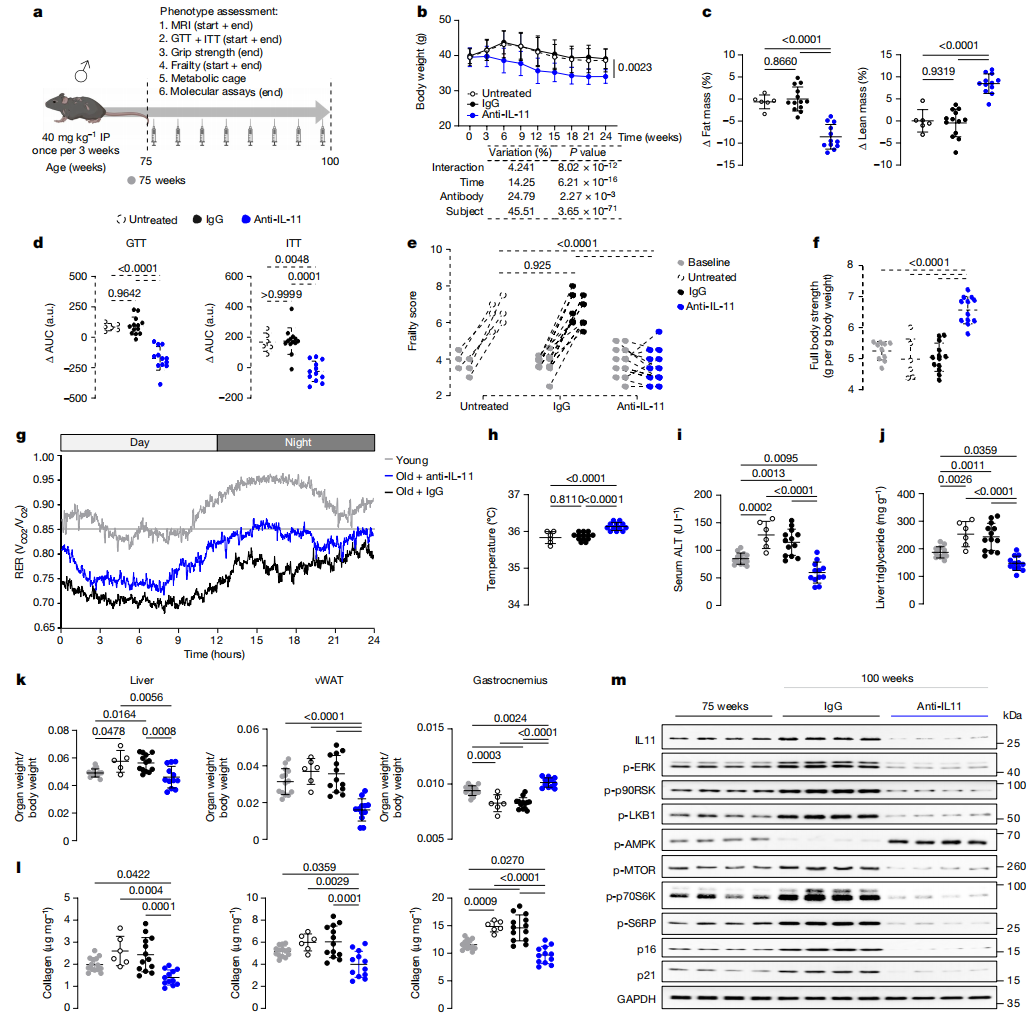
图3:在雄性小鼠中,抑制IL-11的治疗减少了与年龄相关的代谢功能障碍、病理信号传导和肌肉减少症。
图a展示了在老年雄性小鼠中进行的抗IL-11(X203)治疗剂量实验的示意图,该实验的结果展示在b-m图中。小鼠自然老化(未处理),或从75周龄开始,每3周给予一次X203或IgG对照抗体(40 mg/kg),持续时间为25周。使用BioRender.com创建。b,体重随时间的变化。c,d,脂肪和瘦体重百分比的变化(Δ)(c)和葡萄糖耐量试验(GTT)及胰岛素耐量试验(ITT)曲线下面积(AUC)的变化(d)(终点值(100周龄)−起始点值(75周龄))。a.u.,任意单位。e,起始点和终点的虚弱评分。数据以起始点和终点记录的值展示。f,全身抓握力。g,在年轻(14周龄)和IgG或X203治疗的老龄(81周龄)小鼠中的RER,自IgG或X203给药开始后6周测量(每组n=10)。h-j,体温(h),血清ALT(i)和肝脏甘油三酯(j)。k,l,肝脏、腓肠肌和vWAT的指数化重量(k)和总胶原含量(通过羟脯氨酸测定)(l)。m,显示vWAT中ERK1/2、p90RSK、LKB1、AMPK、mTOR、p70S6K、S6RP的激活状态以及IL-11、p16、p21和GAPDH蛋白表达水平的西方印迹(每组n=6)。总蛋白的西方印迹呈现在扩展数据图7i中。b-d,f,h-l,数据是平均值±标准差。75周龄对照组:n=10(f),n=14(i-l);未经处理的100周龄:n=6(除肝脏的k外,n=5);IgG处理的100周龄:n=13;X203处理的100周龄:n=12。双向重复测量ANOVA与Sidak校正(b);单向ANOVA与Tukey校正(c,d(GTT),e,f,h-l);单向ANOVA与Kruskal-Wallis校正(d(ITT))。关于凝胶源数据,见补充图1。
与对照组相比,从75周到100周接受X203治疗的小鼠体重逐渐减轻,这主要表现为脂肪质量指数的降低(图3b,c)。在研究开始时,所有实验组都表现出葡萄糖代谢受损,但接受X203治疗的小鼠情况有所改善,而IgG治疗则没有效果(图3d)。在研究开始时,所有实验组的虚弱评分略有增加(图3e)。在研究期间,未接受治疗或接受IgG治疗的小鼠表现出虚弱进展(例如,震颤和步态障碍),而接受X203治疗的小鼠则没有(图3e和补充表3)。接受抗IL-11治疗的100周龄小鼠的肌肉力量高于接受IgG治疗或未治疗的年龄相匹配的对照小鼠,也高于实验开始时的75周龄小鼠(图3f和扩展数据图7a)。
在给予抗体6周后,将小鼠放在代谢笼中进行研究。接受X203治疗的小鼠的RER高于接受IgG治疗的小鼠,但低于一组年轻小鼠(图3g和扩展数据图7b),这表明X203减缓了与年龄相关的代谢不灵活性。给予X203与更高的核心体温和增加的食物摄入量有关,而运动活动水平和粪便热量密度在研究组之间相似(图3h和扩展数据图7b,c)。
未治疗或给予IgG的小鼠在研究结束时血清胆固醇、甘油三酯和IL-6水平增加,这些指标在接受X203治疗后均降低到75周龄时的水平以下(扩展数据图7d,e)。在实验过程中,未治疗和IgG对照组小鼠的肝损伤标志物、肝脏甘油三酯含量和肝脏质量指数增加,而在接受X203治疗的小鼠中,这些表型得到改善或减少(图3i-k和扩展数据图7f)。
与年龄匹配的对照小鼠和75周龄小鼠相比,接受X203的100周龄小鼠vWAT和肝脏质量指数减少,而肌肉质量指数增加(图3k和扩展数据图7g)。接受X203治疗的小鼠皮下白色脂肪组织(scWAT)减少,而棕色脂肪组织(BAT)增加(扩展数据图7h)。老年雄性小鼠特有的精囊扩大现象再次因IL-11功能丧失而减少(IgG:13只中有8只,X203:12只中有2只;P=0.022)(补充表3)。
纤维化是衰老的典型特征和衰老的标志,已知IL-11在人类细胞和年轻成年小鼠中具有促纤维化作用22,39。我们量化了老年小鼠不同实验组vWAT、骨骼肌和肝脏中的纤维化程度,结果显示接受X203治疗的小鼠各器官组织纤维化逆转(图3l)。
与75周龄小鼠相比,接受IgG治疗25周的小鼠vWAT中IL-11-mTORC1轴活化增加,并高表达衰老标志物(图3m和扩展数据图7i)。相比之下,接受X203治疗的小鼠ERK-mTOR活性降低,p21和p16表达减少(图3m和扩展数据图7i)。100周龄未治疗和IgG治疗的小鼠出现端粒磨损和mtDNA拷贝数减少,这在X203治疗的小鼠中未见(扩展数据图7j,k)。
抗IL-11疗法在老年雌性小鼠中的应用
我们还研究了抗IL-11疗法对老年雌性小鼠衰老病变的影响(扩展数据图8a)。接受X203治疗的老年雌性小鼠体重减轻,而接受IgG治疗的小鼠体重增加(扩展数据图8b)。在研究期结束时,接受X203治疗的小鼠与开始时相比,脂肪质量更低,瘦体重更高,且糖耐量试验(GTT)和胰岛素耐量试验(ITT)表现更好,而在IgG治疗的小鼠中观察到相反的效果(扩展数据图8c,d)。实验开始时,研究组之间的虚弱评分相似,接受IgG治疗的小鼠虚弱评分进展,而接受X203治疗的小鼠则没有(扩展数据图8e和补充表4)。接受X203治疗的雌性小鼠肌肉力量超过起始水平,核心体温略有升高(扩展数据图8f-h)。
抗IL-11恢复白色脂肪组织的米色化
为了进一步剖析分子机制,我们对接受IgG治疗或抗IL-11治疗的100周龄小鼠的vWAT、腓肠肌和肝脏进行了批量RNA测序(RNA-seq)(补充表5)。在所有组织中,接受抗IL-11治疗的小鼠在氧化磷酸化和代谢的标志基因集富集分数最为显著,而炎症、上皮-间质转化(EMT)和JAK-STAT3信号传导的标志分数降低(图4a)。
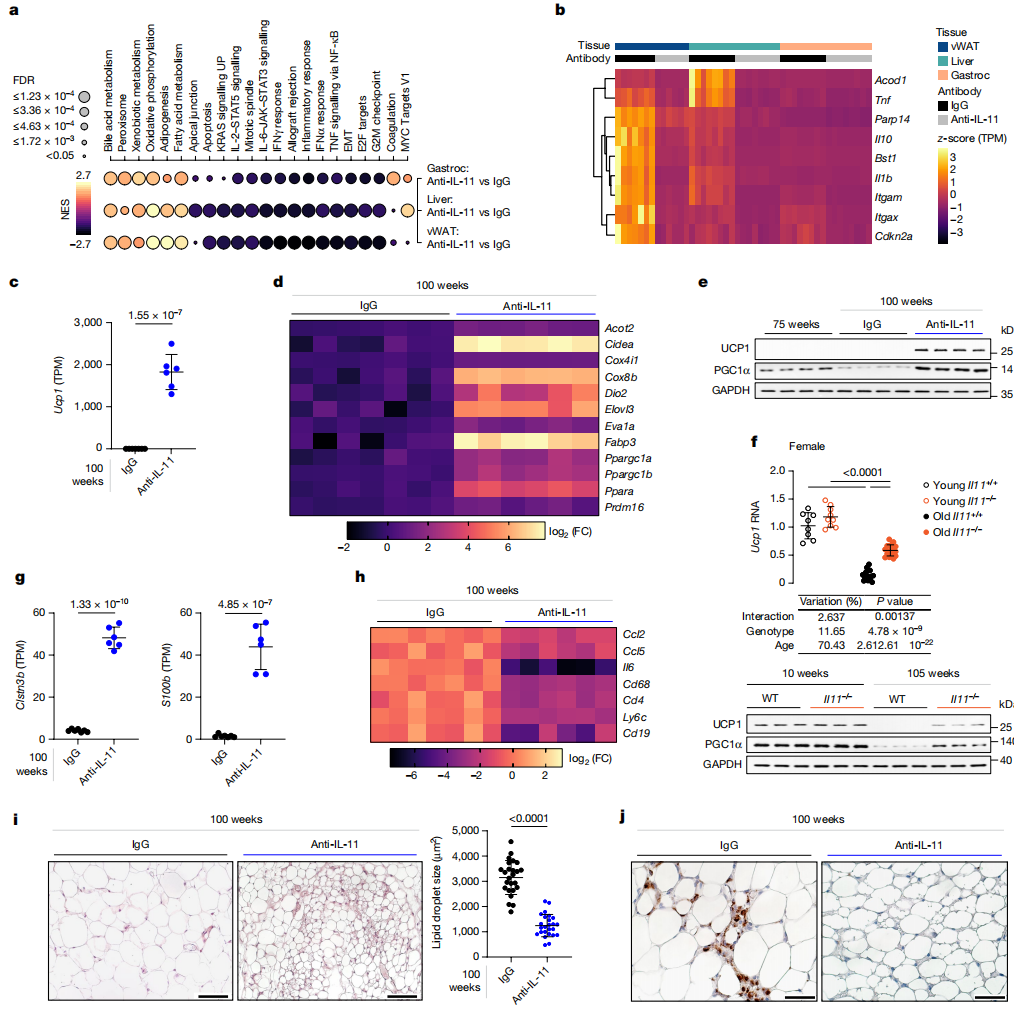
图4:抗IL-11减少vWAT炎症并重新激活被年龄抑制的产热程序。
a-e,g-j, 如在图3a中所示的老年雄性小鼠的治疗实验数据。a,气泡图显示了在接受抗IL-11治疗与IgG治疗的小鼠vWAT、肝脏和腓肠肌中差异表达基因的标志基因集富集分析。颜色代表标准化富集分数(NES);黑色代表负NES,表明基因集下调;黄色代表正NES,表明上调。点的大小表示显著性(点越大,调整后的P值越小)。EMT,上皮-间质转化。b,vWAT、肝脏、腓肠肌中衰老基因的行标准化转录本每百万(TPM)值的热图。c,vWAT中Ucp1读数的丰度。d,基于RNA-seq的100周龄小鼠在接受IgG或抗IL-11治疗后vWAT中米色化基因的log2转换的倍数变化热图。e,vWAT中UCP1、PGC1α和GAPDH表达的西方印迹(每组n=6)。f,年轻野生型(n=8)、年轻IL-11−/−(n=9)、老年野生型(n=16)和老年IL-11−/−(n=18)小鼠vWAT中Ucp1 mRNA的相对表达水平,以及UCP1和PGC1α蛋白的表达(每组n=6)。g,h,vWAT中Clstn3b和S100b读数的丰度(g)以及来自RNA-seq的促炎标志物的log2转换的倍数变化热图(h)。i,vWAT的苏木精和伊红染色(比例尺,100μm)以及对脂滴大小的定量(每组5只小鼠每只5个视野的平均脂滴面积,n=25)。j,vWAT中CD68的免疫组织化学染色(比例尺,50μm)。a-d,f-h,肝脏和腓肠肌(每组n=8),vWAT IgG,n=7;vWAT抗IL-11,n=6。c,f,g,i,数据是平均值±标准差。双侧Student’s t检验(c,g,i);双向ANOVA与Sidak校正(f)。关于凝胶源数据,见补充图1。比例尺:i为100μm,j为50μm。
在老年vWAT中,与衰老相关的基因(Cdkn2a、Tnf、Il10、Il1b、Bst1、Irg1、Parp14、Itgax和Itgam)如《Tabula Muris Senis》所鉴定的,这些基因表达上调,而抗IL-11治疗可以缓解这一效应(图4b和扩展数据图9a)。在接受抗IL-11治疗的小鼠的肌肉和肝脏中也观察到了类似的、尽管不太明显的衰老标志物的抑制。
对vWAT转录组的更详细研究揭示,抗IL-11全基因组中最上调的基因是Ucp1,这对于白色脂肪组织(WAT)沉积中产热“米色”脂肪细胞的发展很重要(图4c和补充表5)。经过仔细检查,我们发现在接受抗IL-11的小鼠vWAT中上调了一个更大的米色化程序(Acot2、Cidea、Cox4i1、Cox8b、Dio2、Elovl3、Eva1a、Fabp3、Ppargc1a、Ppargc1b、Ppara和Prdm16)(图4d)。在接受抗IL-11的雄性小鼠中,UCP1和PGC1α的年龄依赖性上调在蛋白质水平上得到了验证(图4e)。
为了支持我们的发现,我们展示了在雌性对照小鼠vWAT中UCP1表达的年龄相关抑制,这种抑制在缺乏IL-11的雌性小鼠以及两性都缺乏IL-11ra1的小鼠中得到缓解(图4f和扩展数据图9b)。对vWAT中的线粒体基因表达进行针对性评估显示,在接受抗IL-11的小鼠中与线粒体生物发生和功能相关的术语显著增加(扩展数据图9c,d)。
在接受X203治疗的小鼠中,Clstn3b强烈上调,这是Clstn3位点3'端新发现的哺乳动物特有产物,与S100b合作促进WAT甘油三酯代谢,S100b也上调了(图4g和扩展数据图9e)。随着年龄的增长,野生型小鼠BAT中Ucp1的下调有限,而在IL-11−/−小鼠的BAT中Ucp1表达略有增加,但在接受抗IL-11的小鼠中没有增加(扩展数据图9f,g)。
与接受X203治疗的小鼠相比,接受IgG治疗的小鼠vWAT中的促炎基因表达更高(图4b),这与IL-11ra1−/−小鼠肝脏和IL-11−/−小鼠vWAT中所见的发现相呼应(扩展数据图2-i和5m)。对年轻和老年IL-11ra1−/−和野生型小鼠的进一步分析确认了野生型小鼠vWAT中的年龄依赖性促炎基因表达,在IL-11ra1−/−基因型的小鼠中跨性别减少(扩展数据图9h)。
基质炎症与免疫细胞浸润有关,我们发现在接受X203治疗的小鼠vWAT中,免疫细胞表面标记基因Cd68、Cd4、Ly6C和Cd19的表达降低(图4h)。组织学研究揭示,接受X203治疗的小鼠vWAT表现出平均2.5倍的脂滴面积减少,增加了米色脂肪细胞焦点和较少的常驻CD68+巨噬细胞(图4i,j)。
抑制IL-11延长寿命
与健康期实验并行,我们对雄性和雌性IL-11−/−小鼠及其野生型同窝对照进行了寿命研究,直到它们被发现死亡或在垂死时被安乐死(图5a-c)。汇总分析显示,IL-11−/−小鼠的寿命显著长于野生型对照组(中位寿命:野生型,120.9周;IL-11−/−,151周)。性别特定分析揭示了雌性IL-11−/−(中位寿命:野生型,118.9周;IL-11−/−,148.3周)以及雄性IL-11−/−(中位寿命:野生型,128.7周;IL-11−/−,待确定)小鼠的显著寿命延长。
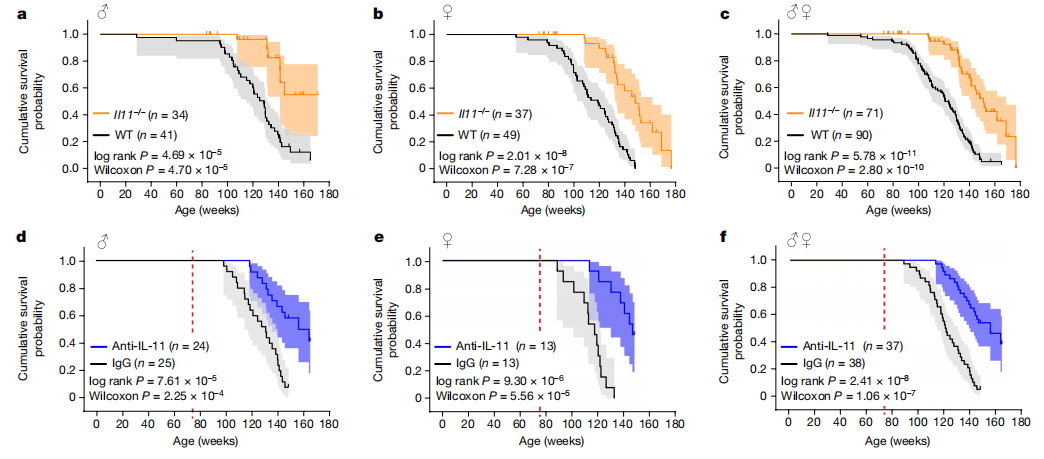
图5:遗传或药理学抑制IL-11延长了雄性和雌性小鼠的预期寿命。
a-c, Kaplan-Meier生存曲线(阴影表示95%置信区间)显示了雄性(a)、雌性(b)和性别合并(c)的野生型和IL-11−/−小鼠的累积存活概率。d-f, Kaplan-Meier生存曲线显示了从75周龄开始,每月接受IgG或X203(40 mg/kg,腹腔注射)治疗的雄性(d)、雌性(e)和性别合并(f)小鼠的累积存活概率(红色虚线表示)。通过log-rank(Mantel-Cox)和Wilcoxon检验评估生存曲线比较的统计显著性(双尾P值)。
为了将我们的研究推进到更具转化相关性的方法,我们检查了在晚年使用75周龄的雄性和雌性小鼠接受每月一次的抗IL-11或IgG注射直到死亡后的寿命影响(图5d-f和扩展数据图10)。汇总分析显示,接受抗IL-11的小鼠寿命显著延长(中位寿命:IgG,120.9周;X203,155.6周)。性别特定分析显示,雌性(中位寿命:IgG,117.1周;X203,146.4周)和雄性(中位寿命:野生型,130.3周;X203,159.6周)的寿命都显著延长。
癌症是老年小鼠常见的死亡原因,粗略解剖数据显示,在IL-11缺失(合并性别:野生型,84只小鼠中有49只有肿瘤;IL-11−/−,25只小鼠中有3只有肿瘤;P<0.0001)或接受抗IL-11治疗(合并性别:IgG,36只小鼠中有22只有肿瘤;X203,19只小鼠中有3只有肿瘤;P=0.0013)(补充表6和7)的小鼠中,宏观肿瘤较少。
讨论
随着年龄的增长,IL-11在各种组织中的表达逐渐增加,这可能是一种警报类型的反应,对包括细胞因子、蛋白毒性压力、氧化物质和DNA损伤等与年龄相关的致病因素作出反应。我们提出,通过抑制IL-11观察到的多效性益处反映了其对多种衰老途径(如ERK、AMPK、mTOR和JAK-STAT3)的调节作用,正如在果蝇中使用多药治疗所见到的那样。尽管IL-11尚未被广泛研究,之前也未被认为是影响衰老的重要因素,但IL-11基因座的SNPs与骨关节炎和更年期有关,并且IL-11与衰老和老年人常见疾病有关联。
在老年小鼠中抑制IL-11观察到的代谢效应,与年轻小鼠中特异性删除WAT中的Raptor所观察到的效果相似。虽然我们没有在恒温条件下研究小鼠,但我们推测抑制IL-11可以防止脂肪中mTORC1的激活,使得老年小鼠的WAT变褐,这在小鼠中可能特别明显。我们需要强调的是,尽管我们排除了食物摄入以及肠道或运动相关的能量消耗,并展示了遗传和治疗模型中的WAT变褐,我们并未确定导致IL-11抑制引起体重减轻的具体生理机制。
除了代谢之外,抑制IL-11还改善了在脊椎动物中常见的衰老的决定性特征(如虚弱和肌肉减少症),在生物体层面显示了通用的抗衰老益处。有趣的是,一些有益效果,特别是在肌肉和脂肪中,即使在年轻小鼠中也是明显的,这或许表明代谢益处的重要性。我们没有区分细胞类型特异性,但推断局部组织的IL-11活性很重要,鉴于其已知的自分泌和旁分泌活动。
抑制IL-11增加了雄性和雌性小鼠的寿命。寿命延长的程度尚待完全确定,但当前数据显示,在晚年给予抗IL-11治疗可以使两种性别的中位寿命增加20%以上。在这些实验中,从75周龄(相当于人类约55岁)开始给小鼠注射抗IL-11,尚不清楚对更老的小鼠进行给药是否有类似的效果,或者短期的抗IL-11治疗是否能有效延长寿命,正如雷帕霉素所见。老年小鼠的死亡通常与癌症有关,我们的临终尸检数据支持抑制IL-11显著降低与年龄相关的癌症的观点。值得注意的是,IL-11对于肿瘤发生和肿瘤免疫逃逸很重要,计划进行抗IL-11联合免疫疗法治疗癌症的临床试验。
慢性无菌性炎症是衰老的一个重要标志,与衰老紧密相关,并在与年龄相关的虚弱、代谢功能障碍和多重疾病的发病机制中有牵连。无脊椎动物的研究已经显示,先天免疫信号传导,特别是果蝇脂肪组织中的Jak-Stat信号传导,会对代谢和寿命产生不利影响。我们在这里展示了一个促炎细胞因子可以在哺乳动物中影响与年龄相关衰退和寿命。IL-11信号传导的经典(JAK-STAT3)和非经典(MEK-ERK)途径的相对贡献,单独或结合时,对衰老表型的影响仍有待确定。
通过trametinib、雷帕霉素或二甲双胍分别抑制ERK或mTOR或激活AMPK,在模型生物中增加寿命,这些药物被一些人提倡用于人类。然而,这些药物具有靶点和非靶点的毒性,以及对健康寿命和炎症有可变且有时有害的影响。我们的数据表明,抗IL-11治疗具有令人安心的安全性档案,并且目前正在针对纤维化炎症性疾病进行早期临床试验,是一种潜在的可转化方法,用于延长人类的健康寿命和寿命。
https://blog.sciencenet.cn/blog-41174-1442803.html
上一篇:动物实验研究不总是王道!
下一篇:氢气吸入对肺静脉闭塞性疾病的机制研究【广医】