博文
氢气吸入对肺静脉闭塞性疾病的机制研究【广医】
||
氢气用于肺静脉闭塞性疾病的机制研究【广医】
背景
作为一种肺动脉高压(PH)的亚型,肺静脉闭塞性疾病(PVOD)是一种破坏性极大且致命的疾病,目前尚无有效治疗方法。有研究报道,氢气在由单克罗太林诱导的大鼠PH模型中显示出抗氧化和抗炎作用。本研究中,我们探讨了吸入氢气对预防和治疗由丝裂霉素C(MMC)诱导的大鼠PVOD的效果。
方法
通过以3 mg·kg−1·wk−1的浓度腹膜内注射MMC,连续2周,来诱导雌性Sprague-Dawley大鼠发生PVOD。氢气(H2)的吸入是通过一个特制鼠笼同时或在MMC给药后两周进行。通过使用血流动力学测量和组织学分析来评估PVOD的严重程度。测量肺组织中一般控制非抑制性2(GCN2)、核因子红细胞2相关因子-2(Nrf2)、血红素氧合酶-1(HO-1)和内皮向间质转化(EndoMT)相关蛋白的表达水平。确定血清中脂质过氧化促炎细胞因子的水平。
结果
吸入氢气改善了血流动力学和右心功能,逆转了右心室肥大,并阻止了肺血管重构,无论是在预防还是在治疗方法中。它降低了血清中的丙二醛(MDA)水平和肺组织中的NADPH氧化酶1(NOX-1)的表达。它调节了肺组织中的Nrf2/HO-1信号通路和抗炎因子GCN2,伴随着巨噬细胞和促炎细胞因子的减少。我们的数据表明,氢气吸入有效地对抗了MMC诱导的EndoMT,如通过检测内皮标志物(例如VE-钙粘蛋白和CD31)和间充质标志物(例如波形蛋白和纤维连接蛋白)所证实的那样。进一步的研究揭示了氢气保存了p-Smad3并诱导了p-Smad1/5/9。
结论
吸入氢气有效地抑制了由MMC诱导的大鼠PVOD的发病过程。这种抑制机制可能归因于氢气的抗氧化和抗炎特性。
本研究作者主要来自广州医科大学呼吸病研究所。
Zhang C, Xing Y, Wu X, Jiang Q, Luo X, He W, Liu S, Lu W, Wang J. Inhalation of hydrogen gas protects against mitomycin-induced pulmonary veno-occlusive disease. Respir Res. 2024 Jul 16;25(1):281.

一、前言
肺静脉闭塞性疾病(PVOD)是一种罕见且毁灭性的疾病,其特征是肺小静脉狭窄,导致肺动脉压力和阻力逐渐升高。它与特发性肺动脉高压具有相似的临床和血流动力学特征,后者是第1组PH的一个重要亚组。然而,由于PVOD的发病缓慢,诊断往往具有挑战性,常导致诊断延迟和预后不佳。尽管70年前就已经被观察和描述,但PVOD的确切机制仍然大部分未知。最近,化疗药物的使用已成为诱发PVOD的潜在风险因素。回顾性研究显示,暴露于博莱霉素、顺铂和丝裂霉素C(MMC)等化疗药物与PVOD发病率增加之间存在强烈关联。不幸的是,目前没有可行的无副作用替代药物。此外,化疗在PVOD中的因果关系已经通过成功建立MMC诱导的PVOD大鼠模型得到证实,该模型表现出显著的肺静脉闭塞和典型的肺高压病理生理特征,包括升高的右心室收缩压(RVSP)、增加的Fulton指数(右心室[RV]与左心室[LV]+隔膜[S]之比),以及远端肺血管的重塑。虽然PVOD和PH有许多共同的临床症状和血流动力学特征,但患有PVOD的个体被认为对肺血管扩张剂治疗反应较差,因为肺水肿的并发症。因此,发现针对PVOD的新型有效治疗策略至关重要。
氢气(H2)是一种无色、无味、无臭、非刺激性且高度易燃的双原子气体。它被发现对多个器官系统具有积极影响,包括大脑、心脏、肺、肾、肝和胰腺。氢气显示出对氧化应激的保护作用,通过减轻阿尔茨海默病、血液病和慢性阻塞性肺疾病(COPD)等疾病中的炎症反应。研究报道,吸入氢气可以剂量依赖性地缓解由香烟烟雾在大鼠中引起的肺部炎症。此外,高浓度氢气吸入被发现可逆转由香烟烟雾诱导的小气道重塑,并抑制小鼠肺功能的下降。氢水也展示了在单克罗太啉诱导的PH大鼠模型中的治疗作用,通过减少炎症细胞因子的表达。
鉴于氢气对各种器官系统的积极作用以及其减轻炎症反应和减少氧化应激的能力,氢气吸入可能代表着预防和治疗PH以及减轻化疗药物副作用的新方法。在本研究中,我们的目的是调查氢气在MMC诱导的PVOD大鼠模型中的作用。
二、研究方法
动物模型
从广东医学实验动物中心(中国广州)购买的雌性Sprague-Dawley大鼠(150-180克),并在特定病原体自由(SPF)设施中饲养。所有实验方案均经广州医科大学动物护理和使用委员会批准,并按照先前发布的过程进行[5]。为了建立PVOD的大鼠模型,大鼠接受MMC(MedChemExpress,目录号HY-13,316)的腹膜内注射,剂量为3 mg·kg−1·wk−1,持续2周。随后,大鼠被随机分为四组:正常对照组(N,n=15)、MMC处理组(MMC,n=15)、氢气预防组(HP,n=15)和氢气治疗组(HT,n=15)。对照组大鼠接受了与MMC注射相同体积的0.9%盐水。在HP组中,氢气与MMC注射同时给药。相反,在HT组中,氢气吸入在首次MMC注射后2周开始。所有大鼠在首次MMC注射后4周被安乐死。如图1A所示,对于HP组,氢气与MMC注射同时给药,而对于HT组,氢气吸入在首次MMC注射后2周开始。所有大鼠(每组n=15)用于计算存活率,其余存活的大鼠被安乐死以进行后续实验。
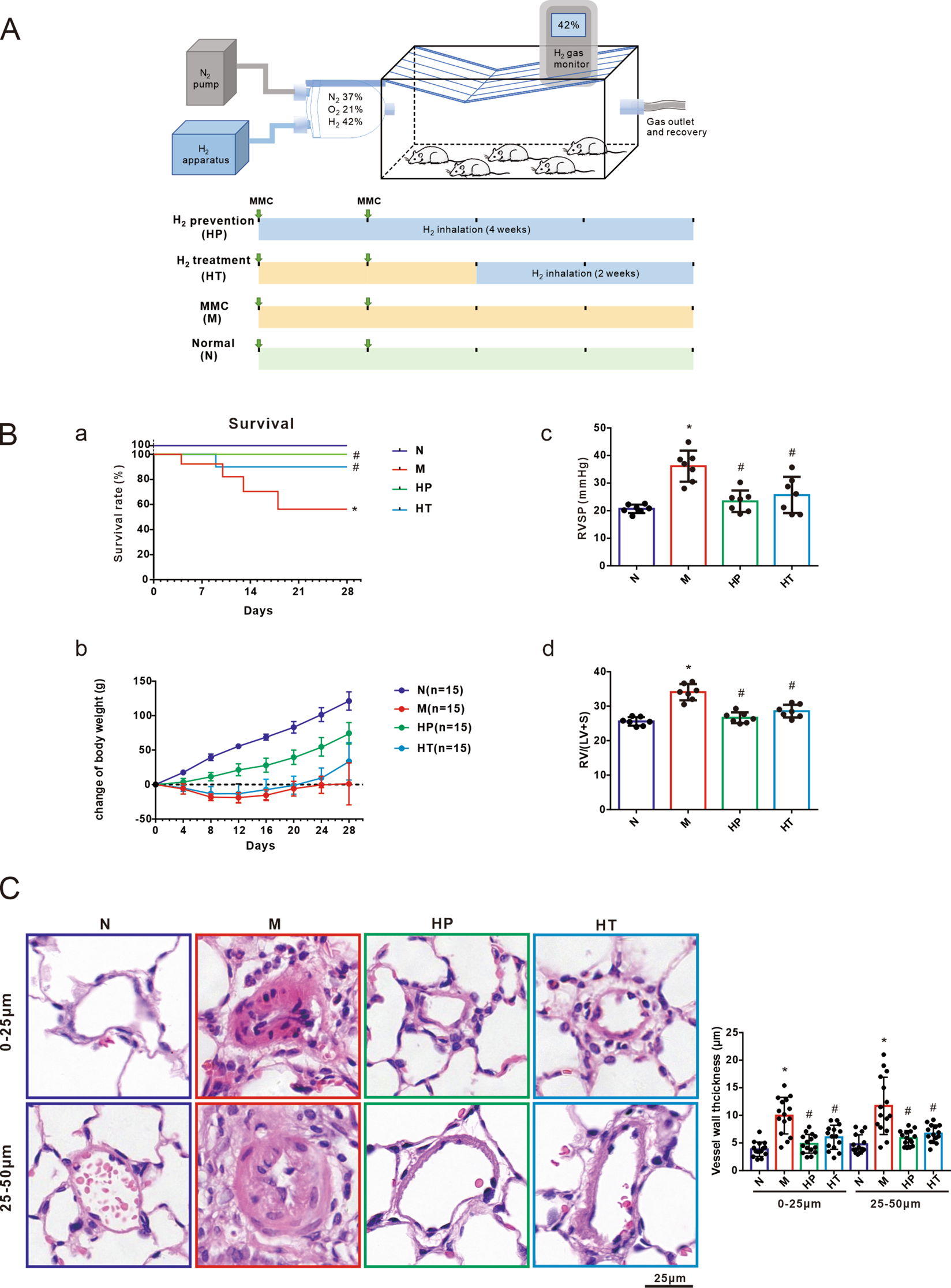
图1 氢气缓解了MMC诱导的肺静脉闭塞性疾病(PVOD)。通过两次腹膜内注射丝裂霉素C(MMC,3 mg/kg/周)建立了PVOD的大鼠模型。氢气吸入以标准化混合物(42% H2,21% 氧气,33% N2)的形式给予大鼠,每天两次,每次1小时,从MMC注射当天开始,持续28天,或在MMC注射后14天开始,持续14天。A:不同实验方案的组别和程序:正常(N)、MMC(M)、氢气预防(HP)、氢气治疗(HT)。正常组的大鼠暴露于空气中。B-a:存活率(每组n=15);B-b:体重变化(每组n=15);B-c:右心室收缩压(RVSP,mmHg,每组n=7);B-d:以Fulton指数(FI,右心室[RV]/左心室[LV]+隔膜[S]的重量比)表征的右心室肥大(每组n=7)。C:苏木精和伊红(H&E)染色的代表图像以及在0-25μm和25-50μm范围内计算的肺微血管厚度。比例尺表示25μm(如指示放大)(每组n=5,每只大鼠3个显微镜视野)。所有数据以平均值±SEM表示。使用单因素方差分析(ANOVA)进行四组间的比较。*P<0.05 vs. 正常组,#P<0.05 vs. MMC组。
给大鼠吸入氢气和氧气
通过电解蒸馏水(dH2O)的机器(上海阿斯克勒庇俄斯医疗科技有限公司,中国上海)产生分子氢(H2)和氧气(O2),得到固定比例为66.7%的氢气与33.3%的氧气(2:1的比例)。为确保大鼠笼中的氧气浓度与室内空气保持一致,避免缺氧或高氧的潜在影响,混合了氮气(N2)以在鼠笼中创造含有42%的氢气、21%的氧气和37%的N2的空气混合物。这种混合气体通过一个密封的室连接到外部空气,并以低流速3.8 L/min输送给MMC注射的大鼠。正常对照组(N)和MMC组的大鼠给予常规空气。每次吸入期开始和结束时监测氢气、氧气和CO2的浓度,以确保空气中各组分的稳定性。
超声心动图和血流动力学测量
使用配备MS250(13-24 MHz)线性阵列传感器的Vevo 2100成像系统(FUJIFILM Visual Sonics,加拿大多伦多)对每组大鼠(每组n=6)进行超声心动图检查。按照我们之前描述的相同方法测量右心室收缩压(RVSP)和右心室肥大指数(RVHI)(每组n=7)。完成超声心动图和血流动力学测量后,用3%戊巴比妥钠(30 mg/kg,腹腔注射)麻醉下取出肺和心脏后牺牲大鼠。
酶联免疫吸附测定(ELISA)
从右心抽取约4 ml血液,与EDTA抗凝管混合后低速离心(800 g,10分钟)。从上清液中获得血浆,准备用于Elisa。使用Elisa试剂盒按照制造商的协议(Andygene北京,中国)测量IL-1β、IL-6、IL-8、IL17、TNF-α和MDA的浓度。
组织学和免疫荧光染色
通过切割每组大鼠的肺组织样本制备肺切片,进行H&E染色、Masson染色和免疫荧光染色。固定的肺用石蜡包埋并切成5 μm厚。肺切片用苏木精和伊红(H&E染色)、马松丰塔纳(Masson染色)染色。对于免疫荧光染色,肺切片脱蜡脱水,然后在沸腾的EDTA抗原修复缓冲液中进行抗原修复。然后,将肺切片与巨噬细胞标记物CD68(Cell Signaling,目录号#97778)、平滑肌细胞标记物α-SMA(Sigma-Aldrich,目录号#A5228)和内皮细胞标记物vWF(Sigma-Aldrich,目录号#F3520)一起孵育。从不同组的每个肺切片随机选择两到三个显微镜视野(每组n=5)进行免疫细胞计数和荧光强度测量。
蛋白质印迹法
收获肺组织样本并与含有苯甲基磺酰氟(PMSF)和磷酸酶抑制剂的放射免疫沉淀分析(RIPA)裂解缓冲液混合以分离蛋白质。然后将样品以10,000 g离心15分钟,收集上清液并用二辛可酸(BCA)测定法定量蛋白。每组等量的总蛋白加载并在SDS-PAGE(Bio-Rad)上分离,转移到聚偏氟乙烯膜上,然后将膜与抗p-Smad3(Cell Signaling,目录号#9520)、抗p-Smad1/5/9(Cell Signaling,目录号#13820)、抗Vimentin(Cell Signaling,目录号#5741)、抗FN1(Proteintech,目录号#15613-1-AP)、抗CD31(Proteintech,目录号#11265-1-AP)、抗VE-cadherin(Invitrogen,目录号#36-1900)、抗GCN2(Cell Signaling,目录号#3302)、抗β-actin(Santa Cruz Biotechnology,目录号#sc-47,778)、HO-1(Abcam,目录号#ab305290)、Nrf-2(Abcam,目录号#ab313825)、NOX-1(Abcam,目录号#ab131088)一起孵育过夜于4°C。用TBST洗涤膜后,在室温下与抗兔或抗小鼠二抗孵育1小时。使用ImageJ量化条带强度并以任意单位表示。相对蛋白水平标准化为看家蛋白β-actin。
三、结果
吸入氢气显著改善了MMC诱导的PVOD大鼠模型中的组织学和血流动力学变化。
通过吸入给予氢气改善了由MMC引起的血流动力学改变,并显著提高了存活率。MMC处理导致死亡率增加和体重下降。然而,无论是预防组还是治疗组,吸入氢气都有效逆转了由MMC导致的高死亡率和体重减轻(图1B-a, b)。
与之前的研究结果一致,暴露于MMC导致右心室收缩压(RVSP)和Fulton指数(右心室[RV]与左心室[LV]+隔膜[S]的比率)显著增加。然而,在预防组和治疗组中应用氢气,逆转了由MMC引起的血流动力学变化,表明了治疗效应(图1B-c, d)。
此外,组织学分析显示,经MMC刺激后肺部微血管重塑显著,表现为血管中层面积增加。然而,无论是预防组还是治疗组,吸入氢气减轻了MMC诱导的肺血管重塑。这表明氢气吸入对MMC诱导的肺部血管变化具有保护作用(图1C)。
吸入氢气显著改善了MMC诱导的PVOD大鼠模型中的右心功能
进行超声心动图分析以评估氢气吸入对MMC诱导的PVOD大鼠模型中右心功能的影响。结果显示,MMC给药导致右心功能严重受损,表现为心输出量(CO)、三尖瓣环平面收缩期运动(TAPSE)、肺动脉加速时间/肺射血时间(PAT/PET)和右心室面积变化分数(RVFAC)减少。如图2所述,明确了氢气对右心功能的预防和治疗作用。
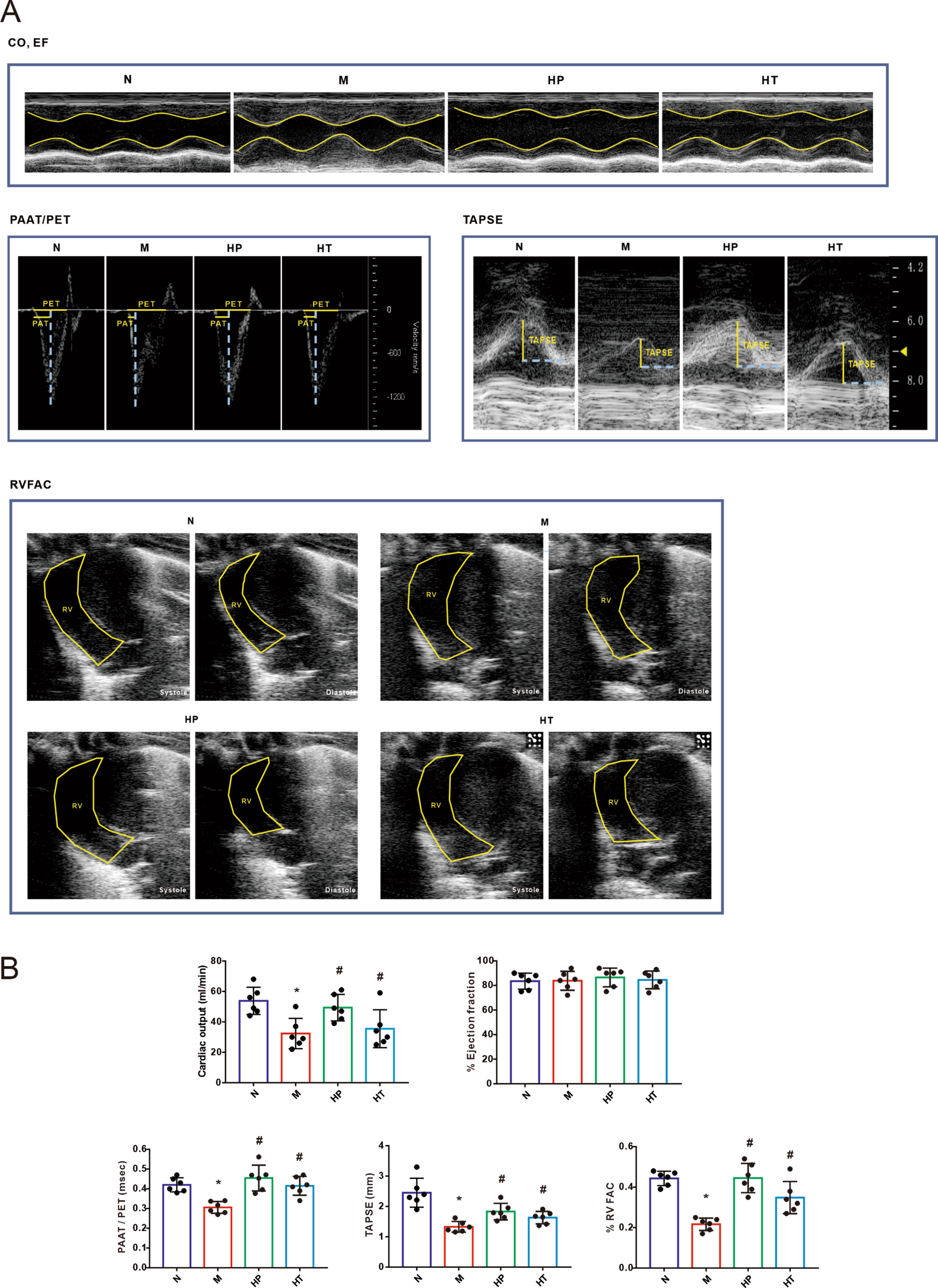
图2 氢气保护了MMC诱导的PVOD大鼠的右心室功能。A-B:大鼠超声心动图的代表图像和分析数据,CO:心输出量;EF:射血分数;PAAT/PET:肺动脉加速时间/肺射血时间。TASPE:三尖瓣环平面收缩期运动。RV FAC:右心室面积变化分数。正常(N),MMC(M),氢气预防(HP),氢气治疗(HT)。数据表示为平均值±SEM,每组n=6。使用单因素方差分析进行四组间的比较。*P<0.05 vs. 正常,#P<0.05 vs. MMC
吸入氢气改善了MMC诱导的POVD大鼠模型中的胶原沉积、肺部炎症和氧化应激。
Masson染色显示,与对照组相比,MMC组在肺血管周围产生和沉积了过量的胶原基质(染成蓝色)。然而,吸入氢气对这些效应提供了保护(图3A)。如图3B所示,暴露于MMC导致IL-1β、IL6、IL-8、IL17和TNF-α显著上调,表明MMC诱导了全身性炎症。此外,MMC处理的大鼠中丙二醛(MDA)水平增加,MDA是脂质过氧化的产物。然而,吸入氢气对这种炎症因子和血浆中MDA水平的增加显示出显著的预防和逆转效果。这表明氢气吸入可以有效抑制MMC暴露引起的肺部氧化应激和减少炎症。为了进一步评估氢气在局部肺部炎症中的作用,通过使用CD68的免疫荧光染色评估了每组中的巨噬细胞数量(图3C)。血红素氧合酶-1的可诱导异构体HO-1在调节炎症和细胞保护过程中起着关键作用。NADPH氧化酶1(NOX1)是超氧化物的主要生产者,它与其他活性氧物种和活性氮物种(ROS/RNS)一起,是病理条件下氧化损伤的主要贡献者。如图3D所示,给予MMC后,NOX-1、Nrf2和HO-1的表达显著增加。无论是预防组还是治疗组,吸入氢气有效地抑制了MMC诱导的NOX-1上调。在HP和HT组中,Nrf2/HO-1通路的表达与MMC组相比显著更高。
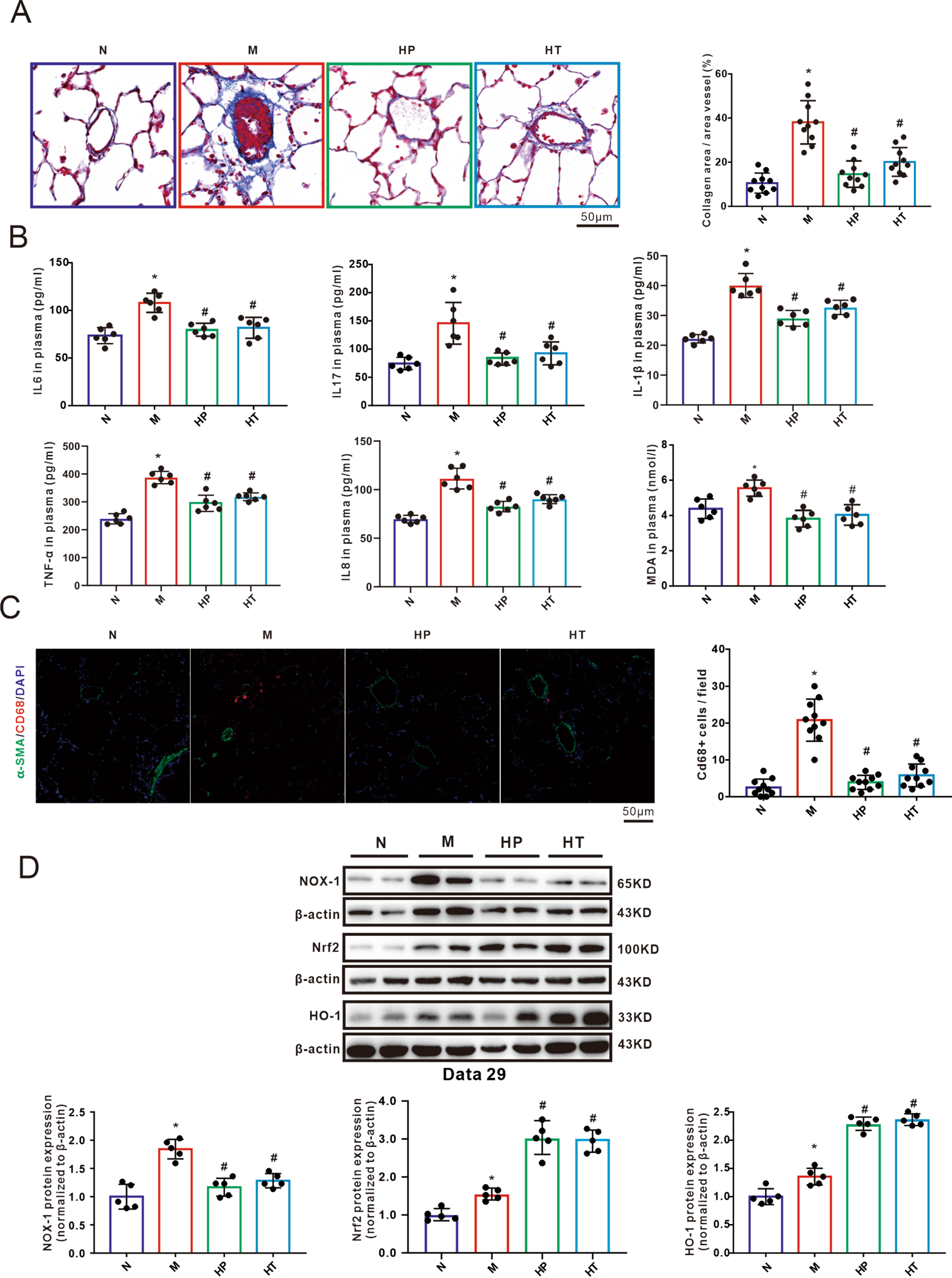
图3氢气吸入抑制了PVOD大鼠的炎症和氧化应激。A:肺微血管胶原面积的马森三色染色代表图像及计算结果(每组n=5,每只大鼠2个显微镜视野)。B:血浆中IL-6、IL17和丙二醛(MDA)的水平(每组n=6)。C:用抗CD68抗体(红色)、抗α-SMA(绿色)和DAPI(蓝色)对大鼠肺切片进行免疫荧光染色的代表图像。每个视野中计数CD68阳性巨噬细胞(红色),从至少九个随机选择的视野中计数(每组n=5,每只大鼠2个显微镜视野)。D:显示HO-1、NOX-1相对蛋白水平的蛋白质印迹及其分析条形图。蛋白质印迹结果标准化为β-actin(每组n=5)。所有数据表示为平均值±SEM,*P<0.05 vs. 正常,#P<0.05 vs. MMC
氢气吸入逆转了MMC诱导的PVOD大鼠的肺血管重塑。
为了进一步评估氢气对肺血管结构重塑的影响,我们使用α-SMA(平滑肌细胞的特定标记物,标记为绿色)和vWF(冯·威尔布兰因子,内皮细胞的特定标记物,标记为红色)进行了免疫荧光双重染色。如图4A所示,与对照组相比,我们发现暴露于MMC后肺血管平滑肌的中层壁明显增厚。此外,α-SMA和vWF之间有显著的重叠,表明存在内皮间充质转化(EndoMT)。这些病理特征共同代表了与PVOD相关的典型的肺血管变化。然而,吸入氢气显著恢复了MMC诱导的血管重塑(图4B)。
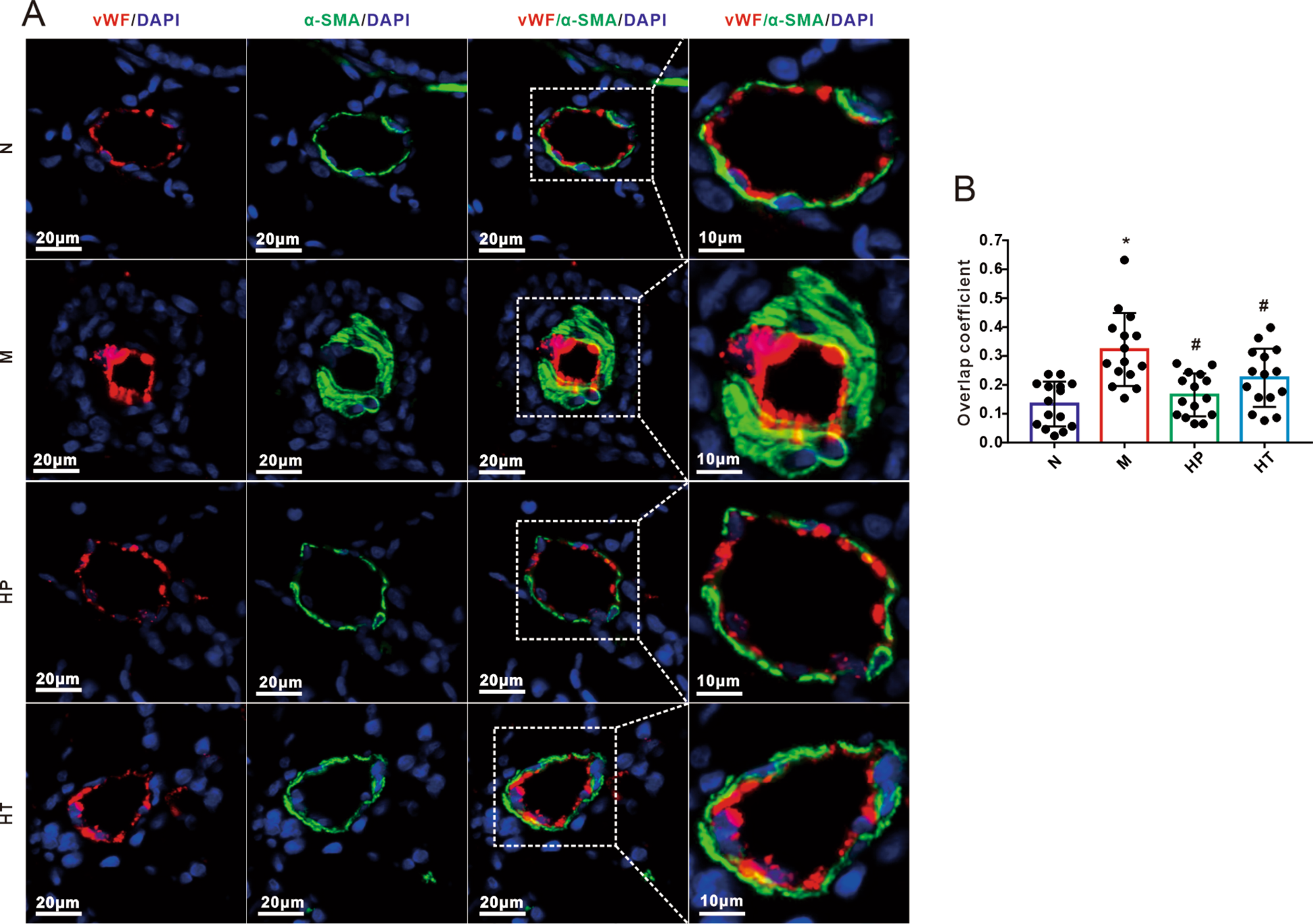
图4氢气吸入抑制了丝裂霉素C(MMC)诱导的肺静脉闭塞性疾病(PVOD)大鼠中的内皮向间充质转化(EndoMT)进程。A:用MMC和/或氢气处理的大鼠肺组织的免疫荧光染色。肺切片用vWF(红色)、α-SMA(绿色)和DAPI(蓝色)染色。B:代表vWF和α-SMA通道重叠系数的条形图,反映了共定位率(每组n=5,每只大鼠3个显微镜视野)。所有数据表示为平均值±SEM。比例尺表示20和10μm(放大如指示)。使用单因素方差分析进行四组之间的比较。*P<0.05 vs. 正常,#P<0.05 vs. MMC
吸入氢气通过重新平衡Smad信号通路保护了MMC诱导的EndoMT
为了进一步研究氢气预防和挽救EndoMT的分子机制,在PVOD背景下,随后测量了肺组织中经典的PVOD相关蛋白GCN2、间充质标志物FN1和Vimentin、内皮细胞标志物CD31和VE-cadherin以及p-Smads的蛋白表达。FN1和Vimentin的表达增加,而CD31和VE-cadherin的表达减少,表明在PVOD大鼠模型中有明显的EndoMT(图5A和B)。这些观察支持了EndoMT在PVOD的发展和进展中起重要作用的观点。然而,我们发现在预防和治疗方式中吸入氢气后,这些EndoMT相关蛋白的表达显著逆转。此外,吸入氢气有效抑制了MMC诱导的p-Smad1/5/9和GCN2的上调,同时也恢复了MMC诱导的p-Smad3的减少(图5A和B)。这些发现表明,氢气对涉及EndoMT调节的分子信号通路产生了深远的影响。具体而言,它抑制了p-Smad1/5/9和GCN2的激活,同时促进了p-Smad3水平的恢复。这表明氢气在预防和逆转PVOD背景下与EndoMT相关的分子变化中起着至关重要的作用。总之,这些数据表明,作为一种禁止性EndoMT介质,氢气气体在MMC诱导的PVOD大鼠模型中通过Smads信号传导发挥了治疗作用。
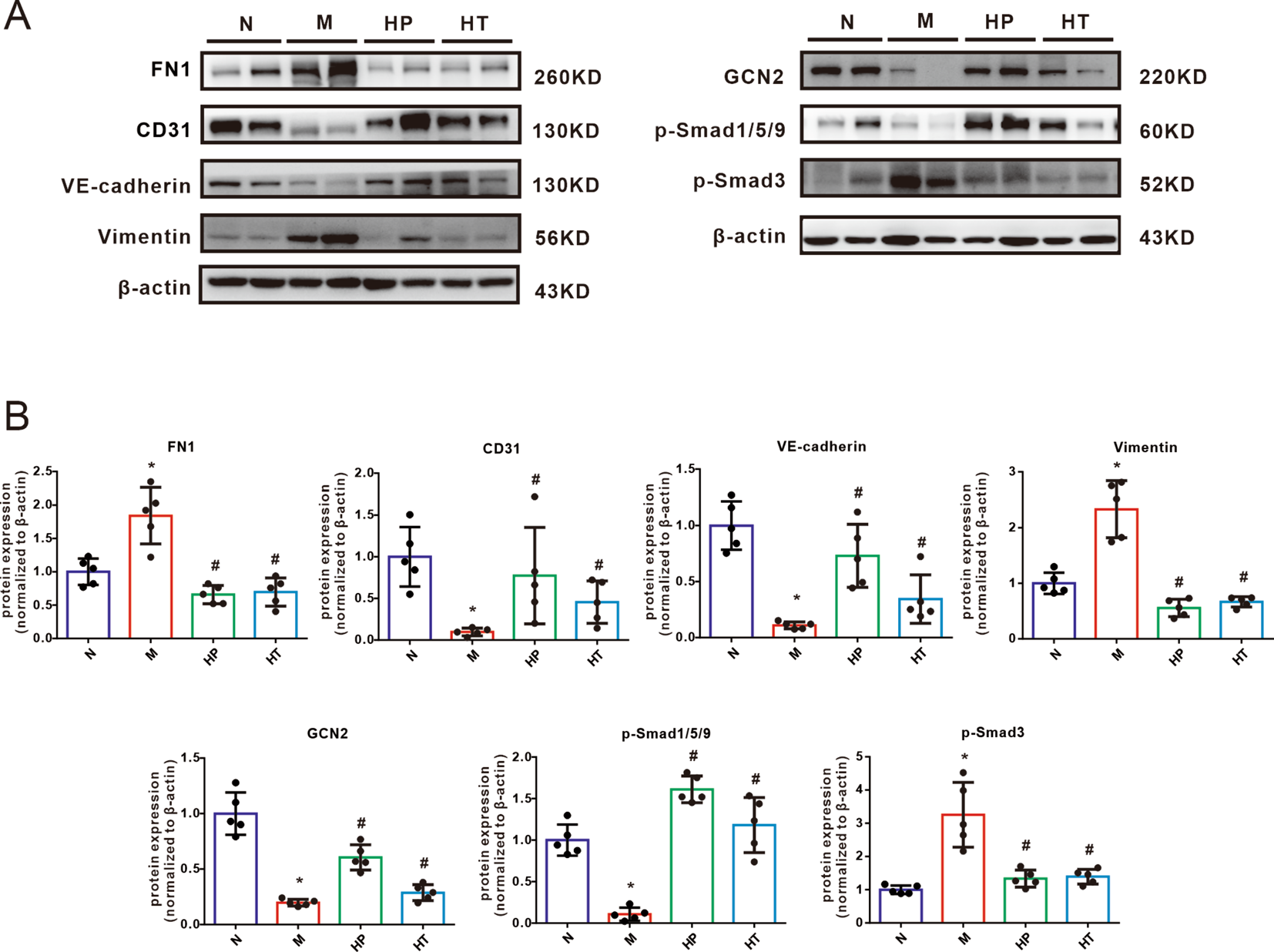
图5氢气对MMC诱导的大鼠肺组织中与内皮向间充质转化相关蛋白的影响。蛋白质印迹(A)和分析条形图(B)显示了用正常(N)、MMC(M)、氢气预防(HP)或氢气治疗(HT)处理的大鼠肺中FN1、CD31、VE-cadherin、vimentin、p-Smad3、p-Smad1/5/9和GCN2的相对蛋白水平。蛋白质印迹结果标准化为β-actin。数据表示为平均值±SEM,每组n=5。使用单因素方差分析进行三组之间的比较。*P<0.05 vs. 正常,#P<0.05 vs. MMC
四、讨论
在这项研究中,我们提供了证据,证明氢气对MMC诱导的PVOD大鼠模型具有治疗效果。在预防组和治疗组中,暴露于42%浓度的氢气显著提高了存活率,并减少了MMC诱导的肺血管损伤。我们的发现表明,氢气通过多种机制保护免受MMC诱导的损伤。首先,它通过其自由基清除活性减少由活性氧物种(ROS)引起的氧化损伤。其次,氢气通过抑制MMC诱导的内皮间充质转化(EndoMT)过程来保护内皮细胞。氢气还诱导了包括Nrf2/HO-1和GCN2在内的抗炎和抗氧化因子的表达。
根据最新的临床诊断和治疗指南,PVOD被定义为PH的一个亚型,与其他形式的PH相比,它与预后较差和对已知PH靶向疗法反应较低有关。PVOD的特点是小肺静脉因纤维性内膜增厚和斑片状毛细血管增生而闭塞,可能是特发性的、遗传的或由药物/毒素引起的。最近,大量证据证实了使用烷化剂和PVOD发病之间存在因果关系,例如MMC,这是一种广谱抗肿瘤剂。在PVOD的发病机理中,认为肺静脉内的炎症损伤和免疫状态起着核心作用。对局部化PVOD患者的细胞溶解分子谱分析显示,循环中的炎症细胞和肺组织中炎症细胞因子的表达有实质性改变。
作为一种理想的抗氧化剂,氢气暴露已被探索为各种与氧化应激相关的疾病的潜在疗法,且很少有副作用的报道。临床前研究和临床研究表明,氢气在减轻由脑和心脏缺血再灌注损伤、肝损伤、糖尿病和COPD等条件引起的器官损伤方面表现出有益效果。Kang及其同事进行的一项随机对照试验表明,富氢水可以减少辐射诱导的氧化应激的生物反应,而不损害对肝肿瘤患者的抗肿瘤效果。然而,导致这些效果的潜在机制仍然大部分未知。据报道,即使在高浓度下,氢气也保持无毒性。我们假设氢气可能通过诱导抗炎和抗氧化后果对MMC诱导的PVOD产生治疗效果。
氢气可以自由扩散到肺组织和细胞中,对细胞呼吸无害,它作为一种选择性抗氧化剂,专门中和·OH和ONOO-,留下生理信号传递不可或缺的ROS。NADPH氧化酶是体内ROS的主要来源,在生理和病理条件下都是如此。NOX-1在包括肺在内的几种组织中表达,在肺部疾病的病理条件下似乎上调。我们还发现,在MMC模型大鼠中NOX-1蛋白表达增加。吸入氢气后,大鼠肺组织中的NOX1表达显著降低。
MDA是常用来评估脂质过氧化和氧化应激水平的标记物。在单克罗太林(MCT)诱导的肺高压大鼠模型中,已报告MDA水平升高,表明该模型中氧化应激增加。在这项研究中,我们观察到在MMC诱导的PVOD大鼠中,循环MDA水平略有升高。然而,吸入氢气后,这些水平显著恢复。这表明氢气具有抗氧化作用,有效减少PVOD中MMC诱导的氧化应激。此外,众所周知,包括巨噬细胞、T淋巴细胞和B淋巴细胞在内的免疫细胞浸润在1型肺高压的各种亚型的肺血管重塑发展中起着至关重要的作用。以前的研究表明,给MCT诱导的肺高压大鼠服用氢水可以减少炎症细胞的浸润,而不会引起明显的副作用。在我们的研究中,MMC诱导的PVOD大鼠中巨噬细胞数量增加,血清IL6和IL17水平上调,这些都被预防或治疗性氢气气体吸入显著抑制。这些结果表明,氢气可能是一种有效的PVOD治疗方法,通过发挥抗氧化和抗炎特性。
HO-1是血红素加氧酶的可诱导异构体,是一种在防御肺部氧化和炎症损伤中起中心作用的细胞保护酶。广泛的机制研究揭示了HO-1基因调控对Nrf2的正向调节作出响应,Nrf2被视为抗氧化反应的主要调节器,并调节一系列参与解毒的其他基因。据报道,当暴露于各种刺激物如血红素、毒性、氧化应激时,肺组织中的线粒体HO-1部分增加。我们还发现,在MMC诱导的大鼠模型中Nrf2/HO-1通路表达升高(图3D)。MMC诱导的HO-1诱导可能对抗肺部炎症具有细胞保护作用。吸入氢气诱导了Nrf2/HO-1表达,并改善了MMC大鼠模型中的肺部炎症和损伤,与其他观察结果一致[30, 31]。动物研究已经证明,HO-1在几种不同的肺部疾病中发挥着关键的保护作用,包括肺高压、COPD、哮喘和高氧性肺损伤。诱导HO-1可能是一种有益的治疗策略,用于对抗由于不当免疫反应和氧化失调引起的不同疾病。尽管可能的治疗方法包括使用药物或基因疗法来调节患者中的HO-1表达以对抗各种氧化和炎症反应,但作为非细胞毒性HO-1诱导剂的分子氢的使用可能比其他疗法更容易转化为临床实践。
如之前报道的,PVOD也受到遗传性基因突变的影响。Eyries等人首次证明,编码GCN2的真核翻译起始因子2α激酶4(EIF2AK4)基因的双等位基因突变与PVOD的发展密切相关。此外,在MMC诱导的PVOD大鼠肺组织中,GCN2的表达也被下调。GCN2在PVOD发病机制中的详细机制仍不清楚。该研究显示,GCN2活性降低可能导致氧化敏感性增加和通过抑制eIF2a/ATF4/HO-1信号通路产生的更强烈的炎症反应。这些发现支持这些基因参与抵抗氧化应激和炎症。鉴于GCN2的抗炎作用,我们观察到氢气气体治疗显著恢复了由MMC诱导的GCN2下调,这表明氢气可能促进GCN2的表达。这反过来可能导致eIF2α/ATF4/HO-1信号通路的激活。这些结果暗示氢气可能提供针对由氧化应激引起的血管重塑的全面保护。最终,这对于预防和治疗PVOD疾病进展可能具有重要的意义。
最近,EndoMT被认为有助于PAH和PVOD发展过程中的肺血管重塑。我们之前的研究表明,通过上调TGFβ/Smad3/snail信号轴,MMC诱导的EndoMT参与并促成了大鼠PVOD的疾病发展。此外,在MMC处理的大鼠和PAH患者中检测到Smad3的磷酸化显著增加,而Smad1/5/9的磷酸化显著减少,表明在PAH过程中Smad通路失衡。在目前的研究中,与仅用MMC处理组相比,氢气吸入组的内皮细胞标记物(CD31和VE-cadherin)和p-Smad1/5/9的表达显著增加。此外,间充质标记物(FN1和Vimentin)和p-Smad3在吸入氢气后显著受到抑制。EndoMT可以由病理过程调节,包括炎症、血管损伤、代谢失调等。总的来说,氢气吸入保护了肺部免受过度的氧化应激和炎症。此外,氢气吸入恢复失衡的Smads信号通路,从而抑制EndoMT并防止血管重塑(图6)。
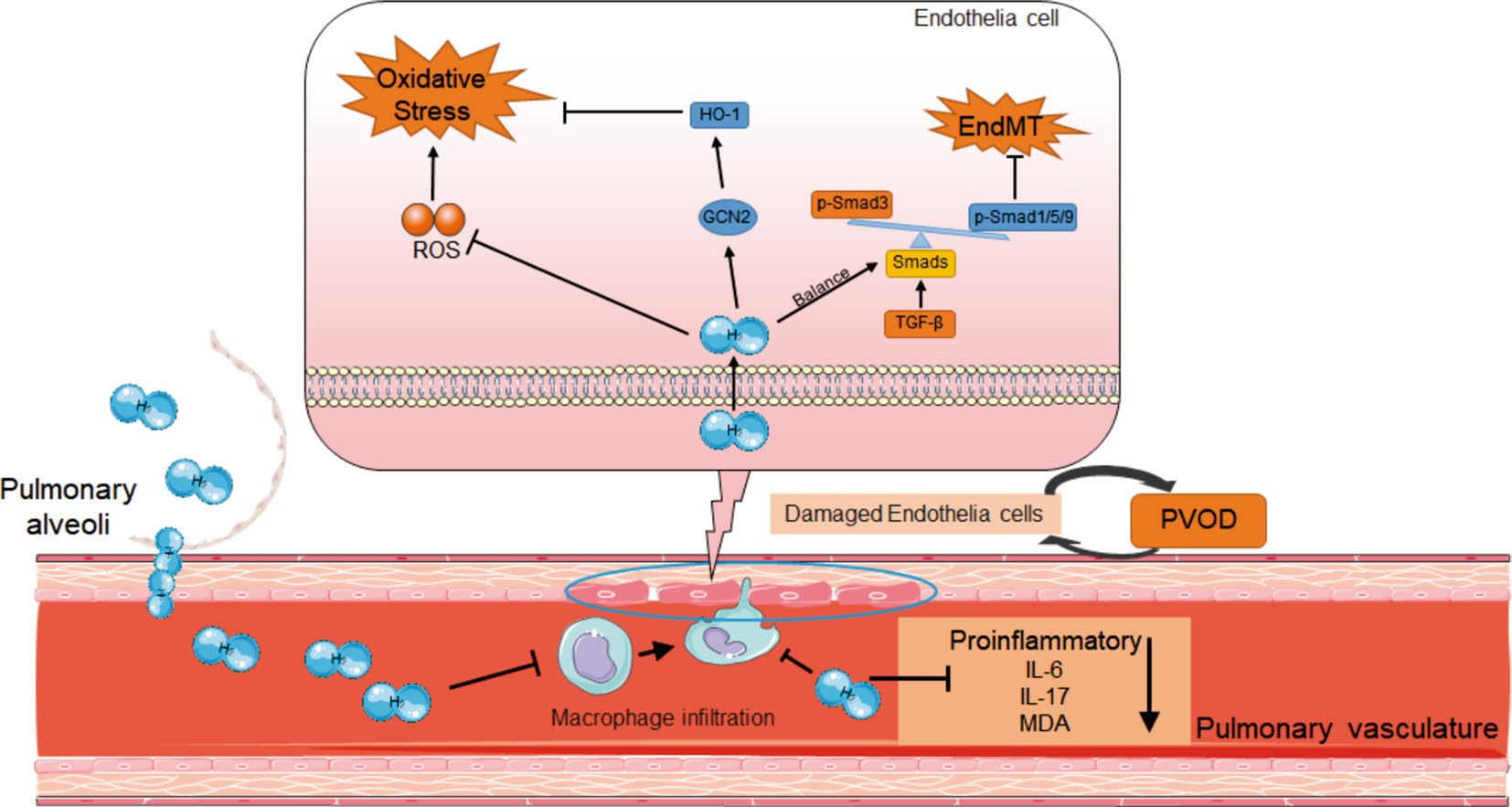
图6研究提出的模型,说明了分子氢缓解PVOD的潜在机制。氢气的吸入能够减轻丝裂霉素C诱导的内皮向间充质转变和氧化应激,通过促进抗炎GCN-HO途径的表达,抑制血浆中炎症细胞因子的产生,并平衡Smads通路。
五、结论
我们的发现提供了证据,表明吸入42% 氢气对于MMC诱导的PVOD大鼠模型在预防和治疗方案中都有显著益处。氢气吸入通过调节涉及炎症的关键因素,如GCN2和HO-1发挥其治疗效果。此外,吸入氢气抑制了与肺血管重塑相关的EndoMT过程。值得注意的是,MMC作为一种常用于化疗的烷基化剂,已被记录为导致患者肺部毒性和PVOD。因此,我们的研究强调了氢气吸入作为减轻MMC诱导的PVOD病理效应和改善患者结果的潜在方法。在我们的研究中,我们提出吸入氢气作为预防措施有潜力减轻与使用化疗药物如MMC相关的副作用。此外,氢气吸入可以作为PVOD患者的辅助疗法,即使在误诊为PH的情况下也是如此。尽管需要进一步研究来完全阐明氢气对PVOD和PH的直接影响,但我们相信,氢气吸入作为一种理想的、有效的和安全的治疗方法,值得进一步评估。氢气作为一种众所周知的分子,由于其抗氧化性能和最小的副作用,可能在治疗PH方面得到广泛应用。
https://blog.sciencenet.cn/blog-41174-1442974.html
上一篇:GLP-1的益处远不是减肥
下一篇:肝素能解蛇毒《科学转化医学》