博文
氢气+汉防己碱治疗矽肺动物实验
||
氢气+汉防己碱治疗矽肺动物实验
硅肺是一种职业病,由于缺乏针对性治疗药物,往往预后比较差。作为抗氧化抗炎症分子,研究表明氢气对许多炎症相关疾病都具有潜在治疗作用。但过去没有针对矽肺治疗有效性的实验研究。本研究来自国内氢医学研究多产的山东第一医科大学,研究人员通过对动物矽肺模型,给与氢气和汉防己碱联合干预,通过组织病理学、氧化应激和肺纤维化水平等证明氢气和汉防己碱联合治疗能有效缓解矽肺动物肺纤维化,肺功能、炎症和氧化应激等指标也符合有效的变化。这是第一篇关于氢气治疗矽肺的实验研究论文,给将来人体试验提供了重要证据。
Li J, et al. Hydrogen combined with tetrandrine attenuates silica-induced pulmonary fibrosis via suppressing NF-kappaB/NLRP3 signaling pathway-mediated epithelial mesenchymal transition and inflammation. Int Immunopharmacol. 2024 Jun 28;138:112563.
硅肺是一种由于吸入二氧化硅颗粒而引起的间质纤维化进展性疾病,目前尚无特效治疗方法。氢气(H2)具有抗氧化、抗炎和抗纤维化的特性,但尚未探讨其在治疗硅肺中的效果。本研究将暴露于二氧化硅的大鼠给予H2与汉防己碱联合干预,并在干预后第14天、28天和56天处死大鼠。收集肺组织和血清样本进行分析。通过组织学检查、丙二醛(MDA)测定、酶联免疫吸附试验(ELISA)、羟脯氨酸测定和蛋白质印迹法评估H2联合汉防己碱对肺纤维化的影响。结果显示,这种联合治疗显著减轻了硅肺大鼠的炎症反应,有效抑制了MDA、肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)的表达水平,并抑制了上皮-间质转化(EMT),从而改善了肺纤维化。特别是,E-钙粘蛋白的蛋白表达水平增加,而波形蛋白和α-平滑肌肌动蛋白(α-SMA)的蛋白表达水平降低,转化生长因子-β(TGF-β)减少,羟脯氨酸含量显著下降。此外,H2联合汉防己碱下调了NF-κB p65、NF-κB p-p65、Caspase-1、ASC和NLRP3的蛋白表达。这些发现证实了H2联合汉防己碱通过NF-κB/NLRP3信号通路减轻硅肺相关的炎症并抑制EMT过程以改善纤维化的假设。然而,本研究未评估气道开放压,也未获得肺生理功能的动态读数,这是本研究的一个重要局限性。
Graphical abstract
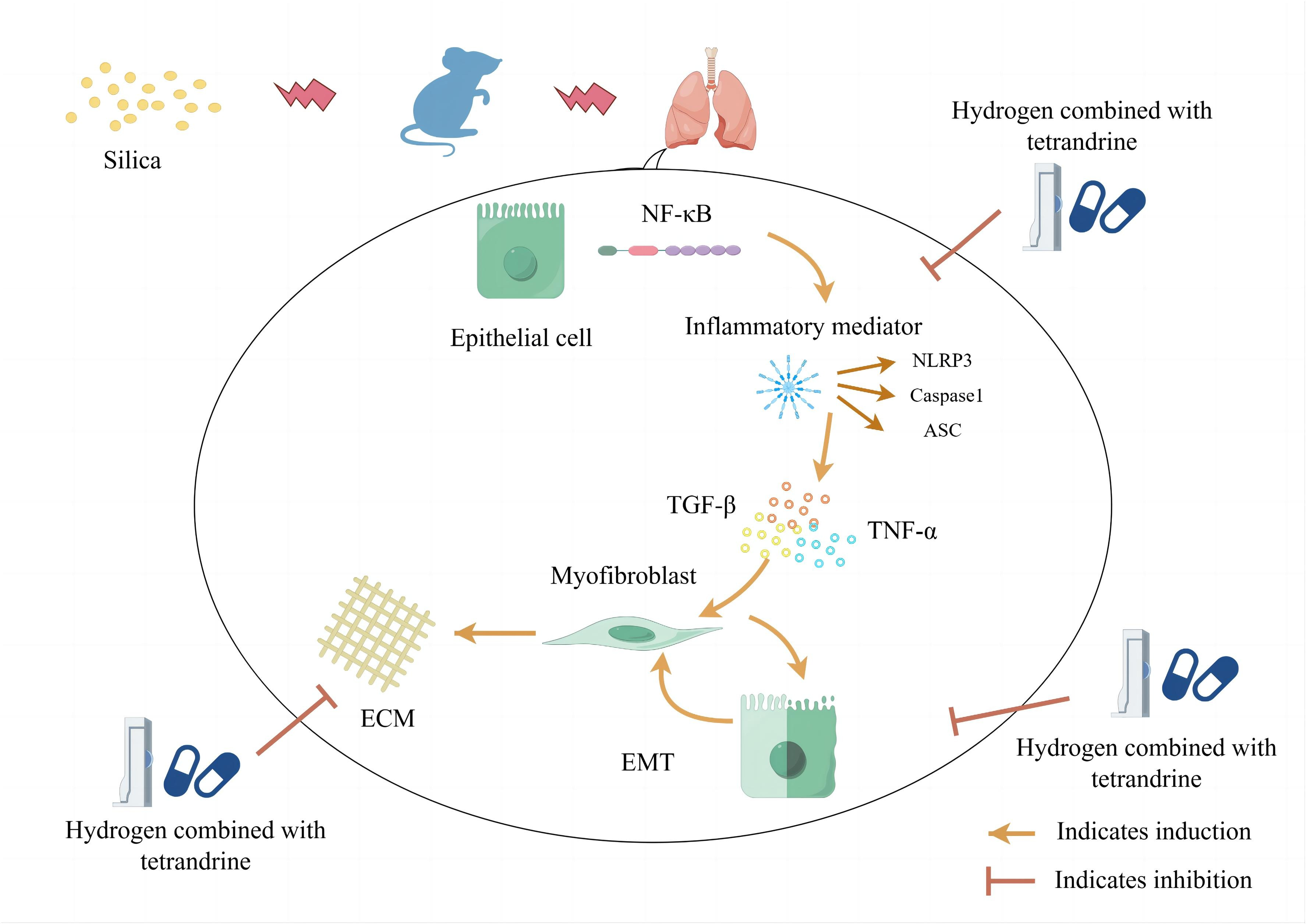
1. 引言
硅肺是由于长期吸入二氧化硅(SiO2)粉尘而引起的间质性纤维化,是一种在全球范围内普遍存在的职业病,其治疗选项有限。肺移植作为一种成本高昂的干预措施。肺灌洗术在延长患者生存期方面效果不佳。因此,迫切需要新的治疗手段。
硅肺的发病机制尚未完全阐明,但普遍认为SiO2对巨噬细胞的直接细胞毒性作用可能伴随着多种相互作用的病理机制组合。炎症反应始终存在并在纤维化的发展中扮演重要角色。吸入SiO2颗粒会激活多个炎症信号通路,如NF-κB信号通路和NLRP3信号通路,进而引发炎症反应和氧化应激,导致炎症小体相关成分(如NLRP3、Caspase-1和ASC)的调节以及多种细胞因子(如TGF-β、IL-1β和TNF-α)的释放。
上皮-间质转化(EMT)成为纤维生成中的关键事件,EMT的发生预示着纤维化的开始。炎症因子和氧化应激可以激活EMT过程并诱导上皮细胞转化为间充质细胞,该细胞分泌胶原蛋白和其他细胞外基质成分,导致肺组织中纤维化增加。在纤维化过程中,肺组织的正常结构被破坏,导致肺功能下降。
氢气(H2)是一种无色、无味、非金属且高度易燃的双原子气体,分子式为H2。它具有抗氧化、抗炎和抗纤维化的特性。据报道,H2可以通过NF-κB信号通路减轻炎症反应,并改善糖尿病中风大鼠的长期神经功能和血糖水平。它还可以经由NLRP3信号通路减轻心肌再灌注损伤中的炎症和氧化应激;抑制TNF-α、IL-1β、IL-18等炎症细胞因子。此外,研究显示H2可以改善巨噬细胞损伤,增强线粒体自噬,并抑制肺损伤;显著减轻小鼠肺挫伤后的炎症反应。H2还可以减轻特发性间质性纤维化,显著增加上皮细胞中E-钙粘蛋白的表达,并以时间依赖方式降低肌成纤维细胞中α-SMA、N-钙粘蛋白和波形蛋白的表达,并对EMT过程进行积极干预。因此,H2可以通过上述途径治疗炎症和纤维化。同样,汉防己碱是一种从汉防己中提取的自然化合物,具有抗氧化应激、抗炎和抗纤维化作用,使其成为硅肺治疗的首选方案。已显示汉防己碱通过NLRP3炎症小体通路减轻硅肺。并且它可以通过NF-κB通路影响T细胞介导的自身免疫疾病。此外,研究显示汉防己碱减少了博来霉素和TGF-β1诱导的成纤维细胞中α-平滑肌肌动蛋白、波状蛋白和I型胶原的表达和增殖,并对肺纤维化起到了保护作用。
为了进一步探索氢气联合汉防己碱治疗硅肺纤维化的效果和机制,我们假设H2联合汉防己碱可能通过抑制NF-κB/NLRP3通路来减轻硅肺纤维化,从而缓解炎症反应,抑制EMT,并改善α-SMA、N-钙粘蛋白和波形蛋白等纤维化标志物。
2. 材料与方法
2.1. 试剂、药物和氢气设备
SiO2颗粒(S5631,约80%介于1-5μm之间)购自Sigma-Aldrich(美国密苏里州圣路易斯),在120°干燥箱中放置2小时,研磨4小时,准确称重,并经过高压蒸汽灭菌后使用。汉防己碱(国药准字H33022075)由浙江金华康恩贝生物制药有限公司提供,溶于蒸馏水并通过灌胃给药。氢氧气混合气(66%氢气;33%氧气)通过鼻导管以3L/min的速率输送,使用氢气/氧气发生器(型号AMS-H-03,上海Asclepius Meditec有限公司,中国)。使用探头式氢气探测器(日本大阪New Cosmos Electric有限公司)监测舱内氢气浓度,以确保最佳气流并防止氢气积聚。
2.2. 动物及干预措施
共购买了150只SPF级雄性Wistar大鼠,体重为160~180g,来自济南鹏跃实验动物养殖有限公司(编号:370726220100860365)。大鼠放置在控制条件下,温度为22±3°C,相对湿度为50%-65%,光照周期为12小时明暗循环。它们被提供标准饮食和随意取水。所有动物实验均经山东省医学科学院动物实验伦理委员会批准(SDZFYEC-A-2023–01),并按照美国国立卫生研究院关于实验室动物护理和使用指南进行。
大鼠使用随机数字表法在三个时间点随机分为五组(每组n=10),即对照组、硅肺模型组、汉防己碱干预组、氢气干预组和氢气联合汉防己碱干预组。根据我们之前的研究,大鼠暴露于硅尘中。简而言之,对照组气管内滴入1ml生理盐水,模型组在异氟醚(深圳VETEASY)轻度麻醉后,气管内滴入1ml硅尘悬浮液(50mg/ml)。建模后的第二天开始干预:汉防己碱干预组大鼠每日接受30mg/kg汉防己碱的灌胃给药,氢气干预组大鼠每天连续吸入氢气4小时。在干预后第14天、第28天和第56天收集血清和肺组织样本进行分析。
2.3. 组织形态学检查
对大鼠肺组织进行组织学检查,以评估炎症和肺泡结构,并确认硅肺模型的成功建立。计算肺器官系数,公式为肺湿重(g)除以体重(g)乘以100%。肺切片用HE和Masson三色染色,并使用Szapiel方法对炎症和纤维化进行评分。使用ImageJ软件进行胶原体积分数(CVF)分析。进行NLRP3和NF-κB p65的免疫组化染色(IHC),并使用ImageJ软件量化平均光密度值(AOD)。
2.4. 丙二醛测定
使用丙二醛(MDA)试剂盒(上海碧云天,中国)测量血清中丙二醛水平,以评估氧化应激水平。
2.5. 酶联免疫吸附测定(ELISA)
准确称量肺组织,然后在冰上操作,按重量(mg)与体积(μl)1:10的比例加入冷的1×PBS,充分匀浆后将组织匀浆在-20°C或以下冷冻过夜。第二天取出后反复冻融2次以破坏细胞膜,然后在4°C下以5000g离心5分钟,吸取上清液进行检测。使用ELISA试剂盒(北京博奥森生物技术有限公司,北京,中国)按照制造商的说明测定肺组织匀浆中的IL-1β和TNF-α浓度。
2.6. 羟脯氨酸测定
使用羟脯氨酸测定试剂盒(南京建成,南京,中国)测量肺组织中的羟脯氨酸含量,以评估肺部纤维化程度。
2.7. 蛋白质印迹分析
准确称量所需组织,进行匀浆和裂解,然后在4°C下以12,000转/分钟离心10分钟。收集上清液,并使用BCA蛋白浓度测定试剂盒(上海碧云天,中国)测定蛋白浓度并进行均质化。在金属浴中100°C下变性蛋白10分钟后方可使用。每组肺中的中等量蛋白通过10% SDS-PAGE分离,并电转移至PVDF膜(密理博,MA,美国)。使用5%脱脂奶粉(索莱宝,北京,中国)封闭PVDF膜。一抗:NLRP3、E-cadherin(1:1000,Abcam,美国);GAPDH、Vimentin、α-SMA(1:1000,Cell Signaling,美国);NF-κBp65、Caspase-1(1:1000,Proteintech,武汉,中国),NF-κBp-p65、ASC(1:1000,ZEN-BIOSCIENCE,中国)在4°C下孵育过夜。最后,加入二抗(Li-Cor,北京,中国)并在37°C下孵育30分钟。使用Odyssey®CLX显影仪可视化蛋白带,并使用ImageJ软件分析条带强度。
2.8. 统计分析
数据以平均值±标准差(SD)表示。所有数据的统计分析和可视化均使用GraphPad Prism 8进行。使用双向方差分析(ANOVA)和bonferroni事后检验比较不同干预方式和多个组之间不同时间点的差异。P值<0.05被认为具有统计学意义。
3. 结果
3.1. 氢气联合汉防己碱减轻硅尘诱导的肺纤维化
暴露于粉尘后,大鼠逐渐表现出肺纤维化的增加,特征为纤维组织和胶原的积累,在第56天达到高峰。与模型组相比,氢气联合汉防己碱的干预导致纤维化显著减少,随着干预时间的延长,第56天的观察效果最为显著(图1A-C)。
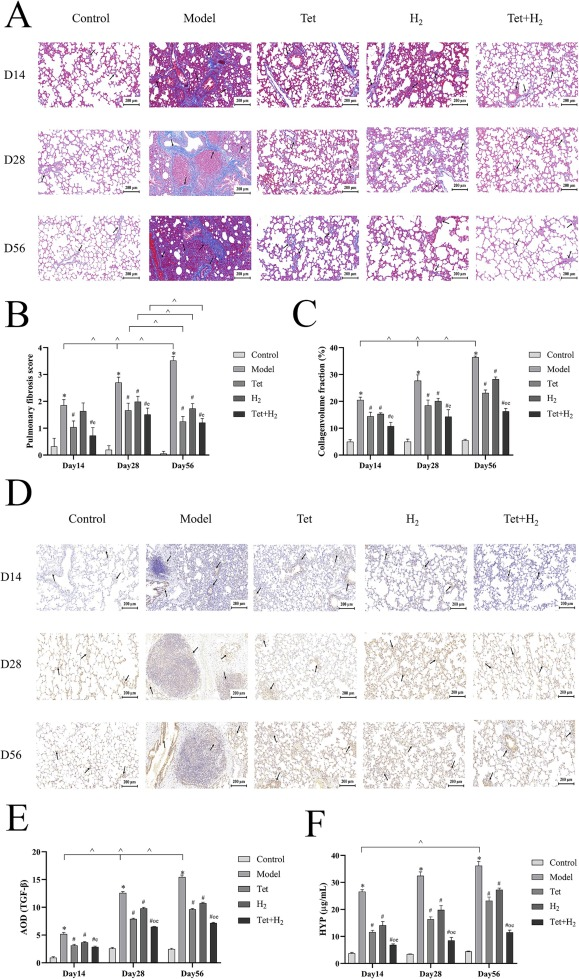
图1. 氢气联合汉防己碱减轻硅尘诱导的肺纤维化。(A) 肺组织切片的马松染色代表性图像(200倍),比例尺=200μm。(B) 肺纤维化评分。(C) 胶原体积分数。(D, E) 通过免疫组化测定TGF-β的表达,比例尺=200μm。(F) H2与汉防己碱联合干预对羟脯氨酸的影响。黑箭头指示具有阳性免疫组化标记的胶原沉积。每个实验至少重复三次,数据进行了归一化处理。*P < 0.05,与对照组比较。#P < 0.05,与模型组比较。o P < 0.05,与汉防己碱组比较。e P < 0.05,与H2组比较。^P < 0.05,同一组内不同时间点的比较。数据表示为平均值±标准误。
转化生长因子-β (TGF-β) 在模型组中的表达在干预后第28天显著增加,并在第56天达到峰值。相反,所有干预组在干预后第28天和第56天的TGF-β表达水平相比模型组均有显著降低(图1 D, E)。
羟脯氨酸(HYP)表达在硅颗粒刺激后的第56天达到峰值。然而,所有三个干预组都有效抑制了胶原纤维的沉积,其中H2与汉防己碱联合组的效果最为显著(图1F)。
3.2. 氢气联合汉防己碱减轻硅尘诱导的肺部损伤
检查肺组织的HE染色病理切片以评估肺泡结构和炎症浸润情况(图2A和B)。与对照组相比,暴露于SiO2颗粒14天的大鼠表现出明显的炎症浸润。到第28天,炎症细胞增加,大鼠肺部出现结节。到第56天,大鼠肺组织的肺泡结构明显改变,结节增多。与模型组相比,所有三个干预组的肺泡结构异常和炎症浸润均有所减少。
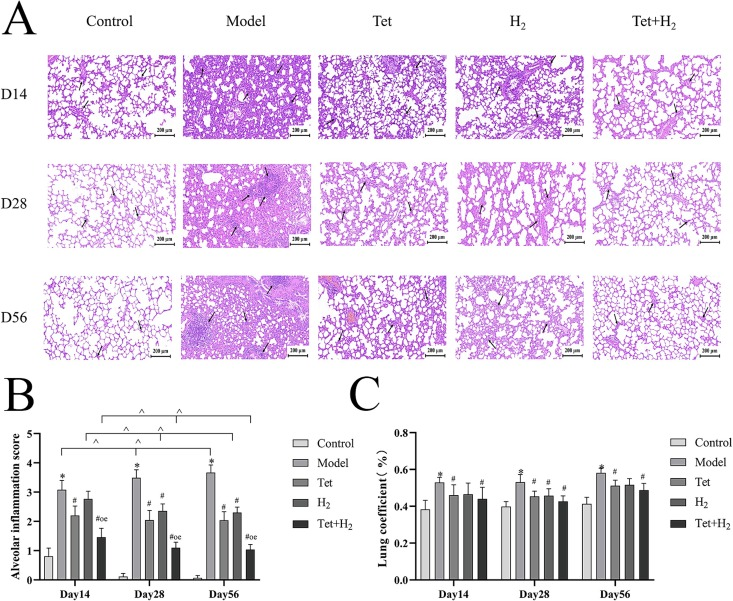
图2. 氢气联合汉防己碱减轻硅尘诱导的肺部损伤。(A) 肺组织切片的HE染色代表性图像(200倍),比例尺=200μm。(B) 肺泡炎症评分的变化。(C) 肺系数。黑箭头指示炎症细胞。每个实验至少重复三次,数据进行了归一化处理。*P < 0.05,与对照组比较。#P < 0.05,与模型组比较。o P < 0.05,与汉防己碱组比较。e P < 0.05,与H2组比较。^P < 0.05,同一组内不同时间点的比较。数据表示为平均值±标准误。
为了验证大鼠硅肺模型,通过测量大鼠的体重和肺重计算了肺系数(图2C)。结果显示,模型组的肺重显著高于对照组。相反,干预组的肺重显著低于模型组。在第14天和第56天的模型组之间观察到统计学上的显著差异。
3.3. 氢气联合汉防己碱减轻硅尘诱导的大鼠氧化应激和炎症
结果表明,与对照组相比,模型组的丙二醛(MDA)含量显著增加,表明氧化应激水平升高。相反,干预组显示出MDA表达显著降低,随着干预时间的延长,效果更为明显(图3A)。
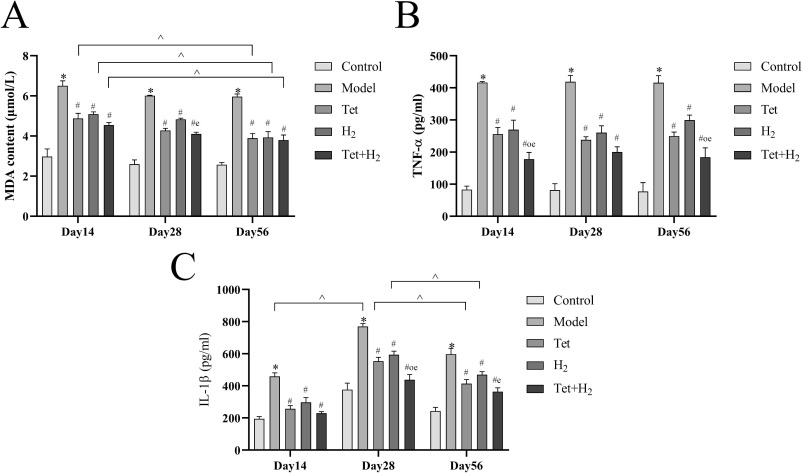
图3. H2联合汉防己碱对硅肺大鼠肺组织中MDA和体内细胞因子的影响。(A) MDA的水平。(B, C) 通过ELISA测量大鼠肺组织匀浆中TNF-α和IL-1β的水平。每个实验至少重复三次,数据进行了归一化处理。*P < 0.05,与对照组比较。#P < 0.05,与模型组比较。o P < 0.05,与汉防己碱组比较。e P < 0.05,与H2组比较。^P < 0.05,同一组内不同时间点的比较。数据表示为平均值±标准误。
在建模后第28天,模型组促炎细胞因子TNF-α和IL-1β的表达水平达到峰值,这与肺部炎症最大化相一致。与模型组相比,除第14天的H2干预组外,所有干预组在TNF-α表达上均显示出统计学上的显著差异(图3B)。同样,H2联合汉防己碱组在所有三个干预后的时间点有效抑制了IL-1β的表达,观察到统计学上的显著差异(图3C)。
3.4. 氢气联合汉防己碱抑制硅尘诱导的上皮间质转化
本研究使用蛋白质印迹分析评估了上皮间质转化(EMT)标志物E-cadherin、vimentin和α-SMA(图4A-D)。结果显示,暴露于SiO2颗粒持续降低了EMT标志蛋白E-cadherin的表达。然而,用H2联合汉防己碱治疗成功阻止了这种减少。相比之下,H2组和汉防己碱组仅在第56天与模型组显示出统计学上的显著差异。这些发现通过免疫组化分析E-cadherin的表达得到了证实(图4E, F)。此外,随着SiO2颗粒暴露时间的延长,vimentin的表达稳步增加,而α-SMA在第56天达到峰值。在所有三个时间点,H2联合汉防己碱组有效抑制了vimentin和α-SMA的表达。
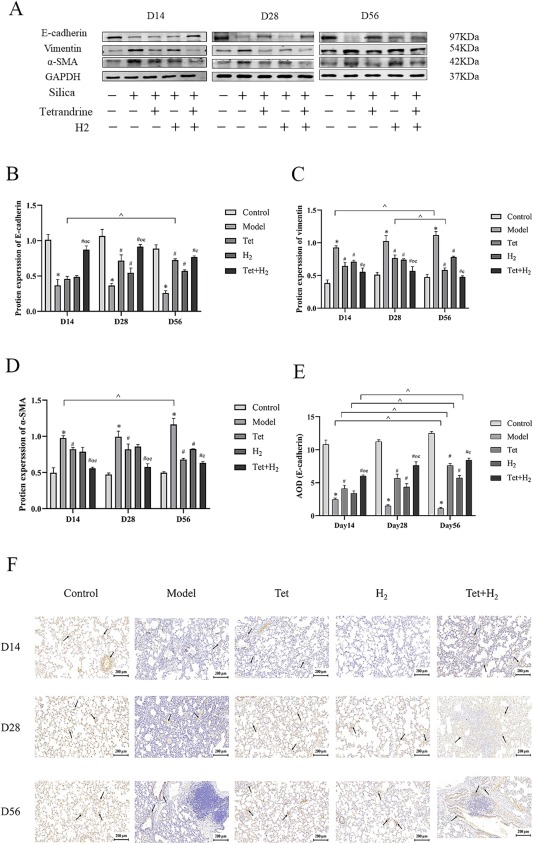
图4. 氢气联合汉防己碱抑制硅尘诱导的上皮间质转化。(A-D) E-cadherin、Vimentin和α-SMA的蛋白质印迹及相对表达分析。(E-F) E-cadherin的免疫组化表达,比例尺=200μm。阳性免疫组化标记由黑箭头指示。每个实验至少重复三次,数据进行了归一化处理。*P < 0.05,与对照组比较。#P < 0.05,与模型组比较。o P < 0.05,与汉防己碱组比较。e P < 0.05,与H2组比较。^P < 0.05,同一组内不同时间点的比较。数据表示为平均值±标准误。
3.5. NF-κB/NLRP3信号通路在氢气联合汉防己碱改善硅尘诱导的肺纤维化中的调控作用
蛋白质印迹分析显示,随着SiO2暴露时间的延长,NLRP3、NF-κB p65和NF-κB p-p65的表达逐渐增加,而氢气联合汉防己碱的干预有效抑制了这些蛋白的表达(图5A-D)。这些发现与NLRP3和NF-κB p65的免疫组化染色结果一致(图5E-H)。
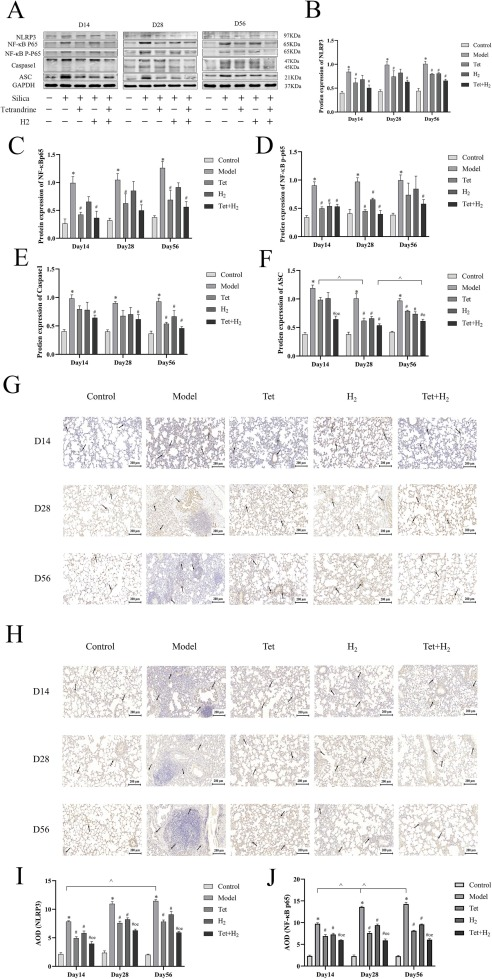
图5. 氢气联合汉防己碱对NF-κB/NLRP3信号通路的影响。(A-F) H2联合汉防己碱干预对硅肺大鼠肺组织中NF-κB p65、NF-κB p-p65、Caspase1、ASC和NLRP3蛋白水平的变化。(G-J) NLRP3和NF-κB p65的免疫组化测定,比例尺=200μm。阳性免疫组化标记由黑箭头指示。每个实验至少重复三次,数据进行了归一化处理。*P < 0.05,与对照组比较。#P < 0.05,与模型组比较。o P < 0.05,与汉防己碱组比较。e P < 0.05,与H2组比较。^P < 0.05,同一组内不同时间点的比较。数据表示为平均值±标准误。
此外,与模型组相比,Caspase1和ASC的相对蛋白表达水平在干预后呈现下降趋势,随着干预时间的增加,在H2联合汉防己碱干预组观察到统计学上的显著差异(图5I和J)。
4. 讨论
硅肺是一种无法治愈的职业性肺部疾病,由吸入晶体SiO2颗粒引起,它是渐进性的、不可逆的并可能导致残疾。SiO2颗粒无法被降解,持续的巨噬细胞激活导致线粒体活性氧(ROS)的产生增加以及NLRP3炎症反应的激活,最终导致巨噬细胞死亡和SiO2颗粒的释放,使炎症持续存在。NF-κB/NLRP3信号通路的激活诱导了氧化应激和炎症反应,随后激活了EMT过程,促进了硅肺纤维化的发展及转移。我们的研究证实了暴露于SiO2颗粒的大鼠肺组织中存在显著的炎症浸润和纤维组织增生。
汉防己碱是中药成分之一,可以通过NF-κB/NLRP3信号通路抑制炎症,减轻病理损伤,抑制硅肺中的氧化应激和炎症反应,减少肺组织的纤维化程度。此外,已有研究表明H2可以通过NF-κB/NLRP3信号通路抑制肺组织的炎症、EMT和纤维化;改善肾脏损伤并治疗多种脑部疾病。H2联合汉防己碱的干预可以减少肺部炎症、氧化应激,抑制EMT过程并改善硅肺纤维化。本研究结果显示,与模型组的病理切片相比,所有三个干预组的炎症浸润减少,纤维组织增生受到抑制,有效减少了纤维化程度。与MDA表达、模型组的TNF-α和IL-1β表达相比,H2和汉防己碱干预组有效地减少了炎症并抑制了炎症因子的表达,而H2联合汉防己碱组的效果最为显著。另一方面,H2联合汉防己碱干预有效地降低了TGF-β和HYP的表达,抑制了胶原纤维的沉积并减轻了肺纤维化。
Epithelial mesenchymal transition (EMT) 指的是上皮细胞转变为具有间质特征的细胞的过程。广泛认为,EMT在肿瘤转移和纤维化等疾病的发展和进程中起着重要作用。研究表明,在硅肺患者的肺组织中也发现了EMT的迹象[36]、[37]。在本研究中,H2联合汉防己碱成功地阻止了E-cadherin降低和vimentin及α-SMA增加的趋势,尽管与模型组相比,H2联合汉防己碱组的差异仅在第56天时具有统计学意义,这与E-cadherin的免疫组化分析结果一致,表明H2联合汉防己碱组的干预具有时间依赖性。羟脯氨酸测定和Masson染色的结果显示,与模型组相比,H2联合汉防己碱干预组有效地抑制了纤维化的进展,且H2联合汉防己碱组的干预效果最为显著。
NF-κB和NLRP3信号通路在硅肺的发展过程中被激活并参与炎症反应和EMT的调控。本研究发现,在硅肺中NF-κB/NLRP3信号通路被激活。随着SiO2暴露时间的增加,NLRP3、NF-κB p65、NF-κB p-p65、Caspase1和ASC的表达逐渐增加。此外,已有研究表明H2和汉防己碱可以通过NF-κB/NLRP3信号通路抑制肺组织炎症、EMT和纤维化。本研究结果显示,H2联合汉防己碱干预有效地抑制了NLRP3、NF-κB p65、NF-κB p-p65、Caspase1和ASC蛋白的表达,且随着干预时间的增加效果更为明显。这表明NF-κB/NLRP3是H2在硅肺中干预的有效靶点。
总之,在本研究中,基于我们之前的研究和通过病理观察、炎症因子检测和蛋白表达验证,证实了H2联合汉防己碱可以通过NF-κB/NLRP3信号通路减少炎症反应、氧化应激,抑制EMT过程,并改善硅肺纤维化。
5. 结论
我们的研究证明了H2和汉防己碱的联合干预通过抑制NF-κB/NLRP3信号通路的激活来减轻硅肺纤维化。这种干预有效地缓解了氧化应激,减少了肺部炎症,抑制了EMT过程,并改善了硅肺纤维化。我们的发现强调了针对NF-κB/NLRP3通路在硅肺治疗中的潜在治疗价值,为进一步研究和临床应用提供了有希望的途径,我们提出了如图6所示的图形总结。然而,本研究未评估气道开放压,也未获得肺生理功能的动态读数,这是本研究的主要局限性。
https://blog.sciencenet.cn/blog-41174-1440379.html
上一篇:科学还是谎言:蛋黄和心脏病
下一篇:氢气治疗动物脑外伤机制研究【天坛】