博文
氢气治疗动物脑外伤机制研究【天坛】
||
氢气(H2)已经成为创伤性脑损伤(TBI)潜在的治疗干预手段。然而,H2在TBI中的神经保护作用的确切机制仍然不完全清楚。
使用控制性皮质冲击(CCI)方法诱导了TBI小鼠模型,并通过将星形胶质细胞暴露于脂多糖(LPS)建立了细胞模型。通过CCK-8试剂盒检测细胞活力。通过流式细胞术测量细胞凋亡。使用ELISA检测细胞因子定量。通过西方印迹和RT-PCR分析检测蛋白质和基因表达。采用共免疫沉淀(CO-IP)进行蛋白质-蛋白质相互作用。对TBI小鼠应用了莫里斯水迷宫测试和旋转杆测试。
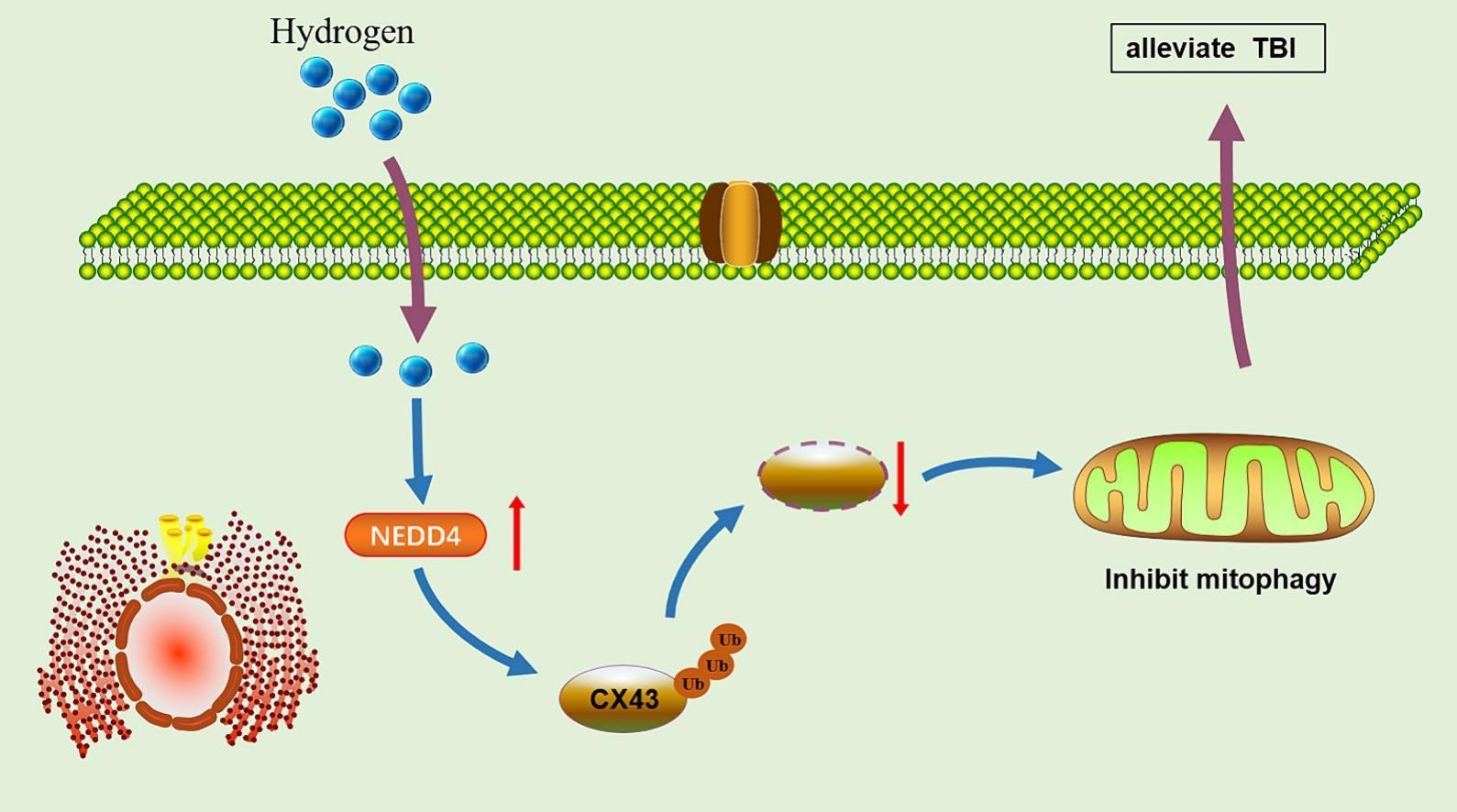
H2处理有效地抑制了LPS诱导的星形胶质细胞损伤和细胞凋亡。在HRS处理后,NEDD4表达增加,伴随着LPS处理的星形胶质细胞中增强的线粒体自噬。NEDD4的过表达和连接蛋白43(CX43)的下调反映了H2处理在LPS暴露的星形胶质细胞中的保护效应。NEDD4与CX43相互作用以调节CX43的泛素化降解。而过表达CX43逆转了H2处理在LPS暴露的星形胶质细胞中的保护效应。此外,H2处理显著减轻了TBI小鼠模型中的脑损伤。
H2促进了NEDD4-CX43介导的线粒体自噬,以保护由TBI引起的脑损伤,凸显了H2在TBI治疗效应中的一条新途径。
Highlights
H2通过促进NEDD4-CX43介导的线粒体自噬来减轻TBI中的脑损伤。
在H2处理的星形胶质细胞中,NEDD4介导了CX43的泛素化降解。
这些发现揭示了与TBI中H2相关的一种新的神经保护机制。
创伤性脑损伤(TBI)是全球死亡和残疾的主要原因之一,具有重要的社会、经济和健康影响[1]。TBI导致长期后果,如认知障碍、情绪波动以及对神经退行性疾病的易感性增加[2, 3]。尽管在TBI治疗方面取得了进展,但仍存在重大挑战,包括缺乏有效的药物干预、需要防止二次伤害以及心理社会和认知障碍的复杂性[3, 4]。克服这些挑战需要持续的研究以揭示TBI的病理生理学并推进更优的治疗方法。
线粒体自噬是维持细胞健康和防止受损线粒体积累的重要细胞机制[5]。越来越多的研究表明,线粒体自噬在各种病理条件下起着关键作用,如神经退行性疾病和TBI[6, 7]。例如,通过皂苷促进SHP-2介导的线粒体自噬可以抑制NLRP3炎症小体介导的神经炎症,并改善APP/PS1小鼠的认知功能[8]。因此,研究TBI响应中控制线粒体自噬的分子机制可能会为TBI的新颖治疗干预开辟新途径。
氢(H2)已因其在各种医学状况下的潜在治疗效果而被研究[9, 10]。H2通过促进PINK1/parkin介导的线粒体自噬,减轻由败血症引起的细胞损伤和急性肺损伤[10]。H2还通过PINK介导的自噬减少心肌缺血/再灌注(I/R)损伤中的炎症和凋亡[11]。此外,H2开始作为一种有前景的治疗方式出现,因其在脑损伤中的神经保护效应而受到关注,如创伤性脑损伤[12]。氢已被证明能够减轻败血症相关脑病中的神经元损伤并缓解神经炎症[13]。H2还可以预防轻度TBI后的氧化损伤和认知缺陷[14]。然而,这些过程中涉及的具体机制仍需要进一步调查,并且H2是否通过促进TBI中的线粒体自噬来减轻神经炎症还不清楚。
连接蛋白43(Cx43)是一种参与间隙连接形成和细胞间通讯的重要蛋白质,在各种组织中扮演多种角色,对生理过程有重要影响[15, 16]。研究表明,缺乏Cx43可以阻止由脂多糖(LPS)诱导的神经炎症[17]。在星形胶质细胞中使用Gap19抑制异常Cx43表达显示出抗炎和神经保护效果[18]。此外,已经确定miR-23a是Cx43的直接调节因子,影响心肌缺血/再灌注损伤中的线粒体自噬[19]。因此,抑制Cx43可能促进线粒体自噬,从而减轻神经炎症损伤。
然而,Cx43在H2通过促进TBI中的线粒体自噬来减轻神经炎症的能力中的作用仍然不清楚。因此,我们假设氢气可能导致Cx43蛋白的泛素化和降解,从而促进线粒体自噬并减轻TBI中的细胞损伤。我们的发现证明了H2促进了星形胶质细胞中的CX43介导的线粒体自噬,凸显了H2在TBI治疗效应中的一条新途径。
https://blog.sciencenet.cn/blog-41174-1440521.html
上一篇:科学还是谎言:蛋黄和心脏病
下一篇:某些肠道细菌能让人类食物成瘾