博文
哺乳动物产热进化
|
哺乳动物产热进化
许多生物有能力产生热量(产热)来调节全身或某些身体区域的温度(内温性)。维持组织温度带来了进化上的优势,包括确保最佳代谢和促进在更广泛的环境中生存的能力。在哺乳动物中,一个重要产热途径是通过棕色脂肪组织(BAT)中的非颤抖性产热(NST),这涉及到解偶联蛋白1(UCP1)的表达。但是这种能力在这些动物中是如何进化的仍然不清楚。在这一期的1111页上,Keipert等人使用比较基因组学和古代蛋白质重建研究了UCP1的进化历史,揭示了其介导哺乳动物脂肪组织产热能力的步骤。
产生和维持核心体温的能力涉及不同的途径,包括基础代谢率(BMR)、颤抖性产热(一种对寒冷应激的物理反应,发生在骨骼肌中)以及NST(一种对寒冷应激的生化反应,发生在各种器官中,尤其是肌肉和BAT)。这些途径在不同动物中分布不同。例如,在一些外温性(冷血)物种如鲨鱼、金枪鱼和旗鱼中,从BMR产生的热量通过一种称为逆流热交换的过程得到保存,这一过程中主要动脉和静脉之间的紧密接近使得动脉中温暖的血液将热量传递给相邻静脉中的冷血,导致局部内温性。值得注意的是,一些鱼类如旗鱼拥有一个“加热器”器官也能实现局部内温性,该器官由富含线粒体的改良肌肉细胞组成,类似于哺乳动物中的BAT。鸟类,它们与哺乳动物来自不同的爬行动物谱系,使用基于肌肉的NST途径,其中能量由肌浆网钙ATP酶(SERCA)生成。
非颤抖性产热的进化
不同形式的NST在脊椎动物中分布不同。在哺乳动物中,UCP1介导的产热可能涉及两个步骤。首先,脂肪组织被重新连接以将寒冷应激与非产热性UCP1的表达联系起来。其次,UCP1仅在真兽类哺乳动物从有袋类哺乳动物分化后获得产热功能。
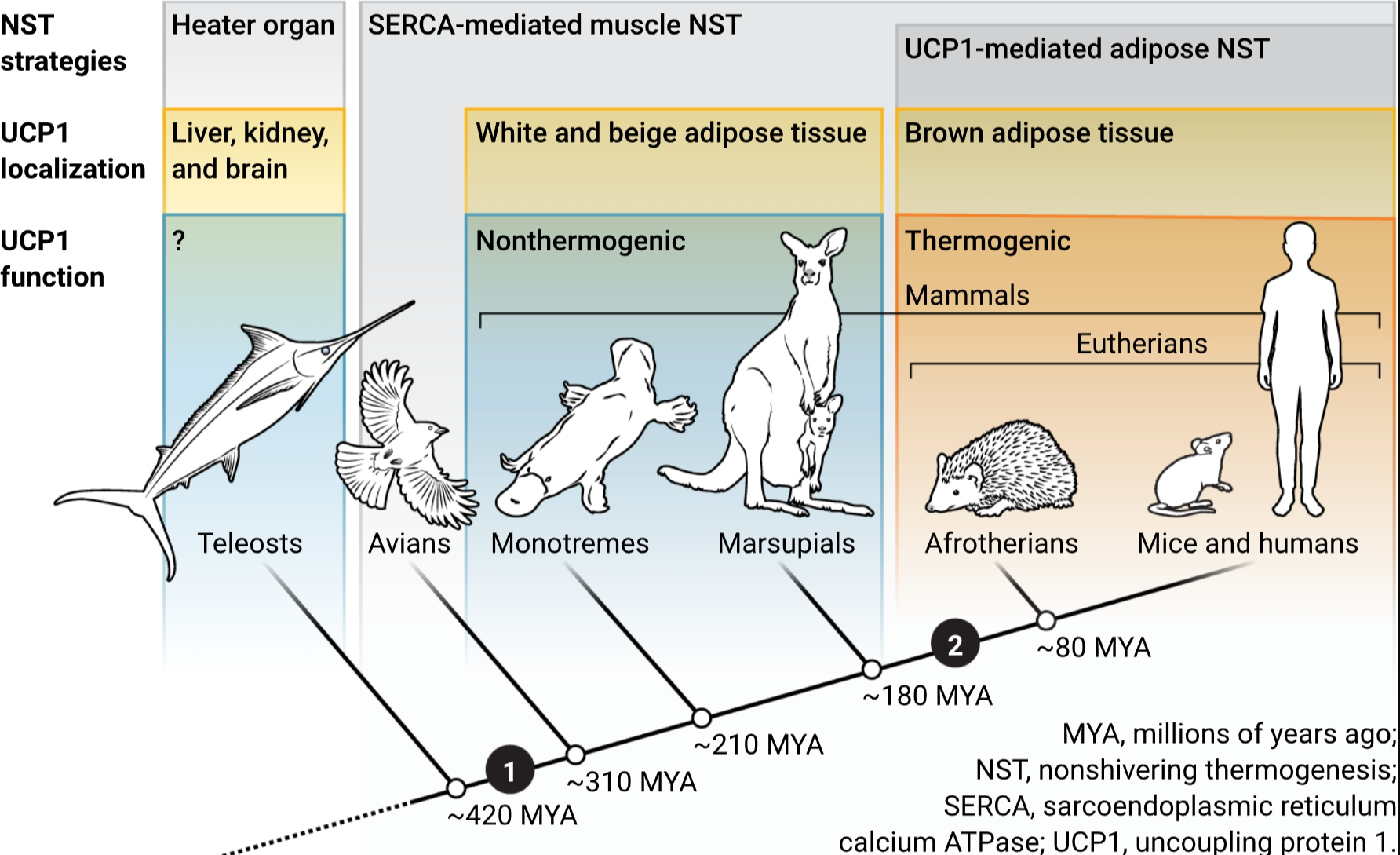
尽管大多数哺乳动物也发生基于SERCA的NST,但这些动物通常使用另一种在BAT中发生的NST途径,并涉及蛋白UCP1。然而,导致哺乳动物内温性进化的一系列事件仍然不清楚。先前的研究发现,较小的刺猬十齿狸(一种系统发育上古老的胎盘哺乳动物,被认为是“原始内温性”因为它只在一天的某些时段是内温性的)在BAT中表达了功能性UCP1直系同源物以驱动NST。相比之下,更古老的哺乳动物如袋鼠(在外部育儿袋中抚养幼崽)和单孔目动物(产卵)似乎要么缺乏BAT,要么其产热能力仍未解决。尽管如此,UCP1是一种古老的蛋白质,存在于外温性硬骨鱼的肝脏、肾脏和大脑中,将其起源至少定位于4.2亿年前。然而,仅在某些哺乳动物中报道了在脂肪组织中的UCP1表达,这引发了关于UCP1何时获得其产热功能以及何时被招募到脂肪组织中以驱动NST的问题。
为了解答这些问题,Keipert等人采用了一种结合比较基因组学与古代蛋白质重建的方法。体外研究表明,小鼠UCP1具有产热功能,而袋鼠UCP1则没有,这表明UCP1仅在袋鼠从真兽类哺乳动物(包含所有胎盘哺乳动物的分支)中分离出来后获得了产热活性。然后,对来自267种哺乳动物的UCP1序列进行比对,使得可以重建一些主要哺乳动物系统发育树节点的预测祖先UCP1序列,包括最后一位哺乳动物共同祖先(在袋鼠和胎盘哺乳动物分化之前)以及最后一位真兽类哺乳动物共同祖先(在袋鼠和真兽类哺乳动物分化之后)。两种祖先形式中,只有真兽类哺乳动物的祖先UCP1蛋白在体外表现出产热能力,进一步支持了UCP1获得产热活性是在袋鼠从真兽类哺乳动物中分离出来之后的观点。
Keipert等人还对袋鼠腹股沟脂肪组织的转录组进行了测序,以更好地理解UCP1表达是如何被调控的。值得注意的是,袋鼠脂肪组织的基因表达特征部分类似于胎盘哺乳动物中的米色脂肪组织(其特征为白色脂肪组织中出现了一些具有BAT特征的表达UCP1的脂肪细胞群落)。因此,这些发现表明,哺乳动物中UCP1介导的NST进化涉及两个步骤,其中脂肪组织首先经历了一个重连过程,将脂肪组织中非产热性UCP1的表达与寒冷应激联系起来,随后在胎盘哺乳动物从袋鼠中分离出来的后期步骤中,UCP1获得了产热功能(见图)。
这些发现提出了一个问题,即UCP1是如何被招募到BAT成为NST的主要驱动因素的。值得注意的是,骨骼肌NST似乎是更古老的形式,先于其在BAT中的出现(6)。此外,尽管在一些哺乳动物中存在UCP1介导的BAT NST,但骨骼肌NST更为广泛,不仅在哺乳动物中,也在鸟类中(6)。因此,SERCA介导的骨骼肌NST可能代表了脊椎动物向内温性迈出的第一步,但这种NST方式在产热效率上不如UCP1介导的NST,并且还会干扰肌肉功能(6)。因此,UCP1驱动的NST的出现可能是一个重要的进化步骤,使得能够在不牺牲肌肉性能的情况下产生更多的热量。由于BAT与骨骼肌有共同的发展谱系(11),一个假设是UCP1最初可能在介导类似肌肉细胞中的NST时发挥了冗余作用,最终导致了一种更高效的产热形式。未来的研究应该解决这一可能性,并尝试澄清UCP1表达是如何从其他组织转移到脂肪组织的。
在过去的15年里,由于BAT和米色脂肪组织作为代谢调节器的角色及其在治疗人类肥胖症中的潜力,它们已经引起了爆炸性的关注。然而,尽管它们在激活NST方面很重要,针对这些组织中发生的通路的人类疗法仍然很少(12)。这个领域可能还太新,无法产生任何有意义的疗法,但对NST的理解也主要限于一个真兽类物种,即小鼠。Keipert等人采用的方法,通过在更广泛的哺乳动物范围内使用比较基因组学,从而可能提供关于NST和内温性新的洞见,为未来的疗法提供信息。
https://blog.sciencenet.cn/blog-41174-1437346.html
上一篇:原子尺度洞察冰表面融化的奥秘
下一篇:氢气增强短跑间隔训练的表现:代谢组学洞察其潜在机制