博文
肠道微生物组中氢气和胆汁酸的代谢
||
人类肠道微生物组指的是一个高度多样化的微生物生态系统,它与宿主之间存在共生关系。分子氢(H2)和二氧化碳(CO2)是在厌氧生态系统中通过发酵代谢产生的。在肠道微生物组中,氢气的产生和氧化耦合到二氧化碳还原成甲烷或乙酸的过程有助于维持其结构。胆汁酸是由肝脏中的肝细胞从胆固醇合成的,并且是宿主代谢的重要调节因子。在本篇综述中,我们讨论了肠道细菌如何在肠道内代谢氢气和胆汁酸,以及这对宿主生理学的影响。最后,我们将焦点放在由放线菌属Eggerthella lenta进行的胆汁酸代谢上。Eggerthella lenta似乎能够在CO2或N2气氛下,而不是在H2气氛下,将羟基团氧化与还原性产乙酸过程相耦合。因此,在低氢气水平下,E. lenta被认为会使用来自胆汁酸羟基团氧化的NADH来将二氧化碳还原为乙酸。
人类肠道微生物组
人体可以被看作是数以万亿计的微观乘客所使用的载体。实际上,与我们身体相关的原核细胞的数量在数量上与我们自己的真核细胞的数量相当[1]。构成“人类微生物组”的整体微生物群落的变化基于许多因素,包括:饮食、环境以及宿主遗传学等[2, 3]。在过去的二十年中,科学家们已经做出了重大努力来更好地理解这个复杂的微生物群落。下一代核酸测序,以及计算和生物信息学分析的进步,已经允许从培养中的分离细菌菌株和通过单细胞分选分离出的菌株进行全基因组测序。从复杂的微生物群落中重建个体基因组,并模拟细菌的代谢潜能,使我们对这些生态系统中的作用有了更深入的了解[4-6]。与这些高通量分析并行的是,通过对16S rRNA基因测序数据库的比较,将细菌菌株分配到操作分类单位(OTUs)中。在人类结肠中发现的主要细菌门类是厚壁菌门和拟杆菌门,分别是革兰氏阳性和革兰氏阴性的专性厌氧菌[4, 5]。此外,还有大量属于变形菌门(革兰氏阴性的兼性厌氧菌)和放线菌门(革兰氏阳性的兼性厌氧菌)的细菌[图1][4, 5]。利用OTU分类具有重要的意义,因为它被用来预测复杂微生物生态系统的代谢潜能。正是基于OTU分配的基础上,观察到尽管微生物成分存在巨大变化,但不同个体之间保持了代谢潜能的一致性[3]。
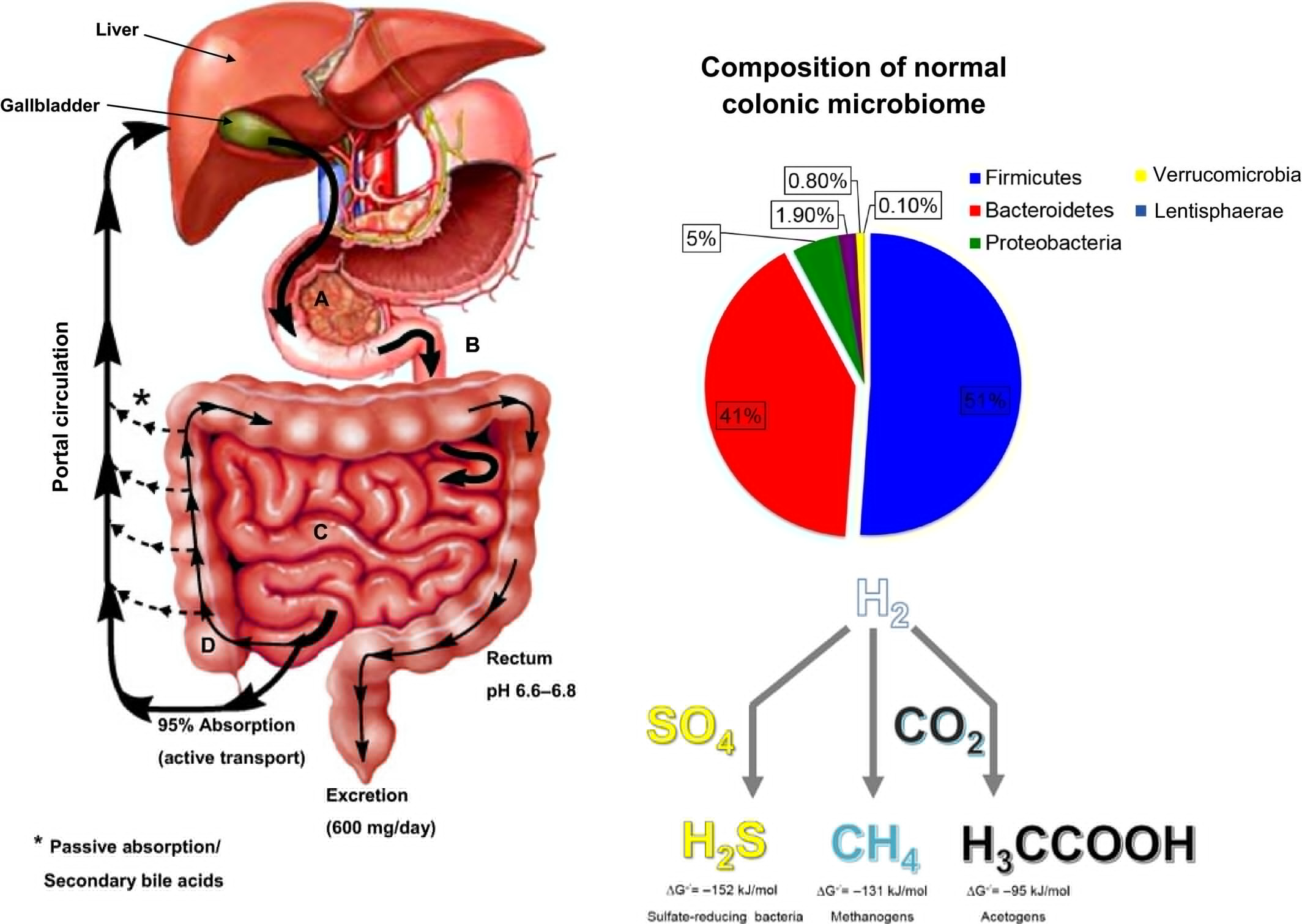
图1 人类结肠中发现的主要细菌门类以及肠道微生物组的气体代谢。A-D分别表示十二指肠(A)、空肠(B)、回肠(C)和结肠(D)。人类结肠中发现的主要细菌门类是厚壁菌门和拟杆菌门,分别是革兰氏阳性和革兰氏阴性的专性厌氧菌。还有大量属于变形菌门和放线菌门的细菌。
肠道微生物组现在被视为一个“虚拟器官”[4]。在这个人类与微生物之间的关联中,大量的关注被放在了大肠的腔内。这个厌氧环境容纳了人体中最高数量(几百克)和浓度(2-5×10^11/g湿重)的微生物。此外,庞大的宿主肠道粘膜层允许与微生物及其代谢产物进行“直接”互动。在我们的微生物组中可能有超过1000种物种,微生物基因的数量是我们自己的100倍以上[7]。“人类肠道微生物组”指的是这个高度多样化的微生物生态系统,在正常的生理条件下与宿主有着共生关系。肠道微生物组在为肠道上皮细胞提供能量来源[8]、防止有害病原体定植[9]以及调节宿主免疫[10]方面发挥着重要作用。
过去,胆汁酸被视为宿主获取营养的单纯洗涤剂,无菌动物中的胆汁酸剖面与常规动物明显不同。近年来,人们普遍接受胆汁酸是营养信号激素[11, 12]。综合起来,我们现在可以将肠道微生物对胆汁酸的代谢描述为肠道微生物组的重要内分泌功能。在这篇综述中,我们将描述这个快速发展领域里的最新进展。特别是,识别编码胆汁酸代谢酶的新基因,以及肠道气体氛围对特定肠道细菌调节胆汁酸生物转化的作用。
大肠中短链脂肪酸的产生
正如共生生态系统中的许多生态位一样,通常存在一个进化上的“开口”,允许大量但其他未被利用的副产品和营养物质被用于能量生产、呼吸或用于其他细胞过程。在大肠中,这种现象最重要的例子是植物来源的复杂碳水化合物,这些碳水化合物在小肠中逃避吸收和代谢。抗性淀粉和复杂碳水化合物通过肠道细菌进行厌氧发酵,形成短链脂肪酸(SCFAs)[13]。人类大肠中产生的三种主要SCFAs包括:乙酸、丙酸和丁酸[14]。SCFAs在肠道腔内的浓度为13-130mm,并迅速被周围的上皮细胞吸收。丁酸被结肠上皮细胞优先作为能源[14],但所有SCFAs都是肠道上皮细胞的重要能源来源,估计占我们每天卡路里摄入量的3-9%[8]。(如果不摄取这类营养成分,不仅大肠细菌没有营养,大肠上皮细胞也没有营养!这一点过去没有考虑过)
丙酸和乙酸都在门静脉循环中检测到[14, 15],但丙酸主要由肝脏代谢,留下乙酸作为到达全身循环的主要SCFA。重要的是要注意,SCFAs的产生差异很大,受到细菌种类、肠道转运时间、pH、氢气分压和复杂碳水化合物底物的可用性的影响[16]。
丁酸和丙酸已被证明对结肠上皮细胞、肠道相关免疫细胞有有益的生理效应,可能影响结直肠肿瘤的生长。SCFAs通过帮助维持粘膜屏障的完整性[17]、调节炎症反应[18]和细胞生长/分化[19],有助于维持结肠上皮细胞的正常生理功能。丁酸和丙酸是细胞组蛋白去乙酰化酶(HDACs)的抑制剂[20]。SCFAs还通过HDAC抑制影响外周调节性T细胞(Treg),导致叉头盒P3(FOXP3)上调,增强Treg群体和抗炎功能,在正常情况下[21]。此外,HDAC抑制剂(HDACi)已被报道增加FOXP3在几个赖氨酸残基上的乙酰化,增强与Il2启动子的结合并抑制IL-2的产生。HDACi通过Treg依赖效应通过抑制炎症显示出治疗炎症性肠病的前景[21]。因此,产生SCFAs的肠道细菌可能在抑制结肠炎症中发挥重要作用。
细菌在胃肠道中对氢气、二氧化碳和硫酸盐的代谢
由于它们是厌氧细菌发酵的副产品,二氧化碳(CO2)和氢气(H2)在结肠中含量丰富。与肠道相关的微生物产生的大部分CO2要么通过肠上皮细胞吸收进入循环,要么被其他微生物迅速利用[22, 23]。另一方面,H2在被其他微生物利用后仍然存在大约60-70%,并通过呼吸或排气排出。人类结肠每天可以产生超过13L的H2[24],而无菌动物研究表明,直到引入含有肠道微生物的粪便浆液前,氢气的产生几乎可以忽略不计。大肠腔内发现的H2量基于许多因素而变化,但主要受到H2产生速率与肠道微生物群成员利用H2的速率的影响[22, 23]。
大肠中微生物对氢气的利用
H2生产者在肠道微生物组中相对丰富。在Firmicutes和Bacteroidetes门类中,氢气的产生很常见,这两个主要的组成成分定居在结肠中(图1)。体外研究表明,Roseburia、Ruminococcus和Eubacterium属的成员产生H2[25]。微生物产生H2的另一种方式是通过微生物氢化酶氧化还原铁氧还蛋白(Fd)和吡啶核苷酸。通过这个过程,厌氧细菌能够清除细胞中的还原等价物并维持细胞内的氧化还原平衡。编码各种氢化酶的基因广泛存在于已知栖息于结肠的细菌中,尤其是在Bacteroidetes门中[25]。 因为H2是许多肠道细菌产生的主要副产品,能够将其作为底物利用的微生物在厌氧肠道生态系统中将具有进化优势。这样一组H2利用者是产甲烷菌,这是一群能够使用H2作为电子供体将CO2、甲醇或乙酸还原为甲烷气体(CH4)的古菌。CH4是完全由微生物衍生的产物,因为它既不是由哺乳动物细胞制造也不被其利用[26, 27]。CO2还原为CH4是由一系列脱氢酶和还原酶进行的,形成电子传递链[28]。CO2首先被还原并作为甲酰基团附着到甲烷呋喃上,然后连接到四氢甲烷卟啉。这个中间体然后经历脱水接着两个还原步骤,然后转移到硫醇辅酶M上并生成膜Na+梯度,最后进行最终还原产生CH4[29]。 从CO2形成甲烷在能量上是有利的,结果的自由能变化(ΔG°′) = -131 kJ·mol−1导致每摩尔CH4形成约产生1 mol ATP[29]。Methanobrevibacter smithii是人类肠道微生物组中发现的数量最多的产甲烷菌,可以在粪便中以高达10^9 CFU·g−1存在[30]。研究表明,产甲烷菌在结肠样本中的发现率从<10^3到超过10^9 CFU·g−1粪便不等[30]。最近,发现了一种使用细菌铁固氮酶从CO2生成甲烷的新途径[31]。来自Rhodopseudomonas palustris的铁-铁(Fe-only)固氮酶被发现同时进行以下还原:CO2 > CH4;N2 > NH3和2H− > H2。仅Fe固氮酶存在于多样的微生物中,可能通过提供CH4给厌氧的CH4代谢古菌和好氧的甲烷营养细菌作为碳和能源来源,在调节微生物群落结构中发挥重要作用[31]。 在结肠中,产甲烷菌并不是唯一能够利用H2的微生物群体。硫酸盐还原菌能够将硫酸盐作为它们的末端电子受体,形成硫化氢气体(H2S或HS−)。这个生化途径能够利用来自多种电子供体的还原当量,包括;乳酸、丙酮酸、乙醇、甲酸、SCFAs和氨基酸。与产甲烷作用类似,硫酸盐还原为硫化氢气体是通过电子传递链进行的[32]。硫酸盐和ATP首先通过ATP硫酸化酶链接形成腺苷-5′-磷酸硫酸盐,然后通过APS还原酶还原形成AMP和亚硫酸盐( )[33, 34]。亚硫酸盐然后经历三个连续的还原步骤导致H2S。这个过程在生理条件下比产甲烷作用更有利,导致ΔG°′ = -152.2 kJ·mol−1,并且整体ATP生成估计为每摩尔H2S形成1 mol ATP[29]。
硫酸盐还原菌与氢气的利用
具有最高活性和对H2亲和力的硫酸盐还原菌被发现在Desulfovibrio属内[33],其水平为10^4–10^11 CFU·g−1湿重。除了使用多种电子供体外,硫酸盐可以来自内源性和外源性来源,包括分泌的黏蛋白、未吸收的蛋白质、含硫氨基酸和牛磺酸(亚硫酸盐的来源)[35]。由于肠道微生物组中的硫酸盐还原菌和产甲烷菌都竞争同一池H2,决定因素是用于硫化氢生产的硫酸盐的可用性。然而,从能量上讲,硫化氢生成是一个比产甲烷更有利的反应。虽然一种细菌的存在并不排斥另一种,但人类粪便样本的筛选测试表明,患者通常要么携带产甲烷菌,要么携带硫酸盐还原菌[35],但在H2丰富的情况下,有报告显示两者都存在并且活跃。在小鼠模型中比较产甲烷作用和H2S产生的体内研究证实,当产甲烷菌和H2S生产者都存在且可用硫酸盐丰富时,H2S生产占主导地位,活体产甲烷菌低于检测限。通过减少可用硫酸盐的量,已经显示产甲烷作用能够恢复,这表明H2S生产和产甲烷之间存在直接的反向联系,并证实硫酸盐还原菌在利用H2方面胜过产甲烷菌[35, 36]。
肠道微生物发酵产生的H2的第三种利用机制是通过乙酸生成,这是细菌使用分子H2作为还原当量来源将CO2还原为乙酸的途径。乙酸生成的研究源于对厌氧土壤细菌气体代谢的研究,因为这种“新型葡萄糖发酵”的首次报告是在从粪便中分离出的Clostridium thermoaceticum菌株中发现的[37]。随后由H. Wood和L. Ljungdahl进行的研究阐明了负责从CO2自养合成乙酸的酶途径,称为Wood-Ljungdahl途径(WLP)[38]。WLP是一个多步骤的酶途径,利用八个还原当量和两个CO2形成乙酸(图2.)。整体反应产生的能量甚至少于产甲烷或硫化作用,ΔG°′ = -95 kJ·mol−1 [29]。在乙酰辅酶A到乙酸的最终底物水平磷酸化过程中,ATP从ADP生成。然而,最近有人建议,乙酸生成可能不是一条能量生产过程,而是一种再生氧化的吡啶核苷酸和Fd以维持细胞内氧化还原平衡的手段[39]。许多乙酸生成菌被发现在电子受体稀缺的厌氧环境中,乙酸生成菌能够通过WLP使用CO2作为电子受体,使它们具有竞争优势。此外,大多数乙酸生成菌能够使用许多不同的电子受体和电子供体,使它们擅长适应其环境的能源和氧化还原需求。

图2 二氧化碳还原为乙酸的WLP概述,Eggerthella lenta菌株中参与二氧化碳还原和膜相关能量保存途径的关键操纵子编码基因。
除了拥有WLP的基因外,大多数乙酸生成菌都有膜结合氢化酶,能够在电子传递链中相互转换其还原当量。一个最好的例子是最初在与氮化酶相关的电子转运蛋白中表征的Rhodobacter固氮复合体(RNF)[40]。在许多乙酸生成菌株中发现的RNF复合体,将Fd的氧化与吡啶核苷酸的还原耦合,产生Na+或H+膜梯度(图2.)。这个过程是可逆的,可以帮助在各种电子载体之间循环还原当量。由RNF复合体产生的膜梯度然后可以用来生成额外的ATP,将乙酸生成与细胞或膜转运底物的ATP生成过程耦合。然而,并非所有乙酸生成菌都拥有RNF复合体,尽管那些没有的通常编码一些能够转换还原当量同时产生膜离子梯度的膜结合能量保存氢化酶系统[41]。在哺乳动物肠道微生物组中发现的最大一组特征化的乙酸生成菌存在于厚壁菌门。然而,与产甲烷作用和硫化作用不同,乙酸生成表型也在其他门中被识别,使乙酸生成菌成为更多样的H2利用者[42]。研究表明,在人类中,肠道微生物通过葡萄糖发酵过程中的乙酸生成贡献了高达总乙酸产量三分之一的份额[42]。由于乙酸生成菌是一组异质性的细菌,传统的16S筛查方法无效,但一些研究已经在粪便样本中筛查了乙酸生成WLP途径的基因,并发现它们以10^3–10^7基因·g−1粪便的水平存在。体内数据表明,乙酸生成菌是肠道微生物组中最丰富的潜在H2利用者[42]。因此,这些观察结果表明,在既不活跃产甲烷也不产生H2S的人类中,结肠中乙酸生成利用H2可能是CO2还原的主要途径。
宿主合成胆汁酸 在正常的生理条件下,大肠中复杂碳水化合物和氨基酸的微生物发酵在数量上是最普遍的反应。然而,其他外源性和内源性分子也进入大肠腔,成为微生物生物转化的底物。这样的一组分子是胆汁酸,由肝细胞从肝脏中的胆固醇合成。人类中产生的两种主要胆汁酸是胆酸(3α, 7α, 12α-三羟基-5β-cholan-24-oic酸;CA)和鹅去氧胆酸(3α, 7α-二羟基-5β-cholen-24-oic酸,CDCA)。在分泌到胆汁之前,胆汁酸与牛磺酸或甘氨酸结合,导致它们具有典型的两亲性质。胆汁盐通过胆汁盐出口泵主动分泌穿过肝细胞的毛细管膜[43-45],随后在胆囊中储存和浓缩。一旦进食,十二指肠中的肠内分泌细胞分泌胆囊收缩素,刺激胆囊收缩和胰腺酶释放,进入肠道促进营养物质的消化和吸收。一旦胆汁盐到达回肠末端,它们通过钠依赖性胆汁酸转运体主动转运穿过回肠上皮细胞的顶端膜[45]。然后它们通过OSTα/OSTβ转运体运输穿过上皮细胞的基底外侧膜[45]并进入门静脉循环。当它们到达肝脏时,胆汁盐通过主要是Na+牛磺胆酸共转运多肽主动转运穿过肝细胞的窦状膜高效摄取并返回胆汁盐池[45],从而完成称为肠肝循环的过程。
胆汁盐的肠肝循环效率约为95%,但允许400-800 mg·day−1的胆汁盐逃逸到大肠,在那里它们被众多微生物生物转化(图3)。值得注意的是,初级胆汁酸的合成在脊椎动物之间有所不同[48]。这在使用动物作为人类生理和疾病模型时尤其重要。在啮齿动物中,CDCA主要转化为6-羟基化衍生物,β-鼠李糖酸(MCA),以及少量的α-MCA和熊去氧胆酸(UDCA)[48]。牛磺-β-MCA是一种有效的法尼醇X受体(FXR)拮抗剂[49],但这种胆汁酸在人类中不存在。相比之下,人类肝脏不表达6α/β羟化酶或胆汁酸7α-羟化酶,这些酶允许次级胆汁酸在人类的胆汁酸池中积累[46]。最近,一种野生型小鼠通过遗传修饰消除了6β-羟化酶基因,使这些动物主要合成CA和CDCA的牛磺酸结合物[50]。
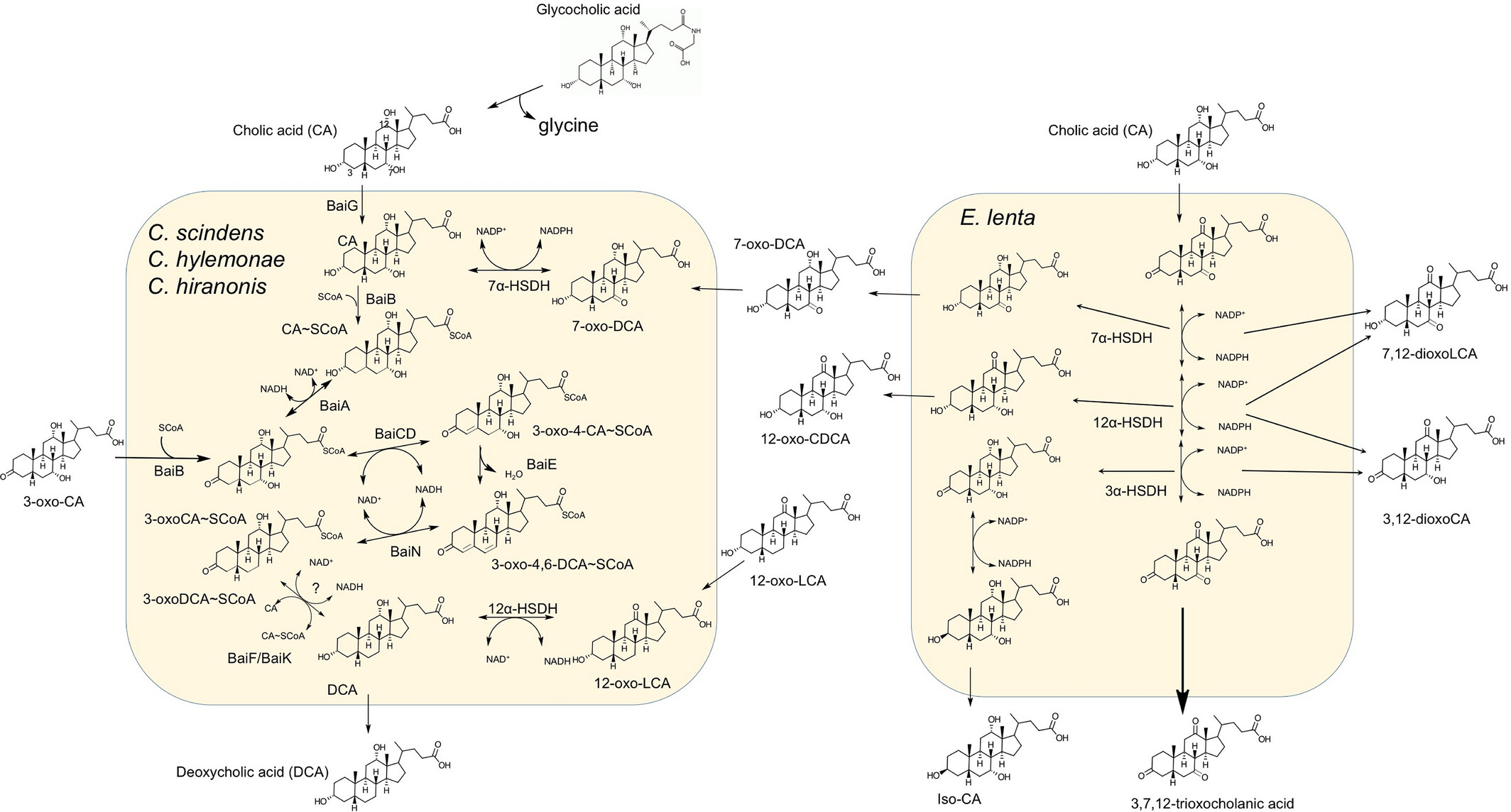
图3 胆汁酸7α-脱羟基肠道细菌和Eggerthella lenta进行的胆汁酸生物转化。左侧显示了这些细菌中发现的胆汁酸7α-脱羟基途径和胆汁酸HSDH。右侧显示了由E. lenta执行的各种胆汁酸生物转化。缩写:baiG,初级胆汁酸转运蛋白;baiB、baiF和baiH,胆汁酸辅酶A连接酶;baiA,3α-羟基类固醇脱氢酶;baiCD,7α-羟基-3-氧代-Δ4-胆烯酸氧化还原酶;baiF,胆汁酸辅酶A转移酶/水解酶;baiE,胆汁酸7α-脱水酶;BaiN,3-氧代-4,6-胆汁酸氧化还原酶;3α, 7α, 12α HSDH,分别是3α, 7α, 12α- HSDH。
肠道细菌对胆汁酸的生物转化
在肠肝循环期间,胆汁盐经历的第一个反应是胆汁盐水解酶(BSH)对其牛磺酸或甘氨酸结合物的去结合[46]。通常,人类中甘氨酸:牛磺酸结合的比例为3:1;然而,这受到饮食的影响。已经表明,采用“西方饮食”的个体主要是牛磺酸结合,而采用素食饮食的个体转向甘氨酸结合[51]。BSH活性广泛存在于大肠和小肠中的微生物中。具有BSH活性的革兰氏阳性共生菌包括:Clostridium、Enterococcus、Bifidobacterium和Lactobacillus [46]。BSH活性在共生革兰氏阴性菌中较少见,但包括拟杆菌属的成员[46]。肠道相关古菌M. smithii和Methanosphera stadmanae也被发现具有BSH活性[52]。BSH酶特异性水解第24个碳上的N-酰基键,该键负责将氨基酸结合物连接到胆汁酸上(图3)。
一旦胆汁酸从其结合物中释放出来,它们就成为众多微生物生物转化的底物。胆汁酸7α-脱羟基是一种过程,通过该过程,Clostridium属内的一小群肠道细菌能够从CA、CDCA和UDCA中去除7α或7β-羟基,分别形成次级胆汁酸,脱氧胆酸(3α, 12α-二羟基-5β-cholen-24-oic酸;DCA)和石胆酸(3α-单羟基-5β-cholen-24-oic酸;LCA)[46, 47]。测量粪便胆汁酸组成的研究表明,次级胆汁酸构成了主要成分,这表明7α-脱羟基途径是肠道微生物对初级胆汁酸进行的最定量重要的生物转化,仅次于BSH。在宏基因组分析中,Clostridium scindens,一种特征明确的7α-脱羟基物种,已被证明是人类“核心肠道微生物组”的成员,因为它在人类粪便样本中的高流行率[46, 47]。DCA和较小程度上的LCA都被动扩散穿过上皮屏障并进入门静脉循环,在那里它们被肝脏摄取并进入人类的循环胆汁酸池[46]。
Norman和Sjövall能够区分宿主制造的初级胆汁酸和共生肠道微生物制造的次级胆汁酸[53]。在确定初级胆汁酸向次级胆汁酸的微生物转化途径的最早工作中,提出了一个两步过程,有一个中间体,cholen-6-oic酸[54]。然而,Hylemon等人的后续工作[55]显示了C. scindens细胞提取物对[24-14C]-CA的代谢形成了许多胆汁酸代谢物。代谢物的鉴定和化学合成表明胆汁酸7α-脱羟基是一个复杂的生化途径[45]。编码此途径中酶的许多基因已被识别和特征化[47]。
肠道微生物群的成员拥有编码多种依赖于吡啶核苷酸的胆汁酸羟基类固醇脱氢酶(HSDH)的基因。HSDH广泛分布在肠道微生物群的各种成员中[47]。已知肠道微生物能够氧化和还原胆汁酸上3-、7-和12-碳的羟基(图3)。胆汁酸羟基的异构化(α↔β)需要两种位置特异性的胆汁酸α-和β- HSDH,它们生成稳定的氧代胆汁酸中间体,即7α-羟基⟷7-氧代⟷7β-羟基。细菌胆汁酸HSDH在其pH最适值、吡啶核苷酸特异性(NAD(H)、NADP(H)或两者)、亚基分子量和基因调控方面有所不同[47]。氨基酸序列分析表明,肠道微生物群中的大多数细菌HSDH属于短链醇/多醇脱氢酶家族[56-58]。在结肠腔内栖息的众多属中已检测并特征化了胆汁酸HSDH,包括;拟杆菌属、梭菌属、大肠杆菌、Eggerthella、真杆菌属、消化链球菌属和瘤胃球菌属[47, 56-58]。
已显示粪便胆汁酸、门静脉循环和人血清中存在具有氧化羟基的胆汁酸(氧代胆汁酸)[59, 60]。有趣的是,二羟基胆汁酸(DCA、CDCA)上的羟基比三羟基胆汁酸(CA)对微生物氧化还原更敏感[61]。异构化的程度和氧代胆汁酸的积累似乎受到局部细胞环境的氧化/还原潜力的影响。例如,在与粘膜边缘更近的细菌中形成氧代胆汁酸可能更有利,那里的氧化还原潜力高于肠腔内部。
胆汁酸代谢对微生物和宿主生理学的影响
为了理解微生物对胆汁酸的生物转化对宿主和微生物生理学的影响,首先讨论胆汁酸对正常宿主生理学的影响是很重要的。在千年之交,人们发现内源性胆汁酸是孤儿核受体FXR的配体[62, 63]。在正常的生理条件下,初级胆汁酸(CA和CDCA)激活肠上皮细胞中的FXR,导致成纤维细胞生长因子15/19(FGF15/19)的表达[64, 65]。然后,FGF15/19作用于肝细胞中的肝FGFR4受体,导致胆汁酸合成的限速酶CYP7A1下调[64, 65]。通过这条途径和SHP的诱导,胆汁酸能够有效地抑制它们自己的合成。
在发现胆汁酸激活FXR后不久,人们发现跨膜Takeda G蛋白受体5(TGR-5),一种在人类细胞中广泛分布的受体,被胆汁酸激活[66]。TGR-5是一种Gαs受体,导致细胞内c-AMP的增加。据报道,TGR-5的激活可以导致特定肠细胞释放胰高血糖素样肽1,这在葡萄糖稳态以及食欲抑制中起作用[67]。随后的工作还表明,特定的胆汁酸是孕烷激活受体(PXR)[68]、维生素D受体(VDR)[69]、鞘氨醇-1磷酸受体2[70]和一些毒蕈碱受体(M2,3)[71]的配体。
虽然初级胆汁酸已被证明是许多不同受体的激动剂,但它们的激活效能基于其结构而有所不同。在这方面,次级胆汁酸对于特定的核受体和G蛋白偶联受体来说,具有比初级胆汁酸更强的激动剂性质。就FXR而言,CDCA似乎是最有效的激活剂,但LCA和DCA比CA更有效[62, 63]。同样,PXR似乎最有效地被LCA激活[68],VDR由3-氧代-LCA激活[69],而TGR-5由DCA和LCA激活[67]。总的来说,这表明胆汁酸不仅可以调节肠道微生物组的结构,而且微生物也可以通过创造次级胆汁酸“激素”来调节宿主生理学。
CDCA上7α-羟基的异构化产生了更具亲水性因此毒性更低的代谢物UDCA[72]。此外,特定肠道细菌对胆汁酸3α-羟基的异构化也增加了亲水性并降低了对肠道细菌的毒性[57]。最近的研究表明,7-氧代-LCA作为人类肝脏11β-HSDH-1的竞争性抑制剂[73]。11β-HSDH-1负责将7-氧代-LCA转化回宿主中的CDCA;然而,它也催化皮质醇从可的松的活化[74]。当7-氧代-LCA浓度高时,它作为一种竞争性抑制剂阻止活性皮质醇的产生。次级胆汁酸7-氧代-LCA和UDCA都比CDCA对FXR的激动作用弱[62, 63]。
Eggerthella lenta的胆汁酸氧化
20世纪70年代,有报告称鉴定为Eggerthella lenta(以前称为Eubacterium lentum)的粪便分离株在氧化胆汁酸羟基方面的能力各不相同。这导致两个独立实验室提出了基于观察到的羟基类固醇脱氢酶活性的数量和类型的E. lenta分离株分类方案。在光谱的一端,E. lenta菌株缺乏可观察到的胆汁酸HSDH活性,而在另一端,观察到菌株表达3α、7α和12α–HSDH以及胆汁酸异构化酶3α和3β-HSDH。最近报道了E. lenta菌株中编码异型胆汁酸途径3α-HSDH和3β-HSDH的基因[57, 58]。
我们最近报道了E. lenta DSM 2243和来自宏基因组序列Eggerthella CAG:298中的NADPH依赖性12α–HSDH的编码基因[58]。尽管在其他肠道细菌如C. scindens [56]、大肠杆菌和脆弱拟杆菌[47]中已报道,但E. lenta中编码7α–HSDH的基因仍然未知。在严格的厌氧条件(氮气环境)下,我们观察到初级和次级胆汁酸完全转化为二氧代和三氧代衍生物,以及少量3β-异构体的形成。有趣的是,当气体环境被氢气替代时,胆汁酸氧化被显著抑制[75]。
我们假设E. lenta将胆汁酸氧化与还原性乙酰生成偶联。支持这一假设的是,我们在E. lenta DSM 2243和菌株C592中观察到完整的Rnf复合体(rnfBAEGDC)(图2)。Rnf复合体是一种质子转运铁氧还蛋白:NAD+氧化还原酶,它在自养条件下通过H+转运ATPase建立质子动力并保存能量,使用H2作为电子供体和CO2作为电子受体[76]。我们还观察到几种氢化酶,包括NiFe组4e能量保守氢化酶和NiFe组1a[25]。乙酰生成菌通常通过FeFe氢化酶从H2分流电子,目前尚不清楚NiFe氢化酶是否可以参与电子分流。我们在E. lenta DSM 2243的基因组中观察到Wood-Ljundhal途径的甲基分支和羰基分支中的基因。乙酰生成菌需要乙酰辅酶A合成酶/一氧化碳脱氢酶,这些基因位于E. lenta DSM 2243的基因簇(Elen_3026–3030)中[75]。我们还观察到,iso-CDCA对C. scindens进行的胆汁酸7α-去羟基化具有高度抵抗力,因为这种细菌没有3β-HSDH。此外,氧代胆汁酸也抵抗胆汁酸7α-去羟基化[75]。
结论和未来方向
为了在E. lenta中建立还原性乙酰生成或识别由H2抑制胆汁酸氧化的替代机制,仍有许多工作要做。开发定义的生长培养基和遗传系统以操纵Eggerthella的基因组将有助于对该重要类固醇代谢成员的生理学进行详细的机制研究。肠道气体组成对胆汁酸代谢的作用尚未在体内探索。用产生氢气和胆汁酸代谢菌株,包括E. lenta,定殖无菌动物,并结合可食用电子气体传感器,可能提供关于H2分压对E. lenta胆汁酸代谢作用的详细了解。E. lenta沿径向(粘膜到腔内)的空间时间分布,以及胆汁酸氧化相对于此径向轴上氧气梯度的性质是另一个重要方面,就像是否存在纵向上的显著变化一样(图4)

图4肠道中分子氢对胆汁酸代谢的调节。在高H2水平下,胆汁酸7α-去羟基化的肠道细菌主要产生次级胆汁酸,而肠道微生物产生的异型和氧代胆汁酸较少。相反,在低H2水平下,Eggerthella lenta形成更多的异型和氧代胆汁酸,减少胆汁酸7α-去羟基化,并改变结肠中胆汁酸池的疏水:亲水平衡。
肠道内氢气是否参与胆汁酸的代谢,在这篇文章里仍然是假说,没有真正的研究证据。
结肠气体组成和浓度可能是调节粪便中胆汁酸疏水-亲水平衡的重要因素。在这方面,初级胆汁酸向次级胆汁酸的转化增加了结肠胆汁酸池的疏水性。相反,羟基的氧化和羟基的异构化,特别是在碳3和7上,显著增加了胆汁酸分子的亲水性。结肠气体组成可能在调节这一生理过程中发挥作用。这对调节肠道微生物组的结构具有重要意义,因为疏水性胆汁酸对细菌的毒性比亲水性胆汁酸更大。此外,最近有报道称,胆汁酸7α-去羟基化细菌分泌色氨酸衍生的抗生素,这些抗生素被疏水性胆汁酸增强,但不被亲水性胆汁酸增强。未来的研究应该旨在揭示胆汁酸、肠道细菌分泌的抗菌化合物以及结肠生态系统中气体组成之间复杂的相互作用。
https://blog.sciencenet.cn/blog-41174-1436257.html
上一篇:新型聪明抗生素不破坏肠道菌群【自然】
下一篇:微滴加速化学分解过程《科学》