博文
在蛋白质变坏前移除它,能否改变致命朊病毒疾病的进程?
||
在蛋白质变坏前移除它,能否改变致命朊病毒疾病的进程?

本文作者Meredith Wadman
Meredith Wadman's beat includes biology research, policy, and sexual harassment .
我的朋友查理·克拉克(Charlie Clark)从2023年9月开始抱怨他的眼镜有问题。去光学店调整后仍未解决问题;他说,眼镜仍然“未对准”。同月,他几十年的失眠问题变成了折磨。然而,即便年届七旬,作为弗吉尼亚州阿灵顿的一名顽强的记者和著名的当地历史学家,查理依然活跃。他巧妙地在阿灵顿乡村俱乐部的一次晚宴观众面前采访了慈善家大卫·鲁宾斯坦(David Rubenstein);他参加芒特弗农图书馆晚会穿上燕尾服;并且每周接着为《福尔斯教堂新闻-压力》(Falls Church News-Press)撰写他的专栏《阿灵顿的男人》。
9月份,“生活是美好、快乐和丰富的,”他的妻子艾伦·克拉克(Ellen Clark)回忆说。(艾伦和她成年的女儿们同意在本文中讲述查理的故事。)
10月初,查理突然记不起《60分钟》是哪一天播出的了,尽管他看了40年的每个星期天晚上的电视节目。他对空间位置的感觉变得扭曲:外出散步时,他惊慌地抓住艾伦,以为一辆经过的汽车正朝着他们所在的人行道驶来。
10月22日,查理因日益增长的混乱和偏执被送往弗吉尼亚医院中心。几天内,他出现了复视和左侧震颤,很快变成了僵硬的瘫痪。在震耳欲聋的MRI机器中,他以为医院被轰炸了,并哭喊:“我们必须救救婴儿!
他在11月15日去世,经历了巨大的痛苦。但直到最后,查理展现了他标志性的慷慨精神。“祝贺你解开了这个谜团,”他在去世前12天对告知他患有克雅二氏病(Creutzfeldt-Jakob disease, CJD)的医生说。
CJD是少数几种致命疾病中最显著的一种,这些疾病是由脑中功能不确定且含量丰富的蛋白质——朊蛋白错误折叠成具有广泛传播性的感染形式时引起的。这些异常蛋白将正常朊蛋白转化为它们的恶性形状,就像梯子上的横档一样,加入到不断增长的、绳状的聚集体中,这些聚集体摧毁神经元,有效地在大脑中咬出洞来。(朊蛋白疾病官方称为“可传播性海绵状脑病”,因其大脑损伤呈现出“海绵状”的瑞士奶酪图案而得名。)
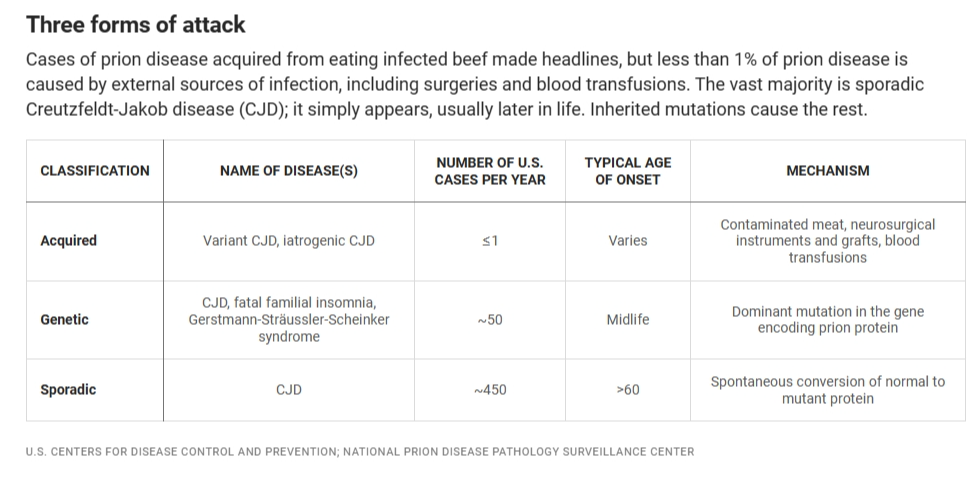
朊蛋白疾病很罕见或极其罕见。每年每100万人中大约有一到两起新病例,大多数发生在60岁以上的人群中。在美国,这意味着每年大约有500例诊断出的病例,其中绝大多数是CJD(见下表)。其他动物也有它们的朊蛋白疾病:羊的痒病和鹿及其他鹿科动物的慢性消耗性疾病,后者已在美国32个州和加拿大5个省报告过。最著名的人类形式的朊蛋白疾病,称为变异型CJD,通过食用患有类似疾病的牛的牛肉而获得,曾在1990年代末和2000年代初在英国引发了一次疫情高峰。由于畜群监测、扑杀和改变牛只饲养实践,该病此后已经消退。
从受污染的肉类、输血、神经外科器械和移植物获得的病例现在占所有朊蛋白疾病的不到1%。10%到15%的病例源于遗传基因突变。但是,大多数是散发性的,可能是由正常蛋白在细胞内制造后自发突变、化学变化或两者共同作用导致的突然错误折叠。由此产生的疾病在临床上可能看起来不同,因为朊蛋白虽然都是相同蛋白的不同版本,但可以采用独特的形状,具有不同的生化特性,倾向于首先攻击不同的大脑区域。但所有的结果都是错误折叠蛋白的传播、大脑破坏和死亡。
三种攻击形式
从食用受感染的牛肉获得的朊蛋白疾病病例曾成为头条新闻,但不到1%的朊蛋白疾病是由外部感染源引起的,包括手术和输血。绝大多数是散发性克雅二氏病(sporadic Creutzfeldt-Jakob disease, sCJD);它通常是在晚年突然出现的。遗传突变引起了其余的病例。
分类 疾病名称 美国每年发病数 典型发病年龄 发病机理
自1982年加州大学旧金山分校神经学家斯坦利·普鲁西纳(Stanley Prusiner)确认传染性朊粒为神经退行性疾病的病因以来,对于治疗方法的探索一直未能取得显著进展。但1月4日,一个新时代开始了。在克利夫兰大学医院医疗中心,首位潜在参与者接受了首项针对朊粒疾病的随机、安慰剂对照试验的筛查,这是十多年来首次针对此类疾病的试验。
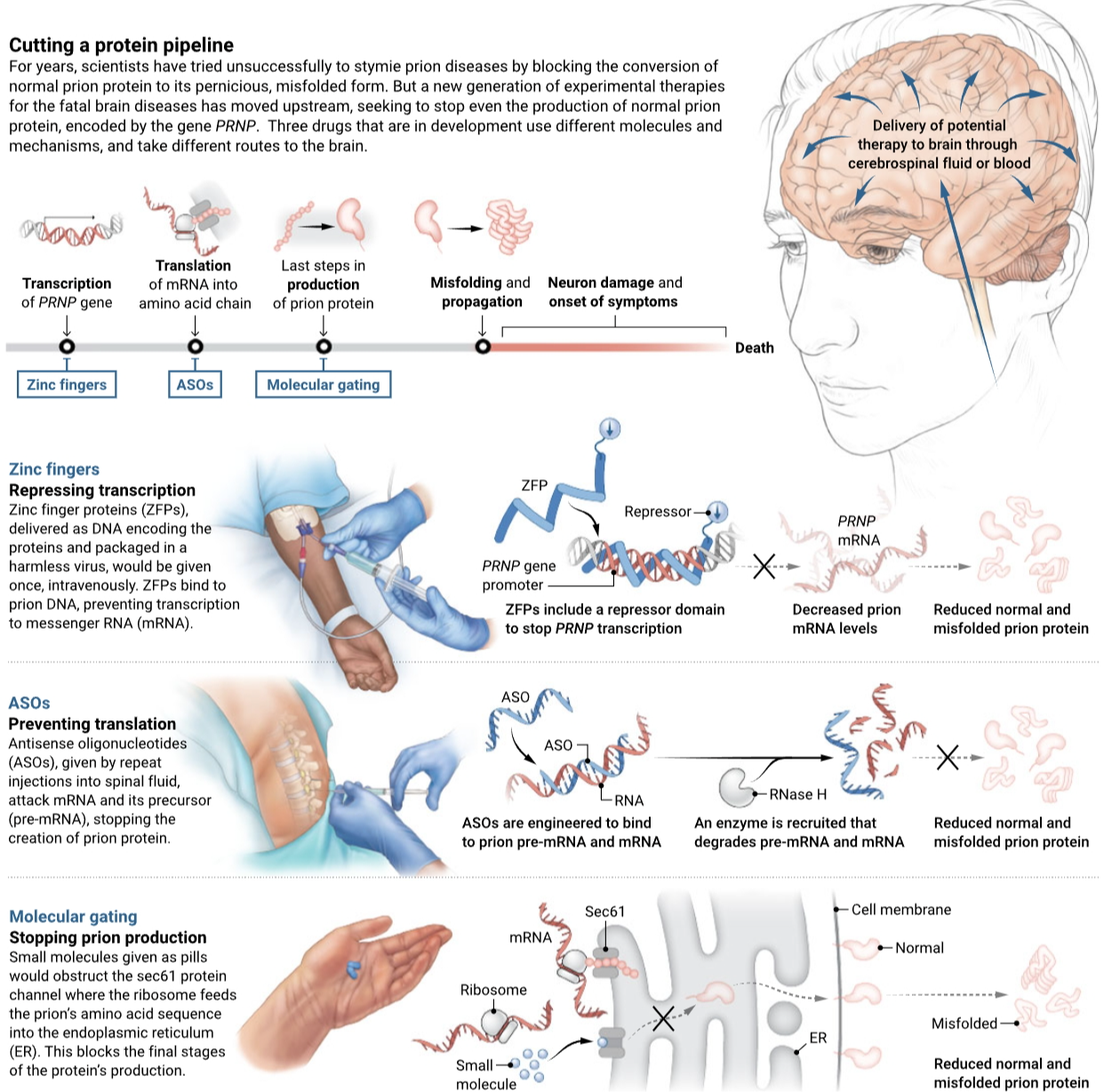
此次试验将采用一种已经在其他神经退行性疾病中测试过、但成果参半的策略:使用一种称为反义寡核苷酸(ASO)的合成DNA片段,通过向脊髓周围的液体中注射,使其能够到达大脑,并破坏对致病蛋白产生至关重要的信使RNA(mRNA)。新试验中的ASO由艾奥尼斯制药公司(Ionis Pharmaceuticals)制造,名为ION717,其目标是编码正常朊粒蛋白的mRNA,没有这种mRNA,朊粒蛋白就无法发生错误折叠。
另外两家公司旨在通过不同的方法移除正常朊蛋白。Sangamo Therapeutics正在开发锌指蛋白(ZFPs),这些蛋白定制用于与患者DNA结合并关闭朊蛋白基因PRNP的表达。这些将作为编码ZFPs的DNA,包装在无害的病毒中,并通过一次性静脉注射给药。上周,该公司报告了将ZFPs送达非人类灵长类动物大脑的有希望的结果,并且希望明年申请许可在英国启动人体试验。
与此同时,Gate Bioscience正在开发一种口服药物,该药物将阻止大脑细胞中朊蛋白的产生。如果一切顺利,该公司的小分子药物距离临床应用还有3到5年的时间,首席执行官Jordi Mata-Fink如是说(见下方图)。
还有其他团体正在寻求开发小分子或抗体,这些药物在过程的后期起作用,防止朊蛋白错误折叠或限制恶性形式的伤害。但过去的尝试令人失望,而三家领先的治疗竞赛公司认为,首要且必要的要求是在朊蛋白产生之前就将其消除。“这是三种不同的方法,针对相同的治疗假设:消除朊蛋白将在减缓、停止,甚至可能是逆转疾病方面具有重要意义,”Mata-Fink说。“这感觉像是潜在地非常、非常、非常大的变革的前夕。”
“我在这个领域已经17年了。这是我第一次有治疗试验可以提供给患者……在家庭面前很难不显得兴奋,”Brian Appleby说,他是一位神经精神科医生,负责指导凯斯西储大学国家朊蛋白病病理监测中心,并且是Ionis试验克利夫兰站点的首席研究员。
如果ION717有效,其回报可能不仅限于朊蛋白疾病。在过去20年中变得清晰的是,异常蛋白质以类似朊蛋白的方式在阿尔茨海默病、帕金森病以及其他破坏神经元的疾病中传播。“机制是相似的,”波士顿大学医学中心的神经科学家David Harris说,他正在努力识别小分子以阻断朊蛋白的错误折叠。“因此,有理由认为为朊蛋白疾病开发的疗法可能对其他神经退行性疾病也有效。”
Ionis试验的启动,可以说更多归功于两个人:Sonia Vallabh和Eric Minikel,这对夫妻团队在Broad研究所工作,他们在朊蛋白研究社区中成为了超级明星。
2010年冬天,Vallabh是哈佛法学院一名25岁的学生,当时她的母亲Kamni Vallabh,一位热情好客、富有艺术天分的女性,经常为Sonia和她的表亲们举办吃薄饼比赛,开始出现双视和迅速体重减轻的症状。到了六月,经过几个月令人担忧的认知能力下降,她依靠生命支持系统维持。到了十二月,一个不太理想的诊断测试——当时唯一可用的测试——暗示了CJD,之后,生命支持被移除。
Kamni去世十个月后,她的女儿,那时已经是法学院毕业生并在咨询行业工作,收到了一个令人震惊的修订诊断:Kamni死于致命的家族性失眠症(FFI),一种通常在中年发作的极其罕见的朊蛋白疾病。FFI是由朊蛋白基因的显性突变引起的,这意味着Sonia有50%的几率继承了它。如果是这样,她肯定会随着时间发展这种疾病。她接受了检测。结果是阳性。
在一个现在广为流传的故事中,Vallabh和Minikel,一位交通顾问,改变了他们的生活。他们离开了工作岗位,在哈佛获得了生物医学科学的博士学位。他们在Broad研究所启动了一个共享实验室。他们开始自称为“患者-科学家”。Minikel将朊蛋白疾病称为“我们的疾病”。
两位科学家在一个实验室里。

Sonia Vallabh(右)和Eric Minikel在得知Vallabh携带一种使她最终肯定会发展成该疾病的突变后,改变了职业去研究朊蛋白疾病。MONICA JORGE/THE NEW YORK TIMES/REDUX
即使还是初出茅庐的博士生,他们也在研究下点燃了一把火。“Sonia和Eric为这个领域带来了独特的紧迫感和治疗焦点,”Sangamo的基因调控高级主管Bryan Zeitler说。
朊蛋白科学家Byron Caughey在国家过敏症和传染病研究所的落基山实验室工作,他的实验室最近开发了一种用于脊髓液中错误折叠的朊蛋白的变革性诊断测试,他接纳了他们进行培训。Vallabh回忆说:“那时,我从未拿过移液管。”
Ionis的神经学研究高级副总裁Holly Kordasiewicz也印象深刻。当这对夫妇在2014年访问她在加利福尼亚州卡尔斯巴德的公司总部时,急切地提出建议,Ionis已经深入开发针对神经退行性疾病的ASOs;甚至在十年前就为急性朊蛋白疾病开发了小鼠ASOs。手持幻灯片,Vallabh和Minikel直言不讳地告诉Kordasiewicz,公司也应该将注意力转向彻底预防朊蛋白疾病。他们争辩说,这在突变携带者中是完全可能的。
他们的幻灯片展示了一个案例,即移除正常朊蛋白不太可能有害。健康蛋白锚定在整个大脑的神经元和胶质细胞膜上,尽管其最佳验证的作用是在维持外周神经的髓鞘化。它也可能参与神经发育、突触的形成和正常功能,以及保护神经元免受细胞压力。但是,被设计为缺乏两拷贝朊蛋白基因的牛、山羊和小鼠一直很健康,并且繁殖得很好。没有它,当小鼠和山羊的大脑注射传染性朊蛋白时,它们被证明是不易感染的;实验室检查的牛脑组织也是如此。
Vallabh和Minikel甚至向Kordasiewicz展示了他们自己的人类数据。在马萨诸塞州总医院由人口遗传学家Daniel MacArthur领导的一个遥远同事团队的带领下,他们分析了来自超过60万人的遗传数据,并确定了几位只有一功能性朊蛋白基因的老年人。尽管他们只有正常配额一半的蛋白质,但他们显然没有受到影响。
Kordasiewicz的兴趣被激发了,然后她给这对夫妇提供了药物开发的速成课程,描述了Ionis成功开发一种预防朊蛋白疾病的ASO所需的要求。他们需要研究显示用ASO治疗的小鼠比未经治疗的小鼠更好地抵抗朊蛋白疾病。他们需要一个朊蛋白病患者登记册以加快治疗试验的招募。为了帮助确定最终预防试验的参与者,他们需要对携带朊蛋白疾病突变但尚未出现症状的人进行生物标志物的研究。“他们把这当作待办事项清单,”Kordasiewicz回忆说。
“Holly和我们一起深入细节,”Vallabh在一月的某一天说,当时她和Minikel讲述了他们的故事。采访他们两个人就像和一个充满激情、高度智慧的单一个体交谈。他们的评论无缝衔接,似乎在将每一丁点时间都引向他们的唯一目标。没有浪费一个字或一个手势。
Ionis很快为这对夫妇提供了针对小鼠中朊蛋白疾病的ASOs。在他们与Caughey实验室合作进行了初步的小鼠研究后,Ionis药理学家Curt Mazur飞往波士顿,向他们展示如何自己将这些注射到小鼠的大脑中。另一位合作者,McLaughlin研究所研究朊蛋白疾病的Deb Cabin,从蒙大拿州的大瀑布市飞来,指导他们给小鼠注射感染性朊蛋白。
在2019年,Vallabh, Caughey, Minikel及他们在洛基山实验室、Ionis以及其他机构的合作者们在《JCI Insight》杂志上报告了来自小鼠研究的鼓舞人心的结果。团队发现,注射了ASO的小鼠在接种传染性朊蛋白后存活的时间比对照组的小鼠长61%至98%。即使是在症状通常出现前不久、接种后120天才开始用ASO治疗的小鼠,也存活了55%,这表明即使在大量有毒朊蛋白已经积累之后,ASO仍然是有益的。
这对夫妇和合作者很快展示了生存益处与动物大脑中朊蛋白RNA抑制程度直接相关。他们开发了一种测试方法,使用脊髓液样本准确测量人类和动物大脑中正常朊蛋白的水平——这是展示ASO在人类治疗试验中影响所需的工具。Ionis帮助支持了这项工作;自2018年以来,它已为这对夫妇提供了超过100万美元的资金。但他们并不持有公司的股份,如果ION717商业成功,他们也不会从中获得经济利益。
与此同时,受到Vallabh和Minikel的成功以及其自身内部研究小组的进展的推动,Ionis设计了用于治疗人类的ASO。当ASO与编码正常朊蛋白的mRNA结合时,它会召唤一种酶来破坏mRNA。然后ASO被释放出来,以针对另一个mRNA分子。2021年,该公司选定了一个分子进行人体测试,ION717,并很快获得了美国食品药品监督管理局(FDA)的批准进入临床试验。
“Ionis的事情真的是对Eric Minikel和Sonia Vallabh工作的致敬,”Harris说。“这是对他们的坚持和决心的致敬。”
61岁的Paul Hoffman是密歇根州里德市一家注塑公司的机械师,他在2020年春天莫名其妙地开始失去平衡。他跌跌撞撞,很难抬起脚。他开始坐在他站了40年的机械旁。他的医生排除了血糖问题、莱姆病、长期新冠和重金属中毒,但无法给出诊断。
2021年,他的儿子Zach Hoffman,同一家公司的设计师,开始出现类似症状。当他在2023年春天寻求医疗帮助时,他的初级保健提供者迅速将他送往一个遗传学家。当Zach的妻子Mackenzie Hoffman怀着他们的第一胎孩子怀孕9个月时,测试结果出来了。32岁的Zach患有格斯特曼-斯陶斯勒-申克病(GSS),这是一种极为罕见的、显性遗传的朊蛋白病,最早可在生命的第四个十年发病,通常在2到10年内致命。(这种较慢的病程在朊蛋白病中是不寻常的。)Paul自己的遗传测试在Zach和Mackenzie的儿子Henry出生前几天呈阳性反应,患有GSS病,“在这场灾难中的一束阳光”,Mackenzie说。
今年1月,两人都坐在轮椅上来到了大学医院的检查室。在那里,Appleby和他的团队为他们参加Ionis试验进行了筛选,进行了神经学检查,运行了心电图,取了血液和尿液,并要求他们重复单词列表。
Paul是一个高大、秃顶的男人,有着浓密的灰色胡须和络腮胡,他在2023年退休。他说他参加试验是为了“帮助每个人”,但也希望能缓解他的症状。“如果它[使]...我的日常生活哪怕好一点,”他哽咽着说。情感不稳定是朊蛋白病的常见症状。准备好的眼泪与Paul患病前的性格“完全不同”,他的妻子Billi Hoffman指出。
Zach参与的动机是他的儿子——“这样如果他确实有病,他们可以治疗他。”(如果Henry继承了致病突变,他的症状要到成年后才会出现;他可以在18岁后决定是否接受检测。)
研究人员计划在克利夫兰以及洛杉矶、西班牙巴塞罗那、波士顿、德国哥廷根、加拿大埃德蒙顿等地的研究地点,招募56名处于朊蛋白病早期阶段的患者。每位患者将在他们有生之年接受一系列为期24周的脊髓注射,其中一些是活性ASO,另一些是安慰剂;CJD患者通常在症状出现后只能存活4到6个月。公司希望该试验将在2025年10月前结束。
扎克和保罗知道,这次试验的目的仅在于确定ASO的安全性和适当的剂量水平。除了脊髓注射常见的预期副作用,如头痛和背痛外,研究人员还将观察肢体麻木或无力的情况,小鼠研究表明这可能是长期抗朊病毒疗法的副作用。
但面对快速进展、一致致命的疾病,风险与收益的比例很小,未参与该试验的桑加莫公司的策特勒说。“未满足的需求是非凡的……科学非常清楚地表明没有明显的安全问题,”他说。“这似乎是一个不错的赌注。”
Ionis之前对ASO的一些赌注已经得到了回报。FDA在2016年12月批准了nusinersen,这是一种由Biogen许可给Ionis的药物,用于治疗神经肌肉疾病脊髓性肌萎缩症(SMA)。七年的实际应用后,尤其是在儿童出现症状之前给予时,它带来了显著的好处。去年,FDA批准了一种针对罕见的遗传性肌萎缩侧索硬化症(ALS)的ASO,由Ionis开发并授权给Biogen。Ionis还发布了来自早期人体试验的鼓舞人心的生物标志物结果,该试验使用ASO攻击轻度阿尔茨海默病患者中称为tau的异常蛋白。
但其他针对脑部疾病的Ionis ASO令人失望。2021年,其针对亨廷顿病的ASO,授权给罗氏,在后期临床试验中失败。2022年,该公司及其合作伙伴Biogen终止了针对已知最常见ALS突变的ASO的早期人体试验。
凯斯西保留分子生物学家孔清忠说,“最大的问题”是脊髓注射是侵入性的,通常有不舒服的副作用,并需要数周或数月的重复给药。(他正在开发一种替代上游策略,一次性静脉注射小RNA分子的基因,以沉默PRNP基因的表达。)让ASO在大脑中传播是另一个挑战,他说。它们容易穿透大脑皮层,但更难到达大脑更深层的部分,如纹状体,这些部分也会受到朊病毒疾病的损害。
“当我们进入大脑更深层结构时,我们得到的药物越来越少,”科达西维奇承认。但她补充说,Ionis正在开发的针对轻度阿尔茨海默症的ASO,其设计与ION717非常相似,逆转了整个大脑中错误折叠的tau蛋白的积累,“这让我们有信心我们正在广泛地针对目标。”
如果ION717被证明是有效的,治疗可能会很昂贵,这是罕见疾病疗法的典型情况。Ionis的SMA药物nusinersen的挂牌价格为第一年注射75万美元,此后每年37.5万美元。(该药物通常从儿童早期开始给予。)投资银行公司Piper Sandler & Co.的高级研究分析师艾莉森·布拉策尔表示,对于病程更短的更罕见疾病群体的ASO“将相应定价”。布拉策尔指出,如果ION717获批,Ionis将需要努力寻找患者,同时还有时间治疗他们。另一方面,她补充说:“我们已经看到,一旦有了治疗方法……医生更有可能寻找它,诊断率就会上升。”
"在一月份,Minikel和Vallabh在Broad共享的小型办公室里,他正沉浸在与合作者的在线对话中。'我们显然需要不止一次射门,'他一边说,一边以他标志性的强度向前倾斜。
Minikel和Vallabh正在实践这种哲学。他们推动了Ionis试验成为现实,现在他们正在与Sangamo合作,在准备提交监管批准启动人体试验的同时,测试该公司的锌指试剂在小鼠身上的效果。他们还与Gate Bioscience合作,该公司的首席执行官Mata-Fink表示,正是Minikel的博客cureFFI.org促使他联系这对搭档,并最终使他的公司致力于攻克朊病毒疾病。这家初创公司的方法被称为分子门控,使用一个小分子药物停靠在内质网通道的入口处,这是蛋白质从细胞中分泌出去之前进行最后阶段制造的地方。该药物旨在阻止新生的氨基酸链通过,从而阻止产生朊病毒蛋白。由于没有成熟的朊病毒产生,错误折叠的朊病毒就没有了作恶的底物。
Mata-Fink表示,Minikel和Vallabh一直在“帮助我们理解前进的道路,并在这种疾病中给了我们一些立足点。”他补充说:“他们是这个社区中不可思议的中心节点。”
其他研究人员表示,仅仅阻止正常朊病毒蛋白的产生可能还不够。对于那些无法预见发病的85%至90%的散发性疾病患者来说,“你永远不可能完全防止”正常朊病毒蛋白转变成有毒的同类蛋白,Harris说。“你想要将其与作用于下游的某种物质结合起来。”
Harris正在通过探索错误折叠的朊病毒是如何造成损害来寻找这样的药剂。他已经确定了一种酶,p38 MAPK,它是神经元信号通路的一部分,由畸形蛋白激活,导致神经元树突棘的崩溃。他说,药物设计者可能会针对该酶或通路中的其他酶来保护神经元。
伦敦大学学院的神经学家John Collinge长期以来一直在寻求下游干预。他在2003年展示了抗朊病毒抗体能够延长患有朊病毒疾病的小鼠的存活时间。在2022年发表的六人同情用途研究中,静脉注射抗体治疗并没有显著改变他们的疾病进程。但是两次尸检暗示抗体可能正在减少并清除大脑中的错误折叠蛋白。“证据清楚地表明,现在是时候进行有效性研究了,”Collinge说,但是私营部门没有人愿意资助随机对照试验。“过去几年我几乎和每家公司都谈过,”他说。“他们的商业发展团队……[都]说数字不对。”
即使Ionis的ASO在降低有症状患者的朊病毒mRNA方面取得了实质性的成功,Minikel也承认,“[现有的]蛋白质必须按照其自身的半衰期清除。那个患者还能活多少个半衰期?或者还能剩下多少生活质量?”
但对于那10%到15%像Vallabh一样携带突变的人来说,情况可能就不同了。对他们来说,在症状出现之前就开始去除朊病毒的治疗是显而易见的目标,这对二人辩称。Ionis完全支持这种方法,这将扩大其市场,因为预防性治疗将需要多年给药。“我们的目标是治疗所有患有朊病毒疾病的患者……包括基因携带者以及有症状的患者,”Kordasiewicz在2023年10月的投资者电话会议上说。
本周刚满40岁的Vallabh补充说:“当你坐在[我的]位置上时,等待所有的多米诺骨牌倒下然后试图追赶它们……看起来像是疯了。”
至少,Vallabh和Minikel没有承担Hoffmans和其他家庭所背负的一个重担。他们使用植入前遗传诊断来确保FFI已经从他们的家族中根除。他们现在4岁和6岁的孩子没有携带母亲的突变。
在我访问克利夫兰试验点的那天,Appleby收到了最近捐赠的大脑的遗传测试结果清单。凯斯西储大学的朊病毒病理监测中心是美国唯一一个接收、处理并为研究存储死于朊病毒疾病并选择成为器官捐献者的大脑的地点——到目前为止已有数千个。我的朋友Charlie Clark现在是其中之一。
对于每一位新的捐赠者,Appleby在结果传达给幸存的家庭成员之前都会进行审查。那天他收到的最后一份报告是Charlie的。他的家人已经允许Appleby与我讨论结果,但在此之前,他走出了听力范围并打电话给Ellen Clark。
他告诉她,Charlie的疾病是散发性的,不是遗传性的,所以他们的女儿们没有继承这种疾病的风险。他还解释说,Charlie有一种自然发生的朊病毒基因版本,存在于三分之一到一半的欧洲后裔人群中,如果一个人自发发展朊病毒疾病,这种基因与非常迅速的疾病进展有关。
Ellen也向Appleby透露了一些关于Charlie的事情。
当他重新加入我时,他说:“我没意识到他也是一名记者,这篇文章就像是他的终极贡献。这有点美。”
https://blog.sciencenet.cn/blog-41174-1426340.html
上一篇:《我们为什么会死》:学习生物学以了解长寿
下一篇:通过咳嗽和呼吸噪音诊病的谷歌AI