博文
氢气对脊髓缺血损伤没有治疗作用!
||
氢气对脊髓缺血损伤没有治疗作用!
点评:阴性结果是很难发表论文的,但关于氢气治疗的阴性结果已经有几篇论文发表,这应该是非常好的。从某种意义上说,阴性结果往往更可靠,因为作者不太容易故意,人为误差的可能性比较小。当然本研究使用的氢气浓度比较小,只有1.2%,作者是考虑到实际应用的标准限制。但从研究角度,氢气的潜在效果本身是重要问题,应该从效果的角度考虑,而不是单纯从实际应用的限制角度考虑。例如氢气剂量虽然吸入不容易实现更高剂量,但可以通过加压舱路线或直接组织注射氢气的方法。脊髓硬膜外氢气直接注射也是可以考虑的使用路线,只要效果理想,剂量增加并不是问题。
本研究旨在确定吸入氢气和给予富含氢的醋酸钠林格氏液(HS)的结合治疗是否能够保护兔子免受缺血性脊髓损伤。
在实验1中,将兔子随机分配到1.2% 氢气组、HS组、1.2% 氢气+HS组合组(联合组)或对照组(每组n=6)。HS中的氢气浓度为0.65 mM。从再灌注前5分钟开始吸入氢气 60分钟。HS(20 mL/kg)分为六次注射,每次间隔10分钟,从再灌注前5分钟开始。通过夹闭腹主动脉15分钟产生脊髓缺血。在再灌注后7天进行神经学和组织病理学评估。在实验2中,通过测量铂针电极上的电流来比较给予1.2% 氢气或HS后脊髓组织中的氢气浓度(n=2)。在实验3中,兔子被分配到2% 氢气组或对照组(每组n=6)。产生脊髓缺血并进行与实验1相同的神经学和组织病理学评估。
在实验1和实验3中,各组之间的神经学和组织病理学结果没有显著差异。在两只动物中,给予HS(10 mL)的注射仅使电流短暂增加到吸入1.2% 氢气时的1/30th和1/27th的稳态电流。
这些结果表明,1.2% 氢气吸入和给予富氢溶液的结合治疗并不能保护免于缺血性脊髓损伤,且与1.2% 氢气吸入相比,给予HS后脊髓组织中氢气浓度的增加非常低。
Yamashita A, Fukui T, Yamashita S, Ishida K, Matsumoto M. The combination of hydrogen gas and hydrogen-rich solution does not protect against ischemic spinal cord injury in rabbits. J Anesth. 2024 Mar 17.
引言
截瘫是胸主动脉瘤(TAA)或胸腹主动脉瘤(TAAA)外科修复后最严重的并发症之一。然而,尚未建立保护策略,并且需要一种在大多数医院都能安全且易于实施的方法。
使用氢气(氢气)可能是一种符合上述要求的潜在策略。尽管人们曾认为氢气在生物学上是不活跃的,但最近的研究表明它具有抗氧应激的生物效应,包括选择性减少羟基自由基和过氧化亚硝酸盐而没有不良影响[1, 2]。氢气可以通过吸入氢气或静脉给予富氢溶液来施用[3, 4]。
已经证明吸入2-4%的氢气,而不是1%的氢气,可以保护兔子[3]和大鼠[5]免受缺血性脊髓损伤。然而,在TAA或TAAA的外科修复期间,给予2%的氢气吸入以保护脊髓是困难的。超过4%的氢气浓度存在爆炸风险[2],因此,日本的规定严格限制存储在气瓶中与30%氧气混合时的最大氢气浓度为1.3%,与96%氮气混合时为4%。因此,当使用2%的氢气(4% 氢气:100% O2 = 1:1)时,最大氧气浓度为50%,这可能不足以在TAA或TAAA的外科修复期间维持足够的PaO2,因为经常需要进行单肺通气。增加氧气浓度需要相应减少氢气浓度。例如,当氧气浓度增加到70%时,最大的氢气浓度变为1.2%。
富氢溶液的给药并不存在爆炸风险。然而,只有一个临床前研究为富氢溶液对脊髓保护的有效性提供了证据[4]。在那个研究中,5或10 mL/kg的富氢盐水在再灌注前5分钟给药[4]。这意味着大量的富氢盐水被非常快速地给予,这在临床上似乎不太相关,特别是对于10 mL/kg的富氢盐水来说。
在目前的研究中,我们试图调查是否有更具临床适用性的氢气给药方法,即结合1.2% 氢气吸入和较慢的富氢溶液给药,能否保护兔子免受缺血性脊髓损伤。我们还比较了1.2% 氢气吸入和静脉注射富氢溶液时脊髓组织中的氢气浓度,因为据我们所知,没有研究检验过这两种给药方式之间脊髓组织中氢气浓度的差异。我们预期脊髓组织中氢气浓度的差异可以解释结果研究的结果。此外,由于实验1即使结合1.2% 氢气吸入和富氢溶液给药也没有显示出保护效果,我们对是否2% 氢气吸入在我们的模型中显示出对缺血性脊髓损伤的保护效果进行了复制研究。
材料和方法
这项研究得到了山口大学医学研究生院动物护理和使用委员会的批准,并使用了38只体重为2.8 ± 0.2 kg(均值 ± 标准差)的雄性新西兰白兔。
实验1
手术准备如之前报道所述[6, 7]。简而言之,经过一夜禁食但可自由饮水后,兔子在30%氧气/70%氮气和芬太尼的2-3%异氟醚麻醉下进行机械通气。一根导管插入耳静脉以输注液体(乳酸林格氏液,10 mL/kg/h)和药物,另一根导管插入耳动脉以测量血压。食管和椎旁肌肉组织温度被监测,并且在整个研究中将椎旁肌肉组织温度维持在约38.0 °C。一根PE-50导管插入右股动脉,以测量稍后将要制造的主动脉闭塞下方的血压。平均动脉压和心率被监测直到导管被移除。
脊髓缺血的产生也如之前描述[8]。简而言之,兔子处于右侧卧位,一根PE-50导管放置在左肾动脉下方的腹膜后围绕主动脉,以便稍后进行主动脉闭塞。手术完成后,维持呼气末异氟醚浓度在2%。
实验方案如图1所示。二十四只兔子被随机分配到氢气组、富氢醋酸钠林格氏液(HS)组(HS组)、氢气+HS组合组(联合组)或对照组(每组n=6)。氢气中的氢气浓度为1.2%,而HS中的为0.65 mM。氢气(储存于含有1.2%氢气/30%氧气/68.8%氮气的气瓶中)和HS由岩谷产业公司(日本东京)提供。HS组和联合组接受了20 mL/kg的HS,而氢气组和对照组接受了20 mL/kg的醋酸钠林格氏液,分成六次注射,每次间隔10分钟,从再灌注前5分钟开始。我们没有输注HS,因为氢气可以通过普通的输液管渗透,导致实际给予的氢气量减少。每次给药时,HS和醋酸钠林格氏液都是在1分钟内给予。在氢气组和联合组中,吸入气体(30%氧气/70%氮气)在再灌注前5分钟至再灌注后55分钟期间改为1.2%氢气/30%氧气/68.8%氮气。如果近端平均动脉血压降至55 mmHg以下,则输注去氧肾上腺素以维持血压在55 mmHg或更高。

图1实验1中的实验方案。缩写:HS富氢醋酸钠林格氏液。
在夹闭主动脉之前立即给予400 U的肝素。通过夹闭腹主动脉15分钟来诱导缺血。在缺血前、缺血过程中的第7.5分钟以及再灌注后15分钟记录平均动脉压、心率以及食道和椎旁肌肉温度。在缺血开始前和再灌注后15分钟采集动脉血样以测定PaO2、PaCO2、pH值、血细胞比容和血浆葡萄糖。然后移除所有导管并缝合切口。肌内注射抗生素(庆大霉素,4 mg/kg)。当出现强烈的自主呼吸和运动时进行气管拔管。动物在一个含有补充氧气的温暖塑料箱中恢复3小时。根据需要手动排空膀胱内容物。
动物在再灌注后的7天内每天进行神经学评估,由一个对治疗组别不知情的观察者使用Drummond和Moore提出的5点评分系统进行评估[9]:4分,正常的运动功能;3分,能够将腿拉到身体下方并跳跃,但不正常;2分,下肢有一定的功能,有较好的抗重力力量但不能将腿拉到身体下方和/或跳跃;1分,下肢功能差,只有微弱的抗重力运动;0分,截瘫,下肢无功能。
在最后一次神经学评估(再灌注后7天)后,在异氟醚麻醉下用10%磷酸盐缓冲福尔马林进行经心灌注和固定。在L5水平获取脊髓的冠状切片(8 μm厚),并用苏木精-伊红染色。在光学显微镜下由一个对治疗组别不知情的观察者计数正常神经元(位于中央管前方垂直轴心线绘制的线之前的前脊髓区域),并在每个兔子的两个切片中取平均值。如之前报道[8]所述,损伤的神经元被识别为胞质嗜酸性、尼氏物质丧失以及存在均质性固缩核。
实验2
进行了实验2以比较根据给予氢气或HS后新西兰白兔脊髓组织中的氢气浓度(n = 2)。麻醉诱导如实验1所述。将动物置于俯卧位,从第三腰椎至第一骶骨棘突之间切开中线皮肤和皮下筋膜。解剖肌肉后,依次移除第三至第七棘突、黄韧带和硬膜外脂肪,暴露下面的硬膜。使用微操纵器,将直径0.3 mm的铂金针电极垂直插入L5水平处中垂轴线侧1 mm、深3 mm,放置于腰髓灰质中。一个Ag–AgCl参考电极放置在背部肌肉中。通过这种方法,电极中的电流与组织中的氢气浓度成正比,从而能够在吸入氢气和给予HS之间比较脊髓组织中相对氢气浓度。
在测量期间,动物在与实验1相同的条件下麻醉。我们首先给予1.2% 氢气8分钟。在氢气水平恢复至基线后,给予10 mL的HS推注。10 mL的体积几乎与实验1中的单次推注剂量相同。在进行实验2之前,我们计划在四只动物上进行测量。然而,在两只动物中观察到氢气和HS在脊髓氢气浓度之间的大差异,并且在另外两只动物的结果中观察到小差异。因此,为了尽量减少使用的实验动物数量,我们没有在另外两只动物上进行测量。
实验3
实验3是一个复制研究,旨在调查吸入2% 氢气是否能保护免受缺血性脊髓损伤。兔子被分配到2% 氢气组或对照组(每组n = 6)。脊髓缺血、氢气吸入以及神经学和组织病理学评估的方法与实验1中相同。
统计分析
生理变量以均值±标准差表示,并通过重复测量方差分析进行分析。对下肢运动功能数据和前脊髓正常外观神经元数量的统计分析采用非参数方法(Kruskal-Wallis检验或Mann-Whitney U检验)。P值小于0.05被认为具有统计学意义。
结果
实验1中的生理变量显示在表1中。在实验1的四组中,缺血前、缺血期间7.5分钟或再灌注后15分钟的生理变量之间没有显著差异。这个实验中的所有兔子都存活到最终的神经学评估(再灌注后7天)。
表1 生理变量(实验1)
图2显示了实验1中每组的运动功能评分随时间的变化情况。运动功能评分在四组之间没有显著差异。
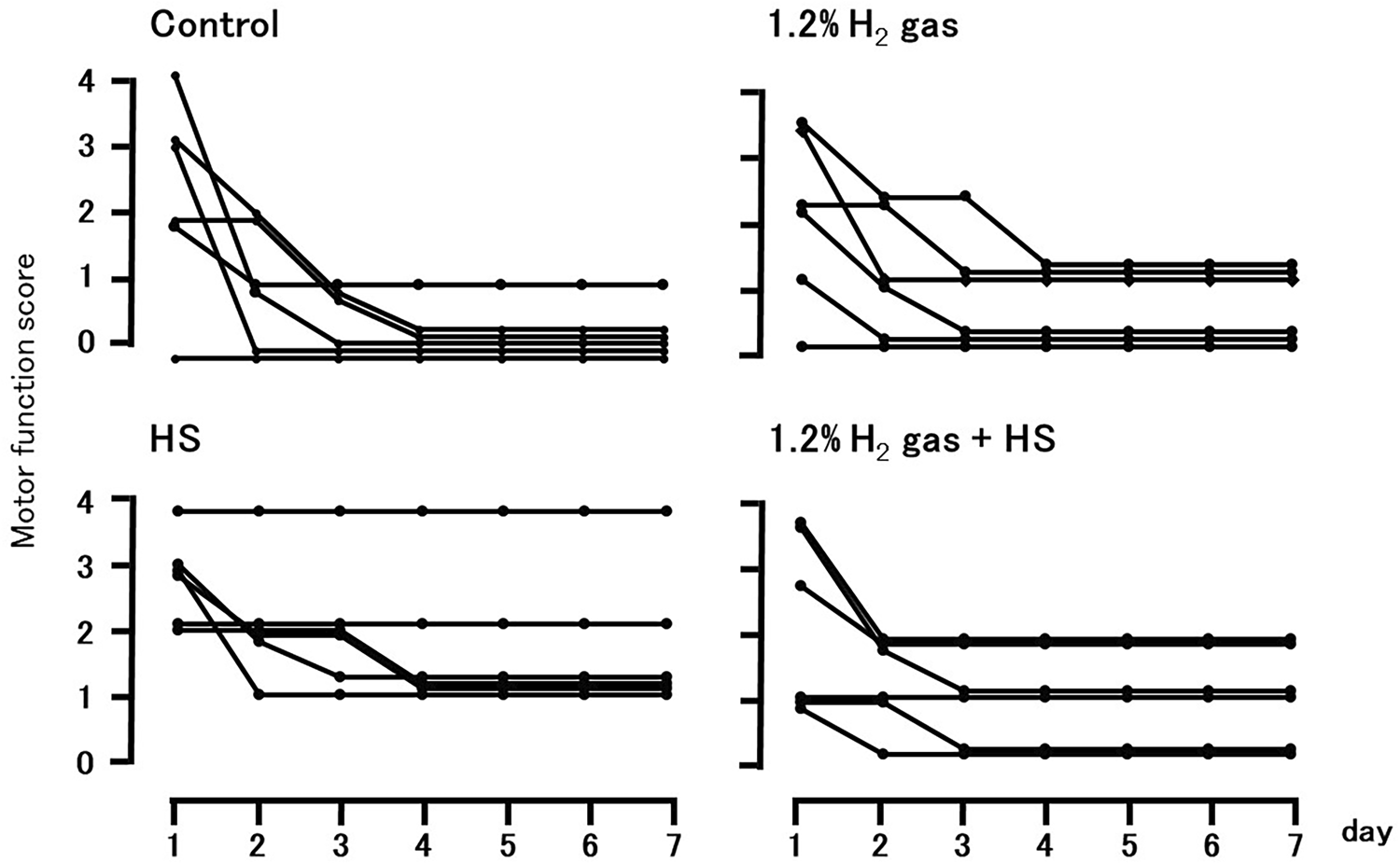
图2实验1中再灌注后1至7天个别运动功能评分的变化。运动功能评分范围从0(截瘫)到4(正常)。每个符号代表一只动物的数据。缩写:HS富氢醋酸钠林格氏液
图3a显示了每组正常外观神经元的数量,四组之间没有观察到显著差异。图3b, c展示了实验1中对照组中一个截瘫动物(评分=0)(图3b)和HS组中一个正常动物(图3c)的腰髓(L5水平)的典型显微照片。在运动功能障碍严重(评分≤1)的动物中,脊髓灰质的结构被破坏,大多数运动神经元消失,且观察到明显的炎症细胞浸润。这些动物的白质中也观察到空泡化。相比之下,在运动功能正常的动物(评分=4)中,脊髓的灰质和白质结构基本完好,运动神经元保持正常外观。

图3实验1中再灌注后7天在L5水平的前脊髓正常神经元数量。每个符号代表一只动物的数据(a)。代表性的光学显微照片,显示了实验1中对照组的一个截瘫动物(运动功能评分=0)(b, b-a)和HS组的一个正常动物(运动功能评分=4)(c, c-a)的腰脊髓(L5水平,苏木精-伊红染色)。在截瘫动物中,整个灰质完全被毁,正常神经元很少,伴有炎症变化(b, b-a)。相比之下,正常动物的脊髓灰质结构大部分完好,运动神经元得以保存(c, c-a)。B和C,原始放大倍数40倍;b-a和c-a,原始放大倍数400倍。缩写:HS,富氢醋酸钠林格氏液
图4显示了放置在腰脊髓前灰质(L5水平)的电极电流变化的代表性数据。在开始吸入1.2% 氢气后,电流迅速增加并在5分钟内达到平稳状态。当氢气吸入停止时,电流在5分钟内返回基线值。HS(10 mL)的推注仅使电流短暂增加到平稳状态电流的1/30和1/27,这是在两只动物中与1.2% 氢气吸入相比的情况。
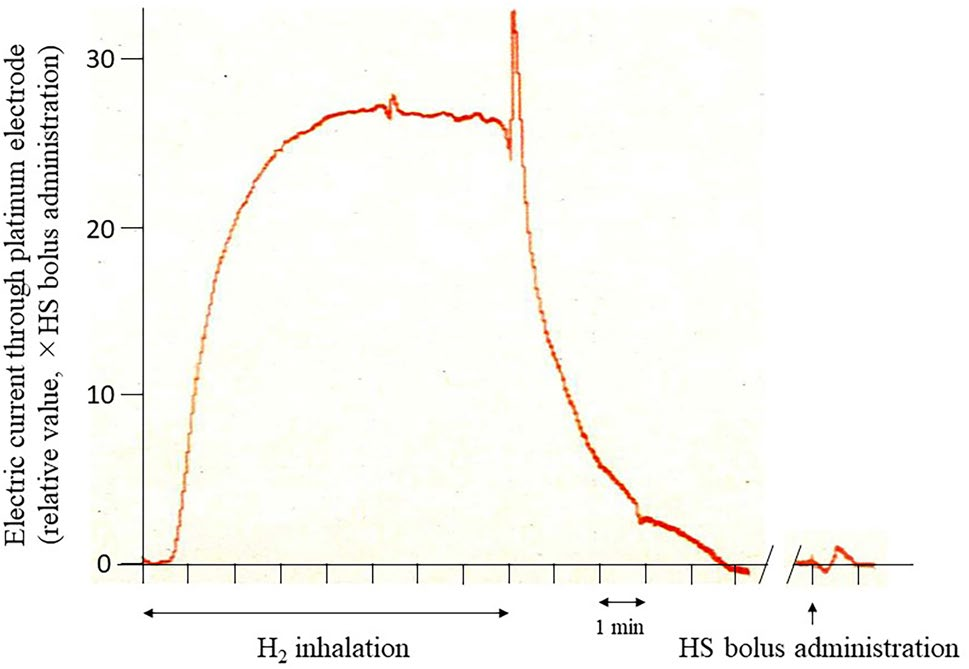
图4在氢气吸入和HS给予后腰脊髓前灰质放置的铂金电极通过的电流(L5水平)。通过这种方法,通过电极的电流与组织中的氢气浓度成正比,使得能够比较氢气吸入和HS给予之间脊髓组织中氢气浓度的相对情况。氢气吸入后的峰值电流大约是HS给予后的27倍。(氢气吸入平稳阶段的末尾出现的人为实现现象表明氢气吸入结束。)缩写:HS,富氢醋酸钠林格氏液
实验3中的生理变量在表2中展示。在实验3的两个组别中,缺血前、缺血期间7.5分钟或再灌注后15分钟的生理变量之间没有显著差异。有一只动物在从麻醉中苏醒后表现出急性严重的截瘫,并在第一天死亡。因此,最终的神经学和组织病理学评估在11只动物中完成。
表2 生理变量(实验3)
图5显示了实验3中每组的运动功能评分随时间的变化情况。两个组之间的运动功能评分没有显著差异。

图5实验3中再灌注后1至7天个别运动功能评分的变化。运动功能评分范围从0(截瘫)到4(正常)。每个符号代表一只动物的数据。对照组中有一只动物在第一天死亡
图6显示了每组正常外观神经元的数量,两组之间没有观察到显著差异。
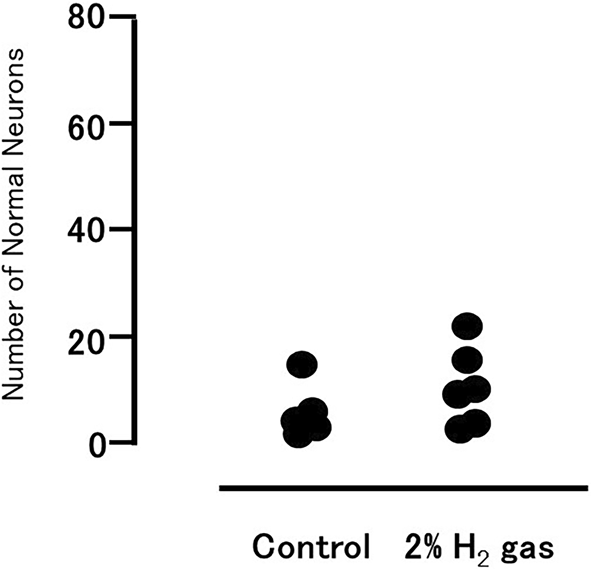
图6实验3中再灌注后7天在L5水平的前脊髓正常神经元数量。每个符号代表一只动物的数据
讨论
在目前的研究中,我们选择了1.2%的氢气浓度,假设在手术修复胸主动脉瘤(TAA)或胸腹主动脉瘤(TAAA)期间使用氢气来保护脊髓。选择1.2%的氢气浓度是为了将吸入的O2浓度提高到70%,这可能有助于在手术期间维持单肺通气下的PaO2。我们还计划以更具临床相关性的方式给予HS,即以20 mL/kg的HS分成六次推注,每隔10分钟给药一次,目的是与周等人的研究中的快速给予10 mL/kg富氢盐水的方法进行比较[4]。对于1.2%的氢气和分次给予的HS,我们预期它们各自的保护效果不会像之前的研究[3,4,5]中看到的那样强。然而,我们预计如果1.2%的氢气和HS结合使用能够将脊髓中的氢气浓度提高到与2% 氢气相同的水平,那么它们可能会对缺血性脊髓损伤起到保护作用。然而,即使结合使用1.2%的氢气和HS,也没有观察到保护效果。
实验1的负面结果促使我们进行了两项额外的研究。我们比较了1.2% 氢气吸入和HS给予之间脊髓组织中的氢气浓度。此外,我们还进行了复制研究,探讨在我们的模型中2% 氢气吸入是否显示出对缺血性脊髓损伤的保护效果。令我们惊讶的是,给予10 mL HS(大约3.6 mL/kg)后脊髓组织中达到的氢气峰值浓度远低于1.2% 氢气吸入平稳阶段的浓度。即使是2% 氢气吸入也没有观察到保护效果。
目前的结果暗示了两种可能性。第一种是即使有报道称2% 氢气吸入可以保护兔子[3]和大鼠[5]免受缺血性脊髓损伤,2% 氢气吸入可能并没有强大的保护效果。有人可能会争辩说我们的缺血损伤太严重以至于看不到任何保护效果。然而,我们研究中的主动脉闭塞时间是15分钟,而黄的研究[3]是20分钟。此外,我们相信我们的模型可以检测到保护措施的效果,因为我们已经用它证明了缺血预处理的强大保护效果[7]。第二种可能性是,由于脊髓组织中氢气浓度增加不足,富氢溶液可能无法保护缺血性脊髓损伤。本研究中HS中的氢气浓度为0.65 mM,我们在实验2中给予的HS推注剂量约为3.6 mL/kg。即使我们尝试了周的研究中相同的方案(氢气浓度0.85 mM,10 mL/kg推注)[4],脊髓中的氢气浓度仍然会远低于1.2% 氢气吸入时的浓度。
氢气在水溶液中的溶解度并不高,室温下1大气压时最大氢气浓度被认为是0.8 mM。考虑到本研究中比较了脊髓组织中氢气浓度在1.2% 氢气吸入和HS推注给药之间的巨大差异,通过静脉给药富氢溶液向脊髓组织输送足够的氢气量似乎很困难。实际上,在人类中,当氢气通过2% 氢气吸入给药时,血液中的氢气浓度比通过静脉给药富氢溶液(0.8 mM)高出10倍以上[10]。综合来看,1.2% 氢气吸入与富氢溶液给药的结合似乎不太可能比2% 氢气吸入向脊髓输送更多的氢气。由于在本研究中2% 氢气吸入没有显示出保护效果,我们认为1.2% 氢气吸入与富氢溶液给药的结合在防护缺血性脊髓损伤方面不会有效。由于在日本使用氧气配合氢气的最大氢气浓度受到严格限制,因此在修复TAA或TAAA时使用氢气保护脊髓仍然是一个挑战。
本研究存在几个局限性。首先,我们没有测量脊髓组织中氢气的绝对浓度。然而,我们在本研究中使用的技术能够测量通过电极的电流,该电流与脊髓组织中的氢气浓度成正比。因此,我们能够比较氢气吸入和HS给药之间的氢气浓度。其次,我们在再灌注前5分钟开始氢气吸入,而黄等人[3]在再灌注前10分钟开始氢气吸入。然而,在实验2中,开始1.2% 氢气吸入后,电流迅速增加并在5分钟内达到平稳。因此,在再灌注开始时,氢气吸入组的脊髓组织中的氢气浓度被认为是稳定的。
总之,我们研究了1.2% 氢气吸入与富氢溶液结合是否能够在兔子中防护缺血性脊髓损伤。结果表明,本研究中测试的联合策略并不能防护缺血性脊髓损伤。
https://blog.sciencenet.cn/blog-41174-1425817.html
上一篇:高压氧医学概述
下一篇:人为什么会过度恐惧!【科学】