博文
补体激活免疫反应是长新冠病因的临床证据【科学】
|
有些人在最初感染严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 后,可能会持续数月出现使人衰弱的症状。然而,导致这些健康问题(称为 Long Covid)的因素知之甚少。Cervia-Hasler 等人将确诊感染 SARS-CoV-2 的患者的血液与未感染的对照组的血液进行比较。发现,患有 Long COVID 的患者表现出血清蛋白的变化,表明免疫系统补体级联反应的激活、凝血改变和组织损伤(参见 Ruf 的观点)。在细胞水平上,Long Covid 与包含单核细胞和血小板的聚集体有关。这些发现为诊断提供了潜在的生物标志物资源,并可能为治疗方向提供信息。——莎拉·罗斯(Sarah H. Ross)
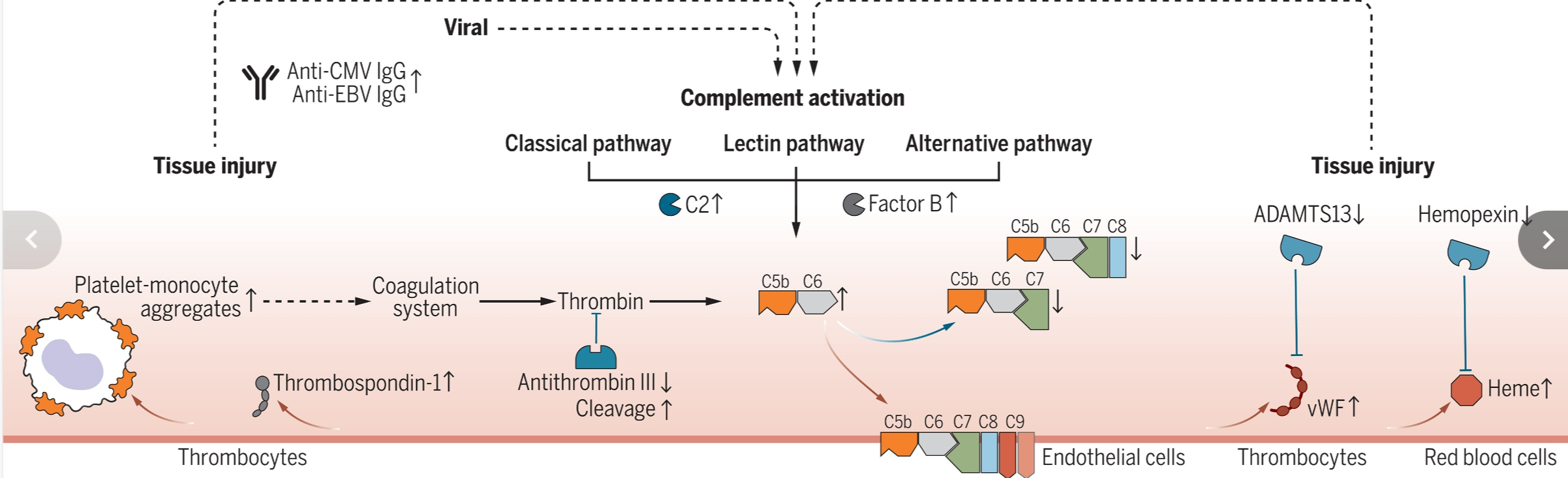 Long Covid 的 Pathomechanistic 模型。
Long Covid 的 Pathomechanistic 模型。
补体介导的血栓炎症模型,显示与康复的 COVID-19 患者和健康对照组相比,在持续性 Long Covid 症状的患者中,在 6 个月随访中测量的生物标志物(分别为向上箭头和向下箭头)增加和减少。使用蛋白质组学、光谱流式细胞术、单细胞转录组学、高通量抗体测量和靶向检测进行测量。红色箭头标记激活蛋白质相互作用,蓝色箭头标记抑制蛋白质相互作用。虚线箭头连接不同生物途径的变化。
急性感染严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)会引起一种呼吸道疾病,可能与全身免疫细胞激活和炎症、广泛的多器官功能障碍以及血栓形成有关。并非每个人都能从COVID-19中完全康复,导致长期新冠病(Long Covid),其临床治疗效果非常不理想(1)。长期新冠病可以影响所有年龄段的人,无论是严重的还是轻微的疾病,并且涉及多个器官。急性疾病后持续存在的症状为理解长期新冠病的具体病理生理学和风险因素带来了相当大的挑战。在最新《科学》的第273页,Cervia-Hasler等人(2)报告了一项多中心、纵向研究,涉及113名患者,他们要么完全从COVID-19中恢复过来,要么发展为长期新冠病,识别出先天免疫防御补体系统的局部激活很可能是诱导血栓炎症并阻碍急性COVID-19后恢复健康的罪魁祸首。
患有长期新冠病的患者表现出免疫功能障碍和耗竭的迹象(1)、持续的免疫细胞激活(3)和自身免疫抗体的产生(1),这些也是急性COVID-19的病理特征。Cervia-Hasler等人进行了一项蛋白质组学筛查,测量了6596种人类蛋白质的血清水平,这些蛋白质被7289个表位特异性DNA寡核苷酸适配体探针所识别。在急性感染期间和6个月后分析了严重或轻度急性COVID-19的患者。对40名长期新冠病患者、73名康复患者和39名健康对照组的比较显示,大多数在6个月时在长期新冠病患者中升高的血清生物标志物与在严重急性COVID-19亚组中改变的那些重叠。
特别是,血液抗微生物防御系统补体和五聚素3与长期新冠病的发展显著相关。补体成分和五聚素,包括血清淀粉样蛋白,通过破坏和标记病原体以供先天免疫细胞快速清除来服务体液免疫。这些蛋白质作为炎症诱导的全身急性期反应的一部分在肝细胞中上调(4)。然而,长期新冠病患者中这种反应的上调标记——五聚素3和某些补体因子——主要由免疫和其他组织驻留细胞产生,而不是肝脏(5),这表明长期新冠病患者中的持续性炎症是局部的而不是全身的。
在急性COVID-19期间,补体和凝血系统可能被激活,并在长期新冠病患者的各种组织中保持局部激活。补体C5b-C7复合物通过膜插入导致内皮细胞损伤,从而释放vWF和TSP1。这是高度促血栓形成的,因为产生的vWF多聚体募集血小板并促进凝血酶生成,而TSP1促进单核细胞与血小板的相互作用。此外,长期新冠病患者中ADAMTS13的减少促进了超大型vWF多聚体的积累,这会诱导C3b结合并刺激补体激活的替代途径。这些反馈循环共同作用可以维持局部补体激活和炎症,以及产生微血栓,这可能是长期新冠病的一些特征的基础。
补体系统对于通过溶解破坏入侵微生物的先天免疫防御至关重要,但当失去控制时,会导致细胞和血管损伤。补体级联反应可以通过经典途径或凝集素途径中的抗原-抗体复合物激活,也可以通过识别特定碳水化合物结构的多聚蛋白质(凝集素)激活,这些结构也存在于SARS-CoV-2刺突蛋白上,有助于宿主细胞进入。这两种途径都可能在急性COVID-19中引起显著的补体激活(6)。除了这些病原体识别触发的机制外,所谓的替代途径中,C3b招募补体因子B,导致其蛋白水解,可以放大细胞表面的补体激活。补体级联反应中的连续蛋白水解切割最终产生C5b,它结合C6和C7。C7作为C5b-C7复合物的细胞膜锚点,并使随后的C8和C9在末端补体复合物(TCC)中的招募成为可能,该复合物介导病原体和宿主细胞的溶解。
关注长期新冠病特有的蛋白质组变化,并考虑到年龄、性别和住院情况,Cervia-Hasler等人检测到C5b-C6水平增加,支持过度补体激活。然而,一种测量C7的适配子探针显示出令人惊讶地降低的水平。对适配子靶点的特异性验证显示,它识别的是与其他TCC成分结合的C7,而不是游离的C7。循环中包含C7的复合物水平的降低表明,C7与C5b-C6的结合导致膜插入增加,从而导致长期新冠病患者中的细胞损伤。一致地,复合C7/C5b-C6比值的降低是发展为长期新冠病的强烈预测因素(见图)。
Cervia-Hasler等人发现,长期新冠病患者还表现出血清血管性血友病因子(vWF)和血栓调节素1的明显上调,它们都从受损或活化的内皮细胞以及血小板中释放出来。相反,长期新冠病患者中具有血小板凝血酶原酶抑制剂活性的去整合素和金属蛋白酶13(ADAMTS13)的水平降低,表明循环中vWF的调节失衡。ADAMTS13在控制从活化内皮细胞中释放的高度促血栓形成的超大型vWF多聚体方面起着关键作用。此外,vWF多聚体能结合C3b,从而促进补体替代途径的激活,这也在长期新冠病患者中基于测量活化因子B片段得到证实。相比之下,ADAMTS13处理超大型vWF会增加C3b的降解敏感性,从而减弱局部补体扩增(7)。除了无效的vWF降解外,Cervia-Hasler等人还发现证据表明红细胞溶解和释放血红蛋白,这可能进一步促进长期新冠病患者中的持续局部补体激活。
凝血激活导致由血小板和纤维蛋白组成的血栓形成,这些血栓会被纤溶酶蛋白降解。急性、严重的COVID-19与D-二聚体水平升高相关,并且通常伴有血小板计数不减少的多器官血栓形成。在急性COVID-19中,D-二聚体和纤维蛋白水平的增加预测长期新冠病患者(Long Covid)认知功能障碍(“脑雾”)的发展(8)。D-二聚体和纤维蛋白水平的升高在长期新冠病患者中没有持续存在,但除了vWF外,Cervia-Hasler等人发现凝血因子11(F11)的水平升高,这可能是额外的促凝机制。F11参与凝血放大循环,该循环在血小板上产生凝血酶,并招募到内皮细胞上的vWF,F11可以促进血管炎症而不会导致明显的血栓形成(9)。长期新冠病患者中持续存在的血栓炎症调节失调发生在看似正常的内皮功能下。特别是,长期新冠病患者的生物标志物谱未提供证明内皮保护性凝血调节蛋白途径受损的证据,该途径不仅调节纤维蛋白溶解和补体激活,还支持炎症诱导性过敏毒素C3a和C5a的降解(10),这两种物质在长期新冠病患者中没有改变。此外,通过检测循环中富含vWF、C7、急性期血清淀粉样蛋白和纤维蛋白的纤溶抗性微血栓,可以指示长期新冠病患者中持续有限的凝血(11),这些蛋白质是Cervia-Hasler等人在蛋白质组学筛选中发现的对长期新冠病有贡献的物质。
中性粒细胞胞外陷阱(NETs)的形成、将病原体固定住的促血栓形成的DNA“网”以及其他免疫血栓形成的迹象在急性COVID-19中很常见,但在长期新冠病患者中不存在。相反,Cervia-Hasler等人发现血小板与经典单核细胞在患有持续性长期新冠症状的患者血液中相关联,这与已证实的血小板衍生蛋白刺激血小板与单核细胞相互作用的增加水平一致。尽管对一小部分长期新冠病患者进行单细胞测序并未检测到经典单核细胞中的促凝或促炎基因诱导,但这些细胞显示了转录因子NR4A1表达的下调,这是单核细胞转化为具有内皮保护作用的巡逻单核细胞所需的关键转录因子(12)。此外,CD16+巡逻单核细胞的转录组显示干扰素调控基因的表达上调,这与之前的研究结果一致,即持久的干扰素信号在长期新冠病中起作用(3)。由于单核细胞可以在补体激活的背景下迅速改变其促凝特性而无需组织因子的转录诱导,因此在未来研究中应考虑改变的单核细胞监测对内皮功能障碍和局部生成凝血酶的影响,凝血酶也会激活C3,这应被视为长期新冠病相关的血栓炎症的额外机制。
长期新冠病的症状包括类似于其他病毒感染后的疲劳,如肌痛性脑脊髓炎-慢性疲劳综合征(MECFS),疑似潜伏病毒再激活(1)。长期新冠病患者的抗体滴度变化表明疲劳与潜伏的Epstein-Barr病毒(EBV)再感染有关(13),Cervia-Hasler等人发现长期新冠症状的严重程度与巨细胞病毒(CMV)再激活相关。此外,在长期新冠病患者中观察到各种自身抗体改变,其对病理生理学的贡献尚不清楚(1)。Cervia-Hasler等人发现,持续性长期新冠症状患者的B细胞刺激C-X-C基序趋化因子13(CXCL13)自身抗体减少,这可能与增加的干扰素信号一起导致持续的自身免疫性疾病。有趣的是,急性COVID-19中出现的依赖于补体的促血栓形成抗磷脂抗体与凝血信号相交,诱导单核细胞中的干扰素反应,并通过树突状细胞中的I型干扰素产生促进自身免疫(14)。更好地理解病毒再激活、持续的干扰素信号和自身免疫性疾病之间的联系有望为长期新冠病相关的血栓炎症提供新的见解。
尽管在急性COVID-19中使用凝血和补体抑制剂的治疗干预产生了混合结果,但长期新冠病特有的病理特征表明有潜在的临床测试干预措施。微血栓也见于ME-CFS患者(1),表明在病毒感染后综合征中补体、vWF和凝血介导的纤维蛋白形成之间存在关键相互作用。针对特定靶点的凝血抑制剂可以重新编程先天免疫表型并中断vWF的微血管病变作用(15)。通过使用临床上批准或正在开发的单克隆抗体阻断不同的放大点可以实现补体激活的平衡。补体和凝血系统不仅是先天免疫反应的重要组成部分,而且在多个层面上相互连接形成前馈放大循环。在临床前和临床环境中更好地定义这些相互作用对于将新的治疗概念转化为慢性血栓炎症疾病至关重要。
Persistent complement dysregulation with signs of thromboinflammation in active Long Covid | Science
结构摘要
介绍
严重急性呼吸系统综合症冠状病毒 2 (SARS-CoV-2) 的急性感染会导致多种临床表型,从无症状到危及生命的 COVID-19。大约 5% 的感染者没有从急性疾病中恢复,而是会出现长期并发症,称为 Long Covid。目前关于导致 Long Covid 的因素的假设包括组织损伤、病毒库、自身免疫和持续炎症。目前尚无针对受影响患者的诊断测试或治疗解决方案。
理由
在初步确认急性 SARS-CoV-2 感染后,我们对 39 名健康对照组和 113 名 COVID-19 患者进行了长达 1 年的随访,以确定与 Long Covid 相关的生物标志物。在 6 个月的随访中,40 名患者出现 Long Covid 症状。重复的临床评估与抽血相结合,总共产生了 268 份纵向血液样本。我们通过蛋白质组学测量了血清中 >6500 种蛋白质。使用计算工具确定最佳候选生物标志物,并进一步进行实验评估。
结果
Long Covid 患者在急性疾病期间表现出补体激活增加,这种情况在 6 个月的随访中也持续存在。补体系统是先天免疫系统的一部分,通过靶向病原体和受损细胞等功能,促进免疫和体内平衡。有趣的是,在 6 个月的随访之前恢复的 Long Covid 患者的血液补体水平恢复正常。补体系统可以通过各种触发器激活,从而形成由补体成分 C5b-9 组成的末端补体复合物 (TCC)。这些复合物可以整合到细胞膜中并诱导细胞活化或裂解。Long Covid 患者表现出不平衡的 TCC 形成,其特征是可溶性 C5bC6 复合物增加和可掺入细胞膜的含 C7 TCC 形成水平降低。这表明 Long Covid 患者中 TCC 的膜插入增加,导致组织损伤。因此,Long Covid 患者表现出血液中组织损伤标志物升高和血栓炎症特征,其特征是内皮激活标志物,例如血管性血友病因子 (vWF) 和红细胞裂解。Long Covid 患者的抗凝血酶 III 水平较低,并伴有凝血酶裂解增加的迹象,凝血酶是 TCC 形成的驱动因素。此外,Long Covid 患者在 6 个月的随访中血小板活化标志物和单核细胞-血小板聚集体升高,尤其是在 Long Covid 持续 12 个月或更长时间的情况下。这些患者还表现出抗体介导的经典补体通路激活的迹象,这与抗巨细胞病毒(巨细胞病毒,也称为人疱疹病毒 5)和抗 EBV(EB 病毒)免疫球蛋白 G (IgG) 抗体水平升高有关。
结论
我们的数据表明,活动性 Long Covid 伴随着以补体活化和血栓炎症增加为标志的血液蛋白特征,包括活化的血小板和红细胞裂解标志物。组织损伤也可能是补体介导的,进而激活补体系统。此外,补体激活可能由抗原-抗体复合物驱动,涉及自身抗体和针对疱疹病毒的抗体,以及与凝血系统失调的串扰。除了为新的诊断解决方案提供基础外,我们的工作还为长期新冠患者的补体调节剂的临床研究提供支持。
论文讨论
新出现的SARS-CoV-2变种使世界面临反复的SARS-CoV-2感染(54),导致长期新冠(Long Covid)的高发病率(55)。我们通过对轻度和重度COVID-19患者以及健康对照组的前瞻性队列研究,识别了急性感染后6个月仍未康复的长期新冠患者的血清蛋白组中的常见模式。 对超过7000个蛋白质测量的分析揭示了补体系统是长期新冠中失调的生物途径。在6个月的随访中,包括可溶性C7复合物C5b-7、C5b-8和C5b-9在内的晚期TCC形成减少,这些个体经历了活跃的长期新冠。这些发现与早期TCC形成C5bC6的增加和补体活性增加相平行。通过计算C5bC6/C7复合物比率来量化TCC形成的不平衡,这一比率也被机器学习确定为长期新冠的最佳预测生物标志物。C7与稳定的双分子复合物C5bC6结合,使得三分子复合物C5b-7能够整合到细胞膜上(30)。
我们在存在高水平的C5bC6和降低的可溶性C7复合物的情况下观察到补体活性的增加,这表明在活跃的长期新冠中TCC向膜的插入增加。 因子B水平增加表明替代性补体途径激活可能是TCC形成的驱动因素(27)。此外,反映经典补体途径激活的增加C2水平与长期新冠的持续有关。我们发现在6个月随访时长期新冠患者抗CMV和抗EBV IgG滴度增加,这表明在长期新冠患者中有增加的病毒抗原暴露和因此的抗病毒抗体形成,可能是通过疱疹病毒的再激活。C2水平与抗CMV IgG滴度和长期新冠持续之间的关联可能将我们发现的增加补体激活与最近关于长期新冠中疱疹病毒再激活的报道联系起来(52)。此外,通过凝血酶直接活化C5,正如我们在两个独立队列中发现的失调凝血级联、长期新冠患者中的低抗凝血酶III水平和增加的抗凝血酶III裂解反应所支持的那样(33-36)。 升高的vWF和TSP-1以及减少的保护因素,如ADAMTS13、PAF-AH和ApoA1,表明了血栓炎症反应,这也可以驱动补体激活(38, 39, 47)。vWF和TSP-1都可以由内皮细胞和血小板分泌。长期新冠患者中持续低水平的ICAM-1表明没有强烈的内皮激活,并已与遗传ICAM-1变异相关联(41, 56)。在6个月随访时发现长期新冠患者中单核细胞–血小板聚集体增加,表明血小板激活(57)。
然而,尽管存在增加的单核细胞–血小板聚集体,血小板计数正常表明有补偿机制。由于单细胞单核细胞转录组缺乏促血栓签名的迹象,聚集体可能是由血小板激活而不是由单核细胞驱动的(50)。然而,单核细胞在长期新冠患者中显示出独特的转录组变化,包括NR4A1减少和干扰素诱导跨膜蛋白转录本增加。有趣的是,NR4A1依赖的单核细胞亚群已在小鼠中与内皮稳态相关联(58)。此外,增加的干扰素诱导转录本已与严重的SARS-CoV-2感染相关联(59)。与单核细胞一样,我们没有观察到任何增加的中性粒细胞激活和NETosis的标志物,并且在6个月随访时的中性粒细胞计数正常。 病理性补体激活以前已与血栓炎症和小血管病变的表现相关联(38)。涉及补体激活的慢性疾病包括神经退行性疾病(60)以及不典型的溶血性尿毒症综合征和阵发性夜间血红蛋白尿症,这些病状以补体介导的溶血为特征(38)。
我们发现长期新冠中有溶血过程的迹象,包括低水平的血红素结合蛋白和增加的血红素水平。血红素结合蛋白–血红素复合物是在溶血后形成的,以防止血红素介导的氧化损伤。这些发现伴随着增加的血红蛋白和IL-6,以及正常的血红蛋白和红细胞计数,表明了一个慢性炎症过程(42, 61, 62)。由于组织损伤可以由补体介导,并且反过来也激活补体系统,观察到的标志物可能是补体激活的结果和原因。临床病史和我们发现的整个模式表明慢性过程,可能由外部驱动维持,包括慢性疱疹病毒感染,或者由血栓炎症的自我循环维持。 在严重的急性COVID-19中报告了过度的补体激活(32)。MBL是凝集素途径的中心成员,可以直接结合SARS-CoV-2(63)并在严重的儿科病例中增加(64),但在我们队列中的6个月随访时未改变。PTX3的增加已与短期COVID-19死亡率相关联(65)以及8个月随访时的长期新冠相关联(66),但我们的研究通过两种不同的方法没有改变它。其他补体激活途径包括SARS-CoV-2感染宿主细胞内的细胞内机制(67, 68)。COVID-19相关的血栓炎症已在住院患者中描述过(32),也被提出是长期新冠的基础(69–71)。COVID-19患者的脑部尸检显示了伴随经典补体成分沉积在内皮细胞和血小板上的神经血管损伤迹象(72)。此外,vWF/ADAMTS13比率与长期新冠患者的增加血栓形成风险相关联(73),vWF和C7是在长期新冠患者中发现的淀粉样微栓块中富集的前几个蛋白质之一,支持了C7的核心作用(74)。
我们的多中心、纵向研究提供了证据,证明仅在活跃的长期新冠患者中存在炎症特征,具有诊断准确性,可在症状发作后6个月进行诊断,且独立于任何有关COVID-19历史的信息,从而促进了临床应用。此外,我们的发现填补了观察到的SARS-CoV-2的补体激活特性与报道的小栓块、血管炎症和心血管并发症之间的差距(75)。我们能够通过不同的实验方法以及独立的住院COVID-19患者的纵向队列验证我们关于失调补体激活的假设。然而,需要使用更大的队列对外部验证我们的发现进行验证,包括患有轻微急性COVID-19的长期新冠患者以及较晚的时间点血液采样。更大的队列可能允许对长期新冠亚组进行更细致的评估。其他限制包括高通量生物标志物的发现警告,这些问题已通过多次解决。
https://blog.sciencenet.cn/blog-41174-1418802.html
上一篇:“氧化应激”是糖尿病管理的重要靶点
下一篇:AI新闻主播的诞生及其影响【PNAS】