博文
口服寡聚糖提高肠道菌群产氢气预防小鼠胎儿氧化应激
|
低聚果糖(FOS)由肠道微生物发酵生成肠道微生物衍生的氢气(IMDH)。氧化应激在妊娠期间增加,而氢气具有抗氧化作用和治疗作用。我们之前曾报道过,来自怀孕过量叶酸小鼠模型(PEFAM)的后代在生长后葡萄糖代谢异常。我们假设 PEFAM 妊娠期间通过 FOS 喂养的 IMDH 会抑制母体和胎儿的氧化应激。将妊娠第1天的C57BL/6J小鼠分为3组,在妊娠第18天解剖。对照(CONT)日粮为含叶酸2 mg/kg日粮的AIN-93G;PEFAM饲喂含有40 mg/kg叶酸的过量叶酸(EFA)日粮,EFA-FOS日粮中蔗糖被EFA日粮中一半的蔗糖替代。EFA-FOS中母体肝脏和整个胎儿的氢气浓度分别显著高于CONT和EFA(P < .05)。EFA-FOS组母胎8-羟基-2'-脱氧鸟苷与CONT组无显著差异,而EFA组与CONT和EFA-FOS组相比显著增加(P < .05)。在EFA-FOS中,母亲和胎儿超氧化物歧化酶和血红素加氧酶1的蛋白和mRNA表达与CONT无显著差异,而EFA中的蛋白和mRNA表达显著增加(P < .05)。Nrf2蛋白在母胎中的表达在EFA-FOS和CONT之间差异无统计学意义。因此,在妊娠期间向PEFAM饲喂低聚果糖可通过IMDH减少母体和胎儿的氧化应激。
Fructooligosaccharide feeding during gestation to pregnant mice provided excessive folic acid decreases maternal and female fetal oxidative stress by increasing intestinal microbe-derived hydrogen gas - ScienceDirect
低聚果糖 (FOS) 是低聚糖的混合物,聚合度为 2 至 4 个果糖与蔗糖残基结合成的分子。在工业上,它是通过β-呋喃果糖苷酶的真菌酶的作用由蔗糖产生的。低聚果糖天然存在于洋葱和香蕉等水果和蔬菜中,甜度约为蔗糖的一半。低聚果糖是一种双歧原性不可消化的低聚糖,可逃避小肠酶的降解,由肠道微生物发酵,产生短链脂肪酸、肠道微生物衍生的氢气(IMDH)和其他代谢物。
据报道,补充低聚果糖不会增加健康人和啮齿动物的血糖,能刺激胰岛素分泌,抑制脂肪组织的积累,对动物模型中的葡萄糖稳态产生有益作用。在2型糖尿病患者中摄入富含FOS的菊粉可改善炎症标志物,并且在D-半乳糖处理的小鼠中观察到FOS喂养的抗氧化作用。之前的研究已经阐明,持续摄入低聚果糖可抑制衰老加速小鼠的氧化应激,并减少衰老加速小鼠的炎症。此外,在肝损伤模型大鼠中,通过喂食FOS可以减轻肝损伤症状,同时观察到IMDH显著增加。Nishimura等人报道,低聚果糖或膳食纤维产生的结肠氢气扩散到腹腔,改善了肝缺血的症状。这些结果与补充低聚果糖产生的IMDH具有抗氧化和抗炎作用的发现一致。然而,妊娠期补充低聚果糖对母亲和胎儿氧化应激的影响尚未得到证实,但已有澄清表明,妊娠期氧化应激显著增加。妊娠期8-羟基-2′-脱氧鸟苷(8-OHdG)、丙二醛(MDA)或其他氧化物的排泄增加,抗氧化酶活性下降,氧化应激诱发不良妊娠结局或先天性畸形。
妊娠期饮食中叶酸过量的母亲的后代会导致哮喘、过敏、呼吸系统疾病和生长后胰岛素抵抗。我们建立了怀孕过量叶酸模型小鼠 (PEFAM),该小鼠喂食含有 40 mg/kg 叶酸的过量叶酸 (EFA) 饮食。在我们之前的研究中,我们确定添加38 mg/kg的AIN-93G饮食是不会导致母体肝损伤的量。我们已经报道,在PEFAM中,仅在7周龄的雌性小鼠中观察到口服葡萄糖耐量试验后血糖的显著升高,空腹胰岛素分泌减少和胰岛素阳性细胞萎缩,但在雄性小鼠中未观察到。过量的叶酸会增加氧化应激,因此表明后代在胎儿时期暴露于氧化应激。
氢气具有强大扩散能力,能穿透细胞膜,扩散到细胞质和细胞核,并调节参与氧化和炎症防御系统的基因的表达。吸入氢气、饮用富氢水和注射盐水等治疗方法已应用于各种疾病。核因子红系 2 相关因子 2 (Nrf2) 转移到细胞核中是氢分子保护细胞、组织和器官免受氧化的因素之一。Nrf2 激活 Nrf2 下游酶,如超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT) 和谷胱甘肽过氧化物酶 (GPx)、血红素加氧酶 1 (HO-1),并下调烟酰胺腺嘌呤二核苷酸磷酸氧化酶 。氢分子是羟基自由基和过氧亚硝酸盐活性氧(ROS)的特异性清除剂[26]。我们已经澄清了IMDH分布在母亲的组织中,特别是在肝脏、脂肪组织、子宫、羊水、胎盘和胎儿中,在怀孕的Wistar大鼠喂食FOS饮食后,从子宫中取出后立即。氧化应激会诱发胰腺β细胞功能障碍,降低胰腺和十二指肠同源盒1(Pdx1)[32,33],因为胰腺β细胞极易受到氧化应激的影响,因为ROS的内源性产生高,抗氧化酶的表达低。叉头盒蛋白 O1 (FoxO1) 分布在 Pdx1 阳性β细胞的细胞质中,而 FoxO1 在暴露于氧化应激时位于 Pdx1 阴性β细胞的细胞核中。因此,FoxO1的核表达与Pdx1表达的降低有关。
我们假设,母亲通过低聚果糖喂养产生的IMDH通过胎盘转移到胎儿,并同时降低母亲和胎儿的氧化应激。据我们所知,这是第一项旨在抑制喂养低聚果糖的母亲产生的IMDH对母亲和胎儿氧化应激影响的研究。我们研究的主要结果测量是 EFA-FOS 喂养对 EFA 喂养刺激的氧化应激和抗氧化酶的影响。此外,我们测量了 Pdx1 和 FoxO1 的叶酸和氢气浓度以及蛋白质表达作为解释我们主要结局的因素。在这项研究中,我们使用 PEFAM 检查了氧化应激标志物、参与 IMDH 抗氧化的酶和细胞因子在母亲和胎儿中的表达。此外,我们研究了Pdx1和FoxO1在PEFAM朗格汉斯胎儿胰岛中的表达,并讨论了其与氧化应激的相互作用。
三、主要结果
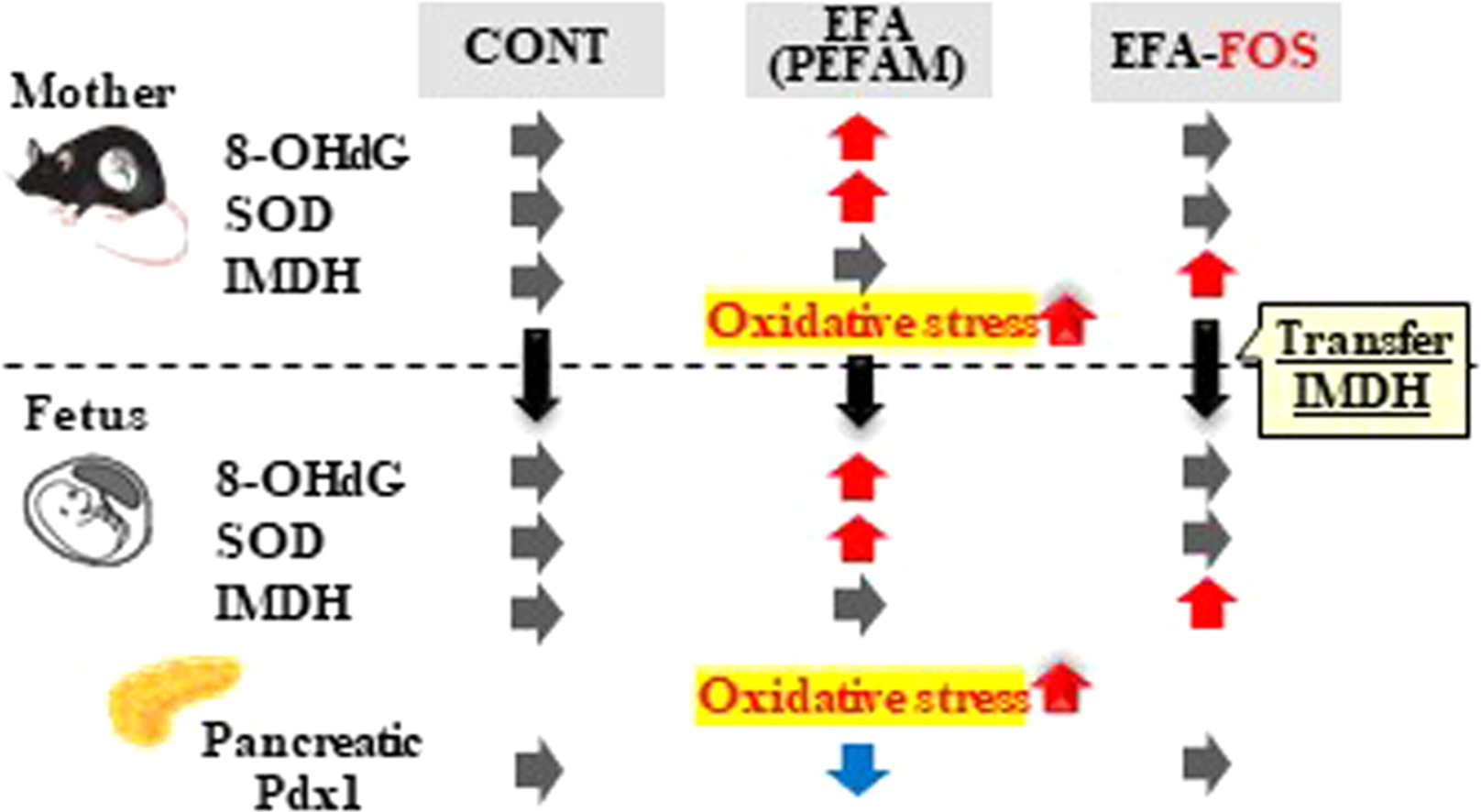
3.1. EFA-FOS喂养母亲对抑制母体及其胎儿氧化应激标志物的影响,这些标志物因EFA喂养母亲而增加。
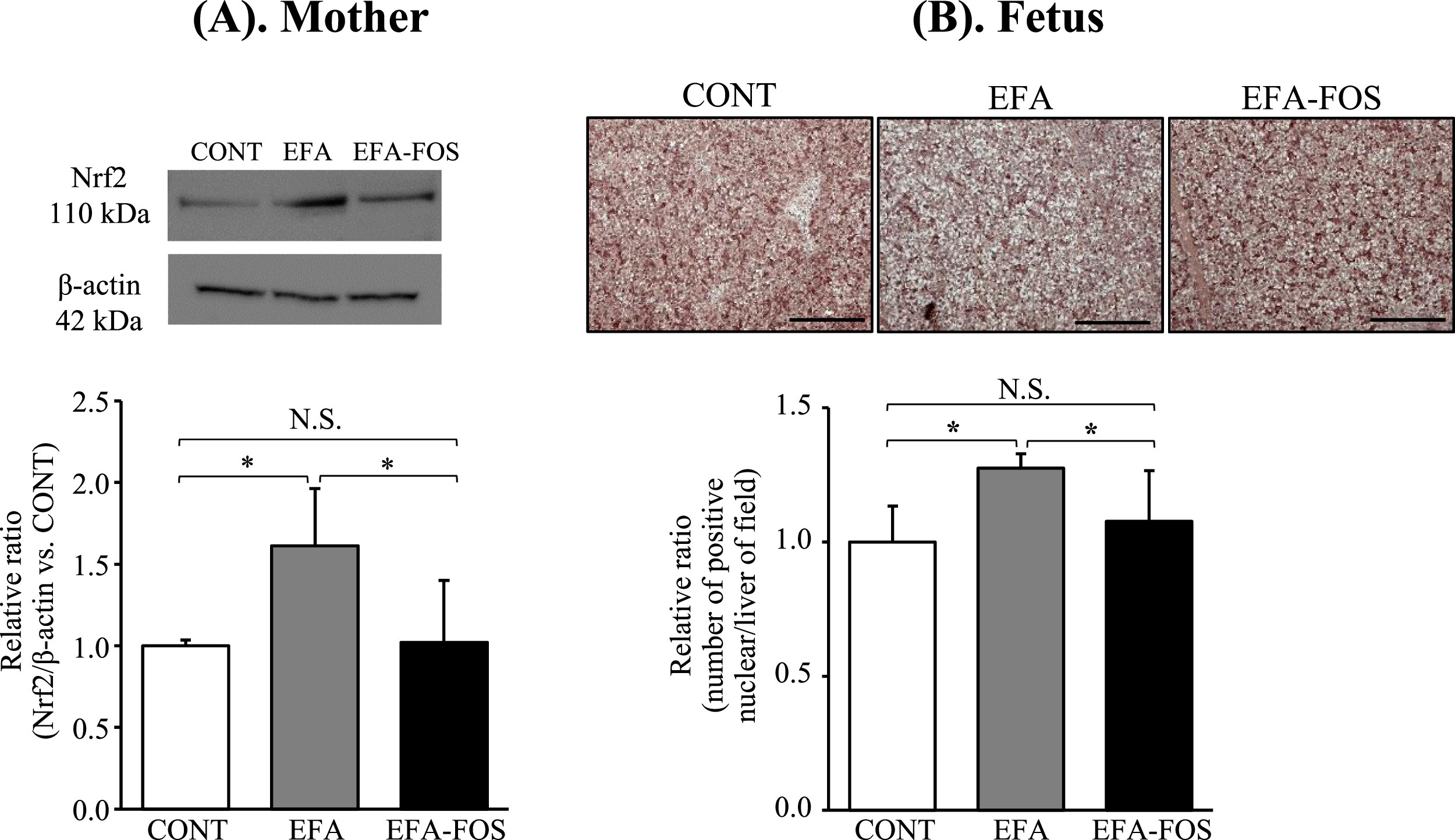
3.2. 母体EFA-FOS喂养对母体及其胎儿抗氧化酶和转录因子抑制的影响,这些酶和转录因子因母体EFA喂养而上调。
3.3. 向母亲喂食 EFA-FOS 对维持胰腺胰岛中 Pdx1 和 FoxO1 蛋白表达的影响,这些蛋白表达因向母亲喂食而降低。
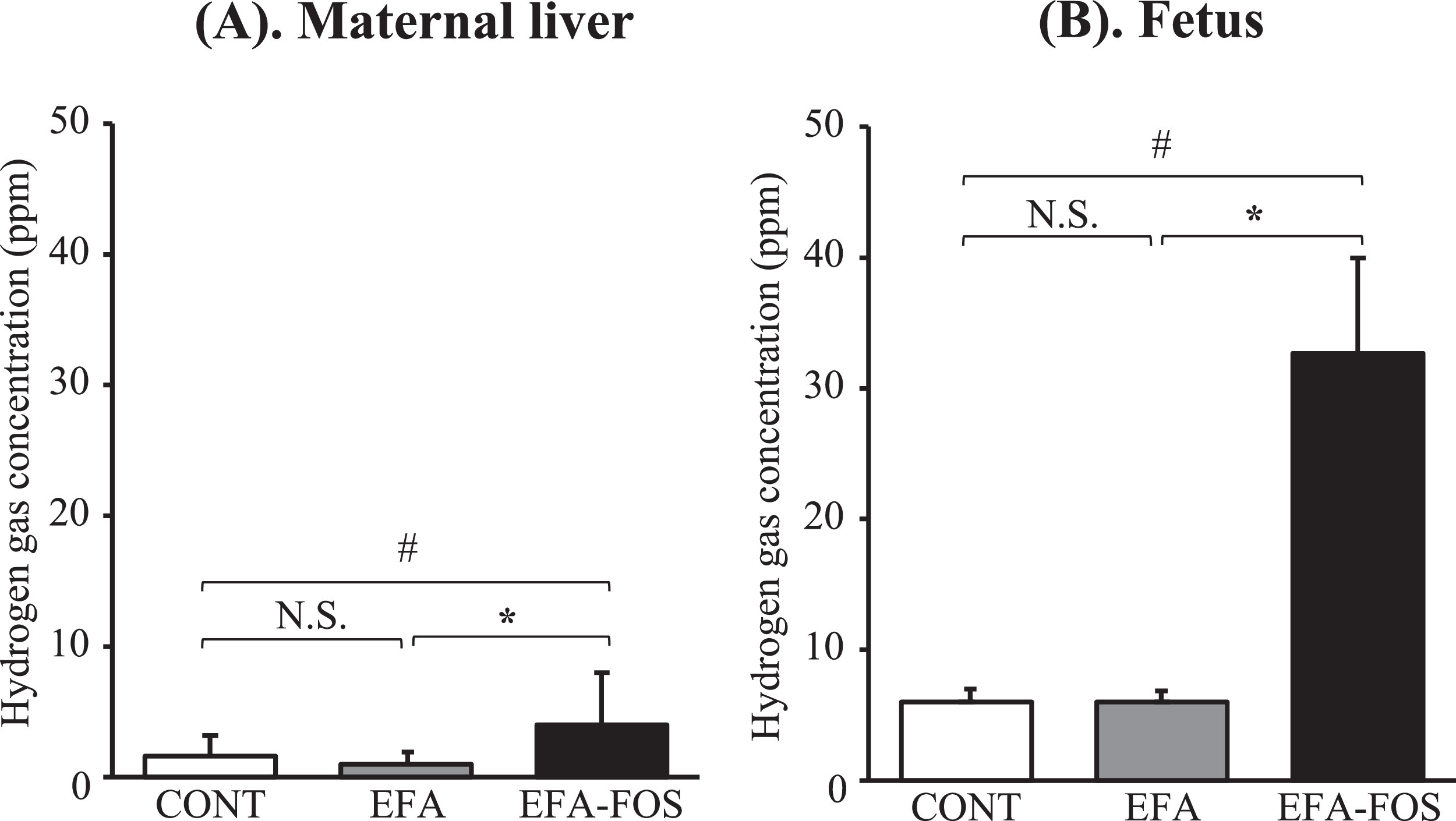
3.4. 母体EFA-FOS喂养对母体及其胎儿氢气浓度的影响。EFA-FOS组母体肝脏和女性胎儿氢气浓度分别显著高于CONT组和EFA组(P < 0.05)。
3.5. 喂养 EFA-FOS 或向母亲喂食 EFA 对母体肝脏、胎儿肝脏和胎儿周围羊水总叶酸水平的有一定影响。
四、讨论
在这项研究中,我们调查了我们的假设,并澄清了妊娠期间的低聚果糖喂养会导致母亲和女性胎儿的IMDH浓度显着,然后抑制因EFA摄入而增加的氧化应激。此外,EFA-FOS组胎儿胰腺朗格汉斯胰岛中Pdx1和FoxO1的蛋白表达与CONT组保持相同。
孕妈妈的正常炎症反应会诱导氧化应激和ROS积累,妊娠期氧化应激标志物(包括8-OHdG和MDA)增加。孕妇的ROS会对妊娠健康和胎儿的正常发育产生不良影响[14],特别是营养不良或ROS会导致发育不全并破坏胎盘功能。在这项研究中,我们研究了喂食 EFA-FOS 饮食对减少氧化应激的影响,氧化应激是由喂食 EFA 诱导的。EFA-FOS组对母亲8-OHdG和胎儿羊水的尿液排泄有抑制作用,与CONT组差异无统计学意义;然而,与CONT和EFA-FOS组的水平相比,EFA组的EFA水平显著升高。在我们之前的研究中,喂食5%FOS饮食的小鼠尿中8-OHdG的排泄量明显低于喂食对照饮食的小鼠。这些结果表明,进食低聚果糖产生的IMDH可减少氧化应激。在这项研究中,3组之间未观察到母体和胎儿MDA水平排泄的统计学差异。Haubert等和Nakamura等报道,MDA没有受到FOS日粮喂养的影响,因此可能很难检测到FOS的影响。
据报道,氢气通过选择性清除羟基自由基而不是消除所有ROS来减少氧化应激。因此,在这项研究中,氧化应激标志物的选择重点关注氢气的抗氧化方面。微生物对低聚果糖发酵产物的影响不具有特异性;因此,我们使用 8-OHdG 和 MDA 测量了对氧化应激的全身影响。据报道,氢气会激活Nrf2和抗氧化酶。Nrf2激活抗氧化酶,如SOD、过氧化氢酶、GPx和HO-1,以及细胞因子,如IL-1β和IL-6[28]。因此,我们研究了Nrf2与HO-1、SOD、过氧化氢酶和GPx之间的关系。在母体肝脏中,EFA-FOS组SOD和HO-1的蛋白和mRNA表达在CONT组中差异无统计学意义。此外,EFA-FOS组胎儿SOD蛋白和mRNA的表达与CONT组无显著差异。然而,与CONT和EFA-FOS组相比,EFA组的SOD表达显著增加。此外,Nrf2是影响抗氧化酶(如SOD、CAT、GPx和HO-1)表达的转录因子,EFA-FOS组的蛋白表达没有增加,与CONT组相似,但EFA组的表达受到明显刺激。在这项研究中,喂养 EFA-FOS 饮食对 CAT 和 GPx 的影响尚不清楚,排除了母亲中 mRNA 的表达。一个可能的因素是,在这个实验中,EFA饮食的引入并不多。Kobayashi等人报道,Nrf2干扰脂多糖诱导的促炎细胞因子(包括IL-6和IL-1β)的转录上调。本研究显示,EFA组母体IL-1β mRNA表达显著高于CONT组和EFA-FOS组;然而,EFA-FOS组和CONT组之间没有观察到统计学上的显着差异。3组患者母体IL-6和胎儿细胞因子mRNA表达差异无统计学意义。一个可能的因素是妊娠期间发生免疫耐受。
我们假设胎儿和母亲氧化应激的抑制是由于通过喂养低聚果糖将IMDH从母亲转移到胎儿。仅EFA-FOS组的母亲及其胎儿的IMDH浓度显著升高,而CONT组和EFA组的IMDH浓度非常低。这一结果表明,母体氢气通过胎盘的渗透转移到胎儿体内。在我们之前的研究中,我们发现IMDH分布在喂养5%FOS的母亲的器官和组织中,如肝脏、脂肪组织和子宫,并且IMDH同时在大鼠的胎儿中检测到。Yamamoto等人还证明,大鼠吸入3%氢气后,氢气分布在肝脏等器官和组织中,吸入氢气用于治疗,例如用于治疗与损伤相关的疾病。基于这些结果,建议在EFA-FOS组中检测到的IMDH可能对生物体具有与外源性氢气相同的生理效应。
哺乳动物细胞不具有产生氢气的机制,许多种类的肠道微生物具有产生氢气的机制。我们之前的研究表明,在人类和啮齿动物中摄入FOS后,IMDH显著升高。通过喂养EFA-FOS的IMDH起到了抗氧化剂的作用,因为它很容易通过胎盘的渗透从母亲转移到胎儿。氢分子是羟基自由基和过氧亚硝酸盐的特异性清除剂,它们与核酸、脂质和蛋白质不加区别地反应,导致DNA片段化、脂质过氧化和蛋白质失活。我们的结果表明,在EFA-FOS组中观察到的氧化应激减少是由于仅在EFA-FOS组中检测到的IMDH显着增加。这项研究的结果是首次发现,从母体喂养的低聚果糖转移的IMDH抑制了胎儿的氧化应激,尽管有报道称外源性氢盐水对妊娠有积极影响。
此外,我们还研究了对胎儿胰腺β细胞中 Pdx1 和 FoxO1 蛋白表达的影响。胰β细胞容易受到氧化应激的影响,容易受损。细胞核转移的FoxO1有助于β细胞对氧化应激的抵抗力,当高血糖与衰老、妊娠和分娩等代谢应激相结合时,会因蛋白水解而降解[38]。本研究发现,EFA-FOS组Pdx1和FoxO1蛋白表达与CONT组无显著差异,而EFA组氧化应激增加后Pdx1和FoxO1蛋白表达降低。这些结果可能与我们报道的PEFAM后代生长后观察到的异常葡萄糖代谢有关。因此,低聚果糖喂养可能有助于延缓生长后葡萄糖代谢异常的发生。在这项研究中,我们根据之前的研究结果只检查了女性胎儿,因此我们目前无法描述男性胎儿。本研究采用低聚果糖喂养抑制母体和胎儿氧化应激,抑制EFA喂养刺激的母体和胎儿氧化应激和抗氧化酶,维持EFA组降低的胎儿胰腺β细胞中Pdx1和FoxO1的表达。我们研究了EFA组和EFA-FOS组喂养之间叶酸积累的差异。由于EFA组和EFA-FOS组之间差异不显著,因此认为2组间叶酸过量的影响无显著差异。这些结果表明,低聚果糖可能有助于防止摄入过量叶酸的孕妇诱导的氧化应激增加,并可能有助于胎儿的健康发育。
CONT和EFA日粮的能量值为3.8 kcal/g,EFA-FOS日粮的能量值为3.7 kcal/g,基于FOS的有效能量为2 kcal/g的报告。在这项研究中,我们没有测量饮食摄入量以避免刺激怀孕的小鼠,因为该物种的怀孕率和分娩率很低。在我们之前的研究中,我们测量了隔天的饮食摄入量,并报告说小鼠的平均饮食摄入量为3.5克/天。因此,我们计算出 CONT 和 EFA 组的总能量摄入量为 239.4 kcal,EFA-FOS 组为 233.1 kcal。能量摄入的差异可能会影响氧化应激的抑制;然而,我们认为影响很小。
在这项研究中,我们调查了IMDH对健康的有益影响。然而,低聚果糖是由肠道微生物发酵的,这些微生物不仅产生IMDH,还产生其他代谢物,如短链脂肪酸、二氧化碳、维生素和胺。除IMDH外,来自肠道微生物的代谢物可能有助于减少妊娠期间因低聚果糖喂养而摄入过量叶酸对健康的不良影响。
5. 结论
我们阐明了妊娠期喂养低聚果糖通过促进氢气产生抑制了母亲和胎儿的氧化应激,并调节了胎儿胰腺β细胞中Pdx1和FoxO1的蛋白表达。这些结果可以阐明肠道菌群产氢气和FOS的新功能,并可能预防氧化应激引起的疾病。我们认为,低聚果糖可能有助于防止摄入过量叶酸的孕妇诱导的氧化应激增加,并可能有助于胎儿的健康发育。
https://blog.sciencenet.cn/blog-41174-1409713.html
上一篇:神经科学学术明星被举报学术不端【】
下一篇:病原菌在宿主体内建立铁储存系统