博文
病毒感染细胞微环境
|
细胞周围的微环境既不简单也不沉默。细胞通讯不断颤动,涉及膜结合蛋白、化学信号(如肽),甚至与细胞外囊泡相关的蛋白质、脂质和 RNA。因此,细胞可以与自己、邻近细胞和远处细胞交谈。在病毒感染期间,细胞之间的对话会发出警告。宋等阐明这一过程。
称为细胞因子和干扰素的信号分子通过微环境携带信息,从受感染的细胞中释放出来,从而提醒附近的细胞即将发生的病毒威胁,使它们能够建立先发制人的抗病毒防御并限制感染的传播。这些免疫信号通路对许多致病因子进行了很好的研究和描述。然而,病毒感染也会触发其他不太被重视的信息,这些信息有助于病毒目标。正如病毒劫持细胞机器进行自我复制一样,它们也会破坏和选择细胞之间的通信,以阻止其细胞微环境中的抗病毒防御。
宋及其同事使用人类巨细胞病毒(HCMV)作为模型系统揭示了病毒感染对邻近未感染细胞的深远影响。HCMV属于疱疹病毒家族,通常感染人类。与所有疱疹病毒类似,它在感染者中建立了终生休眠(潜伏)感染。虽然HCMV感染通常不会引起明显的疾病,但潜伏病毒的重新激活可能会危及免疫系统受损的个体的生命。HCMV也是先天性残疾的常见原因。
在感染的实验室研究中,大多数研究都集中在病毒感染细胞的生物学上。通常,研究是使用病毒接种进行的,导致每个细胞都被感染。这有助于实现同步感染,允许分析感染期间事件的时间序列。这些研究增加了细胞群的均匀性,否则未感染的细胞会降低细胞群的均匀性。然而,在人类病毒感染期间,单个感染细胞或小簇感染细胞被主要未感染的组织包围。
未感染的细胞从受感染的细胞接收到什么信号,它们如何反应?使用荧光标记方法,宋及其同事提出了开始拼凑病毒微环境的复杂性和病毒感染期间未感染细胞行为改变的工作(图1)。
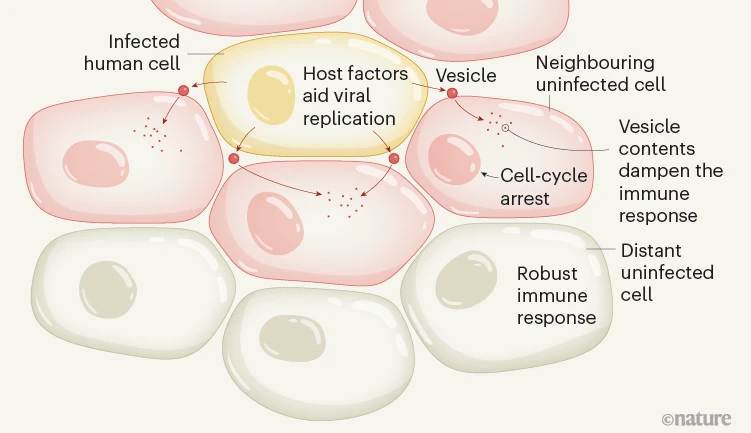 图1 |感染病毒的人类细胞周围微环境的复杂性。
图1 |感染病毒的人类细胞周围微环境的复杂性。
作者设计了一种称为成纤维细胞的人类细胞来表达红色荧光蛋白(mCherry),并且这种细胞渗透蛋白被分泌出来。然后,他们用一种经过工程改造的病毒感染细胞,以表达绿色荧光蛋白(GFP)。由于红色和绿色的组合,呈现黄色的受感染的mCherry分泌细胞被接种到未标记,未感染的细胞培养物中。在这种共培养系统中,与感染细胞相邻的细胞吸收分泌的mCherry。
使用荧光激活细胞分选系统分离三个细胞群。这些是受感染的细胞(黄色),未感染的邻近细胞(红色)和未感染的远处细胞(不发出荧光)。然后使用称为质谱的方法分析每组细胞,以确定蛋白质(蛋白质组)谱,以将它们与不属于该共培养系统的未感染细胞的对照群体区分开来。
值得注意的是,与受感染细胞相邻的未感染细胞具有与较远的细胞和受感染细胞不同的蛋白质组学谱。尽管它们没有病毒基因组,但未感染的邻近细胞含有HCMV蛋白,这表明这些病毒蛋白并非来自细胞的病毒感染。作者继续表明,这些蛋白质可能来自受感染细胞释放的细胞外囊泡的内容物。
蛋白质组学图谱还表明,与更远的未感染细胞相比,邻近的未感染细胞经历了细胞周期停滞,并抑制了免疫反应。生物学特性的这些变化取决于受感染细胞外囊泡的产生和释放,这表明来自受感染细胞的信号有助于为感染的近邻做好准备。
Song及其同事表明,HCMV诱导的变化增加了邻近细胞对随后感染流感或单纯疱疹病毒的易感性,而更远的细胞对感染具有抵抗力。这些发现与蛋白质组学数据一致,表明邻近细胞的防御被感染细胞抑制,而远处细胞感知感染并建立防御。
以前曾对乙型肝炎病毒和肠道病毒进行病毒操作,乙型肝炎病毒和肠道病毒使用称为microRNA(miRNA)的RNA来破坏免疫反应。这些变化导致未感染细胞对病毒进入和复制的脆弱性增加3–5.
虽然在HCMV的情况下,对感染易感性增加的机制尚未完全了解,但它们可能涉及HCMV衍生的干扰miRNA和感染期间抑制抗病毒反应的蛋白质的囊泡转运。需要进一步的工作来确定病毒蛋白和miRNA对病毒微环境的相对贡献,以及从感染细胞传递的宿主蛋白产生的贡献。
宋等.提供对病毒微环境复杂性的诱人窥视。标记附近细胞的方法首创6不到五年前,它在病毒学中的应用是一个新的发展。这项工作为更深入的机制研究奠定了基础,以了解邻近细胞感染病毒启动背后的生物学以及特定病毒蛋白和miRNA的作用。定义病毒微环境可能有助于促进我们对疱疹病毒潜伏期和再激活的理解,以及由此产生的允许病毒持续复制和传播的级联变化。
从驻留在细胞核中的休眠、近乎“沉默”的病毒基因组到存在活动性感染并产生新病毒颗粒的步骤仍然很明确,特别是在病毒微环境的作用方面。重新激活的疱疹病毒能否招募邻近细胞来促进其从潜伏期到生产性感染的进展,从而保护自己免受宿主免疫系统的侵害?宋和他的同事们迈出了回答这个问题的第一步。
https://blog.sciencenet.cn/blog-41174-1394032.html
上一篇:运动对大脑一定有帮助吗?
下一篇:注射“长寿因子”蛋白质可以改善衰老猴的认知功能【突破】