博文
化学分子编辑技术进行中!
|
五年前,化学家马克·莱文(Mark Levin)是一名博士后,正在寻找一个可以改变他的领域的有远见的项目。他从制药行业科学家的一组已发表的愿望清单中找到了灵感,这些科学家正在寻找改变药物化学的方法。1,2.在他们的梦想中,有一个概念脱颖而出:通过删除、添加或交换核心中的单个原子来精确编辑分子的能力。
这种分子手术可以大大加快药物的发现,并可能彻底改变有机化学家设计分子的方式。2018年的一篇评论称其为“大胆创新计划”概念。莱文被迷住了。
莱文现在是伊利诺伊州芝加哥大学一个团队的负责人,他是开创这些技术的化学家骨干之一,旨在更有效地锻造新药、聚合物和生物分子,如肽。在过去的两年里,已经发表了100多篇关于该技术(称为骨骼编辑)的论文,展示了它的潜力(参见“骨骼编辑的兴起”)。“现在围绕这个话题有很多嗡嗡声,”新泽西州凯尼尔沃思制药公司默克公司的发现过程化学总监Danielle Schultz说。
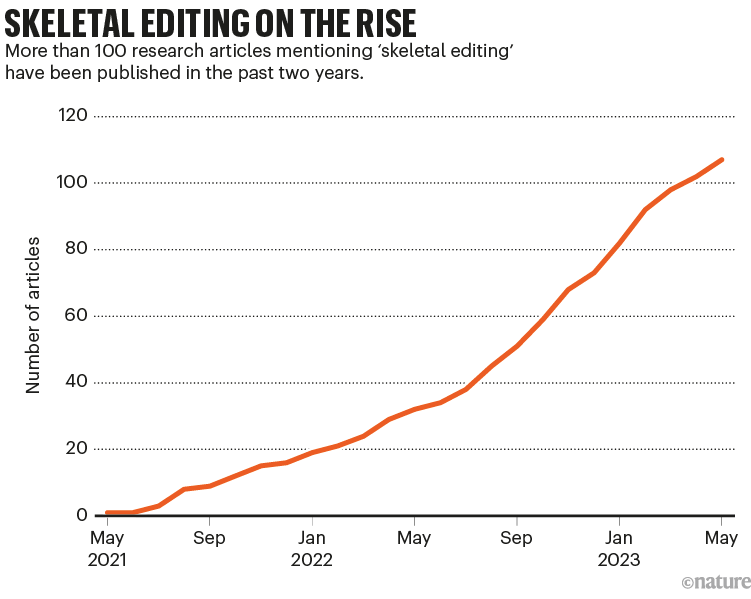
资料来源:使用数字科学维度数据库进行自然分析。
为了了解这一挑战,请考虑构成世界上大多数药物的碳基小分子通常含有少于100个原子,并且在一系列化学反应中一块一块地组装。有些连接分子骨架的大部分;其他人用原子簇装饰骨架以创建最终产品。但是,很少有方法能够在分子组装后可靠地调整其核心骨架。这有点像用乐高积木将房子夹在一起:改造外观是微不足道的,但如果不拆开房子,就无法将一块砖块插入完成的墙壁中间。
对于有机化学家来说,能够交换分子骨架中的原子的想法具有内在的魅力。“这些变化现在成为可能,这几乎是神奇的,”加州大学伯克利分校的里士满·萨尔蓬(Richmond Sarpong)说,他是骨骼编辑领域的领军人物。
但也有一个非常实际的目的。药物发现涉及首先找到一个有前途的分子,然后制作数百个略有不同的版本,以试图提高效力或降低毒性。改变分子外围的原子基团以产生变体相对容易。然而,为了编辑核心,研究人员通常必须回到合成的起点,从头开始制作修改后的骨架。这既昂贵又耗时,在实践中严重限制了制药公司筛选和测试的设计种类。可靠的骨骼编辑可以大大加快这一过程(参见“骨骼编辑的新兴化学反应”)。
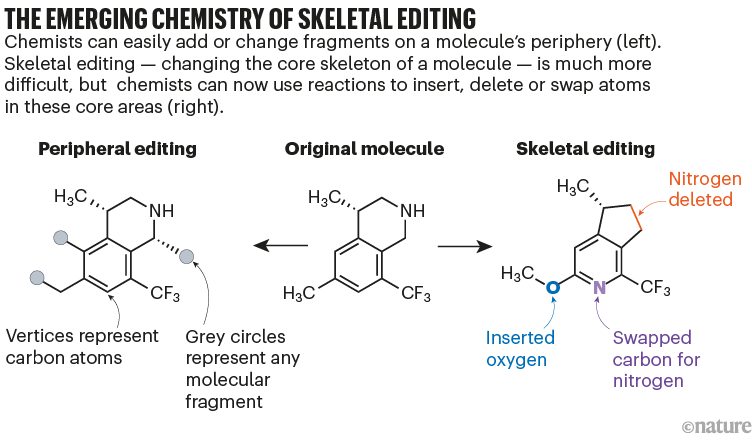
来源:参考文献9
在这个阶段,许多这些方法只适用于特定的分子,或者编辑它们的效率低下。研究人员很兴奋,但也对过度炒作一个年轻的领域持谨慎态度。
尽管如此,制药商辉瑞(Pfizer)和默克(Merck)的化学家已经在测试各种骨骼编辑反应。“我们认识到这可能是变革性的,”康涅狄格州格罗顿辉瑞公司合成,炎症,免疫学和抗感染化学负责人David Blakemore说。“现在还为时尚早,但我认为我们离能够使用其中一些方法还有很长的路要走。
骨架键
对于外行来说,有机化学看起来像是一堆令人困惑的象形文字——一堆锯齿形和六边形在页面上旋转的暴风雪。然而,这些图表是一个视觉词典,其中包含有关它们所代表的分子的丰富信息。形状中的每个顶点代表一个碳原子(伴随着未显示的氢原子),而它们之间的线是化学键。然后是自由的字母调味,代表氧,氮或硫等原子,散布在分子的骨架和外围。
当化学家想要制造特定分子时,他们首先以这种方式勾勒其结构。然后,他们通过擦除可以通过可靠反应锻造的键,逐步将这幅图雕刻成更小的碎片,留下更简单的碎片,可以从化学品供应商那里购买,或者从头开始酿造。

马克·莱文(Mark Levin),骨骼编辑的先驱,在手套箱(用于危险或空气敏感化学品的密封容器)工作。
在化学家的工具包中添加一组可靠的骨骼编辑反应可以提供一组全新的断开,从而实现更有效的合成和制造以前无法获得的化合物的方法。“这与我们过去对合成的看法非常明显,”爱荷华州立大学的有机化学家Junqi Li说。
回报可能是巨大的。合成分子的新型化学反应改变了药物的发现。2005年诺贝尔化学奖的部分原因是,在1990年代开发出用于复分解反应的有效催化剂的研究人员。这些将称为烯烃的化学基团焊接在一起(C = C双键);例如,该方法对于在一系列丙型肝炎药物中创建大分子环至关重要。2010年诺贝尔化学奖授予了在1960年代和1970年代开发出钯催化交叉偶联反应的研究人员,为在药物分子中锻造碳碳键提供了另一种方法。
在二十一世纪,编辑分子外围的反应取得了重大进展。碳-氢(C-H)键通常是化学中的被动旁观者,但在过去的二十年中,已经出现了一系列方法(通常称为C-H活化),用具有更有用化学性质的原子簇代替氢,称为官能团。
如果骨骼编辑可以应用于广泛的分子 - 以完全选择性添加或删除特定原子,并且不损害现有的官能团 - 该方法将与过去的创新并列,英国剑桥Astex Pharmaceuticals首席科学官David Rees说。“我认为它甚至可能比他们中的任何一个都大。
然而,这是一项艰巨的任务。人们可能很容易将骨骼编辑与已经席卷生物技术的基因编辑技术CRISPR相提并论。事实上,莱文说,这是一个糟糕的类比。CRISPR只需要处理DNA或RNA中的四个碱基 - 但为了使骨骼编辑可推广,编辑技术必须在数千种不同的分子上可靠地工作。
满足医疗需求
化学家们公布的骨骼编辑反应,一般都是根据药物化学家的需求量身定制的3.许多被设计用于编辑含有非碳原子(如O,N或S)的分子环:被称为杂环,它们在药物化学中无处不在。例如,大约60%的小分子药物含有氮杂环,部分原因是它通常有助于药物与蛋白质靶标很好地结合。4.药物化学家可能希望从杂环中删除一个原子,以便环收缩,改变其对蛋白质位点的适应度,或者添加一个原子来加强其结合。或者,他们可能希望调整分子以提高其溶解度或降低其毒性。
例如,Levin和他的团队已经开发出一种将碳原子插入五边形氮杂环以产生六边形杂环的方法(参见“骨骼编辑反应:插入碳”)。在生化术语中,这会将吡咯转化为吡啶5.“这是一个非常强大的反应,”布莱克莫尔说。吡啶是美国食品和药物管理局批准的药物中第二常见的杂环。然而,装饰重度的吡啶比相应的吡咯更难制造,因此莱文的反应可以为这些理想的骨骼提供更简单的途径。
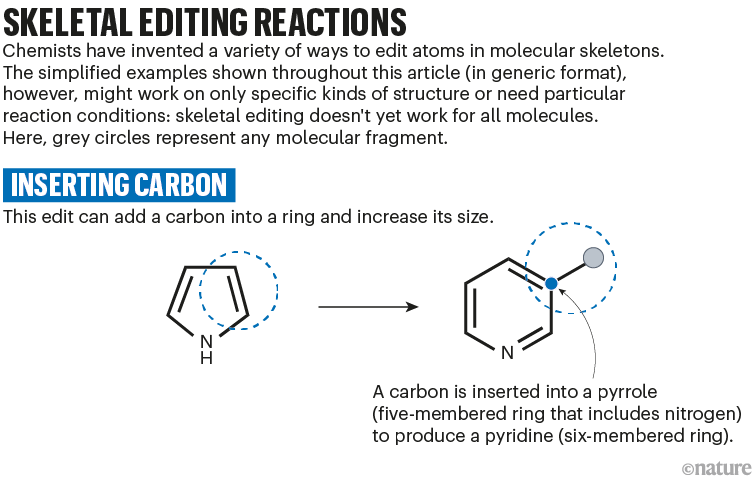
资料来源:参考文献5;省略了反应细节。
Julia Reisenbauer是苏黎世瑞士联邦理工学院有机化学家Bill Morandi团队的博士生,她开发了一种类似的反应,将氮气插入各种环中。6,7(参见'插入氮气')。“对于相当多的这些产品,使用已知方法访问它们会更加困难,”她说。
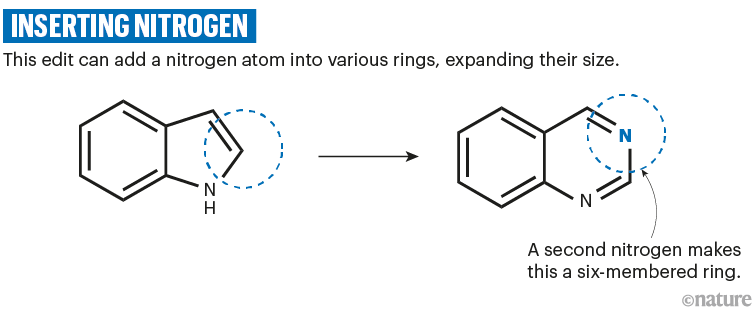
资料来源:参考文献6;省略了反应细节。
想要优化候选药物中氮原子效应的药物化学家有时会进行“氮扫描”,测试一系列类似物的生物活性,每种类似物几乎在每个可以想象的位置都有一个氮原子。8.
但是构建这些变体是耗时的,并且在化学上具有挑战性:氮原子有时会干扰合成中使用的催化剂和化学试剂,Rees说。使用骨骼编辑在合成结束时插入氮可能会避免这个问题,并提供一种在不完全重新合成每个类似物的情况下执行氮扫描的实用方法。

Julia Reisenbauer的氮插入编辑可以帮助药物化学家进行氮扫描。
还有越来越多的缺失反应可供选择,它们要么将原子从分子的骨架转移到它的外围,要么完全去除它。Levin和他的团队报道了从C-N-C基团中剪切氮的反应,这是药物中常见的基序。9(参见'去氮')——尽管他们使用的试剂不能很好地处理体积较大的分子,并且倾向于攻击一些敏感的官能团。
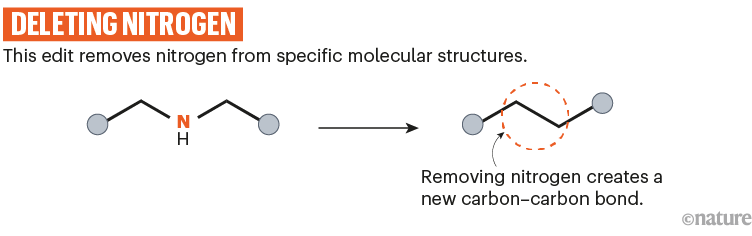
资料来源:参考文献9;省略了反应细节。
与此同时,Sarpong的小组提出了一种方法来删除位于六元环中两个氮原子之间的碳,称为嘧啶。10.(DNA中的胞嘧啶和胸腺嘧啶碱基都是嘧啶结构。
对于一些研究人员来说,最珍贵的骨骼编辑会在一个步骤中将一个原子换成另一个原子。“我一直痴迷于在任何骨骼中替换原子的想法,”莱文说。
去年,Li和她在爱荷华州立大学的同事Quang Luu公布了一种反应序列,该序列可以用氧取代碳原子,这种变化可能会提高分子在水中的溶解度。11(参见'换氧')。但到目前为止,该方法仅用于特定类型的分子骨架,该分子骨架含有碳原子,两侧有两个苯基团。Li还采用了用硼代替碳原子的方法,硼是一种可以帮助药物分子与糖或蛋白质结合的原子。
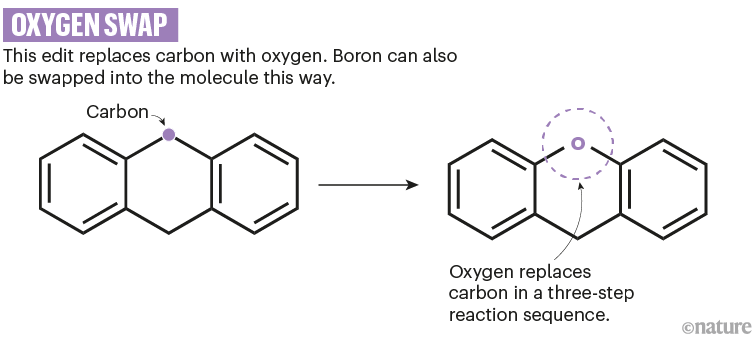
资料来源:参考文献11;省略了反应细节。
在加利福尼亚州的斯坦福大学,化学家诺亚·伯恩斯(Noah Burns)和萨扬·帕特尔(Sajan Patel)开发了一种由蓝光和氧气驱动的碳氮交换。12(参见'氮交换')。然而,它还涉及一种称为叠氮化物的高反应性化合物,该化合物以爆炸性不稳定性而闻名。
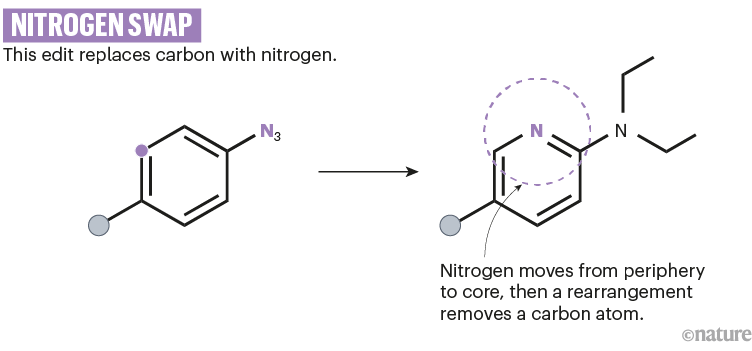
资料来源:参考文献12;省略了反应细节。
目前,原子交换“仍然没有通用的解决方案”,Levin说。“但是我们的实验室里有几件东西在做饭,还没有准备好迎接黄金时间,这是这个挑战的确切答案。
曲速编辑
与其他反应一样,所有这些创新都使用试剂,催化剂或光来推动或拉动原子的共享电子 - 在有机分子的化学键中将原子结合在一起的“胶水” - 以便可以引入新原子或切除现有原子。一些编辑反应有着深厚的历史根源——自十九世纪末以来,一些编辑已经实现了骨架编辑。例如,Baeyer-Villiger氧化插入一个氧原子;贝克曼重排插入氮气,该工艺每年生产数百万吨己内酰胺,尼龙的原料。(像有机化学中的许多反应一样,这些反应以其发明者的名字命名)。
但这些历史方法的范围有限。它们只能在称为羰基的官能团旁边插入原子,因为它们依靠其化学反应性来帮助打开分子。几十年前开发的其他骨骼编辑技术很少使用,因为它们咀嚼分子中的太多官能团或产生需要费力纯化的混乱混合物。
获得现代催化剂和试剂使改进成为可能,Reisenbauer说。例如,Levin和Reisenbauer的原子插入都模仿了1880年代的方法:Ciamician-Dennstedt重排。该反应倾向于破坏外围官能团,限制其使用,但改进的方法使用更宽容的试剂来产生清洁插入所需的反应原子。“我们总是建立在我们之前的基础和发现之上,”宾夕法尼亚州费城坦普尔大学的化学家Sarah Wengryniuk说,他是开发氧气插入编辑的团队的一部分。13(参见'插入氧气')。
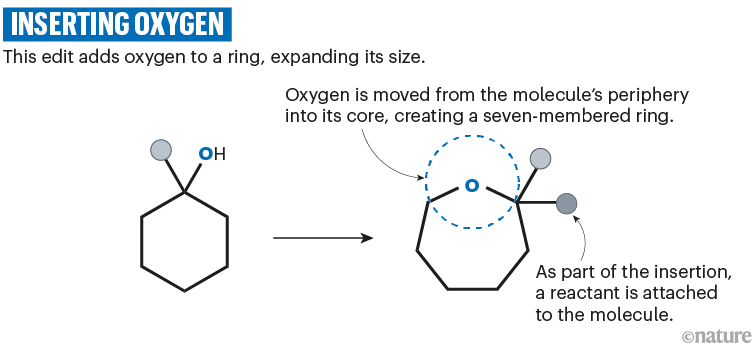
资料来源:参考文献13;省略了反应细节。
另一个进步在于光驱动反应断裂并重新连接原子键。几十年前,这些反应依赖于产生广泛波长的灯,有时反应产物在形成后立即破坏部分产物。如今,化学家使用发光二极管(LED)发射特定波长的光,这可以触发精确的编辑。
Sarpong开发了一种光驱动反应,如果有一个羰基靠近被切除的原子,则从环中切断N,O或S。14(参见'再次氮缺失')。关键是使用正确波长的蓝光来激发这个羰基并触发原子去除的重排。
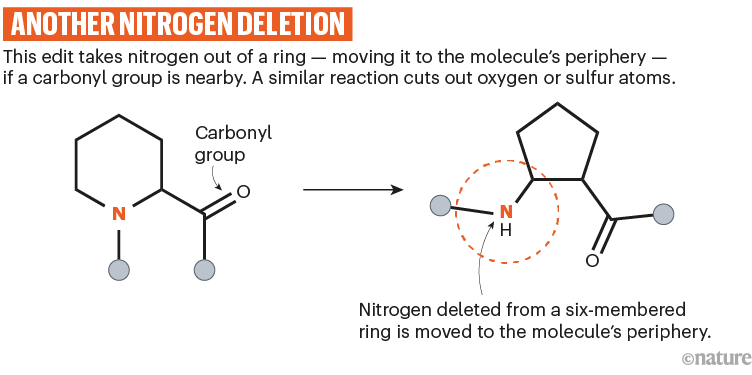
资料来源:参考文献14;省略了反应细节。
莱文的团队与默克公司的科学家合作,开发了一种反应,利用波长为390纳米的紫光从一些氮杂环中删除碳原子。15(参见“删除碳”)。
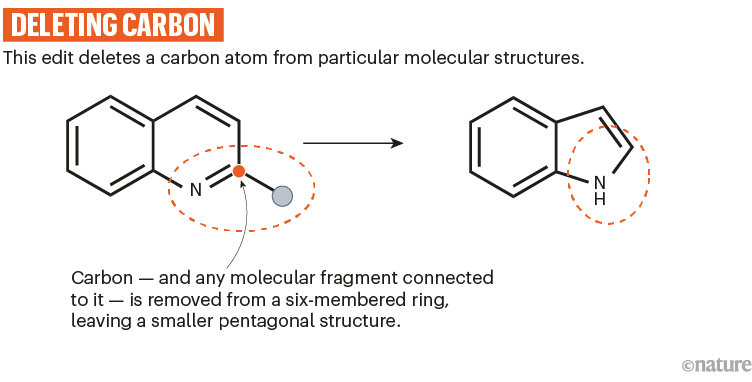
资料来源:参考文献15;省略了反应细节。
争论的骨头
骨骼编辑还可以在药物发现的早期阶段提供帮助 - 帮助药物化学家访问更广泛的分子以筛选类似药物的活性。
化学家把所有可能的有机分子的宇宙想象成一个叫做化学空间的领域。它包括多达 10 个60可能的药物样分子,每个分子都是具有潜在药用价值的闪烁之星16.理想情况下,制药公司的筛选库应该有来自整个化学领域的代表。但是,实际上,更容易制造的分子结构往往在这些文库中被过度代表,在药用化学空间中留下了大片未发光的空隙。17.
骨架编辑可以帮助推回这些边界。通过提供一步法来改变分子的骨架,这些反应充当化学空间中的虫洞,使研究人员能够从一个化合物星系旅行到另一个化合物星系。Sarpong说,这种策略已经在一些制药公司进行了试验(他和莱文都与默克公司的研究人员合作)。

化学家里士满·萨蓬(Richmond Sarpong),骨骼编辑领域的领军人物。
然而,即使是最热心的骨架编辑支持者也承认,常规使用存在许多障碍。有些反应效率不高,只能将一小部分分子转化为所需的产物。(然而,这对药物化学家来说可能无关紧要,因为药物发现的早期阶段通常只需要少量的所需分子。
另一个困难是,许多编辑依赖于高反应性试剂,这些试剂会产生不需要的副产物,或者在工业中可能被认为过于危险。“这是我目前最大的保留,”布莱克莫尔说。有时,必须预先安装额外的分子片段以保护脆弱的官能团,然后在反应完成后将其移除。虽然这个概念在化学中已经确立,但它使整体编辑效率降低。

Sarah Wengryniuk,一个开发氧插入编辑的团队的一员。
也许最大的挑战是使方法更加通用,以便每个反应在各种骨架上可靠地工作。然而,药物化学中许多最有用的反应最初只有有限的范围,并且有迹象表明骨骼编辑同样可以变得更加通用和方便。
一个有希望的迹象来自研究原子和键如何随着反应的进展而移动,形成称为过渡态的短暂中间形式。一些骨骼编辑反应具有相似的机制,这表明常见的,也许是可推广的反应基序在起作用。寻找更温和、更具选择性的试剂来达到这些类型的中间体可能会解锁更广泛的编辑。
更广阔的视野
随着化学家们努力加强骨骼编辑的基础,这些技术已经触及了药物发现以外的领域。例如,北卡罗来纳大学教堂山分校的聚合物化学家Aleksandr Zhukhovitskiy和Rachael Ditzler已经表明,类似的反应可以编辑聚合物的碳基主链。18.这种反应最终可能有助于回收塑料,或者更容易使用可持续的生物分子来生产目前由化石燃料原料制成的日常聚合物。
Sarpong利用他的光驱动氮缺失来修饰肽的结构,肽是氨基酸的短链。舒尔茨说,这样做的一般方法可能非常有用。例如,经过编辑以包含非天然氨基酸结构的口服肽药物可能能够更好地承受消化酶 - 而不会失去其效力。“这可能是一项改变游戏规则的技术,”她说。
与此同时,Morandi的团队将不寻常的同位素,如氮-15或碳-13插入药物分子中。7,19(参见'同位素交换')。例如,药物化学家可以在实验中使用这种策略来跟踪药物的代谢,或者了解它如何与其蛋白质靶标相互作用。
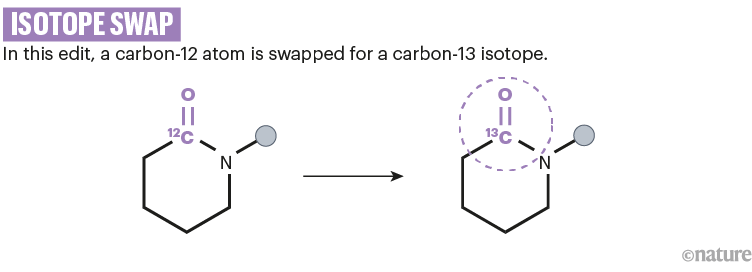
资料来源:参考文献19;省略了反应细节。
很明显,骨架编辑充满了新方法的想法,这个领域充满了早期职业研究人员,他们既有竞争力,又有协作性。“我们想进来做一些人们认为新的、有趣的和不同的事情,”莱文说。“我认为这是未来。”
‘Almost magical’: chemists can now move single atoms in and out of a molecule’s core (nature.com)
https://blog.sciencenet.cn/blog-41174-1390103.html
上一篇:高压氧悖论和大脑疾病治疗
下一篇:大脑信息传递的模式是波