博文
[转载]hLife | 刘继勇、焦仁杰研究团队揭示肠道PGRP-SC介导固有免疫记忆调控果蝇对抗细菌感染
||
狂犬病是一类重要的、由狂犬病毒引起的急性人兽共患传染病,一旦发病几乎 100% 致死。统计数据显示,每年全球约有5–6万人罹患狂犬病,严重威胁人类的生命健康安全。狂犬病作为持续威胁公共卫生安全的烈性传染病,需要研究人员、医疗从业者和政策制定者协同创新。通过科技进步与多领域合作,降低狂犬病的危害,为人类与动物群体构建更安全、更健康的未来。
近日,四川大学华西医院逯光文研究团队在hLife发表了题为“Rabies virus glycoprotein: Structure, function, and antivirals”的综述文章(图1),聚焦狂犬病毒的关键毒力因子——糖蛋白,系统总结了糖蛋白构象变化的结构特征及现有中和抗体和防治药物的阻断机制,为抗病毒靶点选择和药物设计提供理论支撑。

图1 论文标题及作者信息
狂犬病毒(Rabies virus, RABV)属于弹状病毒科狂犬病毒属,是导致狂犬病的最主要病原体。狂犬病毒的基因组为单股负链RNA,可编码5种蛋白:核蛋白(nucleoprotein, N)、磷蛋白(phosphoprotein, P)、基质蛋白(matrix protein, M)、糖蛋白(glycoprotein, G)和RNA聚合酶蛋白(large RNA polymerase protein, L)。其中,狂犬病毒G蛋白(Rabies virus glycoprotein, RABV-G)是病毒囊膜表面的唯一蛋白组分,也是打开人体细胞大门的“钥匙”。在一个完整的病毒复制周期中,RABV-G可识别细胞表面多种潜在受体,将病毒锚定在细胞膜上;随后细胞膜内陷,将病毒粒子包裹于内体(endosome)中,并伴随内体环境pH值的降低,RABV-G发生构象变化,进而驱动病毒囊膜与内体膜融合(图2)。
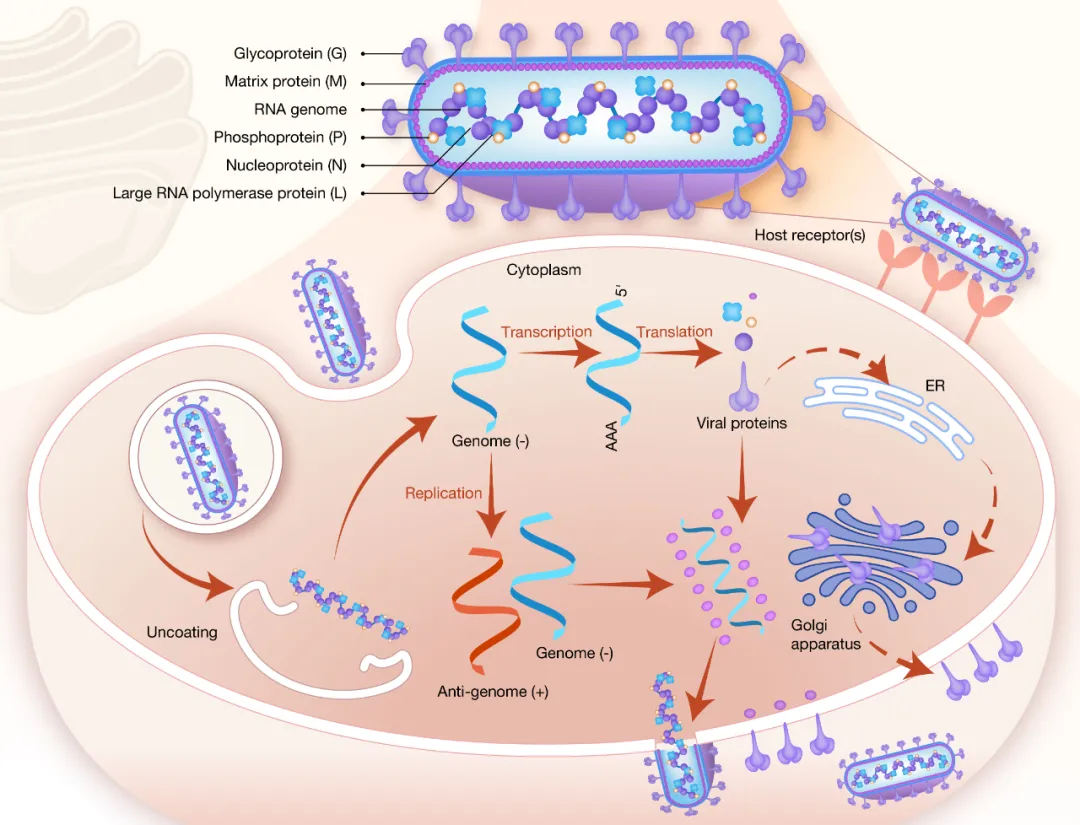
图2 狂犬病毒粒子结构及其生命复制周期
首先,RABV-G是介导病毒侵入的关键组分。RABV-G全长包含524个氨基酸,在病毒粒子表面一般以同源三聚体形式存在,从N端到C端依次由信号肽、胞外域、跨膜区和胞内段组成;其中,胞外域是介导受体识别和膜融合的核心区域,也是中和抗体的最主要靶点。胞外域又可进一步分为三个结构域:CD、PHD和FD。在从“融合前”向“融合后”的转变过程中,三个结构域间会发生较大的空间方位变化,使RABV-G由弯曲的“发夹状”转变为延展的“棒状”构象。这一时空构象变化过程可能包括至少四个阶段(图3):融合前状态、早期-过渡态、晚期-过渡态和融合后状态;并且不同于其他病毒的囊膜蛋白的是,RABV-G的构象变化是可逆的。截至目前,RABV-G的“融合前”三聚体结构、早期-过渡态和晚期-过渡态的结构均已报道,但“融合后”三聚体结构仍未被解析,是未来亟待开展的重要研究方向之一。
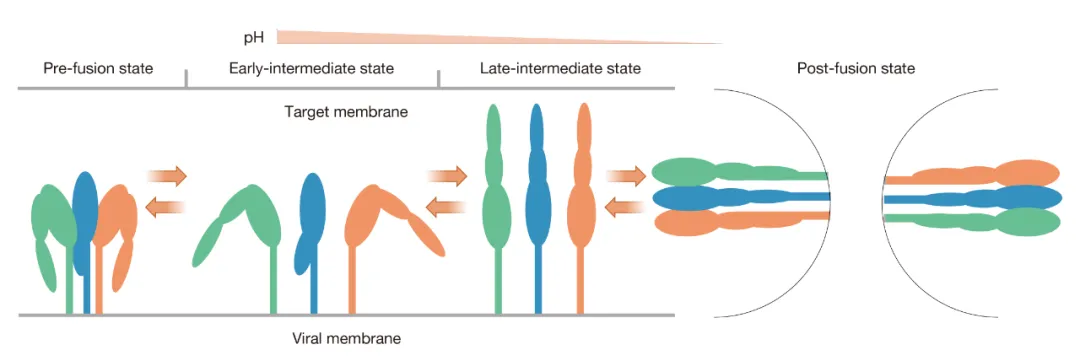
图3 RABV-G的时空构象变化模式
其次,RABV-G还是中和抗体的重要靶标。目前已鉴定的抗原表位包括抗原位点I、II、III、IV,以及 G1 和 G5 等其他位点。大部分抗体靶向表位I/II/III,均位于G蛋白的PHD和CD结构域。例如,抗体RVC20、NM57和SOJB均结合抗原位点I,能够锁定PHD和FD之间铰链区的融合前构象;抗体RVA122主要识别抗原位点III,结合于RABV-G三聚体顶部,能够阻断CD和PHD之间的构象变化;抗体523-11识别CD上的构象表位,可能通过抑制病毒与受体的互作来发挥抗病毒活性;抗体1112-1则主要结合在PHD结构域的抗原位点II上,同时也与抗原位点I的部分氨基酸存在互作。上述对中和表位以及中和机制的归纳总结,为新型抗体设计提供了重要的结构信息。
此外,一些小分子抑制剂也以RABV-G为靶点发挥抗病毒活性。例如,小分子GRP-60367推测结合于G蛋白FD结构域的融合环区域,通过阻断侵入来抑制感染;小分子Clofazimine也被报道能够抑制狂犬病毒的侵入,其抗病毒活性依赖于阻断RABV-G介导的膜融合过程。
最后,RABV-G还是所有狂犬疫苗的核心抗原,靶向RABV-G的创新疫苗研究为更高效的狂犬病预防提供了新的契机。例如,搭载了双G基因的灭活疫苗,与灭活的亲本病毒相比,免疫后可以诱导产生更高水平的中和抗体;编码G蛋白的mRNA疫苗也展现出良好的体液和细胞免疫激活能力,可在动物模型中有效防护病毒感染。重组蛋白疫苗以其安全性优势成为另一种研发选择,但单一的G蛋白结构域免疫原性不足可能制约其作为商业化疫苗的开发,通过将其展示于纳米颗粒表面,能够极大提高其免疫原性并诱导产生更好的免疫保护效果。
RABV-G作为狂犬病毒的"阿喀琉斯之踵",其结构与功能研究已取得了诸多进展,但仍存在大量亟待深入的问题。病毒入侵起始于G蛋白结合宿主受体,解析G蛋白-受体复合物结构以阐明病毒黏附入侵的分子机制,是当前亟待攻克的难题;解析目前仍缺失的RABV-G“融合后”构象的三聚体结构,可以更完整地阐明RABV-G的时空构象变化模式;解析更多中和抗体与RABV-G的复合物结构,将有助于绘制更全面的RABV-G抗原表位图谱,推动疫苗与抗体药物的开发。
作者简介
游瑜 助理实验师
第一作者
机构:四川大学华西医院生物治疗研究中心
研究方向:病原与宿主互作的分子基础研究;抗体表位鉴定;疫苗免疫保护效果评价
杨凡力 副研究员
第一作者
机构:四川大学华西医院生物治疗研究中心
研究方向:狂犬病毒、痘病毒等病原侵入与致病机制研究;基于结构的疫苗和抗体设计及其保护效果评价
逯光文 研究员
通讯作者
机构:四川大学生物治疗全国重点实验室、四川大学华西医院急诊科、四川大学华西医院生物治疗研究中心
研究方向:病毒侵入与致病机制研究;病毒与宿主互作的分子基础研究;基于结构的疫苗设计和抗体改造;基于结构的抗病毒靶点鉴定和抗病毒药物的筛选与优化
引用格式:You Y, Yang F, Lin S, et al. Rabies virus glycoprotein: Structure, function, and antivirals. hLife 2025; https://doi.org/10.1016/j.hlife.2025.06.003.
期刊简介
hLife 由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife 聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊;2024年5月被DOAJ收录;2024年8月被Scopus收录;2024年10月入选“首都科技期刊卓越行动计划——重点英文科技期刊支持项目”;2025年6月入选北京市科委“2025年度支持高水平国际科技期刊建设-强刊提升”项目;2025年8月入选中国科学引文数据库(CSCD)核心库。
hLife实行高标准与高效率并重的同行评审机制:
投稿至给出“是否送审”决定⏰1天
投稿至给出“首轮审稿”决定⏰28天
投稿至给出“是否录用”决定⏰61天
2026年前hLife接收的稿件免收文章处理费(APC)。
https://www.sciencedirect.com/journal/hlife
https://blog.sciencenet.cn/blog-3552961-1507294.html
上一篇:[转载]中国科学院微生物研究所hLife编辑部招聘期刊编辑1名
下一篇:[转载]hLife | 上海交大刘宁宁研究团队阐述全球抗真菌药物研发新进展