博文
我们不知道答案的125个科学问题(81)母婴免疫之谜  精选
精选
||
81. 为什么孕妇对胎儿没有免疫排斥反应?
Why doesn't a pregnant woman reject her fetus?
题记:即使胎儿拥有一半来自父亲的外来基因,母体免疫系统也没有把胎儿当作“外来物”而产生免疫排斥反应。正如诺贝尔奖获得者彼得-梅达沃(Peter Medawar)在1952年首次提出这个问题时所说的那样:“这个问题的原因到现在还未得到科学界的确认”。
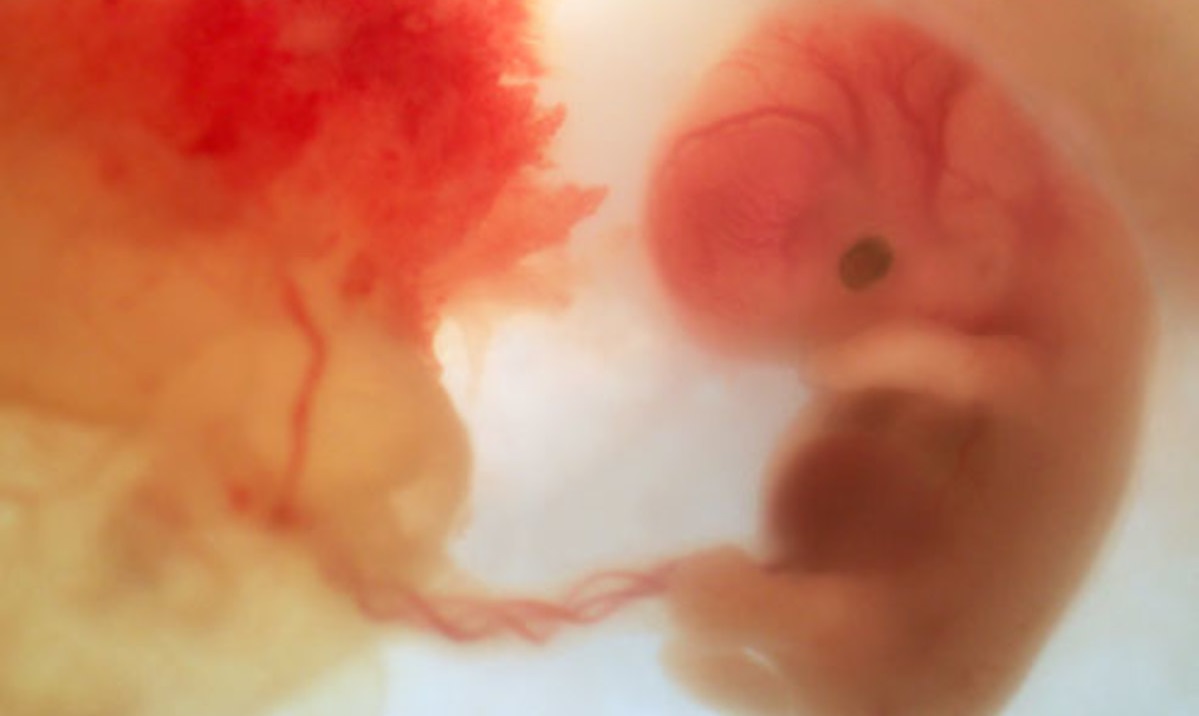
图1 胎儿和母体的连接
关于人类免疫系统的最后一个谜题就是:胎儿是如何规避母体免疫系统的免疫排斥反应的?胎儿在孕妇子宫内通过胎盘(placenta)连接着母体的血液系统为其提供营养物质,所以胎儿细胞可以通过胎盘自由进入母体的血液循环系统。由于胎儿细胞一般是多能性的,这就意味着它们可以驻留在母体的某些组织内,利用来自邻近细胞的化学信号,生长成与周围组织相同的物质,构成所谓的微嵌合体(microchimera)。这种婴儿细胞的微嵌合体可以通过母体血液的DNA来检测,随着深度测序技术的发展,研究人员能够对基因组中的许多区域(包括与免疫相关的基因)进行采样,从而更全面地确定母体组织中外来DNA的起源。
虽然母体免疫系统通常会在婴儿出生后从血液中清除未改变的胎儿细胞,但那些已经与母体组织结合的细胞则会逃脱检测,滞留在母体内。更为奇怪的是,母体免疫系统似乎“认识”这些来自胎儿的细胞,不会对它们产生免疫性攻击反应。本科学问题就是:母体免疫系统为什么不会对胎儿产生免疫排斥呢?
根据前面的科学问题先天免疫和后天免疫机制,机体对外来病原体免疫防御的一个主要特征是:入侵部位的炎症反应并产生多种细胞趋化因子。趋化因子会招募各类免疫细胞,包括活化的T细胞,聚集到炎症发生区域对病原体进行免疫清除。趋化因子介导的活化T细胞被召集到炎症部位是免疫反应的一个重要过程。然而对母婴而言,则根本不会发生炎症和免疫反应,目前解释这种奇异现象的主要理论有:(1)母婴之间的物理屏障;(2)母体免疫系统的普遍和局部抑制;(3)孕期细胞因子如酶和蛋白等物质浓度的变化。
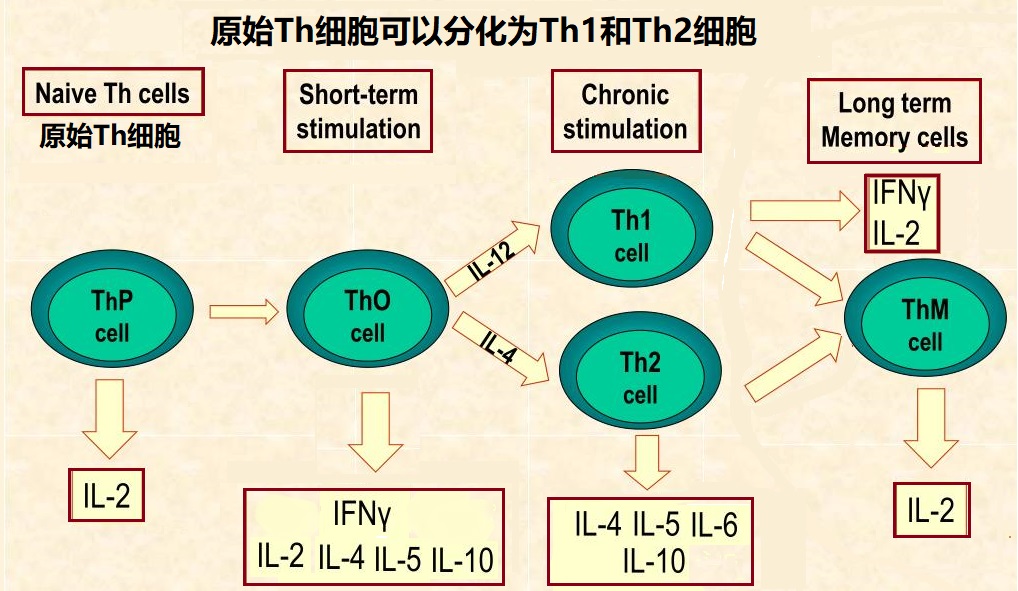
图2 辅助T细胞的分化和细胞因子的分泌
物理屏障假说:这种理论认为胎儿和母亲之间形成的物理屏障导致了彼此的免疫细胞无法相互识别。母体子宫存在一个物理屏障,由包裹胎儿的合体滋养细胞组成,而胎儿的着床部位就是滋养细胞侵入子宫的区域。滋养层细胞会分泌化学引诱剂,向免疫细胞发出信号,使其迁移到侵入部位;然后滋养层细胞产生调节免疫细胞分化的细胞因子让免疫细胞对彼此细胞做出“记忆”训练,彼此在此处“相互认识”,从而停止“敌对”反应。这样在侵入部位会形成一个称为物理屏障的缓冲地带,双方活化的T细胞就无法从外围进入该区域而产生免疫反应,因为大家彼此被该物理屏障隔离了,所以“相安无事”。这就如同在此处双方协商了一个军事缓冲区,那些能够发生免疫反应的细胞被这个区域隔离。实验发现,尽管大量的T细胞会定位于妊娠小鼠子宫壁的肌肉层,但在包住胎儿和胎盘的子宫组织蜕膜中发现的T细胞数量却很少。问题是到底合体滋养细胞是如何在此“教育”彼此的免疫细胞相互认识而不产生招募物质,这在分子层次上或生化机制上并不清楚。
免疫抑制假说:该理论认为并非是母婴物理缓冲区域的隔离造成免疫细胞没有彼此的“外物”识别反应,而是因为母体的免疫系统被全面抑制。研究发现,免疫细胞中参与抗原呈递的重要免疫细胞巨噬细胞,能使杀伤型T细胞彻底失效,由此阻止T细胞攻击被识别为“外来物质”。胎盘中的突触滋养细胞能产生一种特殊的酶(IDO:吲哚胺二氧合酶),它能分解色氨酸,而色氨酸是T细胞破坏外来物所需的一种氨基酸,所以合体滋养细胞通过分泌IDO抑制了母体T细胞对胎儿的免疫反应。相反,如果母亲不能产生足够的IDO,则会导致胎盘周围的炎症反应或导致母亲流产;除了母体免疫系统的普遍抑制外,研究人员还发现母婴蜕膜细胞的局部主动免疫抑制。蜕膜是妊娠期间子宫的一层粘膜,在胎盘形成之前母婴的营养和氧气通过它来发生交换。位于蜕膜中的细胞可以抑制淋巴细胞的产生,抑制如白细胞介素2 (IL-2)受体的产生和表达。IL-2是一种由活化T细胞产生的细胞因子或信号分子,它对身体的异物排斥至关重要。这种类型的细胞抑制是不同于滋养细胞的全局免疫抑制,但它的抑制作用可能依赖于滋养细胞,所以局部主动抑制有助于母亲免疫系统对胎儿产生排斥反应。还有研究表明(Nature 563:347,2018),胚胎细胞能刺激母体细胞产生一些控制免疫反应的免疫细胞,但这些母体自然杀伤细胞不是“战士”,而是“维和人员”,它们能阻止其他免疫细胞攻击胎儿,并产生促进胎儿生长和血管连接的化学物质,这些自然杀伤细胞在一定程度上受蜕膜中称为基质细胞的某些细胞所控制。
细胞因子转移假说:这一假设表明,孕期母体内免疫细胞因子的平衡发生转换,不同细胞因子浓度的转移引起母体免疫反应的变化。免疫细胞因子在免疫中是一类非常重要的信号物质(小分子蛋白质),它们主要由两种不同亚型的辅助T细胞(T helper cells)产生,分别称为Th1和Th2辅助细胞。它们释放的细胞因子会促进不同的免疫反应。当细菌病毒出现时,Th1细胞会分泌促炎细胞因子,发出细胞介导免疫反应的信号;而Th2细胞分泌的细胞因子能促进抗体的产生,介导对大型微生物的体液免疫反应。过强的Th1免疫反应会导致自身免疫性组织损伤,而Th2免疫反应会抵消Th1免疫反应,所以孕期母体免疫反应会从Th1免疫向Th2免疫转变,细胞因子浓度的平衡会从Th1细胞因子向Th2细胞因子的方向发展,从而导致炎症反应被抑制,产生母婴之间的免疫耐受性。然而如何产生细胞因子平衡的转移却在细节上依然非常模糊。
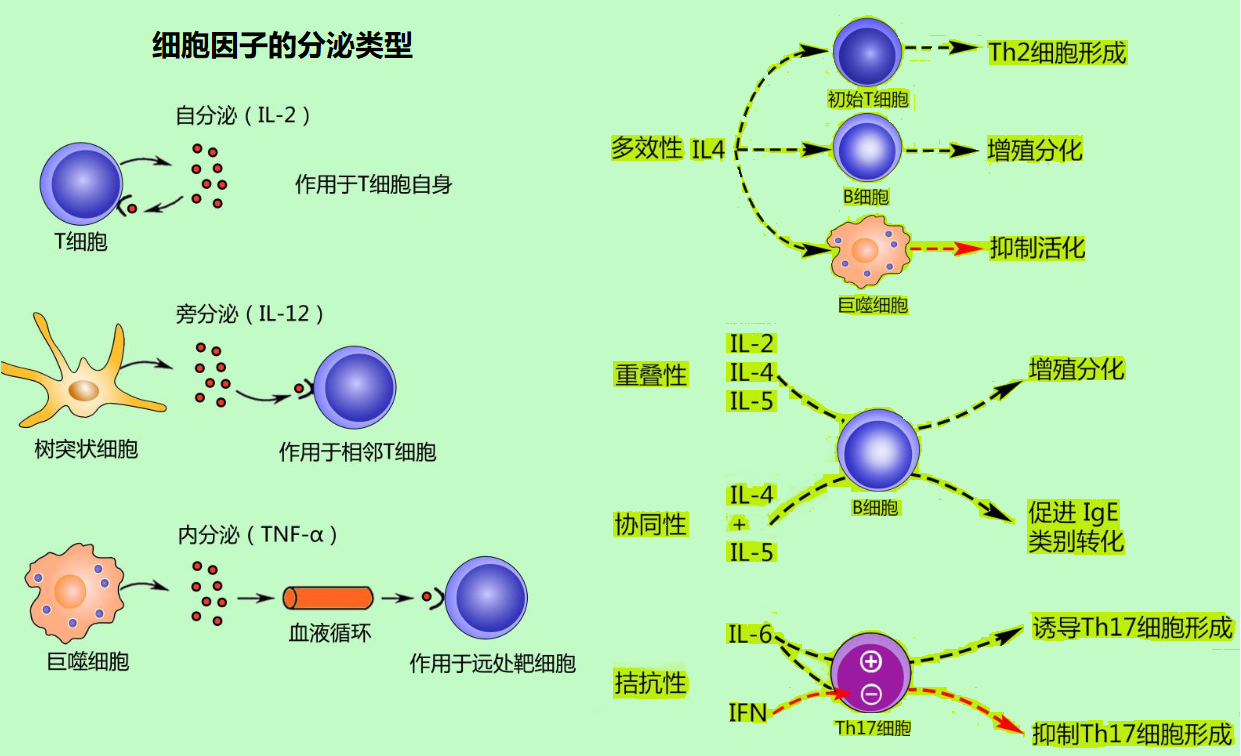
图3 细胞因子的分泌类型和多级功能
总而言之,以上的三种母婴免疫耐受性机制并非相互独立而是互相补充并且共存的。母婴免疫耐受性显然是因为母体免疫系统没有启动而受到抑制造成的,相反如果母体免疫耐受过程出现问题,则必然导致流产、胎儿死亡、先兆子痫和早产等疾病。同样胎儿的免疫系统面临同样的问题,胎儿免疫系统必须在其出生后获得免疫能力,但在出生前则要避免攻击母体。研究发现,早在发育13周时,胎儿就能产生一系列的免疫细胞,包括树突状细胞,它们能识别入侵者,并能向其他免疫细胞发出攻击信号。根据正常的免疫过程,树突状细胞一旦发现外来物通常会发出信号,加速T细胞的增殖,然后通过T细胞去攻击入侵者。然而胎儿的树突细胞能开启不同的基因(合成招募免疫细胞到炎症部位的细胞因子的基因在蜕膜内也会被关闭,趋化因子不表达,T细胞不能被募集到胚胎着床部位,T细胞不能在蜕膜内进一步积聚Science 336: 1317,2012),抑制T细胞的增殖,并阻止T细胞产生细胞因子(例如 TNF-α:一种细胞因子,它在炎症、细胞凋亡和免疫系统发育中起核心作用),它还能产生大量抑制免疫反应的生物酶,降低免疫系统的免疫反应。胎儿细胞控制免疫反应的机制可以在成年人身上利用这种能力找到治疗自体免疫性疾病的新方法。
通过多种途径的不断探索,生物学家们正在全面揭示免疫反应的激活和抑制的机制,不断丰富免疫反应激活和抑制的途径和炎症机制的介质,而其中还有一个有趣的结果就是:补体蛋白的激活机制。研究表明,补体蛋白的活化与许多自身免疫过程相关,包括狼疮、类风湿关节炎、哮喘和各种肾脏疾病等等。在怀孕期间,补体蛋白激活似乎在与抗磷脂综合征相关的胎儿丢失中起关键作用。有研究现表明,妊娠早期补体激活(或抑制失败)会导致更高的早产风险,早期那些被认为是早产的感染性或炎症性原因,可能不是外部感染的结果,而是早期异常补体蛋白激活导致的。
总结:对母婴免疫之谜的研究表明,生物体的免疫反应是由各种细胞因子介导的一系列连锁反应造成的,无论是通过细胞因子、生物酶或者补体蛋白的生物调节,免疫系统完全可以通过生物活性物质的介导而获得增强或抑制,对母婴免疫反应抑制的研究对揭示生物免疫系统的微观作用机制具有重要的科学借鉴意义。
https://blog.sciencenet.cn/blog-318012-1433667.html
上一篇:我们不知道答案的125个科学问题(80)后天免疫
下一篇:我们不知道答案的125个科学问题(82)生物钟同步