博文
我们不知道答案的125个科学问题(76)治愈癌症  精选
精选
||
76. 癌症只能被控制而不能被治愈吗?Can cancers be controlled rather than cured?
题记:切断肿瘤营养供应的药物——比如通过阻止血管生长——可以安全地抑制甚至逆转肿瘤的生长。但这些药物的药效能维持多久人们却并不知道。
随着人类医疗技术的进步,我们最想问的问题可能就是:癌症到底能不能被彻底治愈?对于这个问题基本有两种观点。一些专家认为:完全可以,而另一些专家则认为:癌症最终只能作为一种被控制的慢性疾病而存在。
其实,无论可不可以,癌症如果能被控制而不扩散,彻底治愈或成为陪伴人一生的慢性病二者并没有本质区别。然而癌细胞是干性细胞,只要人体存在不断分裂的正常细胞,那让细胞发生癌变的特定环境总会遇到(谁还没有抽个烟、喝个酒、吃上几口垃圾食品啥的)。癌细胞来自于正常细胞的变异这个事实说明:任何具有分裂能力的正常细胞本身都携带有致癌基因(oncogenes),这是因为人体的某些细胞需要保持不断分裂的能力来进行人体的新陈代谢(癌症容易发生在具有不断分裂能力的组织细胞中,而分裂能力彻底抑制的细胞,如心脏细胞,就较难发生癌变)。那些控制细胞分裂的基因调控被致癌事件所改变,受控分裂的细胞就变成一种不受控制而无序增殖的活跃细胞,它们不仅可以“逃避”免疫系统的攻击,还能“忽悠”周围的正常细胞为它们提供服务(如让血管增生为它们输送营养)。而且癌症干细胞一旦产生就可以非常方便地通过人体内循环系统(血液和淋巴系统)进行迁移,而且总能找到合适的组织环境继而发展(或复发)为肿瘤,所以治愈癌症的关键点就是对癌症干细胞的有效的控制。如果癌细胞不转移,癌症就可以最终得到治愈。
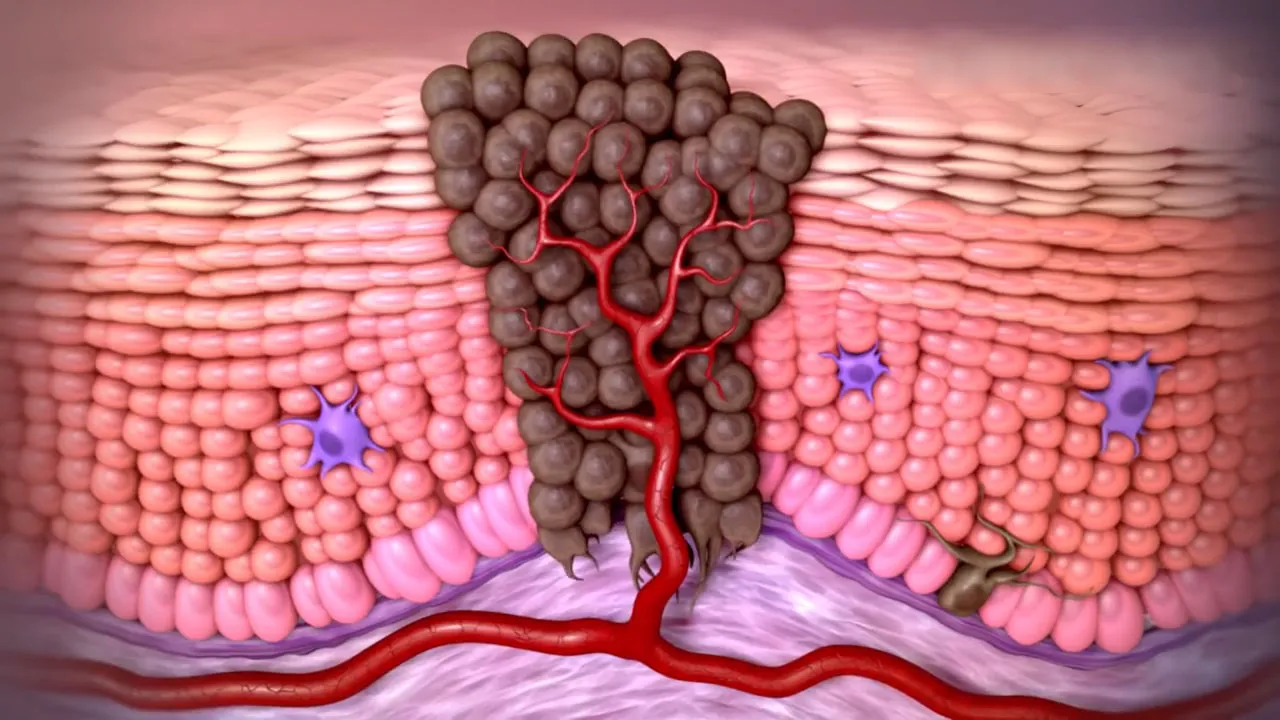
图1 癌症肿瘤的周围环境
所以控制肿瘤生长的一个最为直接的想法就是:能不能阻断癌症细胞的营养供给,让癌细胞通通地饿死?但问题还是在于能不能只让癌细胞饿死而又不伤及正常细胞,这就是靶向药物疗法最初的想法,它通过使用阻止肿瘤周围血管、淋巴管生长的细胞靶点来切断肿瘤的营养供应达到控制肿瘤的目的。研究表明,当肿瘤细胞缺氧时,会释放刺激血管生成的诱导因子,促进血管细胞的分裂生长以增加氧气和营养物质的供给,满足肿瘤的增殖或转移。所以可以通过切断“肿瘤细胞释放诱导因子激发血管增殖”这一过程的信号响应通路(如抑制血管内皮细胞生长因子、纤维细胞生长因子、血小板生长因子等)去控制血管增生,继而控制肿瘤生长。这类分子靶向药(即分子靶点血管生成抑制剂)在癌症治疗中取得了显著的效果。
然而,针对肿瘤细胞的分子靶向策略并不仅仅限于利用抑制血管生长因子的“断粮断供”来阻止癌细胞增殖,更多的靶向药则是通过对癌细胞不正常或失调的蛋白质小分子的抑制剂去干扰肿瘤生长过程中的特定分子,实现抑制或阻断肿瘤的继续发展。由于这些药物充分利用了正常细胞和癌症细胞生理活动的差异性,使得靶向药物的副作用比直接杀死癌细胞的毒性药物的副作用要小很多。然而不幸的是目前靶向药并非是万能的,它只对某些类型的癌症有效, 而且靶向药有靶向阻断后的其他副作用,进而癌细胞耐药基因的进化使得靶向药的疗效无法进一步稳定提高。
图2 癌细胞的非正常分裂
电影《我不是药神》里治疗“慢性粒细胞白血病(CML: chronic myelogenous leukemia)”的“格列卫”(Gleevec:甲磺酸伊马替尼)就是世界上最早研究的肿瘤靶向治疗药(在2001年5月上市)。CML是血液中白细胞异常增殖的一种血液系统癌症。1984年,科学家发现人体的22号染色体和9号染色体发生易位之后,形成了一段被称为BCR-ABL的融合基因(BCR-ABL fusion gene,其中BCR部分来自9号染色体,ABL来自22号染色体,如图3所示),这段融合基因编码合成了一种特异的酪氨酸激酶信号蛋白(Tyrosine kinase,即BCR-ABL蛋白或酪氨酸激酶,它是一种常见的信号分子,它被激活时会引发细胞分裂),正是在这种蛋白质的持续作用下(活跃时间过长)导致人体血液中白细胞异常增殖(一个健康人每立方毫米血液中含有大约4000到1万个白细胞,而同样体积白血病患者血液中白细胞的数目是该值的10到25倍),最终形成慢性粒细胞白血病。所以一个策略就是去除或降低BCR-ABL蛋白的活性来治疗白血病,这就是著名的靶向治疗药“格列卫”,它的标靶就是BCR-ABL蛋白(即酪氨酸激酶蛋白)。格列卫通过抑制酪氨酸激酶蛋白与BCR-ABL复合基因(急性或慢性髓系白血病)、PDGF(血小板衍生生长因子,与淋巴细胞增殖有关)、SCF(干细胞因子)和KIT蛋白的结合,来降低其活性去控制血液细胞的非正常增殖,所以它不仅可以用来治疗髓系白血病,还能用于治疗急性淋巴细胞白血病、高嗜酸性粒细胞综合征等疾病。然而很明显格列卫的副作用就是因为抑制了血液细胞增值也就是降低了血液细胞的数量,导致人体更容易发生其他问题和感染。
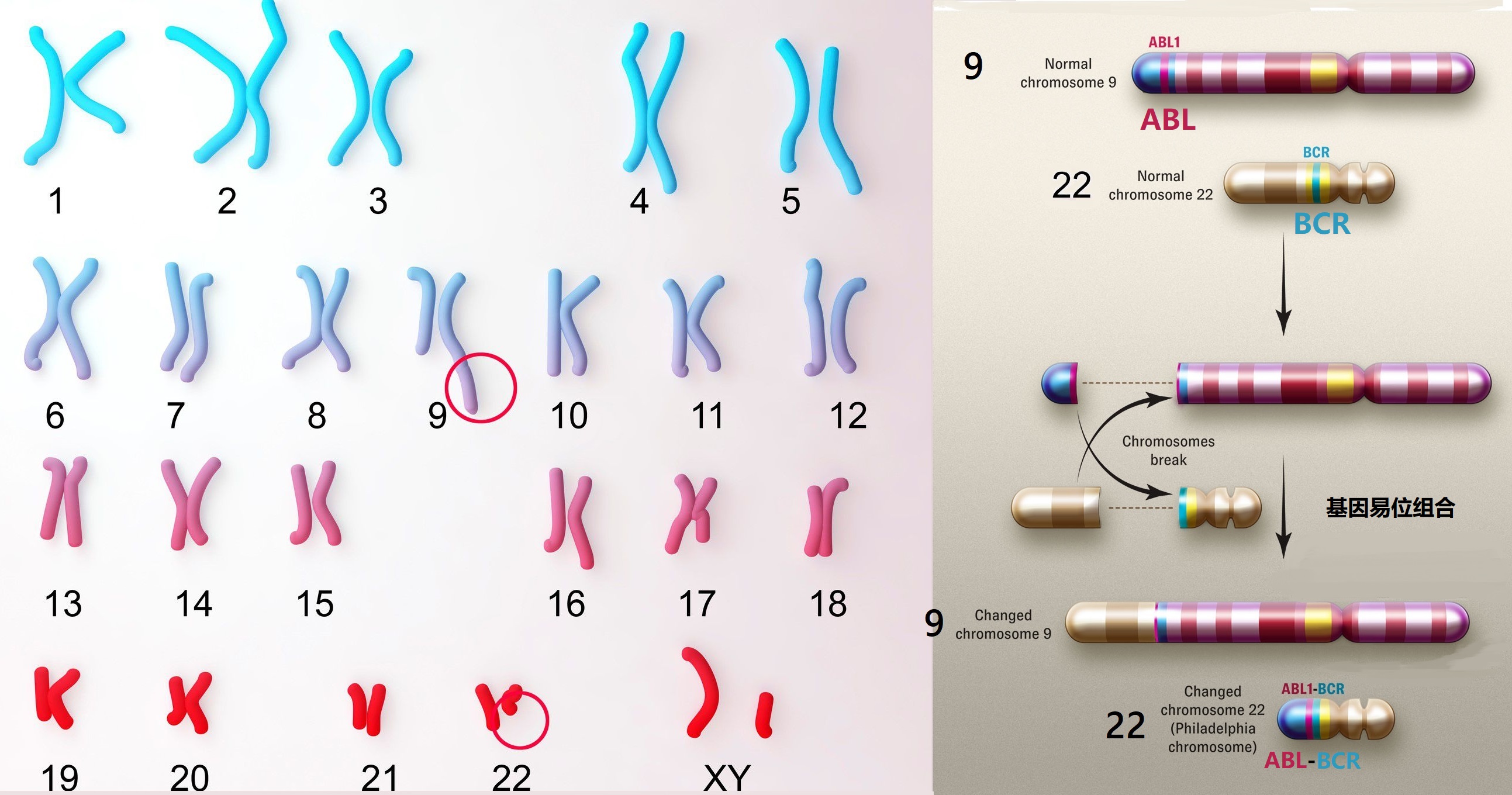
图3 和CML白血病有关的费城染色体及BCR-ABL复合基因
随着分子靶向治疗的发展,人类在分子水平开发了针对各种环节抑制癌细胞发展的靶向药,如通过介入细胞信号转导通路、抑癌基因、细胞因子受体、抗肿瘤血管形成、自杀基因等等来控制癌症的发生和发展。而随着分子水平药物的进步,人类迎来了癌症治疗史上的第三次革命:利用人体免疫系统去治疗癌症的免疫疗法。它利用人体免疫系统中的免疫细胞反应来对抗癌细胞。癌细胞之所以能逃避免疫系统就是癌细胞可以释放对免疫细胞起抑制作用的分子,避免让免疫细胞产生免疫反应,这就是所谓的免疫检查点抑制剂(免疫检测点受体介绍可参见 Immunity,44(5)989-1004,2016:程序性细胞死亡蛋白1 (PD1)、细胞毒性T淋巴细胞抗原4(CTLA4)、T细胞免疫球蛋白和粘蛋白结构域3(TIM3)、淋巴细胞活化基因3(LAG3)和T细胞免疫球蛋白和ITIM结构域(TIGIT)是主要的免疫共抑制受体(CIRs),它们的存在让不同免疫细胞的免疫反应得到抑制,是癌症治疗中重要的免疫治疗靶点)。肿瘤细胞会释放生物分子去激活免疫检查点蛋白分子PD1、CTLA4、TIM3、LAG3等去抑制免疫细胞被激活,而免疫检查点抑制剂的主要作用就是阻断肿瘤细胞对免疫细胞激活的抑制,让免疫系统对癌细胞产生免疫反应从而杀死癌细胞。
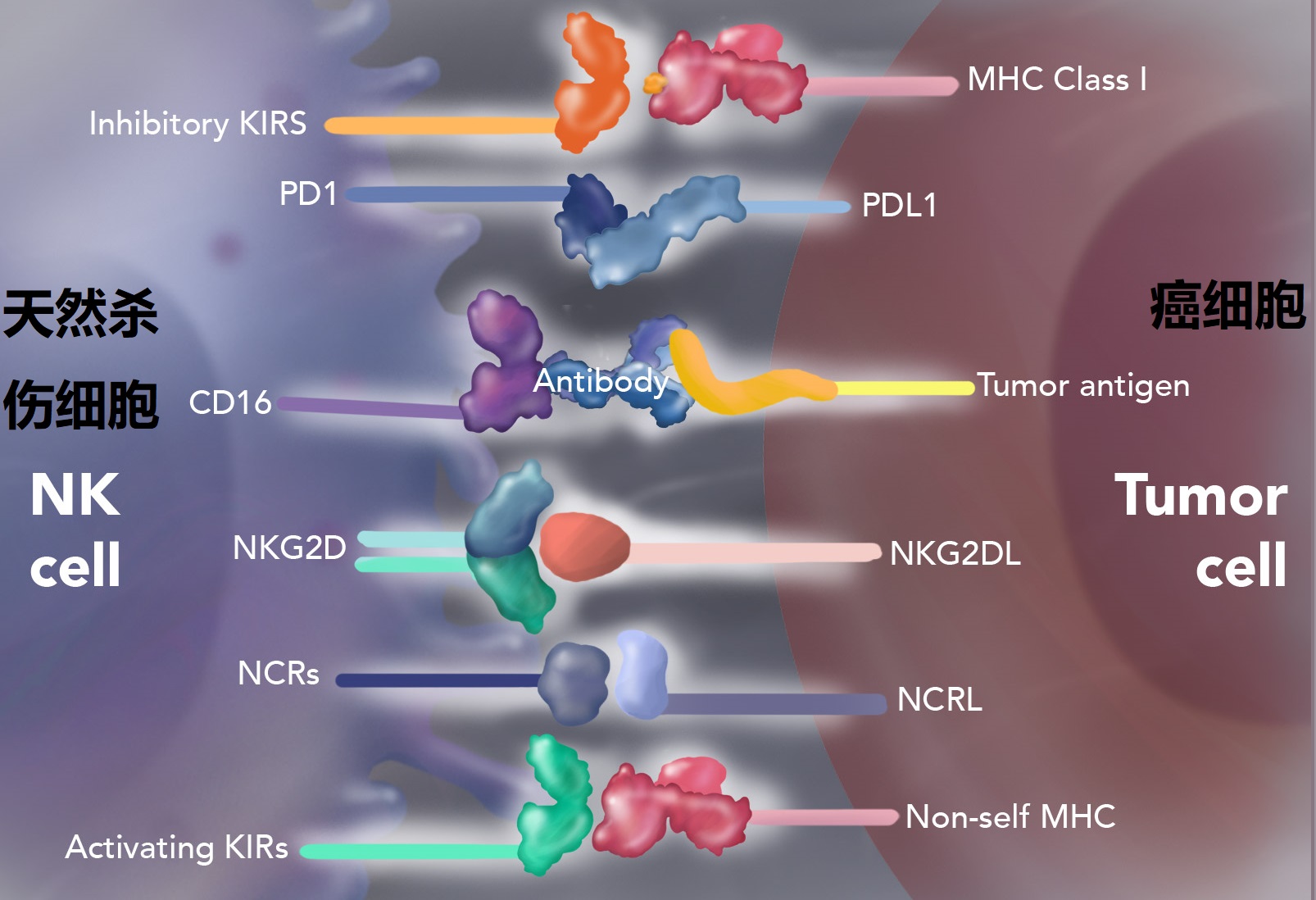
图4 NK免疫细胞的结合靶点及蛋白受体
2020年,卡迪夫大学的研究人员发现了一种在实验室环境中能成功杀死前列腺癌、乳腺癌、肺癌等等其他多种癌细胞的方法。他们利用基因编辑CRISPR-Cas9筛选技术,发现了一种与MR1相互作用的T细胞受体(MR1是一种存在于身体每个细胞表面的蛋白质分子,癌细胞内部不正常的新陈代谢会让细胞表面的MR1产生异常,这样免疫系统就能够通过MR1异常识别癌细胞),这种T细胞能够成功发现并杀死实验室中培养多种类型的癌细胞,而且它对人体正常细胞没有产生任何损伤。显然利用这种T细胞去治疗癌症可能会产生“一劳永逸”的效果(一针去除体内所有癌细胞),因为它通过MR1异常可以识别和摧毁多种类型的癌细胞。然而从实验室到临床治疗的道路充满了非常大的不确定性,只要我们人类还没有从分子层次明白是什么让正常细胞变成了癌细胞,那人类只能达到从宏观上去控制癌症的阶段,而离彻底治愈癌症的目标依然很远。
https://blog.sciencenet.cn/blog-318012-1424924.html
上一篇:我们不知道答案的125个科学问题(75)癌症的免疫
下一篇:我们不知道答案的125个科学问题(77)慢性炎症