博文
代谢学人--Nature Aging:脂肪Crtc2催人老
||
代谢学人
Nature Aging:脂肪Crtc2催人老
撰文 | 李姿萱 郭钰涵 刘梓棋 于柳 李章燕 周文豪 邱瑾
编辑 | 孟美瑶
校对 | 于柳

背景介绍
脂肪组织在调节全身能量代谢中起着至关重要的作用,衰老过程中脂肪组织功能受损可能是能量稳态失衡的主要原因之一。脂肪组织中主要的实质细胞有:白色脂肪组织(WAT)中的脂肪细胞、棕色脂肪组织(BAT)中的脂肪细胞、皮下脂肪组织(SAT)中的米色脂肪细胞。其中,本文提到的内脏白色脂肪组织(VAT)中的脂肪细胞主要负责三酰基甘油(TAGs)的储存,而BAT和SAT中的脂肪细胞主要参与适应性生热,在维持能量平衡中发挥重要作用。
脂肪组织由多种细胞类型组成,包括成熟脂肪细胞、脂肪生成祖细胞(AP)、内皮细胞以及各种类型的免疫细胞。此前,研究人员发现在肥胖小鼠的WAT中,衰老AP细胞的增加可导致在衰老相关分泌表型(SASP)因子介导下发生的脂肪生成抑制和巨噬细胞积累,进而引起代谢功能障碍,而清除衰老的AP细胞后这些表型则会得到明显改善,表明与衰老相关的代谢并发症是可逆转的。此外,衰老AP细胞的年龄依赖性积累也会促进SASP因子的表达,表明脂肪组织中衰老细胞分泌的SASP与脂肪组织衰老过程中的代谢紊乱息息相关。考虑到脂肪组织中多种细胞类型之间潜在的相互作用,不同细胞在衰老过程中引起脂肪组织代谢紊乱的机制还不清楚。
Crtc2是一种由cAMP-response element-binding protein (CREB)调控的转录共激活因子,参与代谢稳态的调控。先前的研究发现,Crtc2能够调节肝脏糖异生、脂质代谢,调节胰腺β-细胞和肠L细胞内分泌激素的分泌等生理过程。研究表明,Crtc2的同源物Crtc1会损害线虫的线粒体功能从而促进衰老,但Crtc在哺乳动物衰老或与年龄相关的代谢紊乱中的作用目前尚不明确。
在本研究中,研究人员探究了衰老过程中Crtc2在脂肪组织中的作用。结果表明,脂肪组织中Crtc2的表达随着年龄的增长而升高,而且在脂肪细胞中敲除Crtc2可以促进BCAA(以亮氨酸、缬氨酸和异亮氨酸为代表的支链氨基酸的统称)分解代谢,增强SIRT 1/AMPK通路,降低mTORC1通路的活性,延缓VAT中细胞衰老,并显著改善小鼠与年龄相关的代谢紊乱。在脂肪细胞特异性Crtc2敲除(Crtc2 AKO)的衰老小鼠中,SASP因子的表达显著降低,年龄诱导的脂肪组织结构重塑减少,AP细胞的脂肪生成潜能恢复到年轻野生小鼠水平。本研究证明了成熟脂肪细胞中的Crtc2会促进哺乳动物细胞衰老,并导致了VAT在衰老过程中的代谢紊乱。

敲黑板啦!
1、脂肪特异性敲除Crtc2可以改善年龄相关的代谢紊乱
2、Crtc2 AKO小鼠通过抑制mTORC1通路缓解衰老
3、Crtc2促进年龄诱导的脂肪组织重塑
4、Crtc2 AKO可恢复老年小鼠的脂肪生成潜能
研究结果
1. 脂肪特异性敲除Crtc2避免与年龄相关的代谢紊乱
为了探究Crtc2在脂肪组织衰老过程中的作用,研究人员首先检测了Crtc2在不同脂肪组织中的表达情况。结果发现,Crtc2在WAT中的表达比BAT高出10倍以上,在VAT中的表达略高于SAT,并且Crtc2蛋白水平在VAT中随着衰老而显著增加,在SAT中无显著变化,而在BAT中则无法检测到Crtc2的表达(附图1a)。研究人员建立了脂肪细胞特异性Crtc2敲除(Crtc2 AKO)小鼠模型(附图1b),并检测了Crtc2在VAT、BAT、SAT、肝脏和肌肉中的表达情况,确认在Crtc2 AKO小鼠中只有脂肪组织中Crtc2的表达显著降低(附图1c,d)。 为了探究脂肪Crtc2在衰老过程中的作用,研究人员选择了18-21月龄的C57BL/6小鼠作为衰老小鼠,选择3-5月龄的小鼠作为年轻小鼠,对年轻WT小鼠、衰老WT小鼠和衰老Crtc2 AKO小鼠三组进行比较,发现衰老WT小鼠表现出明显的葡萄糖和胰岛素耐受不良、脂肪指数增加、肝脏和脂肪组织中脂质积累增加等与年龄相关的代谢异常现象(图1a-g),而衰老Crtc2 AKO小鼠的体重和葡萄糖代谢能力均得到明显改善,与年轻WT小鼠相近(图1a-g,附图1e)。此外,研究人员还发现SAT:VAT的比值会随着年龄的增长而显著降低,敲除Crtc2可以部分缓解这种现象(图1)。与衰老WT小鼠相比,Crtc2 AKO小鼠的外周胰岛素信号传导通路和胰岛素耐受情况得到明显改善(图1b,附图2a,b)。但年轻小鼠脂肪组织敲除Crtc2则不会影响年轻小鼠的胰岛素信号传导通路(附图2c,d),说明在脂肪细胞中Crtc2对衰老小鼠的影响更为突出,证明脂肪细胞特异性Crtc2敲除能够通过改变VAT中某个尚未明确的信号级联反应来逆转年龄诱导的代谢紊乱。
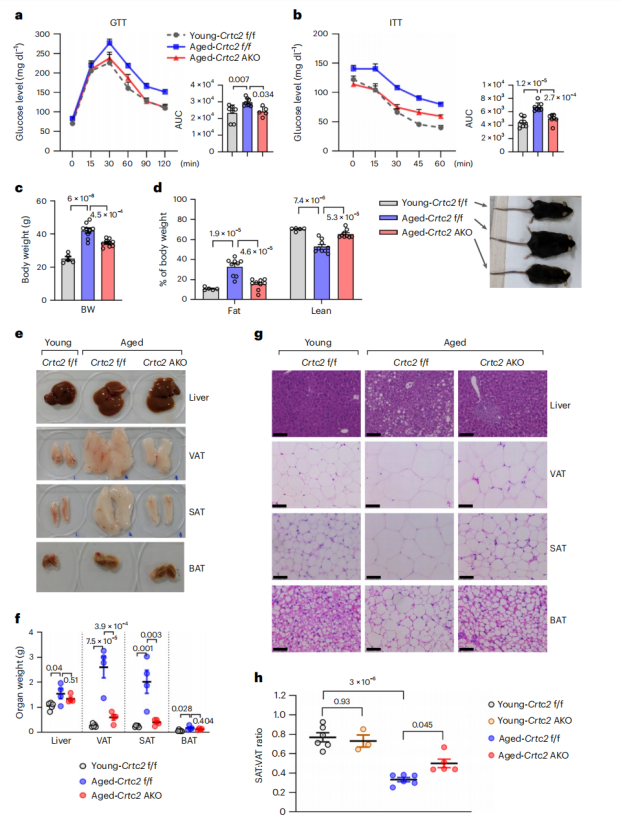
图1. 脂肪细胞特异性Crtc2敲除抑制了小鼠衰老性代谢紊乱

附图1. VAT中Crtc2的表达影响能量稳态
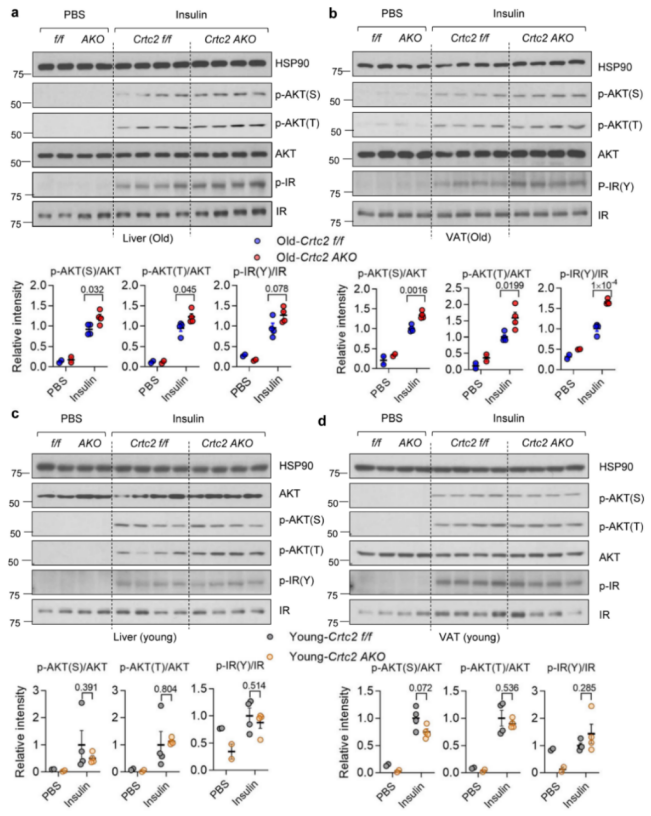
附图2. 脂肪细胞特异性Crtc2敲除恢复了与年龄相关的胰岛素信号传导的变化
2. Crtc2 AKO使衰老小鼠的脂质稳态得到明显改善
为了进一步探究衰老小鼠脂肪特异性敲除Crtc2对脂质代谢的影响,研究人员围绕控制脂质稳态的主要器官——肝脏和VAT展开研究。
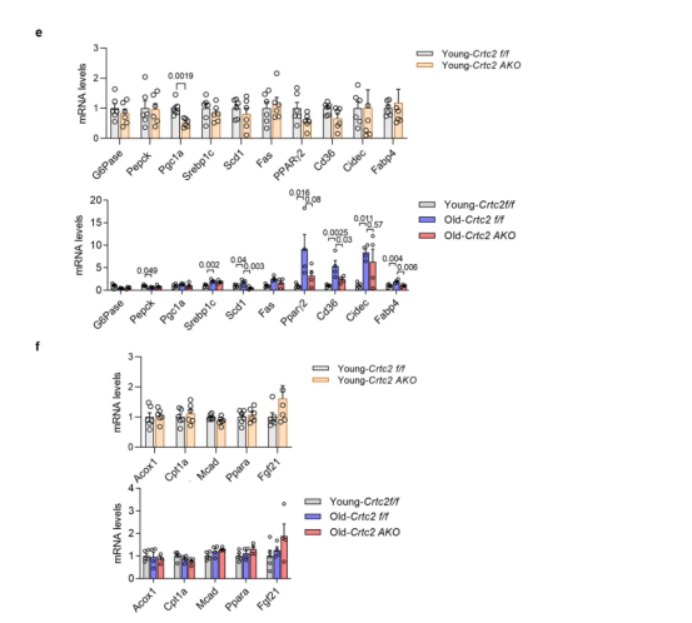
结果发现,与年轻WT小鼠相比,衰老WT小鼠的肝脏脂质含量增加,而脂肪细胞特异性敲除Crtc2可减少衰老所引起的肝脏脂质积累(图1d,g)。为了进一步探究衰老和Crtc2 AKO对肝脏脂质代谢的影响,研究人员又进行了脂质组学分析。分析结果显示,年轻WT小鼠、衰老WT小鼠和衰老Crtc2 AKO小鼠三者之间的定量肝脏脂质图谱存在显著差异(P < 0.05),其中年轻WT小鼠和衰老WT小鼠之间差异最大,而衰老Crtc2 AKO小鼠图谱则趋近于年轻WT小鼠(补充图3a)。此外,与组织学分析结果(补充图 1f)一致,PCA 分析显示年轻的WT 小鼠和年轻 Crtc2 AKO 小鼠的肝脏脂质分布没有差异(补充图 3b)。总的来说,与年轻小鼠相比,衰老 WT 小鼠肝脏中大多数类别的脂质都急剧增加(补充图 3c)。值得注意的是,与衰老WT 小鼠相比, 衰老Crtc2 AKO 小鼠肝脏中胆固醇酯、二酰甘油(DAGs)和 三酰基甘油(TAGs)等特定脂类减少(补充图 3c)。而年轻 WT 小鼠和年轻 Crtc2 AKO 小鼠肝脏的脂质谱中未观察到明显变化(补充图 3d),相应的这两种小鼠间的糖脂代谢关键基因表达也无显著差异(补充图 3e)。进一步研究发现,肝脏中负责脂肪生成的基因(如 SREBP1c、SCD1 和 FAS)表达在衰老或 Crtc2 AKO 的作用下无明显变化,但肝脏中负责脂肪酸摄取或脂滴形成的基因(如 CD36、Cidec、FABP4 和 PPARγ2)的表达在衰老的作用下有特定的增加,而这种增加在脂肪细胞特异性敲除 Crtc2 后降低(补充图 3e)。此外,在两种基因型中,研究人员都没有观察到参与脂肪酸 β 氧化的基因表达因衰老而发生变化(补充图 3f)。这些数据表明,与年龄相关的肝脏脂质积累主要与脂肪组织中脂质代谢失调引起的脂肪酸摄取潜力的增加有关,并可通过在 VAT 中脂肪细胞特异性地敲除 Crtc2 得到改善。
为了探究在衰老过程中Crtc2 AKO对VAT的影响,研究人员检测了年轻/衰老WT、年轻/衰老Crtc2敲除后脂质种类差异情况(附图3a)。结果与上述肝脏的情况类似,衰老Crtc2 AKO小鼠VAT中TAG和DAG水平与年轻WT组类似,且显著低于衰老WT小鼠(图2a,b和附图3a)。另一方面,与年轻对照组小鼠相比,衰老WT小鼠VAT中的磷脂(特别是磷脂酰胆碱(PC))含量显著低于年轻WT小鼠,而衰老Crtc2 AKO VAT中的磷脂水平与年轻WT小鼠的水平一样(图2c和附图3a)。之前有研究发现,在肥胖状态下,脂肪组织巨噬细胞的PC合成水平会上升,并且能够促进产生脂肪组织炎症,这提示着衰老也可能会通过降低PC合成水平来扰乱VAT中的PC稳态。研究表明,谷氨酰胺是脂肪细胞中脂质从头合成的主要碳来源。研究人员发现,与WT小鼠相比,Crtc2 KO脂肪细胞中来自[U-13C]谷氨酰胺的柠檬酸盐水平显著降低(附图3b)。
综合来看,脂肪细胞Crtc2敲除可以缓解衰老过程中肝脏和VAT中脂质成分的变化,且VAT中Crtc2介导的信号通路与衰老过程中全身脂质代谢的变化有关。

图2. Crtc2与VAT脂质谱的年龄相关变化有关
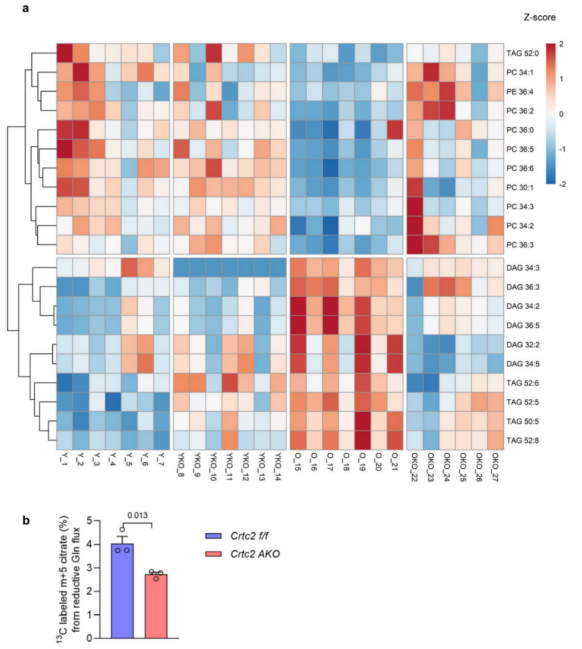
附图3. 脂肪细胞特异性Crtc2敲除恢复VAT脂质图谱的年龄相关变化
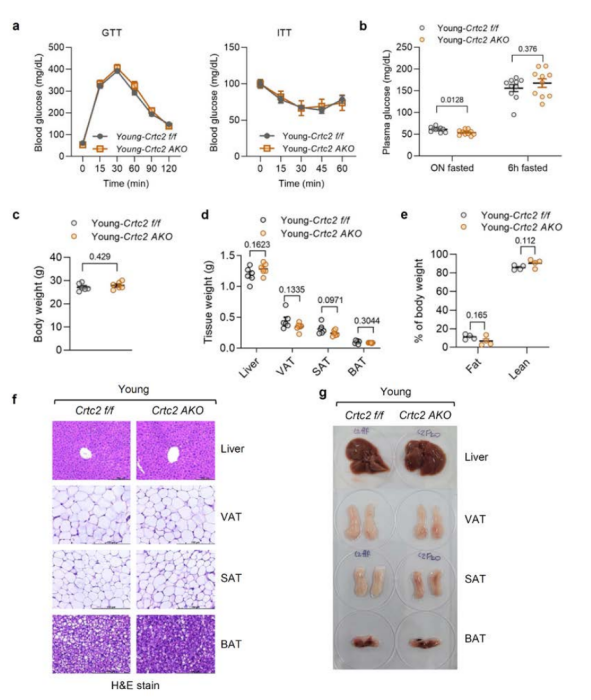
补充图1. 脂肪细胞特异性Crtc2敲除不影响年轻小鼠的代谢稳态
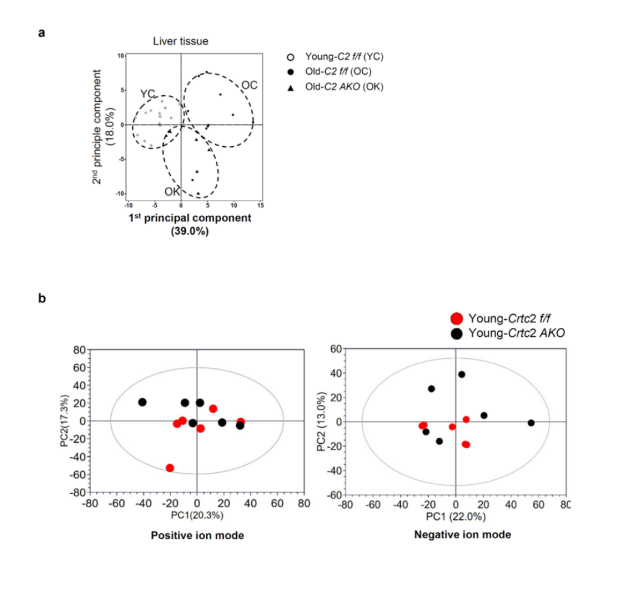

补充图3. 脂肪细胞特异性Crtc2敲除可恢复与年龄相关的肝脂质图谱变化
拓展阅读
谷氨酰胺与脂肪细胞脂质从头合成
谷氨酰胺可以通过多种途径变成柠檬酸和α-KG(α-酮戊二酸),而柠檬酸和α-KG是脂质从头合成的底物,进而通过一系列生化反应生成脂肪酸和甘油三酯。
有文献表明,在脂肪细胞中,谷氨酰胺作为脂质合成的主要碳源,可进入柠檬酸循环,并在异柠檬酸脱氢酶的催化下生成柠檬酸,而柠檬酸在柠檬酸裂解酶ACLY的催化作用下产生的乙酰辅酶A并从头合成脂肪酸,最终脂肪酸通过一系列酯化反应生成TAG。

3. BCAA与VAT中Crtc2-Hes-1表达上调有关
为了探究衰老Crtc2 AKO VAT中起到关键作用的代谢物和代谢通路,研究人员对VAT进行了代谢组学分析,并靶向分析与衰老WT小鼠相比,衰老Crtc2 AKO小鼠在同一种代谢通路中有两种以上代谢物出现显著增加趋势的通路,如:BCAA代谢、半胱氨酸和蛋氨酸代谢、柠檬酸循环、核苷酸糖代谢、嘌呤代谢和嘧啶代谢(附图4)。RNA测序和代谢组学数据显示,RNA表达和其相关代谢物浓度的变化趋势一致(图3a),与年轻小鼠相比,衰老WT小鼠VAT中编码BCAA分解代谢酶的基因表达普遍下调(图3b,附图5a-e),在蛋白质水平上,随着年龄的增长,BCKDHB(而非BCKDHA)(BCKDH, 线粒体支链酮酸脱氢酶复合体,BCAA 的分解代谢途径的限速酶)和BCAT2(支链氨基酸转氨酶2)在VAT中的表达显著减少(附图6a)。在敲除Crtc2后,BCAA分解代谢基因和蛋白的表达在VAT和分化的脂肪细胞中都恢复到正常水平(图3b,附图6a,b)。小鼠VAT中的BCAA分解代谢产物(HMB、3-HMG、L-Valine、L-Glutamic acid、L-Leucine、L-Isoleucine)水平随着年龄的增长而下降,而Crtc2 AKO能够逆转该表型(图3c,d,附图4)。而在年轻WT小鼠和年轻Crtc2 AKO小鼠VAT中,BCAA分解产物水平无明显差异(附图4),证明衰老过程中Crtc2 AKO可以通过调节BCKDH复合物和BCAT2的表达,恢复BCAA分解代谢活性。同位素示踪实验也证实了在Crtc2 AKO小鼠模型中,亮氨酸向下游代谢物的分解代谢通量增加,当原代脂肪细胞吸收[U-13C]亮氨酸时,HMB和3-HMG中的5个碳都被13C标记(图3e),培养4天后,在Crtc2 AKO小鼠的分化脂肪细胞和前脂肪细胞中及其细胞外检测到的五碳标记HMB数量都显著增加(图3f,g)。相反,与年轻WT组相比,衰老WT小鼠的血浆BCAA水平升高,而衰老Crtc2 AKO小鼠血浆BCAA水平显著降低(图3h)。先前的研究表明,血浆BCAA水平的升高与胰岛素抵抗、2型糖尿病密切相关,而且饮食中BCAA的增加还会缩短啮齿动物的寿命。在空腹情况下,小鼠脂肪组织中BCAA代谢基因的表达水平与IR (HOMA-IR,即胰岛素抵抗指数)之间呈强负相关,综上结果表明血浆BCAA水平可能与衰老或与年龄相关的代谢紊乱呈正相关,全身BCAA水平的升高与脂肪组织中BCAA代谢异常相关。
为了探究Crtc2 AKO小鼠的VAT中BCAA分解代谢相关的基因表达上调原因,研究人员检测了两种控制BCAA分解代谢的转录因子——KLF15和Hes1的表达情况。KLF15在WT和Crtc2 AKO小鼠中表达水平无差异,说明KLF15可能不参与Crtc2对BCAA分解代谢基因的调控(图3b)。另一方面,与年轻小鼠相比,衰老WT小鼠的VAT中PPARγ的表达显著降低,特异性敲除Crtc2后恢复(图3b)。先前的研究表明,CREB通过激活肝脏中PPARγ的转录抑制因子Hes1来下调肝脏中PPARγ的表达。Hes1的表达会随着年龄的增长而升高,而Crtc2作为CREB的共激活因子,在VAT中敲除Crtc2会显著降低Hes1的表达(图3b),说明与年轻小鼠相比,Crtc2 - Hes1的表达上调和PPARγ的表达下调可能是衰老小鼠VAT中BCAA代谢异常的原因(小编注:研究表明, PPARγ 可以直接调节小鼠的 BAT 和 iWAT中的BCAA 分解代谢,进而调节循环 BCAA 水平,并且可以通过降低循环 BCAA 水平改善HFD小鼠中的肌肉胰岛素敏感性反应性。文献:Blanchard PG, Moreira RJ, Castro É, et al. Metabolism. 2018。)。

图3. Crtc2-Hes-1轴在与年龄相关的血浆BCAA水平升高中起关键作用

附图4. 脂肪细胞特异性Crtc2敲除恢复VAT极性代谢组的与年龄相关的变化

附图5. 评估衰老和脂肪细胞特异性Crtc2敲除对成熟脂肪细胞转录组的影响

附图6. 衰老和Crtc2脂肪细胞特异性敲除对BCAA分解代谢的影响
4. Crtc2 AKO小鼠通过抑制mTORC1通路缓解衰老
为了证明与年龄相关的代谢功能下降是由细胞衰老引起的,研究人员检测了衰老WT小鼠VAT中细胞衰老标志基因的表达情况,发现与年轻WT小鼠相比,衰老WT小鼠的p16, p19和p21的表达均显著上调(图4a),衰老Crtc2 AKO小鼠的VAT中衰老标记基因的表达水平显著低于衰老WT小鼠。研究人员经SA-β半乳糖苷酶测量、γ-H2AX和p21水平的免疫组织化学评估和western blot分析后,发现与衰老WT小鼠相比,衰老Crtc2 AKO小鼠的VAT中细胞无明显衰老表型,证明了脂肪细胞Crtc2的特异性敲除能够延缓VAT中年龄诱导的衰老(图4b-d)。
先前的研究证明,敲除肝脏中的Crtc2会抑制miR-34a(一种已知的SIRT1抑制剂)的表达,并且增加肝脏中的脂肪酸β-氧化水平以及血浆中的FGF21水平。研究人员发现,在VAT成熟脂肪细胞中,miR-34a、miR-146b和miR-132的表达水平随衰老而显著上升(补充图5c),且三者均被已证明靶向SIRT1。其中,miR-34a和miR-132已被证明受到CREB和Crtc2的转录调控。值得注意的是,在衰老Crtc2 AKO小鼠中miR-34a的表达显著下调,而miR-132的表达无显著变化(补充图5c),这表明衰老过程中miR-34a表达升高可能以Crtc2依赖的方式影响SIRT1依赖的信号传导。Western blot的分析显示,与年轻WT小鼠相比,衰老WT小鼠的VAT中SIRT1和p-AMPK水平显著降低(图4e)。先前有研究表明,BCAA能增强mTORC1通路,从而抑制胰岛素信号通路,研究人员证明了mTORC1通路的活性随着年龄的增长而增强,与BCAA分解代谢途径的变化趋势一致(图4e)。值得注意的是,与WT相比,Crtc2 AKO显著恢复了衰老相关的细胞信号传导的变化,如促进了VAT中的SIRT1/AMPK通路,抑制了mTORC1通路。 (图4e和补充图6a)。衰老Crtc2 AKO小鼠的SAT(补充图7a)中的细胞信号通路也显著恢复,但在BAT中不明显,说明Crtc2在WAT中发挥的作用比在BAT中更明显(补充图6b、c和7)。
为了进一步验证Crtc2在mTORC1介导的细胞衰老中的重要性,研究人员用衰老诱导剂博来霉素处理小鼠原代AP细胞诱导衰老,并使用mTORC1抑制剂雷帕霉素进一步处理小鼠原代AP细胞发现,与WT小鼠相比,Crtc2 AKO小鼠的原代AP细胞中,衰老相关表型都显著减轻,证明了Crtc2- mTORC1轴在细胞衰老中的重要性(补充图8)。雷帕霉素(Rapamycin)治疗有效地减弱了衰老诱导剂诱导的细胞衰老,且这种作用在Crtc2 AKO小鼠中进一步增强,其原因可能是Crtc2的缺失完全消除了部分残余的mTORC1活性。
有研究表明,AMPK信号和mTORC1通路之间的平衡与线粒体功能的维持密切相关。研究人员通过丙酮酸脱氢酶的免疫组化染色发现,VAT中功能性线粒体含量随着年龄的增长而减少(图4f),而Crtc2的敲除能够缓解VAT中由衰老导致的功能性线粒体数量的下降,证明了脂肪细胞特异性Crtc2的缺失能够保护脂肪组织免受与衰老相关的线粒体减少的影响,其部分原因是AMPK-mTORC1的调节作用。

图4. 脂肪细胞特异性敲除Crtc2可减少脂肪组织的细胞衰老
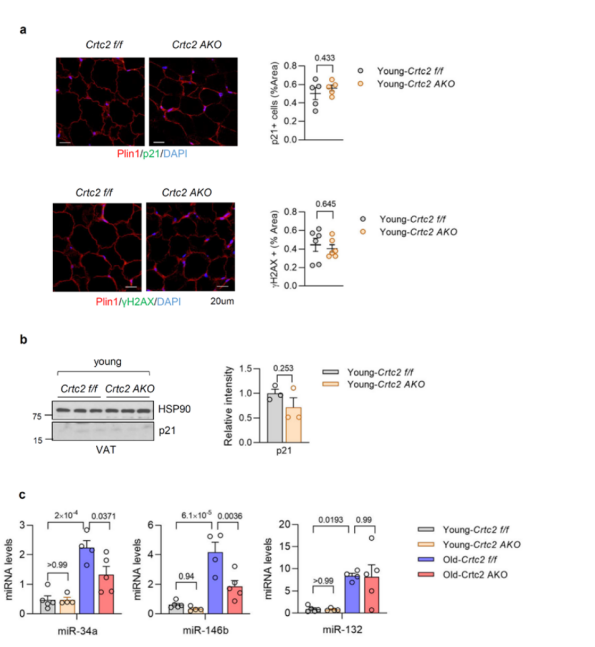
补充图5. 脂肪细胞特异性敲除Crtc2对细胞衰老的影响

补充图6. 脂肪细胞特异性敲除Crtc2对脂肪组织中细胞信号传导的影响

补充图7. 衰老和Crtc2特异性敲除对SAT和BAT细胞信号传导的影响

补充图8. Crtc2-mTORC1轴在细胞衰老中的作用
拓展阅读
AMPK和mTORC1通路与线粒体功能的关系
线粒体是细胞中ATP产生的主要来源。而AMPK是低ATP感受器,线粒体任何一个氧化呼吸的环节受阻致ATP产量下降都会导致AMPK的激活,此外,AMPK还可调节线粒体的生物发生来控制线粒体数量,调节线粒体网络的形状,通过线粒体自噬调节来控制线粒体质量,以及线粒体钙内流。
mTORC1在体内有重要的生理功能,可由氨基酸激活,氨基酸减少时其活性被抑制。此外,mTORC1的激活也受其他营养物质(如葡萄糖和脂质)的调节。早期的研究显示,mTORC1活性降低会损害线粒体的呼吸,而mTORC1抑制剂雷帕霉素会降低线粒体膜电位、ATP合成能力和氧耗,并改变线粒体蛋白质磷酸化组,mTORC1还在翻译水平上控制与线粒体功能和动力学有关的基因表达。
当线粒体供能匮乏时,高AMP水平会激活AMPK,而AMPK会关闭mTORC1复合体的活性。而当营养物质充沛,线粒体供能充足时,AMPK活性低,mTORC1活性高,促进机体利用能量进行合成代谢及生长。二者协同发挥作用,使线粒体的功能稳定发挥。
5. Crtc2促进年龄诱导的脂肪组织重塑
为了探究VAT微环境在衰老和Crtc2敲除过程中的变化,研究人员对四组小鼠衍生的基质血管组分(SVF)进行了scRNA测序(补充图10a)。为了表征VAT中细胞组成的随年龄的变化动态,研究人员生成了来自27个细胞簇的18种细胞类型的单细胞图谱(图5a和补充图10b,c)。结果显示,细胞类型分为三大类:淋巴细胞、髓细胞和非免疫细胞。细胞类型组成分析显示,在衰老过程中,细胞类型比例发生了显著变化,与衰老WT小鼠相比,衰老Crtc2 AKO小鼠的淋巴细胞和非免疫细胞的年龄依赖性变化得到恢复(图5b和补充图10d-f)。
通过对淋巴样细胞重新聚类与注释,研究人员将淋巴样细胞进一步细分为14种细胞类型(补充图11a-c)。结果显示,衰老会导致CD3+ T、CD19+ B细胞的扩增和先天免疫细胞的减少,并且脂肪细胞特异性敲除Crtc2后能够使这些变化得到部分挽救(补充图11d-h)。B细胞亚群中,记忆B细胞在衰老WT小鼠中扩增,而在衰老Crtc2 AKO小鼠中减少,CD4+T细胞, CD8+T细胞和Treg细胞在衰老WT小鼠中显著增加,脂肪细胞特异性敲除Crtc2部分抑制了它们的异常增加(补充图11d-h)。有研究证明,在老年小鼠中选择性清除VAT中的 Treg细胞可以预防与年龄相关的胰岛素抵抗,说明VAT中的 Treg细胞对衰老Crtc2 AKO小鼠的表型发生的变化很重要。值得注意的是,研究人员观察到在衰老WT小鼠中,T细胞亚群中的适应性和先天免疫反应被激活,而Crtc2 AKO抑制了CD4+T细胞, Treg细胞和CD8+T细胞中的这些免疫反应 (补充图11i)。综上所述,这些结果表明,随着年龄的增长,VAT中紊乱的免疫反应可能导致与年龄相关的代谢紊乱,而这可以通过脂肪细胞特异性的Crtc2敲除来部分修复。
为了探究脂肪组织巨噬细胞(ATMs)的细胞异质性,研究人员通过Lyve1、Cd9和Trem2的差异表达表征了两个不同的ATM亚群——Mac.Lyve1和Mac.Cd9(补充图12a-c)。Mac.Lyve1亚群高表达Lyve1、Cd38和Cd209f (补充图12b),饮食引起的肥胖会导致Mac.Lyve1亚群的减少,而Mac.Lyve1亚群能够促进炎症细胞浸润和组织纤维化(血管周围巨噬细胞)。相比之下,Mac.Cd9亚群高表达Cd9, Cd63, Trem2, Cx3cr1 和 MHC-II编码基因 (具有脂质相关巨噬细胞类似特征)(补充图12b)。这些 ATM 亚群在肥胖过程中会扩大,通过代谢神经元释放的去甲肾上腺素促进肥胖的发展或通过防止脂肪细胞肥大来适应肥胖。在衰老Crtc2 AKO小鼠中,Mac.Cd9亚群随着年龄的增长而扩大,而Mac.Lyve1亚群则会随着年龄的增长而减少(补充图12d-i)。这些数据表明脂肪细胞中的Crtc2是衰老过程中调节ATM亚群丰度的关键因子,显示出Crtc2在衰老过程中调节巨噬细胞不同亚群动态变化中的重要性。
此外,研究人员通过天狼星红(PSR)染色和ECM重塑相关基因(Col1a1, Col6a1, Mmp2和Ctsl)的表达水平发现,脂肪细胞中Crtc2的缺失能够抑制衰老过程中VAT的纤维化(附图7a,b)。与年轻小鼠相比,衰老WT小鼠肝脏中的巨噬细胞浸润和促炎细胞因子基因(Mcp1和Il1b)表达显著上调,脂肪细胞特异性敲除Crtc2可逆转该现象(补充图13a,b),并且Crtc2 AKO小鼠肝脏纤维化相关基因(Acta2 (α-SMA)、Mmp12、Timp1和Col1a1)的基因表达显著下调,表明脂肪细胞中Crtc2的敲除能够抑制衰老过程中肝脏的纤维化(补充图13c,d)。

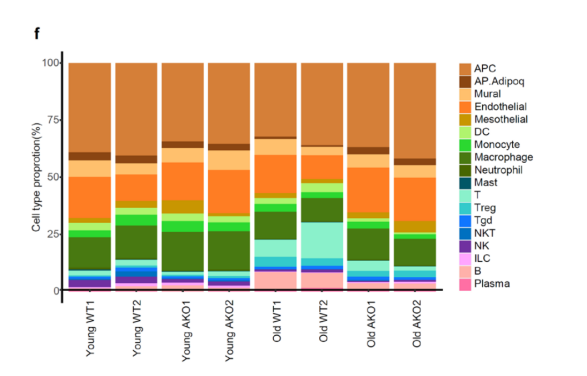
补充图10. 衰老和脂肪细胞特异性敲除Crtc2对SVF中不同细胞类型的影响

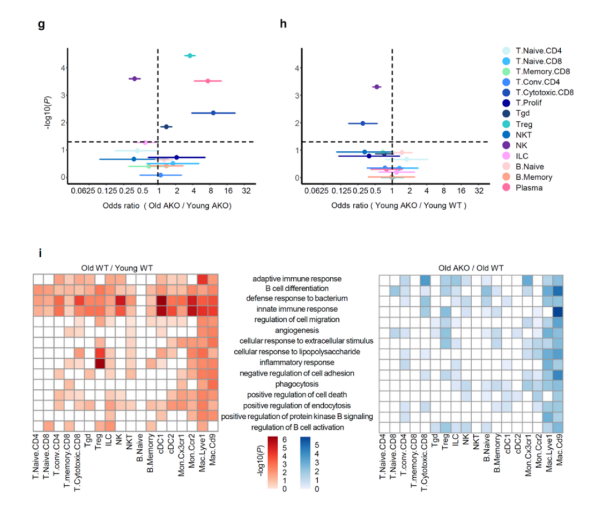
补充图11. 衰老和脂肪细胞特异性敲除Crtc2对VAT中淋巴样细胞的影响

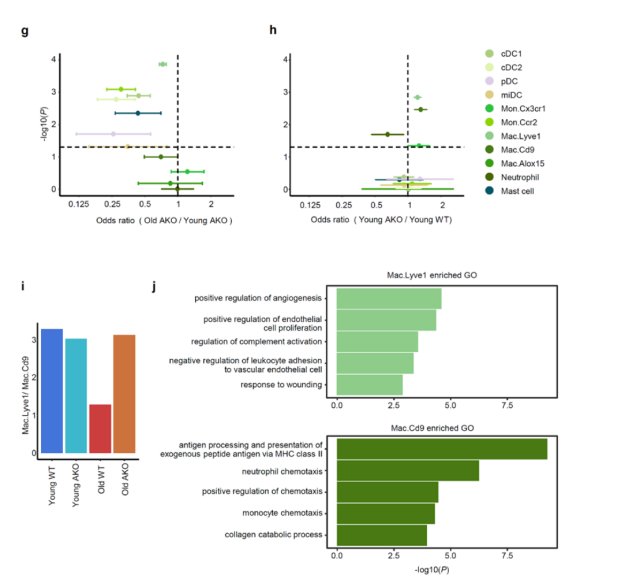
补充图12. 衰老和脂肪细胞特异性消耗Crtc2对VAT中骨髓细胞的影响

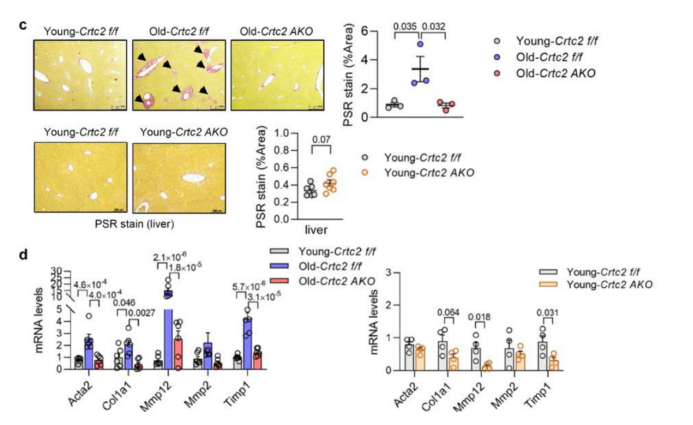
补充图13. 脂肪细胞中的Crtc2在与年龄相关的肝脏重塑中至关重要
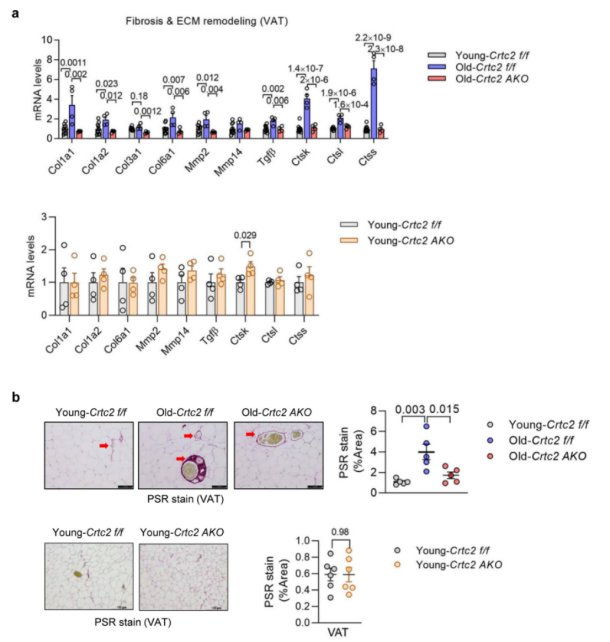
附图7. 脂肪细胞中的Crtc2在与年龄相关的VAT重塑中至关重要
6. Crtc2 AKO可恢复老年小鼠的脂肪生成潜能
为了探究脂肪细胞特异性Crtc2敲除对衰老小鼠APs成脂潜能的影响,研究人员分析了APs的分化轨迹(图5c-f)。已有研究表明APs由不同脂肪生成潜力的细胞亚群组成,研究人员将APs分为两个亚群:表达Dpp4的Ap1和表达前脂肪细胞标记物如Icam1和Fabp4的Ap2 (图5c,附图8a)。两个AP亚群也可以通过细胞亚群中PI3K、WNT和TGF-β信号通路的强度来区分,其中AP1亚群该通路活性显著强于AP2亚群(附图8b)。值得注意的是,衰老WT小鼠AP2细胞中与脂肪组织纤维化和炎症相关的TGF-β、WNT和缺氧信号通路活性强于年轻WT小鼠,但在Crtc2敲除后活性减弱(附8b)。轨迹分析显示,AP细胞有两条分化轨迹——分化成脂(Path1)或分化为纤维炎性终末状态(Path2)(图5c-e)。Path1轨迹的终末状态中,研究人员检测到与脂肪形成和增殖相关基因Igf1、Gdf10、Irf1和Ccnd2的高表达,相反,Path2的终末状态则以与纤维化和炎症有关的基因Mmp11和Ccn1的高表达为主要特征。与年轻小鼠相比,衰老WT小鼠的AP细胞倾向于沿Path2轨迹分化,敲除Crtc2后,能够在一定程度上改变这种趋势(图5e,f)。研究人员从四组小鼠的VAT中分离脂肪祖细胞(PDGFRα+)检测其细胞增殖能力,结果显示,与衰老WT小鼠相比,来自衰老Crtc2 AKO小鼠的AP细胞具有更强的增殖能力(图5g),细胞衰老数量显著减少,脂肪生成潜力增强(图5g和附图8c),证明了衰老会诱导成熟脂肪细胞产生抑制AP细胞成脂潜能的微环境,而脂肪细胞特异性Crtc2敲除可以防止由年龄引起的脂肪组织功能下降。
为了探究脂肪细胞Crtc2敲除后重塑老年小鼠的脂肪组织微环境的机制,研究人员分析了衰老WT小鼠与年轻WT小鼠、老年Crtc2 AKO与老年WT小鼠的配体-受体相互作用数量的差异,结果显示,大多数与年龄相关的细胞相互作用发生在APs和其他细胞亚群之间,而脂肪细胞特异性的Crtc2缺失部分抑制了这些相互作用(图6a)。
为了进一步探究成熟脂肪细胞参与脂肪组织微环境的重塑机制,研究人员分离了四种小鼠的成熟脂肪细胞,培养24h后,收集上清,并用四种上清处理原代Aps(图6b)。与年轻WT或Crtc2 AKO小鼠相比,衰老WT小鼠的成熟脂肪细胞上清处理的APs增殖能力降低,衰老Crtc2 AKO小鼠与年轻小鼠成熟脂肪细胞上清处理的APs增殖能力没有差异(图6c)。此外,与年轻WT小鼠成熟脂肪细胞相比,衰老WT小鼠成熟脂肪细胞上清处理的APs衰老水平增加,成脂潜能降低(图6d,e),而衰老Crtc2 AKO小鼠的成熟脂肪细胞与年轻小鼠的成熟脂肪细胞上清处理的APs成脂潜能一样,表明Crtc2 AKO能够抑制衰老成熟脂肪细胞分泌促进APs衰老的相关分泌因子。
研究人员通过RNA-seq分析了编码配体的差异表达基因,发现在年轻和衰老小鼠之间具有103个存在显著差异表达的编码配体的基因 (P < 0.05),而Crtc2 AKO在衰老小鼠中部分逆转了这些基因表达的变化(图7a)。其中,有97个基因(包括Tgfb1、Il1b和TNF)在衰老的脂肪细胞中表达上调,这些基因的受体在APs中表达且与纤维化和炎症相关。表达下调的6个配体基因中,Fgf10受体主要在APs中表达且与脂肪的形成有关,研究人员通过qPCR证实,在确定的潜在配体中,编码SASP因子的基因(包括IL1b,TNF)表达水平在衰老的成熟脂肪细胞中显著升高(图7b)。值得注意的是,IL1b和TNF是mTORC1的下游靶点,而mTORC1已在上文中被证明在VAT中随着年龄的增长而活性增强(图4e)。在衰老Crtc2 AKO小鼠的成熟脂肪细胞中,SASP因子的表达显著下调,而在体外培养的脂肪细胞模型中,研究人员观察到在衰老诱导剂博来霉素或H2O2的作用下,SASP因子的表达上调,而敲除Crtc2的脂肪细胞不仅能够在衰老诱导剂的作用下抵抗细胞衰老,而且SASP因子的表达水平也显著降低(附图9a-d),证明了Crtc2 AKO能够降低脂肪细胞中SASP因子的表达。
为了确定SASP因子是否是导致AP细胞性质的变化的原因,研究人员使用SiRNA敲低了APs中IL-1R (IL-1β受体)或TNFR1 (TNF-α受体)的表达,并使用衰老小鼠成熟脂肪细胞的上清进行处理,结果显示,单独敲低其中一个受体的水平部分消除了衰老小鼠成熟脂肪细胞的上清对AP细胞增殖的抑制作用(附图10a)和衰老小鼠成熟脂肪细胞的上清介导的APs细胞衰老(附图10b)。同样,衰老小鼠成熟脂肪细胞的上清抑制脂肪细胞分化的作用在IL -1β抗体处理和TNF-α抗体处理的作用下被部分阻断(附图9e),而用IL-1β或TNF-α处理AP细胞则会降低AP细胞的增殖和成脂潜能(图7c,d),进一步证明SASP因子可能是导致AP细胞成脂潜能变化和衰老后功能性脂肪组织下降的原因。

图5. 由于缺乏Crtc2,与年龄相关的VAT成脂潜能下降得以恢复
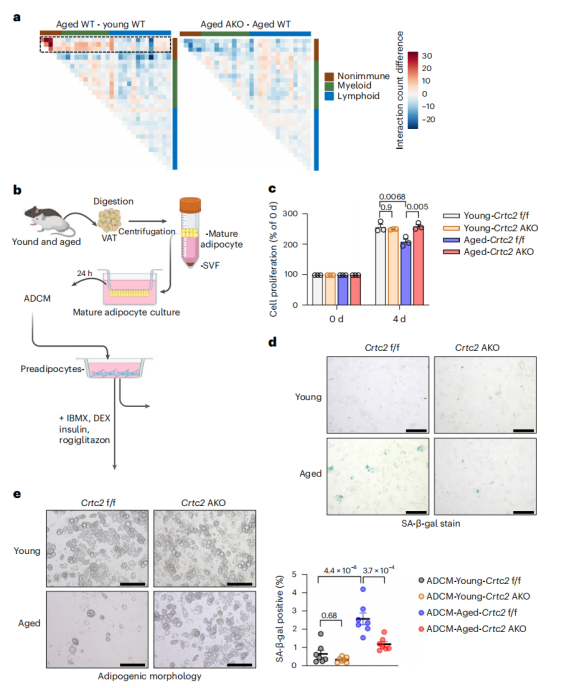
图6. Crtc2依赖性分泌组调节在年龄相关的VAT重塑中至关重要

图7. SASP因子对AP细胞衰老及成脂潜能的影响
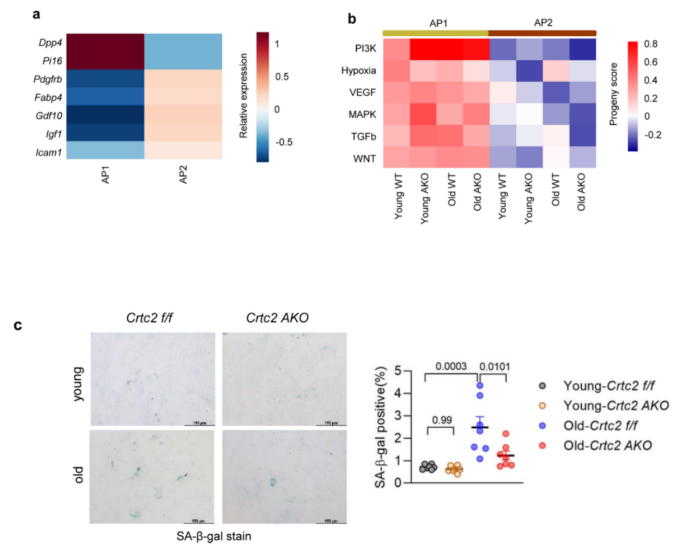
附图8. 衰老和脂肪细胞特异性Crtc2敲除对VAT中AP细胞的影响
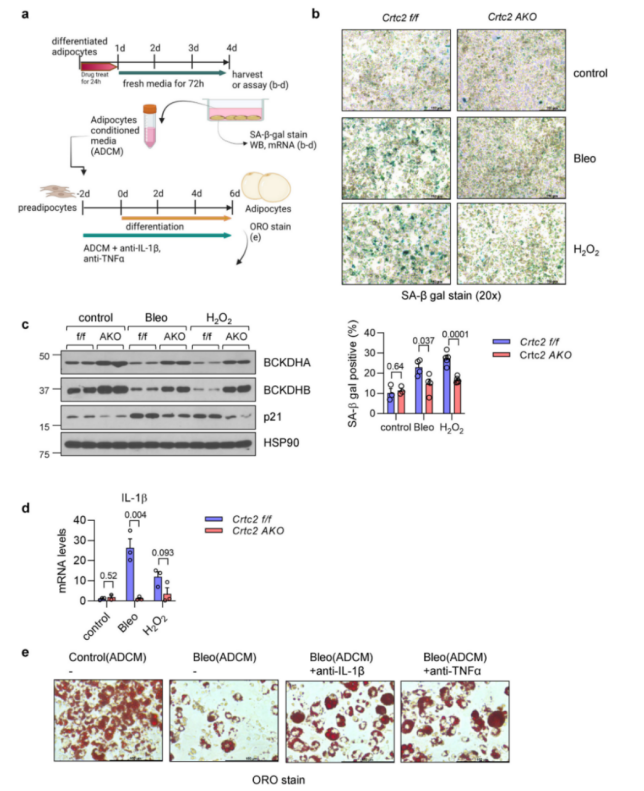
附图9. 在培养的脂肪细胞中,Crtc2的缺失减少了细胞衰老
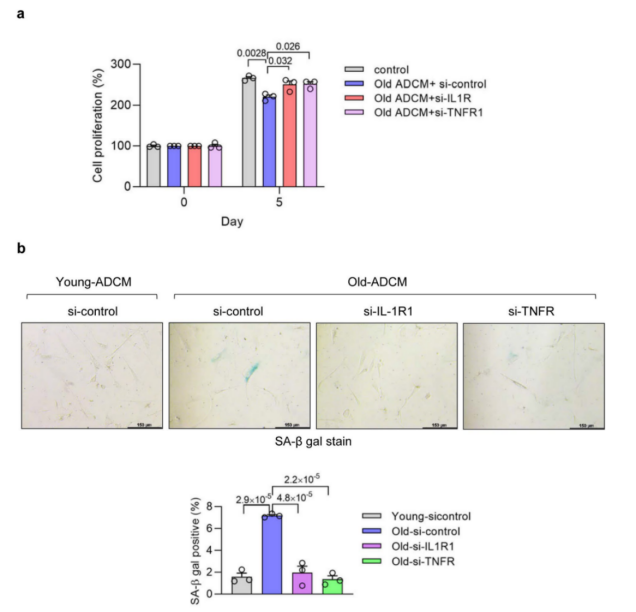
附图10. 脂肪细胞SASP受体在年龄介导的细胞衰老中的作用
总结
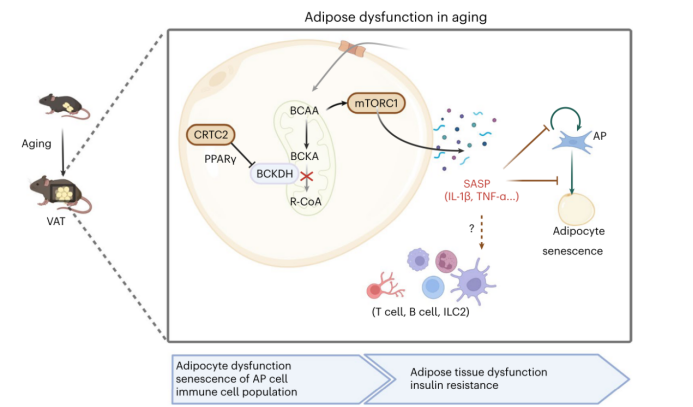
综上所述,脂肪细胞特异性敲除 Crtc2 主要通过影响 VAT来防止小鼠发生年龄相关性的代谢紊乱。具体来说,敲除 Crtc2 可改善衰老过程中成熟脂肪组织功能失调(小编注:本文发现AP细胞有两条分化轨迹—分化成脂(Path1)或分化为纤维炎性终末状态(Path2),作者发现KO小鼠的AP细胞更多的沿Path1分化为具有成脂功能的脂肪细胞),从而通过减少 SASP 因子的分泌,部分地通过阻断年龄诱导的 BCAA 代谢紊乱,保存抗炎巨噬细胞和健康的 AP 细胞(图 8)。该研究表明了脂肪组织在与年龄相关的全身性代谢紊乱进展中的重要性,并提示脂肪细胞特异性抑制 Crtc2 活性或恢复 BCAA 分解潜能可能有益于缓解哺乳动物与年龄相关的代谢异常。
原文链接:https://doi.org/10.1038/s43587-023-00460-8
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://blog.sciencenet.cn/blog-3483272-1410809.html
上一篇:代谢学人—Nature:WARNING!衰老给线粒体捅了大窟窿!
下一篇:代谢学人-Cell Metabolism :VLDL的幕后推手