博文
分子氢:被忽视的土壤生物地球化学过程关键驱动因子
||
分子氢:被忽视的土壤生物地球化学过程关键驱动因子
据推测,早期地球大气中富含氢气(H₂)等还原性气体。由于H₂在整个生物圈中广泛存在、易于扩散穿过微生物细胞且所需活化能较低,它被认为是首个推动三磷酸腺苷(ATP)合成的电子供体。
摘要
据推测,早期地球大气中富含氢气(H₂)等还原性气体。由于H₂在整个生物圈中广泛存在、易于扩散穿过微生物细胞且所需活化能较低,氢气被认为是首个推动三磷酸腺苷(ATP)合成的电子供体。即使在今天,能催化H₂产生与氧化的氢化酶,仍存在于涵盖水生、陆地乃至宿主相关生态系统的三大生命域的数千个基因组中。尽管H₂已被提出可作为一种通用的生长与维持能量来源,但其作为生物地球化学循环驱动因子的潜在作用却鲜少受到关注。
本研究通过概述氢化酶的分类、分布及生理功能,填补了这一知识空白。最后,本研究整合了这些酶在各类微生物功能群中的分布情况及最新实验证据,以支持以下假说:在富氢土壤生态系统中,沿氧气(O₂)浓度梯度分布的氢氧化微生物是驱动碳循环的关键物种。总之,本研究建议通过结合群落水平与个体水平的研究方法,聚焦氢氧化微生物的代谢灵活性——具体可采用培养依赖性与非培养依赖性方法,揭示H₂对碳循环的影响及氢氧化微生物的碳循环潜力,从而更深入地理解H₂作为生物地球化学过程驱动因子的作用。
Piché-Choquette S, Constant P. Molecular Hydrogen, a Neglected Key Driver of Soil Biogeochemical Processes. Appl Environ Microbiol. 2019 Mar 6;85(6):e02418-18.
引言
多项益生元化学模型推测,早期地球的原始大气中富含还原性气体,如分子氢(H₂)、一氧化碳(CO)和甲烷(CH₄)(1-4)。H₂的广泛可利用性、低活化能需求及其扩散穿过微生物细胞的能力,促使研究人员提出假说:H₂是首个电子供体,可通过形成离子梯度进而驱动ATP合成(5, 6)。在这一背景下,“铁硫世界假说”指出,与氢化酶活性中心类似的镍铁(NiFe)/铁硫(FeS)活性中心(可催化H₂转化为质子和电子)可能在十亿年前就已出现,并催生了H₂的首个生物源与生物汇(7)。在许多生态位中,H₂混合比的升高可能构成一种选择压力,使这种古老的代谢方式在当今微生物中得以保留,包括环境分离株(如新建株疣微菌门细菌)(8)和人类病原体(如与幽门螺杆菌相关的胃癌发生)(9)。事实上,氢化酶在生命树中分布广泛,已在超过30个门的数千个基因组中被发现(10, 11)(图1-3)。它们支持自养和混合营养型生活方式,广泛存在于土壤、水生和动物相关等各类生态系统中(6)。
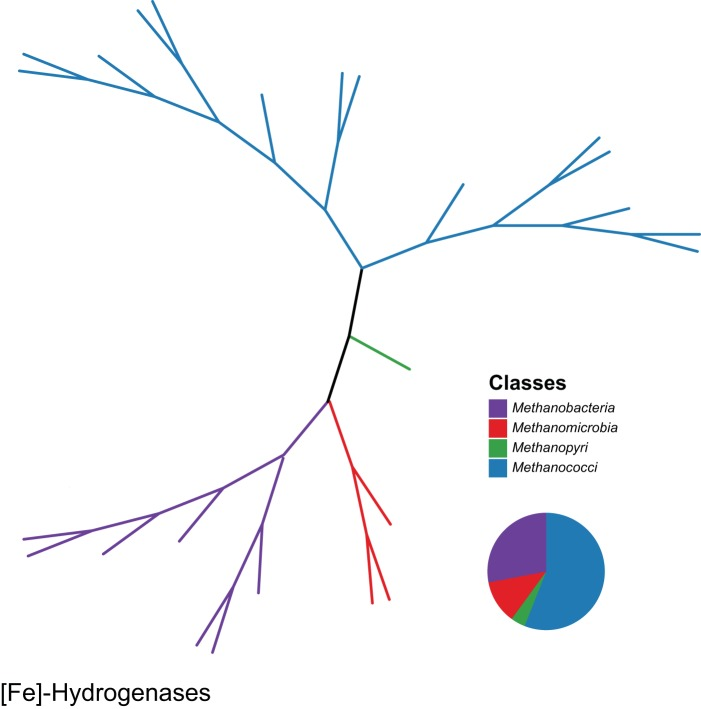
图1 [Fe]型氢化酶序列的共识进化树
包含25条[Fe]型氢化酶序列,比对长度为389个氨基酸。蛋白质序列来源于Greening等人(10)的研究,其中包括来自培养微生物和环境宏基因组的非冗余假定氢化酶催化亚基,数据分别取自NCBI RefSeq数据库和联合基因组研究所微生物暗物质(JGI, MDM)数据库。更多细节参见Greening等人(10)的文章。完整类群名称及更详细的系统发育树见图S1。使用MUSCLE软件(198)对氢化酶氨基酸序列进行比对,并采用以下算法构建系统发育树:使用RAxML 8.2.10版本(199)构建最大似然树(Jones-Taylor-Thornton替代模型)、使用PAUP 4.0版本(200)构建最大简约树、使用BIONJ软件(201)构建邻接树(Jones-Taylor-Thornton替代模型)。系统发育树的构建借助CIPRES Science Gateway 3.3版本(202)服务器完成。最终共识树中仅展示在1000次bootstrap重复检验中支持率超过50%的分支。共识树采用R语言(204)中的“ape”程序包(203)构建。分支颜色代表纲水平的分类学归属(所有25条序列均属于广古菌门),饼图则表示广古菌门内各纲的相对丰度。
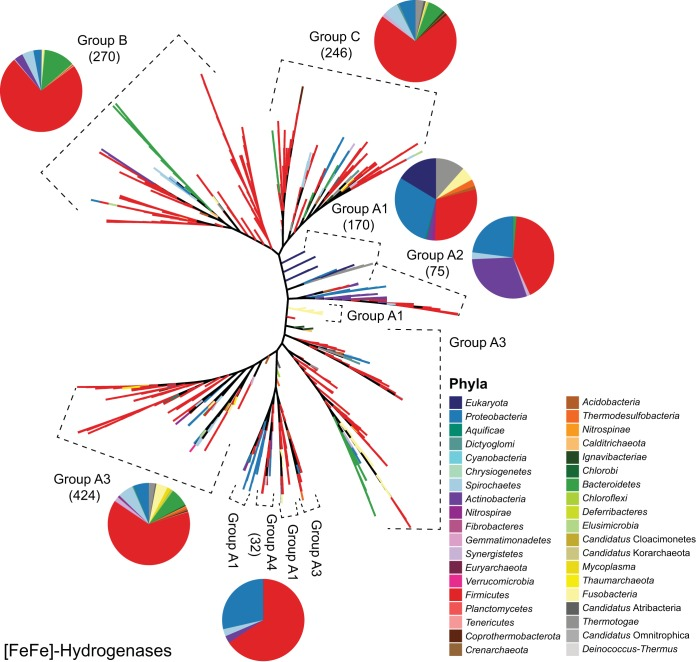
图2 [FeFe]型氢化酶序列的共识进化树
包含1217条[FeFe]型氢化酶序列,比对长度为3525个氨基酸,构建方法同图1。完整类群名称及更详细的系统发育树见图S2。分支颜色代表门水平的分类学归属,饼图表示各氢化酶亚群内不同门的相对丰度(真核生物除外,其属于超界)。虚线括号标注出属于特定氢化酶群的进化树分支。括号内的数字表示该群内的序列数量。
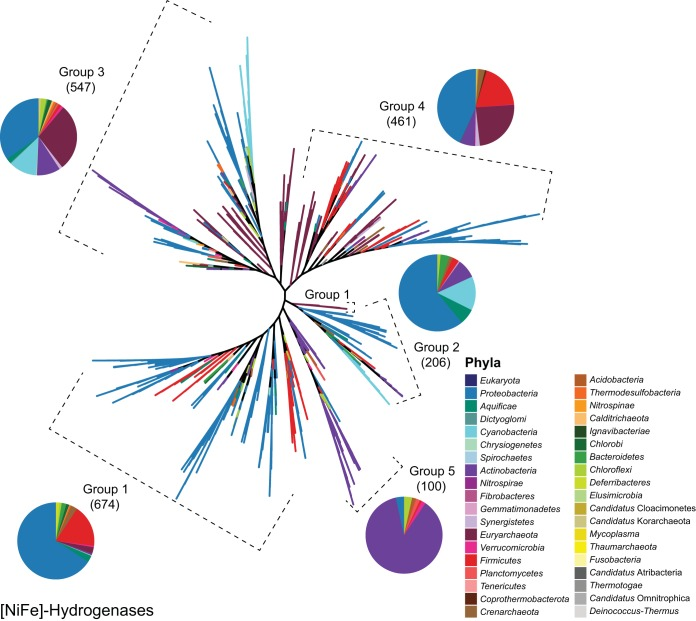
图3 [NiFe]型氢化酶序列的共识进化树
包含1988条[NiFe]型氢化酶序列,比对长度为1850个氨基酸,构建方法同图1。完整类群名称及更详细的系统发育树见图S3。分支颜色代表门水平的分类学归属,饼图表示各氢化酶亚群内不同门的相对丰度(真核生物除外,其属于超界)。虚线括号标注出属于特定氢化酶群的进化树分支。括号内的数字表示该群内的序列数量。
在土壤中,微生物生长常受碳源和营养物质匮乏的限制(6),这导致微生物在饥饿期与存活期之间呈爆发式生长。与之相反,H₂分布广泛、所需活化能低且易于渗透微生物细胞(6)。H₂的广泛存在主要源于其强大的材料穿透能力,以及在地球上地幔中持续的非生物合成,同时微生物发酵、固氮作用和光合成过程也会产生生物源H₂(6)。H₂氧化可与多种氧化剂的还原反应结合,因此在大多数生态系统中均可发生。这种结合能通过H₂快速补充能量,帮助微生物度过从短期到长期的饥饿-存活阶段。已有多项研究从热力学和生物能学角度计算了这种最低能量需求(12-14)。
当环境条件不适宜生长时,H₂氧化可为微生物提供能量以进入隐生状态(anabiosis),即长期稳定期甚至休眠状态(6, 15)。这种生活方式可能将饥饿-存活机制与其他存活策略(如脱水休眠[即干燥耐受]或低温休眠[即冷冻耐受])结合(16),类似于被困在琥珀中或冷冻在永久冻土层中的微生物。代谢失活状态会大幅降低能量需求,但微生物细胞仍需通过持续修复细胞损伤或重新合成DNA,防止氨基酸消旋(即异构体的自发变化)和DNA脱嘌呤在长期内发生(13, 14, 17, 18),而这一过程需要持续的能量输入。当有机质和H₂充足时,氢氧化微生物(HOM)可从短期或长期休眠状态转变为代谢更活跃的生活方式(6)。
尽管近期研究已证实H₂在自然和人工生态系统中的广泛存在及其重要性,但该研究领域仍未得到足够关注——仅有少数研究团队聚焦于生态系统水平的生物源H₂动态(19)。本综述旨在探讨H₂作为维持微生物存活与活性的能量来源,进而支撑土壤生物地球化学过程的潜在作用。首先,简要概述氢化酶的分类和生理功能,重点关注其动力学特性和耐氧性;其次,阐述在有氧和厌氧土壤生境中产生和氧化H₂的功能群;最后,结合氢化酶的生化特性,提出氢氧化微生物沿土壤中O₂和H₂理论浓度梯度的演替模式,及其在碳循环中的潜在意义。综述结尾提出研究展望,以期评估氢氧化微生物在土壤生物地球化学过程中的贡献。
氢化酶分类概述
氢化酶是一类金属酶,可催化H₂与质子和电子的相互转化,反应式如下:H₂ ⇌ 2H⁺ + 2e⁻(20)。这些酶可用于提供能量、还原辅因子或分散厌氧过程中产生的还原当量(11)。结构亚基之间电子传递链的构象,以及蛋白质的定位(膜结合型或可溶性),决定了其生理功能(20)。根据活性中心和氨基酸序列的差异,氢化酶可分为[Fe]型氢化酶、[FeFe]型氢化酶和[NiFe]型氢化酶三类(21)。这三类氢化酶的三级结构、催化活性和分类学分布存在显著差异,因此它们的起源可能源于趋同进化而非渐进式进化(22, 23)。由于氢化酶具有模块化结构,水平基因转移在其进化过程中也十分常见(24-27)。因此,某些微生物(如变形菌门的食酸代尔夫特菌*Cupriavidus necator*和放线菌门的耻垢分枝杆菌*Mycobacterium smegmatis*)的基因组具备表达多种具有不同生理功能的氢化酶的能力,从而增强了其代谢灵活性(28, 29)。
(1)[Fe]型氢化酶
[Fe]型氢化酶为同源二聚体,由两个38 kDa的亚基组成,催化中心含单个铁原子(20)。与[FeFe]型和[NiFe]型氢化酶不同,[Fe]型氢化酶不含铁硫簇,仅存在于广古菌门(*Euryarchaeota*)的氢营养型产甲烷古菌中(30)(图1;另见补充材料图S1),且不会被O₂灭活(31, 32)。在镍限制条件下,[Fe]型氢化酶与依赖F₄₂₀的亚甲基四氢甲烷蝶呤(亚甲基-H₄MPT)脱氢酶协同作用,将H₂氧化产生的电子导向依赖H₂和CO₂的产甲烷过程(33)。
(2)[FeFe]型氢化酶
[FeFe]型氢化酶可为单体、二聚体、三聚体或四聚体酶,其活性中心含两个铁原子(称为H簇),同时还含有铁硫簇(34)。该类酶严格厌氧,因为其活性中心暴露于O₂后会变性(20)。[FeFe]型氢化酶几乎仅用于产生H₂(28, 35),但也存在少数例外,例如变形菌门的普通脱硫弧菌(*Desulfovibrio vulgaris*)——在镍限制条件下,其[FeFe]型氢化酶可通过氧化H₂来替代[NiFe]型氢化酶的合成(36)。由于对O₂敏感,[FeFe]型氢化酶主要存在于厌氧厚壁菌门(*Firmicutes*)微生物和硫酸盐还原菌中(图2及图S2)(23, 37, 38)。它是真核生物中发现的唯一一类氢化酶,存在于单细胞绿藻莱茵衣藻(*Chlamydomonas reinhardtii*,绿藻门*Chlorophyta*)中(39),且定位于叶绿体和氢化酶体等膜包被细胞器内(40)。
(3)[NiFe]型氢化酶
[NiFe]型氢化酶是分布最广泛的一类氢化酶(11),其成熟过程需要多个结构基因和辅助基因的参与(41)。尽管[NiFe]型氢化酶可为多聚体,但至少包含一个核心异二聚体组件,由一个大亚基(约60 kDa)和一个小亚基(约30 kDa)组成(20)。[NiFe]型氢化酶是一类异质性群体,根据系统发育(图3及图S3)和生理学特征(20)可分为5个亚群。在这些生理特征中,耐氧性和低催化亲和力最为常见(20)。事实上,仅有少数亚群对O₂敏感,且仅有一个亚群对H₂具有高亲和力(即能氧化大气中的H₂,浓度为0.53 ppmv(42))。近期,研究人员利用结构基因序列相似性网络重新审视了这一分类体系(该体系此前通过基因序列与氢化酶生理功能的一致性得到支持),结果表明每个亚群内可能存在更多假定的子类(10, 43)。由于目前缺乏实验证据证明这些子类与氢化酶的遗传、生化及生理特征相符,本综述暂不讨论此类重新分类。
(a)1类[NiFe]型氢化酶
1类[NiFe]型氢化酶(膜结合型氢化酶[MBH])是附着于细胞质膜(周质侧)的吸氢酶(20)。它们通过细胞色素b将电子传递至醌池,与电子传递链紧密偶联,进而通过化学渗透作用驱动后续的ATP合成(44)。膜结合型氢化酶通过将H₂氧化与多种电子受体(如CO₂、SO₄2⁻、NO₃⁻、Fe(III)氧化物或O₂)的还原反应偶联,为微生物提供能量(44)。这类酶主要存在于变形菌门(*Proteobacteria*)和厚壁菌门(*Firmicutes*)中,占比分别为62.5%和17.3%(图3及图S3)。在产甲烷古菌和硫酸盐还原菌中发现的原始膜结合型氢化酶对O₂敏感(44);与之相反,在专性和兼性自养菌中与Isp复合体相关的膜结合型氢化酶,以及在γ-变形菌中与HybA-MBH相关的膜结合型氢化酶,对O₂具有一定的耐受性(44)。耐氧型膜结合型氢化酶可用于催化“爆鸣气反应”(Knallgas reaction),即利用O₂作为末端电子受体氧化H₂,或参与其他涉及高电位电子受体(如氮氧化物或细菌叶绿素)的反应(44)。
(b)2类[镍铁]型氢化酶
2类[镍铁]型氢化酶属于胞内酶,可划分为两个功能各异的亚类,即2a亚类和2b亚类(20)。其中2a亚类[镍铁]型氢化酶为可溶性吸氢酶,能够氧化由固氮作用(45)或还原型辅酶Ⅱ/还原型辅酶Ⅰ氧化过程(29)内源性产生的氢气,这类酶主要存在于蓝细菌及其他固氮细菌中(45,46)(图3及图S3)。其作用是将电子传递至电子传递链,为细胞供能(34)。该类酶常存在于蓝细菌的异形胞内,而异形胞中不进行产氧光合作用;由于对氧气敏感,其在厌氧环境下的表达量会升高(47)。与之不同,2b亚类[镍铁]型氢化酶是具有氢气感应功能的调节型氢化酶,可作为双组分信号转导系统发挥作用(20)。其内部存在疏水性气体通道,该通道独特的形状与尺寸能将外源性氢气导向活性中心,这一结构赋予了该酶耐氧性(48)。当环境中存在氢气时,这种调节型氢化酶可诱导爆鸣气细菌中1类和3类吸氢酶操纵子的转录(49,50)。
(c)3类[镍铁]型氢化酶
3类[镍铁]型氢化酶属于胞内酶,也被称为双向异多聚体[镍铁]型氢化酶或可溶性氢化酶(20)。其作用是维持细菌和古菌细胞内的氧化还原平衡(11),酶的结构亚基与可结合可溶性辅因子的蛋白质模块紧密相连(20)。该类氢化酶的活性中心中,镍原子和铁原子还结合了两个额外的氰化物配体,这一结构使其具备耐氧性(51)。这类氢化酶主要存在于变形菌门(占比37.4%)和广古菌门(占比27.4%)中(图3及图S3),并可进一步细分为4个亚类(20)。
1. 3a亚类[镍铁]型氢化酶:该类酶为异源三聚体酶,最初发现于产甲烷古菌中(52),近年来也在部分细菌门中被检出(53),其功能是还原辅酶F420。
2. 3b亚类[镍铁]型氢化酶:属于四聚体酶,具有双功能硫氢化酶的活性(20)。该酶最初发现于超嗜热古菌中,近期也在细菌门中被发现(10)。它既能将单质硫还原为硫化氢,也可通过氧化还原型辅酶Ⅱ或还原型辅酶Ⅰ产生氢气,以此消散发酵过程中产生的还原当量;此外,还能借助氢气生成还原型辅酶Ⅱ(54)。
3. 3c亚类[镍铁]型氢化酶:这类酶与二硫键还原酶相关联,可催化甲基紫精、辅酶M - 辅酶B二硫键等化合物的还原反应(55),主要存在于产甲烷菌和硫酸盐还原菌中。
4. 3d亚类[镍铁]型氢化酶:由异聚体氢化酶和一个可结合还原型辅酶Ⅱ或还原型辅酶Ⅰ的还原型辅酶Ⅰ脱氢酶模块构成(20)。这类酶的亚基数量差异较大,例如食酸代尔夫特菌体内的该类酶为异源二聚体(56),而蓝细菌体内的则为异源五聚体(57)。其功能是利用氢气还原辅酶Ⅰ,从而维持辅酶Ⅰ与还原型辅酶Ⅰ的平衡(20)。
(d)4类[镍铁]型氢化酶
4类[镍铁]型氢化酶也被称为膜结合型能量转换氢化酶,这类多聚体酶对氧气敏感(58),由两个嵌入细胞质膜的蛋白质和多个亲水性亚基组成(20)。该类酶多见于产甲烷古菌、化能无机自养细菌和超嗜热古菌中(图3及图S3)。在兼性化能无机自养菌中,4类氢化酶可将水中质子的还原反应与甲酸、一氧化碳等含一个碳原子化合物的厌氧氧化相结合,以此消散发酵过程中产生的还原当量(59)。在乙酸营养型产甲烷菌中,能量转换氢化酶可借助氢气还原铁氧还蛋白,进而通过细胞质膜形成质子梯度,最终驱动三磷酸腺苷的合成(60)。在不含细胞色素的产甲烷菌中,4类[镍铁]型氢化酶(如能量氢化酶a和能量氢化酶b)既能还原铁氧还蛋白、催化氢气氧化,还可偶联产生钠离子动力势(20)。此外,4类[镍铁]型氢化酶还包含超嗜热型能量转换氢化酶,这类酶可通过产生氢气来恢复铁氧还蛋白的氧化态(61)。
(e)5类[镍铁]型氢化酶
5类[镍铁]型氢化酶属于耐氧型吸氢酶(62),且对氢气具有高亲和力,能够氧化大气中的氢气(63)。研究人员首次在放线菌门链霉菌属细菌的孢子中发现了这类酶的活性(64)。该类酶或许可通过电子受体与细胞膜的细胞质一侧相结合,但相关研究结论存在矛盾(62,65)。基因组数据库分析显示,84.0%的5类[镍铁]型氢化酶存在于放线菌门中(图3及图S3)(10,66)。据推测,这类氢化酶的作用是为微生物提供生长优势(67),或是在微生物的存活型混合营养生活方式中作为辅助能量来源,以维持贫营养环境中微生物种群库的稳定(66)。但食酸代尔夫特菌体内的5类[镍铁]型氢化酶表达量较低,且无法氧化大气中的氢气(62)。目前,赋予该类酶高氢气亲和力的生化特性尚不明确。尽管所有5类[镍铁]型氢化酶的活性中心序列相似度较高,但它们对氢气的亲和力差异显著。例如,食酸代尔夫特菌体内该酶的米氏常数超过1000体积百万分率,而链霉菌PCB7菌株体内该酶的米氏常数仅为11体积百万分率(64)。这一现象表明,要么食酸代尔夫特菌发生了横向基因转移(69),要么高亲和力氢氧化微生物体内的氢化酶进化出了未知的生化特性。此外,5类[镍铁]型氢化酶的生理性电子受体至今尚未明确(65,70),这也可能是影响其氢气亲和力的因素之一。目前,该类酶的亲和力尚未经过充分的体外实验验证,因此不能认定食酸代尔夫特菌就是该类酶作用规律的例外情况。同时,不同的系统发育分析导致氢化酶的命名方式较为混乱,其实5类(62,66,71)与1h类(10)指代的是同一类酶。
氢气生物地球化学循环概述
氢气的生物源产生与生物汇消耗在有氧和厌氧生态系统中均普遍存在。在湿地、化变层以下的淡水环境、海洋沉积物以及动物消化道等厌氧生态系统中,氢气主要是三大生命域生物降解有机质过程中产生的中间产物。厌氧生态系统中氢气的主要生物汇包括产乙酸菌、产甲烷菌、硫酸盐还原微生物、氧化铁还原微生物以及硝酸盐还原微生物(35)。而在高地土壤、化变层以上的淡水环境和开阔海洋等有氧环境中,氢气主要通过固氮作用产生,且主要被爆鸣气细菌和高亲和力氢氧化细菌消耗(35)。由于氢气具有供能潜力,其会在所处微环境中被微生物快速消耗,这意味着氢气的产生很可能是氢气生物地球化学循环中的限制性环节(33)。下文将介绍厌氧和有氧生态系统中参与氢气产生与利用的各类微生物功能群,以此阐明这些微生物的丰富多样性及其在碳生物地球化学循环中的作用。
(1)厌氧生态系统中的氢气产生
厌氧生态系统中的氢气生成,绝大部分源于光合成产氢(或称生物光解)、暗发酵产氢和光发酵产氢这三种途径(35)。
1. 光合成产氢:水生沉积物中的小球藻、斜生四爿藻(曾用名斜生栅藻)(72)、莱茵衣藻(73)等单细胞藻类以及蓝细菌均可进行光合成产氢。土壤中,荚膜红细菌(74)、深红红假单胞菌(75)等多种紫色非硫细菌也能完成这一过程。该过程发生在氧气和二氧化碳受限的环境中(76,77)。在光的作用下,电子被激发后经光系统传递并还原铁氧还蛋白,随后铁氧还蛋白被氧化,通过[铁铁]型氢化酶催化产生氢气(78)。这一过程能够维持电子传递链的电子流动,以便在环境条件改善(如潮汐变化或进入下一个光照周期)时,微生物可迅速恢复产氧光合作用(77)。
2. 光发酵产氢与暗发酵产氢:海洋和陆地环境中的多种生物均可通过暗发酵产氢,例如硅藻门的脆杆藻属、绿藻门的塔胞藻属等单细胞藻类(78)、厚壁菌门的丙酮丁醇梭菌等严格厌氧菌(79),以及变形菌门的大肠杆菌等兼性厌氧菌(80)。暗发酵产氢的过程为:先通过糖酵解途径代谢,随后丙酮酸脱羧生成乙酰辅酶A,在此过程中,铁氧还蛋白/辅酶Ⅰ被还原为还原型铁氧还蛋白/还原型辅酶Ⅰ;这些还原态物质为氢化酶提供电子,自身被氧化的同时生成氢气(78,81,82)。此外,辅酶A与丙酮酸反应生成甲酸和乙酰辅酶A,甲酸进一步分解也可产生氢气和二氧化碳(83)。通过释放还原当量,氧化型铁氧还蛋白和还原型辅酶Ⅰ得以再生,糖酵解过程便可重新生成三磷酸腺苷。光发酵产氢则由紫色非硫细菌完成,例如红螺菌属的深红红螺菌、球形红细菌等,这类细菌能利用光能将乳酸等有机底物转化为氢气和二氧化碳(83)。若环境存在明暗交替周期,光发酵与暗发酵可依次进行。基因组研究和培养依赖性实验表明,水生环境中能通过发酵产氢的生物包括单细胞藻类、厚壁菌门、拟杆菌门、螺旋体门和变形菌门微生物(78,84 - 86)。在稻田等厌氧土壤中,针对[铁铁]型氢化酶的分子检测显示,厚壁菌门(以梭菌纲为主)、变形菌门(以δ - 变形菌纲为主)以及绿弯菌门微生物是产氢的优势类群(87,88)。同样,在弱酸性沼泽泥浆富集体系中,产氢发酵菌主要为厚壁菌门(梭菌纲和厌氧革兰氏阳性菌纲)和δ - 变形菌纲微生物(89)。
3. 固氮作用:梭菌属、芽孢杆菌属等厚壁菌门微生物,以及产甲烷古菌和蓝细菌等,均能在厌氧或微氧环境中通过固氮作用产生氢气(90,91)。现有研究推测,大部分生物固氮作用发生在有氧生态系统中(92),尤其是表层水体(93,94)以及豆科植物和放线菌根瘤植物的根际环境(95),这部分内容将在下文展开论述。
(2)有氧生态系统中的氢气产生
固氮作用:生物固氮作用是有氧生态系统中氢气产生的主要生物过程。固氮酶复合体通过如下反应实现固氮(96 - 98):
氮气+8氢离子+8电子→2氨气+氢气 (1)
生物固氮过程需要消耗大量能量,每固定1分子氮气至少需要16分子三磷酸腺苷(每传递1个电子需2分子三磷酸腺苷(98))。因此,该过程受到严格调控,仅在环境中缺乏可利用氮源时才会启动(99)。由于固氮酶遇氧会发生不可逆失活(98,100),微生物进化出了多种时空避氧策略,具体包括:将固氮作用与产氧光合作用在时间或空间上分离(100)、主动规避氧气环境、维持高呼吸速率,以及借助运氧蛋白缓冲局部氧气浓度(98,101 - 103)。氢气是生物固氮反应中必然产生的副产物,其生成过程消耗的电子约占固氮反应总电子流量的35%(104),这会导致氢气在豆科植物根际等环境中局部积累(105,106)。生物固氮与氢氧化过程往往密切相关、相辅相成:氢氧化与氧气还原反应偶联,既能回收部分用于固氮的三磷酸腺苷,又能降低局部氧气分压、减少氢气累积,而这两种情况均会对固氮作用产生抑制(46,107)。微生物的生物固氮策略主要分为三类,即共生固氮(99,108)、植物联合固氮(109)和自生固氮(97,110)。与其他固氮微生物不同,大多数与豆科植物共生的固氮微生物不具备回收固氮作用所产氢气的基因能力(即缺乏吸氢酶活性)(111)。有研究推测,这些氢气可为宿主植物提供额外能量,发挥肥效以促进植物生长(112,113)。
(3)厌氧生态系统中的氢气消耗
在厌氧生态系统中,众多微生物功能群会以氢气为电子供体,根据电子受体的可利用性及热力学限制,选择性地还原各类末端电子受体(33)。下文将按氧化还原电位从低到高的顺序,介绍部分参与该过程的微生物功能群,涵盖从产乙酸作用到反硝化作用的相关类群。除此之外,二氧化锰、铬酸根等也可作为与氢氧化偶联的电子受体。尽管这些微生物大多为兼性厌氧菌,但这类氢氧化过程仅发生在厌氧生态系统中,因为从热力学角度而言,氧气的还原反应相比其他电子受体的还原反应更易发生。这些微生物功能群并非相互排斥,许多细菌和古菌都能够利用多种不同的电子受体完成氢氧化反应。
1. 产乙酸菌:产乙酸作用由细菌和古菌域中的多种严格厌氧菌完成(114)。产乙酸菌的生态分布极为广泛,常见于湿地(115)、动物消化道(116,117)、海洋、地下沉积物(118)、高盐水体(119)以及有氧土壤(120)等环境。尽管产乙酸菌出现在有氧土壤中看似矛盾,但部分产乙酸菌和产甲烷菌已进化出多种机制以实现有氧存活(121,122)。多数产乙酸菌(如梭菌属)属于厚壁菌门(123),不过在深海古菌门等其他类群中也发现了产乙酸菌(114)。产乙酸菌通过伍德 - 永达尔途径,将一氧化碳等含一个碳原子的无机化合物转化为乙酸等含两个碳原子的有机化合物,其反应式如下(124):
2二氧化碳+4氢气⇌乙酸根+氢离子+2水 (2)
产乙酸菌会捕获有机质降解过程中产生的氢气。这类细菌面临着来自产甲烷菌的激烈竞争,因为产甲烷菌对氢气的利用阈值更低,且能量产出效率更高(125,126)。但在某些生态系统中,产乙酸菌能够竞争过产甲烷菌,例如在白蚁肠道内(127),这是由于产乙酸菌产生的乙酸对宿主动物具有生态价值。产乙酸菌通过耦合二氧化碳与氢气的代谢过程,深度参与氢气循环和碳循环,其产生的乙酸可作为易被利用的碳源供周边微生物利用。同时,作为严格厌氧菌或兼性厌氧菌,产乙酸菌还能通过发酵作用分解溶解性有机质,并在此过程中产生氢气和二氧化碳。此外,羧基梭菌、德雷克氏梭菌等部分产乙酸菌(128,129)还具备将一氧化碳氧化为二氧化碳、降解结晶纤维素和半纤维素、促进难降解聚合有机质周转(130)以及分解腐殖酸的能力(131)。
(b)产甲烷菌
产甲烷作用仅由产甲烷古菌完成,这类古菌广泛存在于湿地、动物肠道、热泉和热液喷口等极端环境(132),甚至在有氧土壤中也有分布(120)。产甲烷菌是唯一含有[Fe]型氢化酶的功能类群,该酶使其能够以H₂为还原剂,通过铁氧还蛋白依赖的途径将CO₂还原为CH₄,简化反应式如下(133, 134):
CO₂ + 4H₂ → CH₄ + 2H₂O (3)
由于CO₂的氧化还原电位较低,产甲烷菌主要在生态系统中硫酸盐、硝酸盐等更高氧化还原电位电子受体耗尽的区域或层级中大量繁殖(33)。它们会捕获有机质降解过程中产生的CO₂和H₂,部分产甲烷菌还能自主发酵有机质产生这些底物。利用电子歧化作用的氢营养型产甲烷菌被认为是专性自养菌(135),而通过氧化磷酸化供能的甲基营养型产甲烷菌可利用的底物范围更广泛(136)。然而,近期研究表明,某些氢营养型产甲烷菌(如广古菌门的海洋产甲烷菌*Methanococcus maripaludis*(137))的代谢灵活性可能远超最初认知——它们不仅能利用CO₂和H₂,还可通过组合利用CO和甲酸供能。此外,“矛盾甲烷丝菌候选菌”(*Candidatus Methanothrix paradoxum*,广古菌门,非氢营养型)(138)的发现,也对“产甲烷菌为严格厌氧菌”这一传统认知提出了挑战。
产甲烷菌对碳循环的参与还体现在其还原腐殖酸的能力上,例如广古菌门的巴氏甲烷八叠球菌(*Methanosarcina barkeri*)(139),不过这一过程会暂时降低其产甲烷潜力。甚至有研究认为,厌氧甲烷氧化古菌(ANME)也可能属于产甲烷菌类群(140, 141)。
(c)硫酸盐还原细菌与古菌
硫酸盐还原细菌(SRB)(如厚壁菌门的脱硫弧菌属*Desulfovibrio*和脱硫肠状菌属*Desulfotomaculum*)以及硫酸盐还原古菌(SRA)(如广古菌门的古球菌属*Archaeoglobus*)均为厌氧微生物,它们能通过耦合H₂(或有机化合物)的氧化与硫酸盐(SO₄2⁻)的还原,生成硫化物(142, 143)。
尽管在海岸沉积物等有氧环境中也能检测到硫酸盐还原微生物(144),但它们更常见于海洋和淡水沉积物、深部地下环境及动物肠道中(143),在酸性矿坑排水和碱湖等极端环境中也有分布(143)。由于生长动力学优势,利用H₂的硫酸盐还原菌在同一生态系统中可竞争过产乙酸菌和产甲烷菌(143)。厚壁菌门的脱卤拟球菌属(*Desulfitobacterium*)微生物还能还原腐殖酸和多环芳烃化合物(145, 146),研究已证实其具备固定CO₂(147, 148)和氧化CO(149)的潜力。硫酸盐还原微生物被认为是海洋沉积物中碳循环的主要驱动者(143),其中氧化H₂的SRB在参与厌氧甲烷氧化(AOM)的共生菌群中还可作为互营菌发挥作用(150)。
(d)氧化铁还原菌
氧化铁还原细菌与古菌[Fe(III)还原菌]广泛存在于土壤、酸性矿坑废水(151)、水生沉积物(152)、热泉(153)及地下生态系统中。由于Fe(III)在水中不溶解,微生物需与Fe(III)直接接触才能将其还原(154)。变形菌门的希瓦氏菌属(*Shewanella*)、地杆菌属(*Geobacter*)以及酸杆菌门的地丝菌属(*Geothrix*)等微生物,可通过产生螯合剂溶解水中的Fe(III),甚至合成导电细菌纳米线以接触Fe(III)(154)。它们以Fe(III)为电子受体,氧化有机质或H₂供能(155–157)。
许多Fe(III)还原菌还能利用其他电子受体,如O₂、SO₄2⁻、NO₃⁻,甚至CO和CO₂(139, 155)。这类微生物既包括地杆菌属、希瓦氏菌属等细菌(152, 155),也涵盖产甲烷菌(139)及泉古菌门的岛生火棒菌(*Pyrobaculum islandicum*)等古菌(158)。与硫酸盐还原过程相比,Fe(III)还原过程对H₂的捕获效率更高(159)。部分Fe(III)还原菌能以腐殖质为电子受体,通过厌氧氧化有机化合物(如产乙酸菌产生的乙酸)或H₂维持生长(160)。这种电子传递过程还能螯合氧化铁,使其转化为地杆菌属(如*Geobacter metallireducens*)可利用的生物有效形式,而这类地杆菌同时也参与污染物(如苯)的降解(160)。
(e)反硝化细菌与古菌
反硝化细菌与古菌通过耦合硝酸盐(NO₃⁻)及后续还原态氮化合物的还原反应,氧化H₂(或有机化合物)供能(161)。反硝化作用广泛存在于水生和陆地生态系统中,主要由异养微生物(如变形菌门的脱氮副球菌*Paracoccus denitrificans*)完成,在自养微生物(如变形菌门的脱氮硫杆菌*Thiobacillus denitrificans*)或变形菌门的氢噬菌目(*Hydrogenophilales*)微生物中也较为常见(162–164)。
反硝化作用是能量收益最高的厌氧呼吸过程,被多种微生物所利用(10, 33)。该过程通常包含NO₃⁻→NO₂⁻→NO→N₂O→N₂等一系列连续还原反应,但多数反硝化微生物并不具备完成完整反硝化过程的全套代谢机制。在同一生态系统中,不同菌株常通过互补反硝化能力实现更高效的能量获取,并避免有毒氮中间体的积累(165)。变形菌门的假单胞菌属(*Pseudomonas*)微生物既能进行反硝化作用,也能降解聚合有机质(POM),包括木质素(166)和芳香族化合物(167)。与SRB类似,部分反硝化细菌在AOM共生菌群中也可作为互营菌(168)。
(4)有氧生态系统中的H₂吸收
在通气土壤中,高混合比H₂的氧化主要由爆鸣气细菌完成;而高亲和力氢氧化细菌(HA-HOB)则能氧化更低混合比的H₂,例如大气中的H₂(约0.53 ppmv(42))。
(a)爆鸣气细菌
爆鸣气细菌是水生和陆生环境中的专性或兼性化能无机自养菌,它们以O₂为末端电子受体,通过爆鸣气反应氧化H₂,反应式如下:
H₂ + O₂ ⇌ H₂O (4)
模式爆鸣气微生物包括食酸代尔夫特菌(*C. necator*,原名真养产碱菌*Ralstonia eutropha*),其基因组中含有分别属于1、2、3、5类的4种[NiFe]型氢化酶(28, 62, 169),但并非所有爆鸣气细菌都拥有多种氢化酶。尽管食酸代尔夫特菌含有5类[NiFe]型氢化酶,但其无法氧化大气混合比的H₂(62),因此不属于HA-HOB,这与耻垢分枝杆菌(*Mycobacterium smegmatis*)(65)不同。当H₂浓度足够高时,食酸代尔夫特菌会利用1类[NiFe]型氢化酶,以CO₂固定和H₂氧化作为唯一的碳源和能源(51);3类[NiFe]型氢化酶则通过耦合H₂氧化与NAD⁺还原,维持细胞内氧化还原平衡(28)。为避免在H₂混合比低时持续表达1类和3类氢化酶造成能量浪费,食酸代尔夫特菌还会产生2类氢化酶——作为传感器调控另外两种氢化酶的结构基因和辅助基因的转录(28)。最终,5类氢化酶的ATP生成速率虽低于膜结合型氢化酶(1类),但对O₂完全不敏感(62)。
其他爆鸣气细菌也具有类似的H₂吸收机制,且涵盖多种系统发育类群(如变形菌门、厚壁菌门、蓝细菌门、绿弯菌门和酸杆菌门)。此外,许多固氮微生物(如放线菌门的放线菌根瘤植物共生菌弗兰克氏菌属*Frankia*和蓝细菌)能氧化固氮作用产生的H₂(170)。已知多种爆鸣气细菌属于植物促生根际细菌(PGPR)(112, 171),更多爆鸣气细菌则参与碳循环的关键步骤。部分爆鸣气细菌能降解聚合化合物,例如假坚强芽孢杆菌(*Bacillus pseudofirmus*)和耐热芽孢杆菌(*Bacillus thermotolerans*)在氧化Fe(III)氧化物时可还原腐殖酸(172, 173),变形菌门的伯克霍尔德氏菌属(*Burkholderia*)则能降解木质素(166)。此外,许多甲烷氧化菌(如变形菌门的三孢甲基弯菌*Methylosinus trichosporium*和疣微菌门的烟色甲基嗜酸菌*Methylacidiphilum fumariolicum*)可在有氧条件下氧化H₂和CH₄(174, 175),因此也属于爆鸣气细菌。多种爆鸣气细菌(如变形菌门的敏捷氢单胞菌*Hydrogenomonas facilis*(176)和食酸代尔夫特菌(177))还能固定CO₂或氧化CO(178)。
#
(b)大气H₂氧化
长期以来,由于无法分离出在低H₂分压下负责大气H₂氧化的微生物,该过程被认为由非生物酶催化(179, 180)。直至近期,能氧化低混合比H₂的细菌才被成功分离(64),因此其在科学文献中的报道较少。最新基因组数据库分析(10)显示,大部分含有5类[NiFe]型氢化酶的微生物属于放线菌(*Actinomycetes*),如链霉菌属(*Streptomyces*)和分枝杆菌属(*Mycobacterium*)。目前已分离并鉴定的高亲和力氢氧化微生物数量有限,包括放线菌门的马红球菌(*Rhodococcus equi*)(181)、多种链霉菌(64, 68, 181)及耻垢分枝杆菌(65)。不过,目前对5类[NiFe]型氢化酶在细胞内的具体功能仍不明确。
HA-HOB主要存在于土壤中,是大气H₂的主要汇(占比70%)(182)。尽管大气H₂能提供可观的能量,但不足以支撑细菌生长(63)。现有研究表明,HA-HOB可将H₂作为额外能量来源,以促进生长和存活(67, 181),或在“存活型混合营养”生活方式中利用H₂(68)。HA-HOB同样参与碳循环,例如约氏红球菌(*Rhodococcus jostii*)和马红球菌能降解木质素及其他多种POM化合物(166, 183);链霉菌属微生物可分解腐殖酸甚至煤炭,推动POM循环(184–186);耻垢分枝杆菌等其他放线菌则能氧化大气中的CO和H₂(187)。部分候选类群也可能具备氧化大气H₂和固定CO₂的遗传潜力(188)。
土壤中H₂与碳生物地球化学循环沿理论O₂梯度的关联
各类氢氧化微生物(HOM)不仅能水解溶解性有机质(DOM),还参与纤维素、半纤维素、木质素、腐殖质和多环芳烃等POM的分解,并催化CO、CO₂和CH₄的氧化还原反应(图4)。HOM可灵活切换碳源和能源利用模式(6),使其在不同碳输入条件下具备极强的代谢适应性。许多碳循环过程还会产生乙酸等可供更广泛微生物利用的碳源。此外,在豆科植物根际、白蚁肠道和蛇纹石化系统等高H₂微环境中,HOM释放的代谢产物可能还会激发有机质(尤其是土壤中的有机质)的分解和周转。近期研究表明,当土壤暴露于自然环境中常见的高H₂浓度(即10,000 ppmv)时,特定时间段内微生物利用的碳源种类增加,且碳源消耗强度显著提升(190, 191)。然而,目前尚不清楚这种类似激发效应的响应是由HOM的混合营养生长策略导致,还是由HOM与非氢氧化异养菌之间的正向相互作用引起。基于此,可推测在富H₂生态系统中,HOM参与的分解、腐殖化和水解等其他碳循环过程也可能增强(图4)。
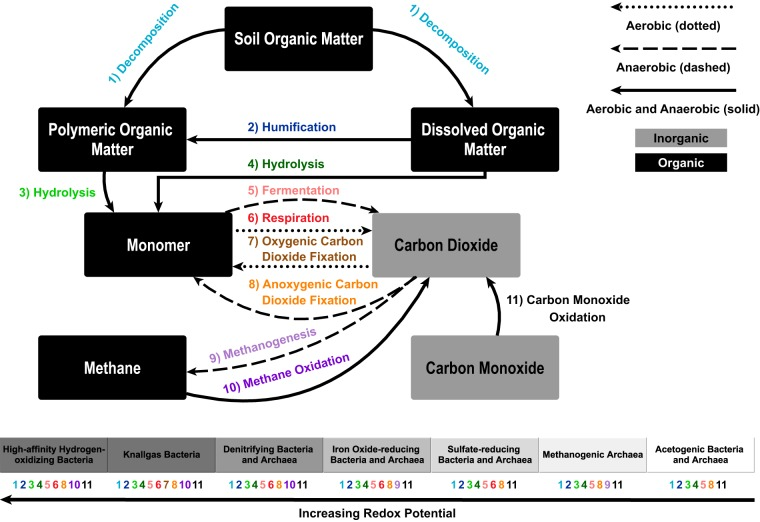
图4 碳循环与主要氢氧化功能类群的关联
HOM参与碳循环的所有关键步骤。微生物功能类群下方的数字代表其执行的反应。尽管CH₄氧化可在厌氧生态系统中发生,但厌氧甲烷氧化(AOM)并非由HOM完成,而是由其互营细菌伙伴(即硫酸盐还原菌或硝酸盐还原菌)执行。如右图底部梯度所示,H₂利用过程的发生遵循热力学优势顺序:优先利用O₂,其次是硝酸盐、氧化铁、硫酸盐,最后是CO₂。有氧生态系统中唯一缺失的关键碳循环过程是产甲烷作用,但在多种生态系统中,残余CH₄会从厌氧层扩散至有氧层。不过存在例外情况:非氢营养型产甲烷菌在有氧层也具有活性(138),可直接向有氧生态系统提供CH₄。
在微量气体方面,研究表明在耕地和森林土壤中,大气CO和H₂的沉积速率呈正相关(192, 193)。最初假设这一现象由扩散作用主导,但近期研究发现,微生物对H₂、CO和CH₄的氧化潜力也存在相关性。具体而言,当H₂暴露浓度从0.5 ppmv增至10,000 ppmv时,低亲和力H₂氧化作用增强,净CO₂产生量减少,高亲和力H₂、CO及CH₄的氧化作用则减弱(194)。尽管CO₂产生量的相关数据尚未发表,但该指标与其他微量气体指标是通过同一仪器同步测定的(194)。综上,这些研究表明富H₂生态系统可能是DOM和POM循环的枢纽:当H₂以高混合比存在时,HOM会优先氧化H₂,而非利用其他微量气体。
尽管潜在活性无法完全代表原位观测结果,但已有H₂驱动碳循环的实例。两项研究显示,在持续通入空气或H₂补充空气的土壤系统中,H₂暴露期间CO₂动态会从净产生转变为净固定(195, 196)。近期宏基因组研究推测南极荒漠土壤中也存在类似现象(188)。固定的CO₂会增加系统中有机碳的输入,这些有机碳可在细胞死亡或产生次级代谢产物后,被其他微生物利用。尽管这些研究中尚未鉴定出具体功能菌株,但已知多种爆鸣气细菌可氧化H₂并固定CO₂。此外,尽管上述假设针对氧化H₂的CO₂固定微生物,但可推测:氧化H₂的甲烷氧化菌在H₂存在时,也可能通过降低CH₄氧化作用,增加产甲烷菌的净碳输入,从而偏向特定代谢途径(图4)(194)。
尽管HOM参与多种碳循环过程,但其对各过程的相对贡献尚不明确。可通过群落水平和个体水平两种研究方法增进对H₂-碳动态关系的理解:
- 群落水平研究:可将土壤(如微宇宙、中宇宙甚至田间土壤)暴露于基准H₂混合比(如对照组0.53 ppmv(42))及代表自然条件的更低或更高混合比中。H₂暴露可通过合成气体混合物实现,或通过调控豆科植物招募的固氮产H₂根瘤菌(分别以无吸氢酶活性和有吸氢酶活性的菌株作为对照和处理组)实现。这种设计可直接比较H₂可利用性与碳周转的关系。
- 个体水平研究:可开展三项实验:新HOM的培养、未培养新HOM的单细胞测序,或未培养HOM的宏基因组组装基因组(MAGs)分析。传统培养方法可直接验证HOM的碳循环能力,而非培养方法则能更全面地揭示其代谢多样性。
此外,土壤中多种H₂和碳循环过程(如大气CH₄与高H₂氧化)存在相关性,但尚不清楚这些过程是由同一微生物执行,还是仅发生在同一生态位中。上述三种个体水平方法不仅有助于解决这一难题,还能减少当前基因组数据库中的偏差(例如,某些类群的测序代表株更多,导致其在数据库中的占比与其实际参与循环的程度不匹配,如放线菌目与高亲和力H₂氧化)。未来在这些方向的深入研究,将有助于阐明物种和生态系统水平上碳循环与H₂循环重叠的重要性,进一步揭示HOM的整体生物地球化学潜力。这些知识可用于开发利用土壤H₂热点区域的技术,例如提高碳周转效率或实现农业效益(尤其是在富H₂的豆科植物根际)(197)。
最后,本综述表明“HOM作为功能类群”是一个简化概念。即不应将HOM仅限定为其氢氧化功能——这类微生物具有高度多样性,其中许多成员执行的关键生态系统功能,在生态系统水平上的重要性可能远超其个体能量获取潜力。
https://blog.sciencenet.cn/blog-41174-1514167.html
上一篇:语言中枢对语言普遍性特异性均会产生响应
下一篇:重组层粘连蛋白为帕金森病干细胞疗法铺平道路