博文
微核崩溃和癌症
|
在细胞分裂(有丝分裂)过程中,染色体分离错误可能导致染色体不稳定,这是人类癌症的一个标志。这些有丝分裂错误导致微核的形成——小的胞浆结构,它们与主核空间上分离,包含滞后染色体或染色体片段。与细胞的主核不同,微核经常发生不可修复的破裂和坍塌。这种破裂将微核DNA释放到胞质中,导致DNA损伤、染色体重排和基因组不稳定,从而促进癌症进展。微核的破裂还激活了一种叫做环状鸟苷酸-腺苷酸合成酶(cGAS)-干扰素基因刺激物(STING)通路的先天免疫系统成分,导致肿瘤相关炎症和转移(1)。在这一期的951页和952页,Di Bona等人(2)和Martin等人(3)分别报告了微核崩溃的分子基础。
细胞已经进化出了非常高效的机制来修复核膜。一种机制涉及激活屏障到自整合因子(BAF)蛋白,当核膜破裂时,它会招募内质网(ER)膜至破裂处以修复损伤。此外,BAF与核包膜蛋白LEMD2(含有LEM结构域的蛋白2)和emerin相互作用,这有助于招募CHMP7(带电多泡体蛋白7)——一种对运输所需的内体分拣复合物(ESCRT)-III复合物的亚单位——至破裂处(4)。
ESCRT复合体是一组在几个重要的需要膜重塑的细胞过程中发挥关键作用的蛋白质,包括分选膜蛋白进行降解、协助细胞分裂、修复质膜损伤以及修复核包膜(5)。它由四个主要亚复合体组成——ESCRT-0、ESCRT-I、ESCRT-II和ESCRT-III——以及相关的辅助蛋白。CHMP7是一种促进ESCRT-III复合体在核包膜组装以封闭膜的支架蛋白(6)。
然而,在微核中,BAF和ESCRT-III核修复机制无效。BAF在微核包膜断裂处富集,但出于不明确的原因未能封闭膜。值得注意的是,存在于破裂微核中的CHMP7和其他ESCRT-III组分也不参与正常修复过程;相反,它们的无限制积累导致了微核的崩溃(7)。
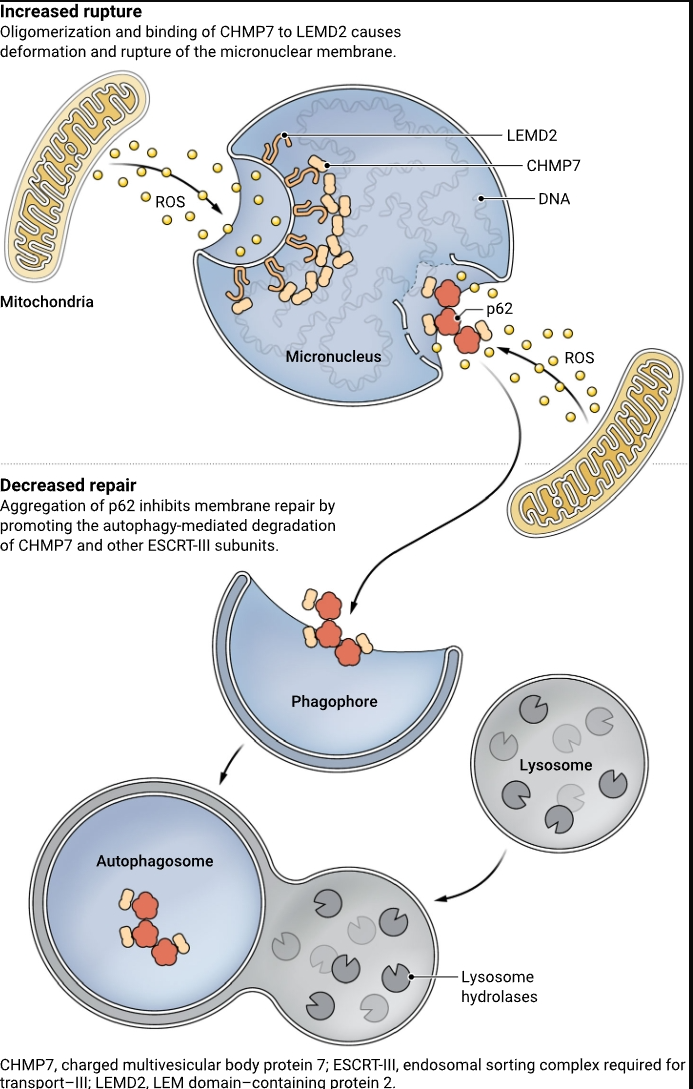
Martin等人和Di Bona等人展示了破坏微核包膜完整性的机制和破坏ESCRT-III核膜修复复合体正常活动的机制共存,并且两者都导致了灾难性的膜崩溃(见图)。而且,两种机制都是由靠近微核的线粒体产生的活性氧物种(ROS)触发的。Di Bona等人使用蛋白质组学分析和遗传操作证明,增加的ROS量抑制了正常的微核输出,导致CHMP7支架蛋白在微核膜内过度积累。此外,ROS诱导的CHMP7氧化触发了其寡聚化和异常结合于核膜蛋白LEMD2,导致微核膜变形和破裂。
马丁等人比较了微核和主核的蛋白质组成,以识别在微核中选择性运作并可能参与微核包膜破裂和修复的蛋白质。他们发现p62/sequestosome 1(SQSTM1)受体蛋白(以下简称p62)在微核中富集,并调节微核的完整性。这种蛋白质是自噬途径的关键组分——一种正常的细胞过程,通过该过程细胞分解和移除旧的、受损的或异常的蛋白质或其他细胞部分。马丁等人发现,附近线粒体释放的活性氧物种(ROS)诱导p62聚集,随后抑制ESCRT-III复合体的修复活性。在典型的自噬途径中,如p62这样的受体基于目标的泛素化(泛素蛋白的翻译后附着)选择性地识别并结合其目标,启动一系列事件,最终导致目标被溶酶体降解。出乎意料的是,马丁等人发现,尽管微核膜上存在大量泛素化的蛋白质,但这些蛋白质被p62识别并不会导致整个微核的降解。相反,p62的聚集促进了CHMP7和其他ESCRT-III组分的自噬介导降解。因此,ESCRT-III修复复合体的耗竭导致膜修复效率低下。
因此,看来两个独立的CHMP7池在决定微核破裂和缺陷修复方面发挥着关键作用,通过增益和损失功能机制:在微核膜内聚集的CHMP7池以ESCRT独立的方式促进膜变形和破裂,而能够在微核胞质侧进行ESCRT-III介导膜修复的功能性CHMP7分子反而被p62介导的自噬所抑制。尽管这两种机制都是由靠近微核的线粒体的存在所引发的,但这些器官之间的确切相互作用性质仍有待确定。
为什么只有一小部分完整的微核受到自噬的影响是一个悬而未决的问题。一种可能性是因为ESCRT复合体对于自噬体生成(形成膜结合囊泡以吞噬由溶酶体靶向降解的细胞物质)是必需的,缺陷的ESCRT-III活性可能限制了受损微核的自噬降解。ESCRT-III还控制着微自噬,即直接将胞质组分在没有自噬体作为中间体的情况下吞噬到溶酶体内的过程。最近的研究表明,内质网和核膜的片段可以通过ESCRT-III介导的微自噬被传递到溶酶体。因此,Di Bona等人和马丁等人报道的ESCRT-III活性的抑制原则上可以影响宏自噬(涉及自噬体的)和微自噬介导的微核移除。
微核崩溃的分子基础
损害微核包膜完整性的分子事件和那些破坏ESCRT-III核膜修复复合体正常活动的分子事件都导致了灾难性的膜崩溃。这些机制是由线粒体衍生的活性氧物种(ROS)触发的,它们刺激微核膜内的CHMP7支架蛋白和膜胞质侧的p62自噬受体的寡聚化。
理解微核破裂和崩溃背后的复杂机制,特别是CHMP7和ESCRT-III复合体的作用,为与微核存在、基因组不稳定性、炎症相关的癌症进展驱动的分子事件提供了重要见解。值得注意的是,这些研究为p62在肿瘤进展中报告的作用增加了重要的洞察。对微核和线粒体之间相互作用的进一步研究可能会揭示关于细胞应激反应和癌症发病机理的额外见解。通过探索这些机制,可以更好地理解导致侵袭性癌症行为的细胞过程,潜在地为治疗和预防开辟新的途径。
https://blog.sciencenet.cn/blog-41174-1448918.html
上一篇:吗啡效应的神经回路
下一篇:能独立科学研究的AI来了!