博文
高压氧对久坐老年人体能和心脏灌注的影响
|
介绍:衰老与身体活动能人力的逐渐下降有关。本研究的目的是评估间歇性高压氧治疗(HBOT)协议对久坐不动的老年人的最大体能表现和心脏灌注的影响。
方法:一项随机对照临床试验将63名成人(> 64岁)随机分配到HBOT组(n = 30)或对照组(n = 33),为期三个月。主要终点包括最大氧气消耗量(VO2Max)和每公斤体重的最大氧气消耗量(VO2Max/Kg),使用E100循环测力计测量。次要终点包括通过磁共振成像评估的心脏灌注和肺功能。HBOT协议包括连续12周每天进行一次,共60次会话,呼吸100%氧气,压力为2个绝对大气压(ATA),每次90分钟,每20分钟休息5分钟。
结果:经过HBOT治疗后,观察到VO2Max/kg有所改善,显著增加了1.91±3.29 ml/kg/min,净效应大小为0.455(p=0.0034)。此外,在第一通气阈值(VO2VT1)测量的氧气消耗量显著增加了160.03±155.35 ml/min(p<0.001),净效应大小为0.617。此外,与对照组相比,心脏血流(MBF)和心脏血容量(MBV)均显著增加。MBF的净效应大小很大,为0.797(p=0.008),而MBV的净效应更大,为0.896(p=0.009)。
结论:研究的结果表明,HBOT有潜力改善老年人的身体表现。所观察到的改善包括关键因素如VO2Max和VO2VT1的提高。这些改善的一个重要机制是HBOT诱导的心脏灌注增强。
本研究来自以色列特拉维夫大学Shai Efrati团队,该小组曾经发现高压氧延长患者血液细胞端粒长度,提高老年性痴呆认知功能。
Hadanny A, Sasson E, Copel L, Daniel-Kotovsky M, Yaakobi E, Lang E, Fishlev G, Polak N, Friedman M, Doenyas K, Finci S, Zemel Y, Bechor Y, Efrati S. Physical enhancement of older adults using hyperbaric oxygen: a randomized controlled trial. BMC Geriatr. 2024 Jul 3;24(1):572.
前言
衰老与身体活动能力的逐渐下降有关,即使是经常锻炼且没有重大疾病或肌肉骨骼问题的健康的个体也是如此。而且,从70岁开始,性能下降的速度加快。这种下降的核心是最大氧气消耗量(VO2Max)的减少,每年损失超过1%。VO2Max的减少是导致脆弱和与年龄相关功能丧失的主要因素,影响85岁以上个体的25-50%。除了是耐力表现的主要限制因素外,VO2Max还是死亡率和心血管发病率的强预测因子。
VO2Max与年龄相关下降归因于由于最大心输出量减少及其分布不均、肺功能下降以及由于线粒体功能障碍导致的肌肉质量和肌肉氧化能力下降而导致的心血管效率下降。一生中参与高强度的身体锻炼可以帮助减缓通常在不活跃的个体中观察到的多系统衰退。然而,即使在运动员中,70岁后也会出现加速的性能下降。
高压氧治疗(HBOT)涉及在高于一个绝对大气压(ATA)的环境压力下施用100%氧气。现在人们意识到,高氧和高压的结合作用可以显著改善组织氧合,同时针对氧敏感和压力敏感基因,从而改善线粒体代谢,具有抗凋亡和抗炎作用。此外,这些基因诱导干细胞增殖并增加内皮祖细胞(EPCs)和血管生成因子的循环水平,这会诱导血管生成并改善缺血区域的血流。
某些高压氧治疗(HBOT)协议,包括在高气压下反复间歇性暴露于高氧环境中,可以诱导与在高氧环境下低氧时观察到的类似生理效应。在我们之前对中年优秀运动员的临床试验中,HBOT增强了体能表现,包括VO2Max。展示的主要机制是线粒体功能和每条肌纤维中的线粒体数量(生物发生)都有所增加。在另一项研究中,我们报告了显著的认知功能增强以及改善的脑血流。HBOT诱导的血管生成和在健康衰老人群中增强的组织灌注不仅仅局限于大脑,这一点通过皮肤活检直接证明了。关于心脏功能,研究发现HBOT能改善衰老无症状个体的超声心动图参数。然而,HBOT对非运动员老年人群中的身体表现和心脏灌注的影响尚未被研究。
本研究的目的是评估间歇性HBOT协议对久坐不动的老年人的最大体能表现和心脏灌注的影响。
方法:
研究设计:
这是一项针对老年人的前瞻性随机对照研究。该研究在2016年至2020年间进行,协议由Shamir医疗中心机构审查委员会批准。该研究已在国家卫生研究院(NIH)临床试验注册处注册,编号NCT02790541(注册日期2016年6月6日)。该研究在Shamir医疗中心进行。所有方法均按照《赫尔辛基宣言》的相关指南和规定执行。
受试者:
招募了70名没有病理性认知下降、年龄在64岁及以上、独立生活、功能和认知状态良好的非运动员成年人。排除标准包括:过去三个月内因任何原因接受过HBOT治疗、过去一年内有恶性肿瘤病史、任何病理性认知下降、严重慢性肾功能衰竭(肾小球滤过率<30)、未控制的糖尿病(糖化血红蛋白A1C>8, 空腹血糖>200)、免疫抑制剂使用、磁共振成像(MRI)禁忌症、主动吸烟和肺部疾病。
所有受试者都被要求继续他们当前的生活方式、饮食和体育锻炼计划(如果有的话),在研究期间不改变锻炼量或训练强度。
随机化和盲法:
签署知情同意书后,受试者被随机分配(1:1)到HBOT组或对照组(无干预)。随机序列由研究协调员(MDK)手动执行,并确保隐藏分配。患者没有被盲分到分配组。评估员对受试者的干预分配情况保持盲态。所有数据存储在专用数据库中,并检查其准确性和完整性。
干预措施:
HBOT协议在Starmed-2700型多位置舱(HAUX, 德国)中进行。该协议包括60次会议,每天进行一次,每周五次,连续12周,在三个月内完成。每次会议包括在2ATA下通过面罩呼吸100%氧气90分钟,每20分钟休息5分钟。加压/减压速率为每分钟1米。
对照组没有接受任何积极干预。在试验期间,两组都不允许改变生活方式、体育锻炼和饮食,也不允许调整药物。
结果:
受试者在基线(干预协议前1-2周)和最后一次HBOT会议或对照期后1-2周进行评估。
心肺最大运动测试(CPET)
使用E100循环测力器(COSMED, 罗马, 意大利)进行运动测试的测量。未在这部机器上完成测试的受试者被排除在分析之外。气体交换通过Quark CPET系统(COSMED)测量,该系统采用逐次呼气采样技术,并集成了心率和运动心电图(ECG)监测与记录,使用12导联ECG系统(COSMED, 罗马, 意大利)。数据通过专用计算机使用Omnia代谢模块软件(COSMED)收集。每次测试前,对气体分析仪和流量计进行校准。
协议的开始包括一分钟不蹬踏的休息时间,然后是两分钟的热身。测试协议包括每分钟功率增加15瓦(每4秒增加1瓦),从0瓦开始,同时保持蹬车节奏为每分钟70转(RPM)。当无法维持70 RPM以上的节奏或参与者终止测试时,即达到疲劳状态。疲劳后,参与者进行三分钟无蹬踏(0瓦)的恢复期。
由一名不知情的生理学家对每项CPET测试分别进行分析,不知道个人姓名、分组、执行日期以及测试是否为基线或干预后测量。逐次呼气数据集按七个呼吸的时间段平均。VO2Max和VO2VT1(第一通气阈值时的氧摄取量)通过验证的标准确定。对于VO2Max,是在踏板节奏保持在70 RPM的同时,工作率增加时VO2出现平台或下降模式,至少持续30秒。对于VO2VT1,结合三种经过验证且一致的方法:(1)换气当量法(换气量(VE)/VO2和VE/VCO2对工作率)(2)端末氧压法(PETO2对工作率)(3)改良的V坡度法(VCO2对VO2)[20]。比较的参数包括最大功率输出、VO2Max、VO2Max/工作率(WR)、VO2Max/心率、VO2VT1、呼吸储备(BR)、呼吸商数(RQ)、心率、VE和呼出的二氧化碳体积(VCO2)。
肺功能
使用KoKo Sx1000肺活量计(Nspire health, 美国)进行肺功能测量。根据制造商的说明,在测量之前使用3升注射器校准设备。测量由训练有素的技术员执行。按照指南推荐执行强制呼气操作[21]。
取至少三次满意的强制呼气操作中获得的最高读数为用力肺活量(FVC)、1秒内强制呼气量(FEV1)、Tiffeneau-Pinelli指数(FEV1/FVC)和峰值呼气流速(PEF)。平均强制中呼气流速(FEF25–75%)和在FVC呼出25%、50%和75%时的强制呼气流速(FEF25%,FEF50%,FEF75%)取自流量-容量环中与最高FVC相差不超过5%的最佳值。
心脏MRI
MRI扫描在MAGNETOM AERA 1.5T扫描仪(Siemens, 埃尔朗根, 德国)上进行。首先进行MRI首次通过灌注成像以量化心肌血流(MBF)和体积(MBV)。在进行0.1mmol Dotarem注射前后执行T1-Trufisp序列。进行了50次重复。扫描与心动周期同步。每次重复的序列参数为:重复时间(TR)178.3毫秒(ms),回波时间(TE)0.95 ms,反转时间(TI)110 ms,翻转角50°,平面内空间分辨率160×125,切片厚度8 mm,间隔8 mm,像素大小2.875×2.875,7切片。MRI分析包括使用SPM软件(版本12,UCL,伦敦,英国)进行刚性运动校正。信号强度-时间数据通过减去基线信号转换为浓度-时间数据。左心室中绘制的兴趣区域(ROI)测量动脉输入功能(AIF)。
MBF和MBV使用MATLAB 2018b (MathWorks, Natick, MA)编写的内部软件通过去卷积计算得出。为了调整扫描之间的变化性,对MBF和MBV图进行了归一化处理。归一化是通过将每个像素的MBF和MBV图除以手动在左心室绘制的兴趣区域(ROI)的平均值来进行的,这样可以测量峰值强度。进行ROI分析以提取心肌中MBF和MBV的归一化值。
脂肪量
使用标准双能X线吸收计量仪(DXA)机器(GE, USA)按照制造商的标准协议[22]评估脂肪量。测量全身脂肪百分比(%)的值。GE的制造商软件自动处理扫描模式选择。
安全性
监测受试者包括气压伤(耳部或鼻窦)和氧中毒(肺部和中枢神经系统)在内的不良事件。
统计分析
连续数据表示为均值±标准差。使用Kolmogorov-Smirnov测试对所有变量的正态分布进行测试。进行非配对和配对t检验以比较两组之间的基线测量变量。使用Cohen's d方法评估净效应大小。Cohen的效应大小分类将其定义为小(d=0.2)、中(d=0.5)和大(d≥0.8)[23]。分类数据以频率和百分比表示,并通过卡方检验进行比较。使用多重插补方法通过五次迭代池化数据来填补CPET缺失数据。
使用卡方/Fisher精确检验进行单变量分析,以识别显著的混杂因素。在基线参数中,年龄是唯一的混杂因素(p-0.08)。为了评估HBOT对身体表现的影响,考虑了正态性、同方差性和线性作为使用t检验和协方差分析(ANCOVA)控制VO2Max基线值并调整可能的混杂变量年龄的基本假设。
Pearson相关系数用于MBF和MBV与CPET参数之间的相关性。相关系数解释如下:可忽略(0-0.1)、弱(0.1–0.39)、中等(0.4–0.69)、强(0.7–0.89)和非常强(0.9-1)[24]。
统计显著性阈值设定为0.05。使用MATLAB 2018b (MathWorks, Natick, MA)进行数据统计分析。
样本量
这项临床研究的样本量是针对已发布的先前研究中认知功能的主要终点计算的[17]。对当前研究主要终点进行了事后功效计算。使用α值为0.05,总样本量为63,效应大小为0.341,采用重复测量内因子交互作用ANOVA设计,发现功效为0.999。
研究结果
在联系参与的100名个体中,有70名符合条件并签署了知情同意书。7人在完成协议前退出(对照组2人,HBOT组5人)。因此,共有63名个体完成了HBOT或对照组干预。由于机器技术问题,8名个体(HBOT组3人和对照组4人)未能完成干预后的E100循环测力计设备上的运动测试,他们的数据被插补。CPET分析是在30名HBOT患者和33名对照患者上进行的。(图1)。其中,18人未完成任一次心脏MRI扫描(HBOT组9人和对照组9人)。对照组共有24名受试者和HBOT组21名受试者被纳入心脏MRI分析。
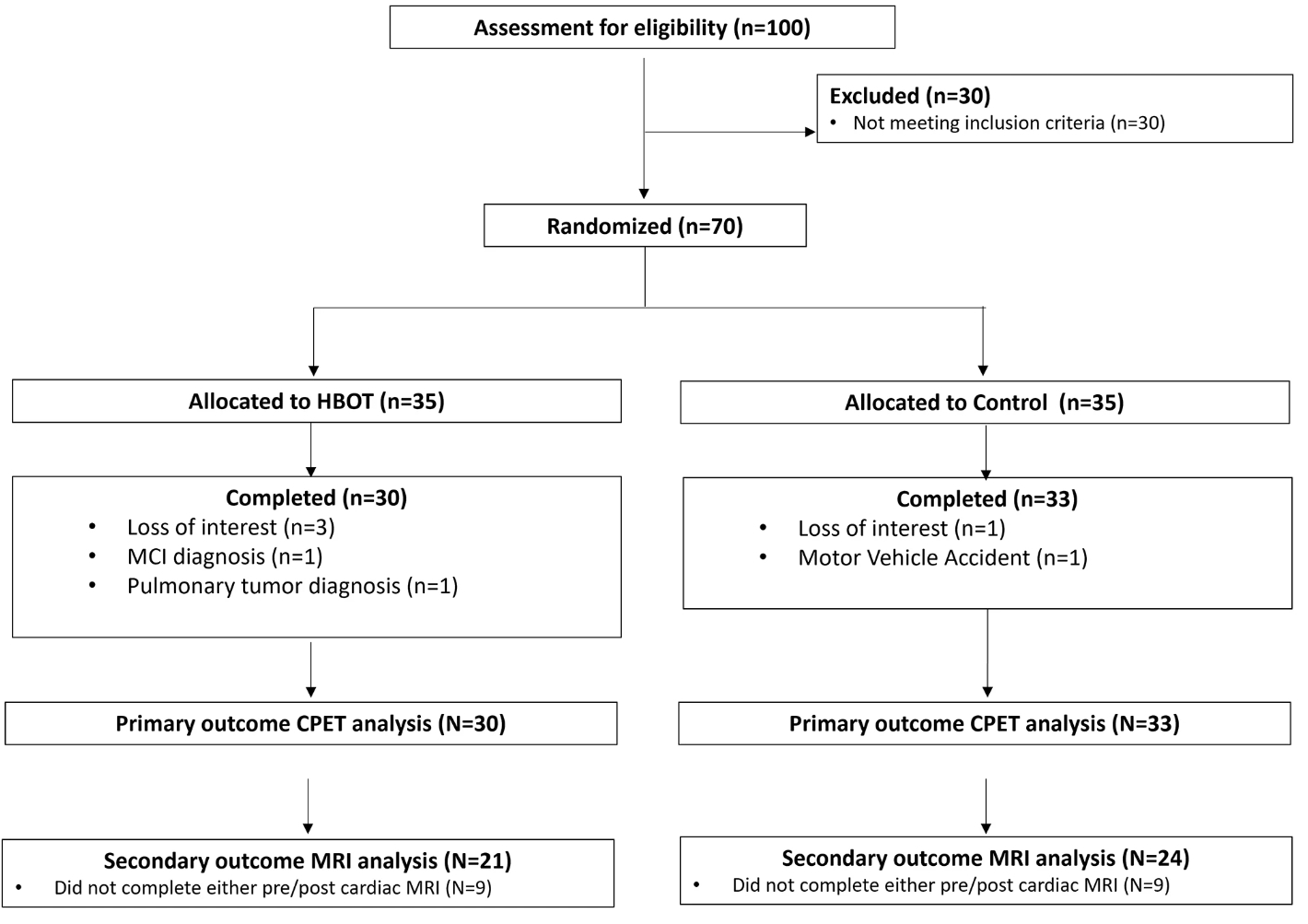
图1参与者流程图
基线特征和队列的可比性在表1中提供。在人体测量学测量、身体组成或基线VO2Max或VO2Max/Kg方面,两组之间没有显著差异(表2)。
表1 参与者特征(见原文)
表2 基线测量(见原文)
体能评估
在基线时,CPET参数在两组之间没有显著差异。经过HBOT后,VO2Max显著增加(从1437.53±57 ml/min增加到1548.93±538.62 ml/min,ANCOVA F=8.508, p=0.005),与对照组相比,净Cohen's d效应大小为0.3410(表2)。VO2Max/kg的结果显示了类似的结果,净Cohen's d效应大小为0.455(ANCOVA,F=9.450,p=0.003)(表3;图2)。在第一通气阈值(VO2VT1)测量的氧气消耗量在HBOT组显著增加(从767.53±217.71 ml/min增加到927.57±308.28 ml/min,ANCOVA,F=11.561,p=0.001),与对照组相比,净Cohen's d效应大小为0.617(表3;图3)。
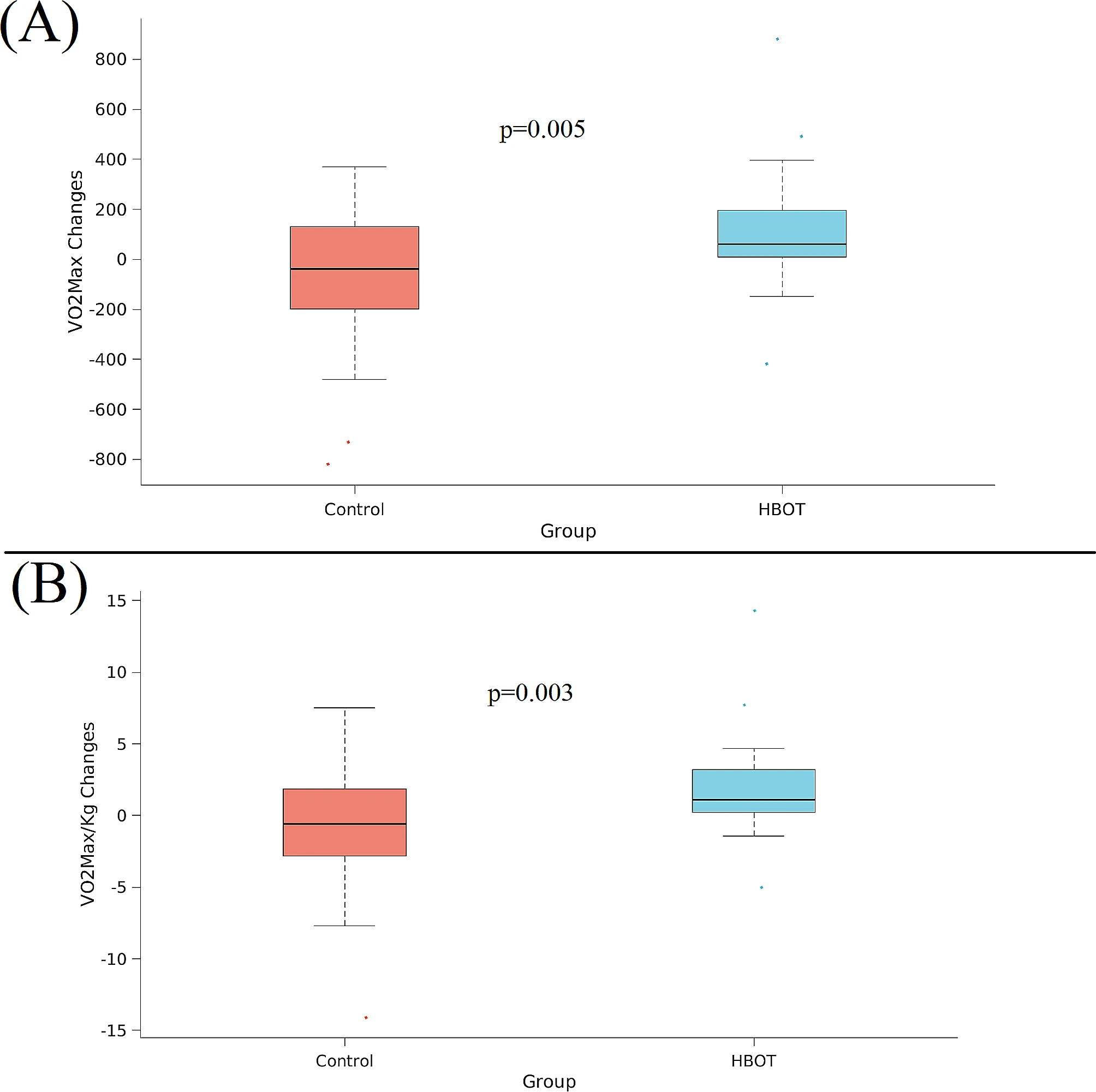
图2 VO2Max和VO2Max/Kg显著变化
CPET参数,(A) VO2Max和(B) VO2Max/Kg,以箱形图展示,其中中间标记表示中位数,箱体的底部和顶部边缘分别表示第25和第75百分位数。
表3 CPET变化
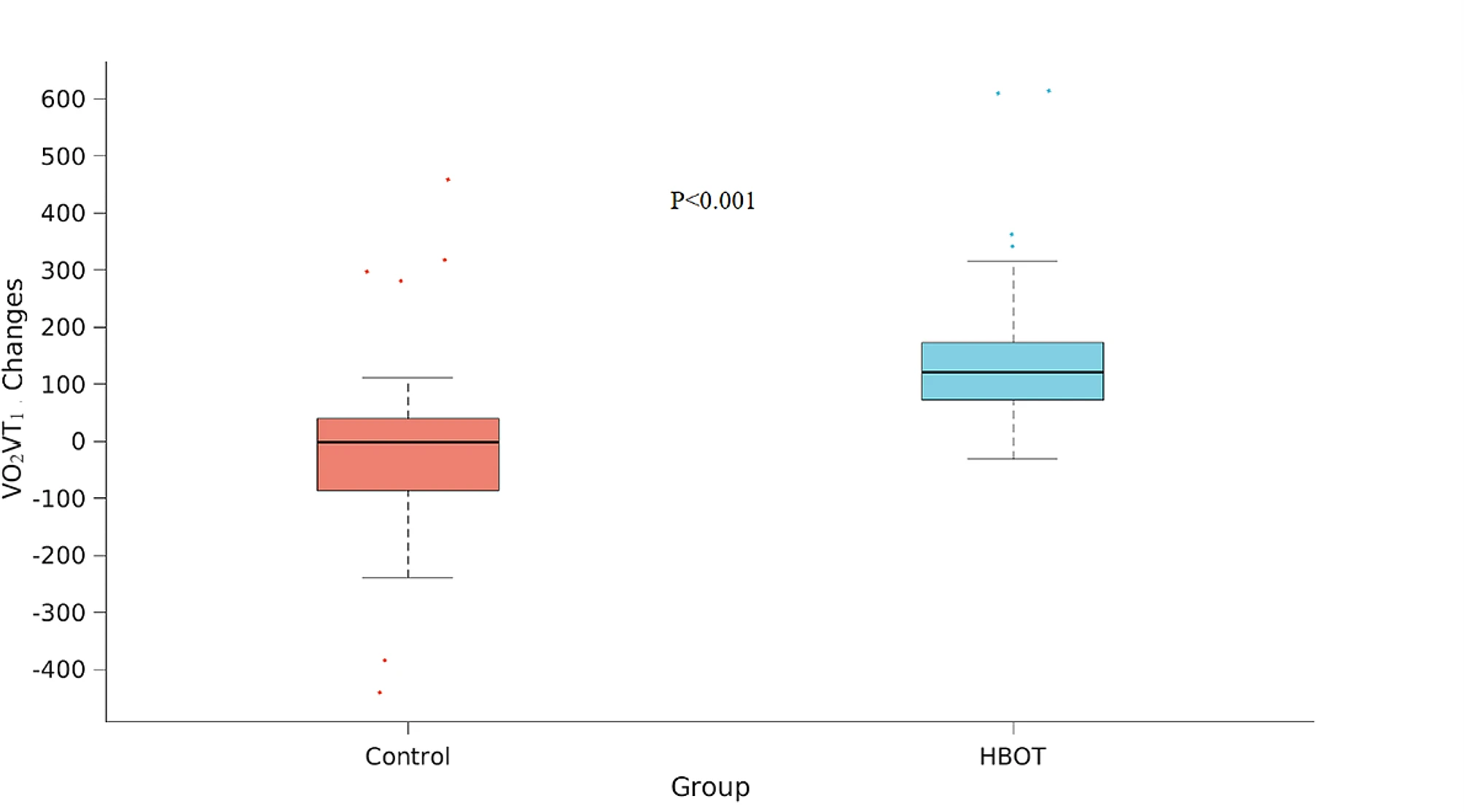
图3 VO2VT1显著变化
CPET参数,以箱形图展示,其中中间标记表示中位数,箱体的底部和顶部边缘分别表示第25和第75百分位数。
在功率、BR、VO2/HR、VO2/WR斜率、VE/VCO2和RQ方面没有显著差异(表3)。
心脏灌注
在基线时,两组之间在全球MBF和MBV方面没有差异(表4)。经过HBOT后,全球MBF显著增加(从0.34±0.10 ml/100 g/min增加到0.42±0.19 ml/100 g/min),与对照组相比,净效应大小为0.797(ANCOVA F=7.686, p=0.008)。同样,HBOT组的全球MBV增加(从0.53±0.14 ml/100 g增加到0.61±0.22 ml/100 g),与对照组相比,净效应大小为0.896(ANCOVA F=7.458, p=0.009)(表4)。
表4 心脏灌注变化
全球MBV变化与VO2Max(r=0.45, p=0.043)和VO2Max/kg变化(r=0.45, p=0.041)之间存在中等程度的相关性。全球MBV与VO2/WR斜率(r=0.73, p<0.001)和VO2/HR(r=0.72, p<0.001)之间存在强相关性。
肺功能
在基线时,两组之间的肺功能测量值没有显著差异。经过HBOT或对照干预后,也没有显著变化(表5)。
表5 肺功能变化
安全性
在HBOT组中,有3名参与者(11.1%)经历了轻度中耳气压伤(TEED 1–2级),而对照组中没有人经历(0%)。所有事件都采取了保守治疗,所有参与者都完成了他们的协议。在HBOT组中有15名参与者(55%)视力发生变化,而对照组中有10名(34.4%)。在HBOT组中有3名参与者(11.1%)加速了白内障程度,而对照组中有7名(24.1%)。
讨论
我们发现HBOT可以显著提高老年人的体能表现。与对照组相比,HBOT后的VO2Max、VO2Max/Kg和VO2VT1均显著增加。此外,通过MBF和MBV测量,HBOT组的一般心脏灌注显著增加。
虽然对于年轻人来说,VO2Max对日常生活的影响通常较小,但老年人在很大程度上依赖他们的VO2Max来有效执行日常任务[25]。因此,VO2Max与年龄相关的非线性下降[7],对维持独立生活方式的能力有明显的影响。第一通气阈值(VO2VT1)被认为是比VO2Max更优的表现指标,因为更高的VT1(第一通气阈值)表明在不经历酸中毒或乳酸积累的情况下保持强度的能力更大[26]。此外,VT1可以在心肺运动测试(CPET)期间客观测量,独立于参与者的动机,这可能会影响VO2峰值。在我们的研究中,我们利用第一通气阈值作为血乳酸水平的可靠估计,消除了在CPET期间进行多次针刺和较长测试协议的需要[20]。值得注意的是,我们的发现表明HBOT显著增强了第一通气阈值以及最大VO2消耗量的氧气消耗。
VO2Max由氧气输送能力和肌肉对氧气的利用能力共同决定。考虑到输送方面,之前的研究显示,老年人的氧气输送能力较低,这限制了肌肉增加氧气消耗的速率。血流受限可能归因于最大心输出量的减少或心输出量分布的改变。
随着年龄的增长,血管变得更厚、更硬,这反过来又增加了血流阻力和心脏后负荷。更重要的是,与年龄相关的内皮损伤导致一氧化氮产生减少,进一步降低了血流。由于心肌细胞与年龄相关的坏死以及后负荷继发性肥大,左心室收缩力和射血分数也随年龄增长而降低。在我们之前对同一老年群体进行的研究中,证明了延长的HBOT方案可以增加左心室和右心室的收缩功能,并改善心肌表现。在当前研究中,我们首次证明HBOT也可以增加心脏灌注,这可能是改善心脏功能的促成因素或结果。
评估心肌灌注的程度是衡量心脏输送氧气能力的关键指标。历史上,正电子发射断层扫描(PET)和单光子发射计算机断层扫描(SPECT)一直是估算心肌灌注的首选方法。然而,心脏MRI作为一种无辐射的非侵入性成像技术,现在越来越多地用于评估和量化心肌灌注。MBF量化反映了在无阻塞性冠状动脉疾病情况下的冠状微循环。MBV是驻留在心肌血管中的血液量,其中90%位于毛细血管中。在当前研究中,HBOT增加了MBF和MBV,这可能表明改善了心脏微循环。HBOT对微血管的有益影响已在非愈合性外周伤口、辐射损伤以及大脑等关键器官的研究中得到了充分研究。具体来说,在我们之前对同一老化人群的研究中,脑血流和脑血容量增加,皮肤活检显示了血管生成。
当前研究中使用的HBOT方案涉及反复间歇性暴露于高氧水平,称为高氧低氧悖论。这些间歇性高氧暴露引发与缺氧期间观察到的生理反应相似的生理反应。HBOT触发并增强低氧诱导因子(HIFs)的释放及其稳定性和活性,这是一组转录因子。因此,HIF-1α和HIF-2α调节血管内皮生长因子(VEGF)的释放,VEGF是一种促血管生成因子。VEGF被广泛认为是血管生成的关键调节因子,促进骨髓中的内皮祖细胞迁移到循环系统中,从现有血管招募内皮细胞,并促进新血管的形成。值得注意的是,这些循环中的促血管生成细胞迁移到缺血区域,在那里它们有助于血管重塑并刺激血管生成和改善微循环。基于这些观察,我们提出,氧气水平的重复波动可能潜在地增强老年人的区域性脑血流和认知功能。
考虑到VO2Max的第二个决定因素,氧气利用,年龄相关的线粒体氧化能力和/或线粒体体积减少已被广泛报道。在我们之前对中年运动员进行的研究中,使用肌肉活检发现,40次间歇性暴露于HBOT既诱导了线粒体的氧化能力,也诱导了线粒体生成,即线粒体含量的增加。尽管这还没有直接评估,但线粒体功能和体积的增加可能解释了当前研究中老年人群中一些表现提升的原因。
特别是高强度间歇训练已被证明能改善老年人的心血管功能,显著增加VO2Max。更重要的是,减少或中断训练会导致VO2Max比单纯老化相关的逐渐下降更快地降低,在老年大师级运动员中更是如此。这会迅速负面影响从之前的长期训练中获得的好处。另一方面,恢复运动训练有可能迅速恢复一些失去的VO2Max和运动表现。这项研究首次在人类中证明了仅通过HBOT就能显著增加老年人的VO2Max。可以预见,结合身体训练和HBOT将产生协同效应,但这还有待研究。
本研究有几个局限性应该被承认。首先,样本量相对较小,这可能降低了研究的敏感性。然而,通过严格的统计分析在这个小组中观察到显著变化,表明干预的影响相对强烈。其次,对照组是一个非干预组,而不是一个假干预组。虽然结果评估者是客观且盲法的,但参与者自己知道他们的分组情况。第三,观察到的效应的长期持续时间尚未确定,需要通过后续研究进一步调查。第四,没有通过肌肉活检直接评估线粒体功能。第五,每次会议的最佳次数和具体协议尚未建立。尽管有这些限制,研究的几项优势应该被强调。通过监控两组任何可能的生活方式变化(如饮食和运动)、药物使用或其他可能作为混杂因素的干预措施,测量了HBOT的独立效应。此外,进行了各种评估,包括肺功能测试、身体成分分析和血液测试,以控制可能的混杂因素。最后,CPET和心脏MRI在最后一次HBOT会议后一周多进行,进一步支持了重复HBOT引起显著生物学变化而非因增加氧气输送而暂时改变的结论。
结论
研究发现表明,新使用的HBOT可以增强老年人的体能表现。观察到的关键提升包括最大氧气消耗量的改善,以及第一通气阈值的提升。此外,使用心脏MRI显示心脏灌注增加是HBOT诱导观察到改善的一个重要机制。
https://blog.sciencenet.cn/blog-41174-1448259.html
上一篇:线粒体内膜损伤后翻转外出的路径
下一篇:高压氧治疗一种罕见慢性疼痛综合症效果显著