博文
高压氧治疗一种罕见慢性疼痛综合症效果显著
||
摘要
纤维肌痛综合症(FMS)是一种慢性疼痛综合症,其特征是中枢神经系统内疼痛处理的紊乱。在有创伤经历的患者中,尤其是童年性虐待(CSA)患者中,该病的发病率很高。本研究比较了高压氧治疗(HBOT)与当前药物治疗标准对遭受CSA相关FMS患者的疗效。48名被诊断为FMS且有CSA历史的参与者被随机分配到HBOT组(60次100%氧气,2 ATA下90分钟,每5分钟休息一次空气)或药物(MED)组(FDA批准的药物,普瑞巴林和度洛西汀)。主要终点是纤维肌痛影响问卷(FIQ)得分,次要终点包括情绪状态和日常功能问卷以及疼痛阈值和条件性疼痛调节测试。通过单光子发射计算机断层扫描(SPECT)评估大脑活动。结果显示,FIQ得分的组别-时间交互作用显著偏向于HBOT而非MED(p<0.001),具有大效应量(Cohen's d=-1.27)。在情绪症状和功能测量中观察到类似的发现。SPECT成像显示前额叶和颞叶脑区活动增加,这与症状改善相关联。总之,对于有CSA史的FMS患者而言,HBOT在身体、功能和情绪改善方面显示出优于药物的益处。这与前额叶和颞叶脑区活动增加有关,突出了HBOT的神经可塑性效应。

引言
纤维肌痛综合症(FMS)是一种使人衰弱的状况,其特征是慢性广泛性疼痛,伴有疲劳、睡眠中断和认知功能障碍等症状。近年来,在理解FMS的发病机制方面取得了重大进展,越来越多的共识认为它代表了中枢致敏的一个原型——一种以中枢神经系统(CNS)内疼痛传递和处理紊乱为特征的状况。尽管FMS的病因尚未完全了解,但人们越来越认识到,遗传倾向和暴露于各种触发因素之间的复杂相互作用是许多病例的基础。在这些触发因素中,包括儿童性、情感或身体虐待在内的创伤经历,被建议作为大量FMS患者的易感因素。
童年创伤,如儿童性虐待(CSA),可以对个体的神经生物学产生深远和持久的影响。在关键和敏感的发展时期长期暴露于创伤会导致大脑结构和功能的持久改变,以及对压力和疼痛刺激的大脑反应的中断。这些持续的神经生物学变化可能在成年期表现为身体疼痛、情绪和功能功能障碍以及其他健康风险,即使在创伤经历多年后也是如此。
当前针对FMS的治疗策略依赖于多学科干预,药物治疗的作用有限。FMS治疗指南推荐使用调节血清素和去甲肾上腺素再摄取抑制剂(SNRI)抗抑郁药或调节大脑和CNS中γ-氨基丁酸(GABA)神经递质的药物,结合定期体育锻炼。然而,尽管这些方法得到了最佳实施,成功率仍然有限,FMS继续构成一个未满足的临床挑战。
在近年来,关于新型高压氧疗法(HBOT)协议引发神经可塑性效应的证据日益增多。HBOT涉及到应用升高的大气压和增加的氧气水平,增强氧气向灌注不良的组织扩散。新HBOT协议利用高氧-缺氧悖论(HHP),是今天临床使用中首批旨在促进受损脑组织再生的治疗干预措施之一。HHP代表了一种新的范式,旨在加强内源性修复机制同时提供最佳微环境。这些效应包括刺激干细胞、迁移和分化、线粒体增殖/生物发生、线粒体转移和血管生成。
HBOT的有益效果已在各种人群中得到证实,包括卒中后、脑震荡后和COVID后患者,即使在急性损伤多年后仍有持续的脑功能障碍。HBOT协议也显示出在诱导神经可塑性和改善退伍军人治疗抵抗性军事相关创伤后应激障碍(PTSD)的临床症状方面的前景。此外,HBOT已成为一个有希望的方式,用于治疗因严重情绪压力而发展成FMS的患者亚组,包括童年虐待。然而,对于患有与CSA相关的FMS患者而言,HBOT的效果是否超过当前推荐的药物治疗尚未探索。
在当前研究中,我们旨在评估HBOT对由过去CSA创伤经历触发的FMS患者的治疗效果,并将其与标准批准的药物治疗进行比较。我们的目标是评估HBOT与药物治疗在这一特定FMS患者亚组中的临床效用,同时通过代谢性大脑成像调查干预的神经可塑性效应。
结果
参与者特征和随机分组
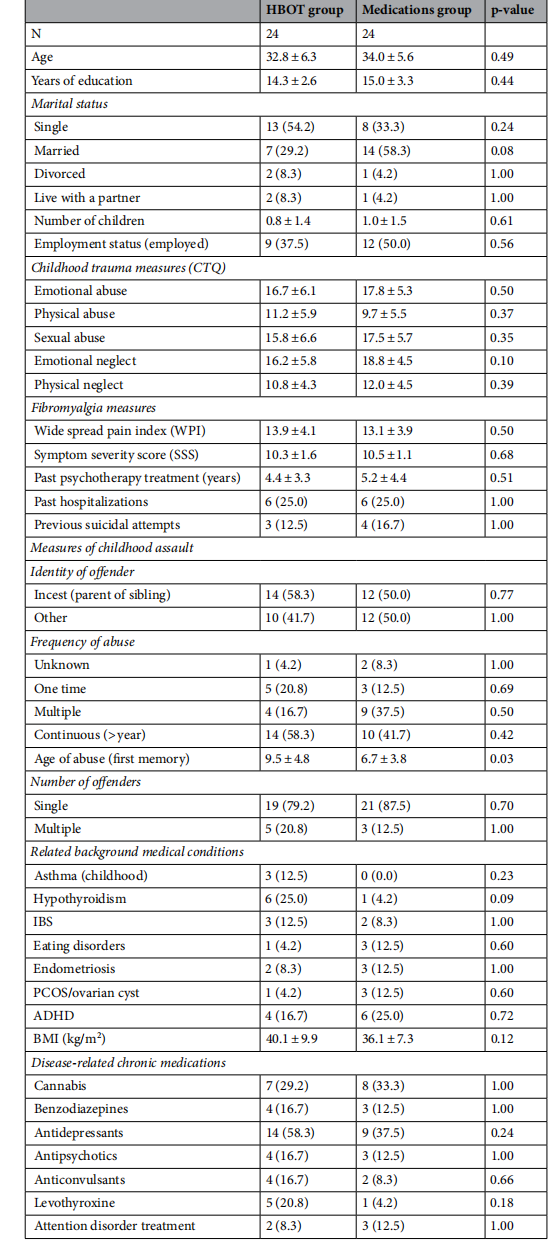
本研究中有60名参与者签署了知情同意书。在随机分组前,8人被排除或拒绝参与。因此,52名参与者被随机分配到两个活跃组,27人进入HBOT组,25人进入药物(MED)组。在HBOT组中,一名参与者因无法比较压力而未能完成治疗协议,两名参与者在几次治疗会议后因怀孕而被排除。在Med组中,一名参与者在分配后撤回了她的同意。最终,48名参与者的数据(每个活跃组24人)被纳入最终分析。所有参与者的流程图以及包含在主要和次要终点的情况呈现在图1中。参与者的人口统计和基线特征详见表1,两组之间没有显著差异,除了虐待年龄(首次记忆)的标准。
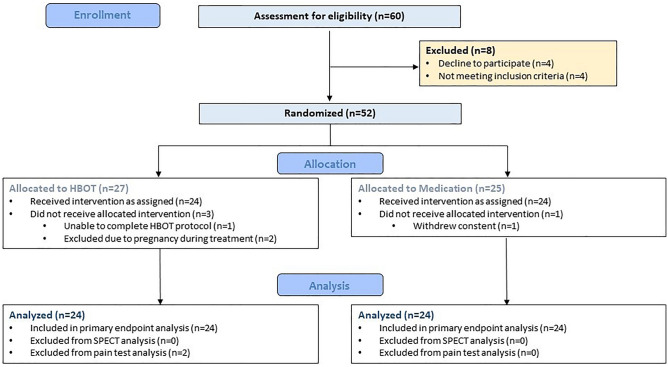
图1 研究设计流程。高压氧
表1 受试者基本资料
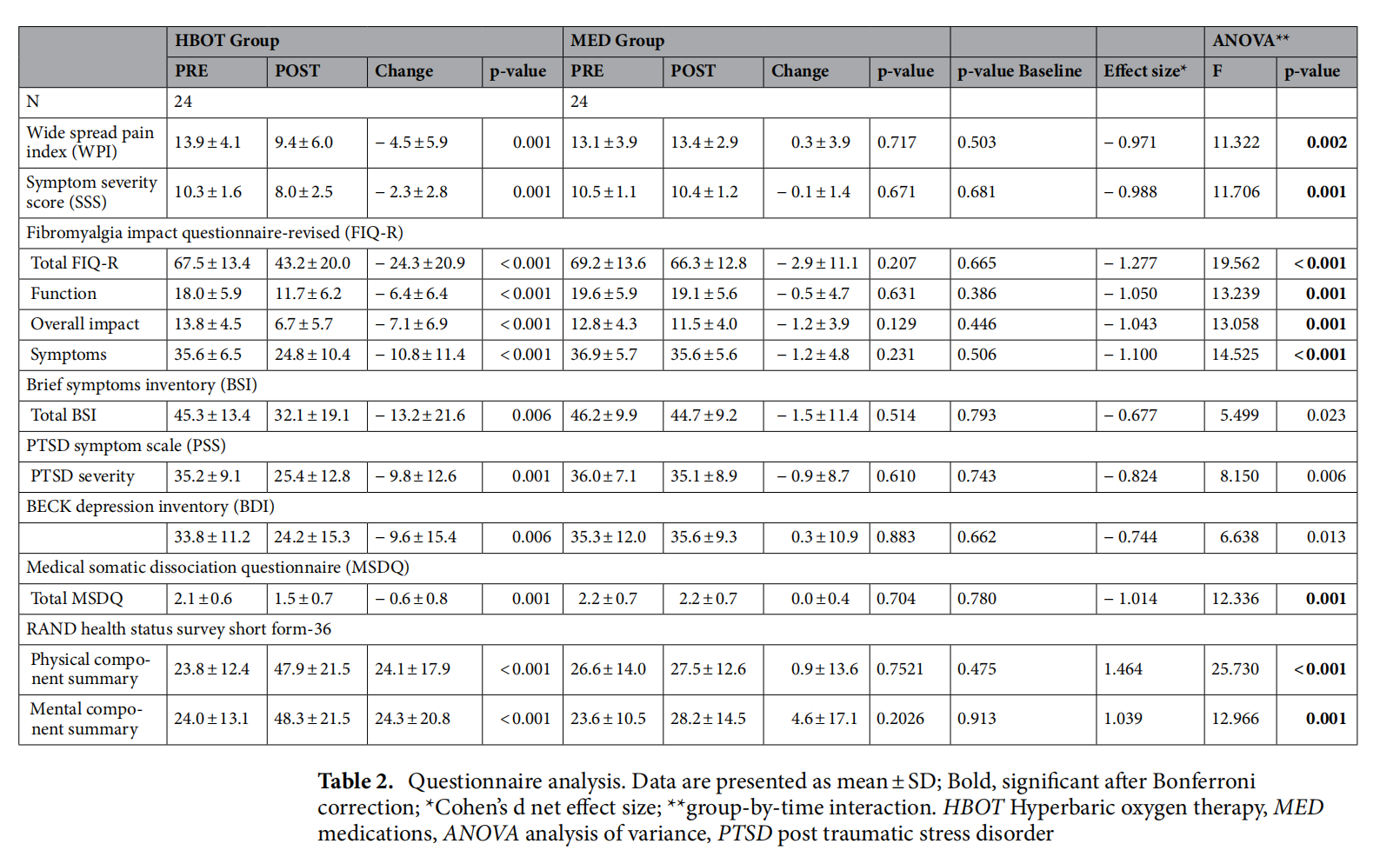
主要结果 在纤维肌痛影响问卷(FIQ)总分中发现了显著的组-时间交互作用,效应量较大(d =−1.27,p < 0.001;图2)。在该测量的所有分量表中也发现了显著的交互作用(表22)。

图2 HBOT和药物组纤维肌痛影响问卷(FIQ)评分变化。显著的组-时间交互效应,效应量较大(p < 0.001,Cohen‘s d =−1.27)。箱形图中显示的数据,中心标记表示中位数,方框的底部和顶部边缘分别表示第25和第75百分位数。
表 2问卷分析
次要结果
问卷分析的主要结果汇总见表表22和图3(补充表S1中所有问卷子测量指标的扩展结果)。在基线时,在不同领域的组间无显著性差异。在基线时,所有参与者均表现出FMS诊断标准(根据广泛的疼痛指数-wpi和症状严重程度评分-sss测量35计算)。在治疗后,HBOT组中的7名参与者(29%)不再符合FMS标准,而MED组中没有人符合。
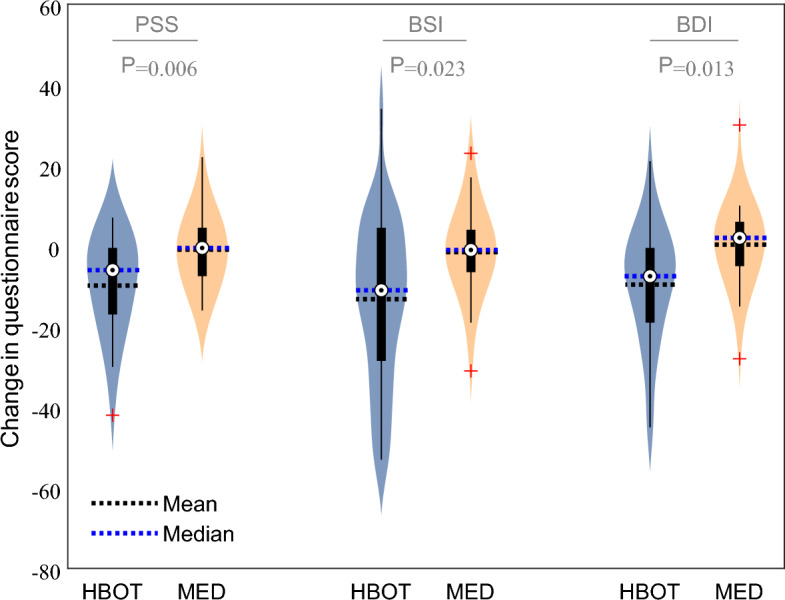
图3在HBOT组和Med组的调查问卷得分的变化。p值表示每个问卷的分组-时间互动的重要性。数据以小提琴图和箱形图表示,方框的底部和顶部边缘分别表示第25和第75百分位数。红色符号表示异常值。PSS创伤后应激障碍症状量表,BSI简要症状清单,BDI Beck抑郁清单,HBOT高压氧治疗,MED药物。
与MED干预相比,HBOT后情绪症状有显著改善:根据大效应量的PTSD症状量表(PSS)评分,d=−0.82,p < 0.01);大效应量的医学躯体分离问卷(MSDQ)总分(d =−1.01,p < 0.005);中等效应量的简要症状清单(BSI)总分(d =−0.67,p < 0.05),贝克抑郁清单(BDI)总分(d =−0.74,p < 0.05)。这些测量方法的所有子量表的交互作用也被发现是显著的(补充表S1)。 RAND健康状况调查简表36(SF36)问卷显示,身体成分得分(p < 0.001)和心理成分得分(p < 0.005)均有显著改善,Cohen’sd效应量较大(d =分别为1.46,1.03)。SF36的所有分量表交互作用也具有显著性(补充表S1)。
疼痛测试
由于技术原因,HBOT组的两名参与者被排除在疼痛测试分析之外。在HBOT组中,PPT增加了70.8±90.6 kPa,相比之下MED组增加了20.1±85.7 kPa,组别-时间交互作用表现出边缘显著性,具有中等效应量(d=0.57, p=0.05)。在浸水条件下,HBOT条件的PPT表现出类似的增加率,为73.6±121.4 kPa,而MED干预的增加率较小,为4.4±121.2 kPa,组别-时间交互作用的边缘显著性和中等效应量(d=0.57, p=0.06)。条件性疼痛调节(CPM)得分的组别-时间交互作用不显著(p=0.56)。两组疼痛测试的详细数据呈现在补充表S2中。
大脑活动成像
SPECT分析的结果呈现在表3和图4中。对于HBOT组,发现四个Brodmann区域(BA)的活动显著增加,且组别-时间交互作用显著:左侧BA6(p=0.01),左侧BA36(p=0.001),右侧BA40(p=0.02),左侧BA46(p=0.01)。在MED组中发现两个BA的活动显著减少,且组别-时间交互作用显著:右侧BA17(p=0.01)和左侧BA32(p=0.01)。其他具有组别-时间效应的BA有右侧BA9(p=0.03)和左侧BA28(p=0.04)。然而,经过FDR校正后,这些都不显著。所有BA的分析呈现在补充表S3中。HBOT组和MED组的大脑区域SPECT激活变化与问卷和疼痛测试数据变化的相关性热图呈现在图5中。
表3 SPECT数据
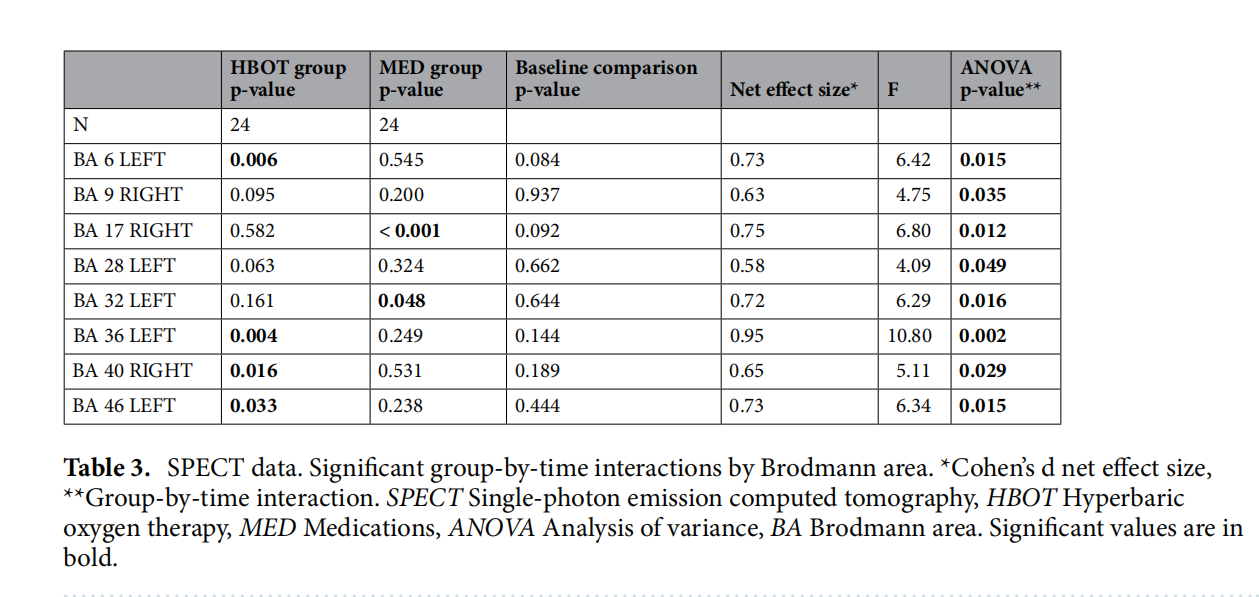
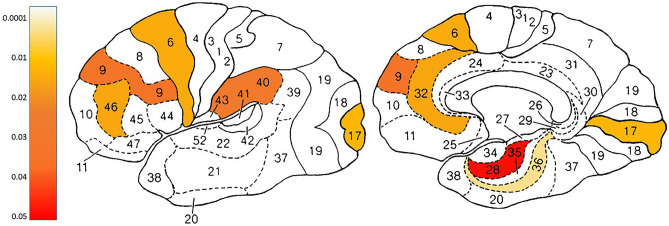
图4单光子发射计算机断层扫描(SPECT)分析。与药物组相比,高压氧治疗(HBOT)组治疗后布罗德曼区域的激活增加。p值代表SPECT数据的组别-时间交互作用。
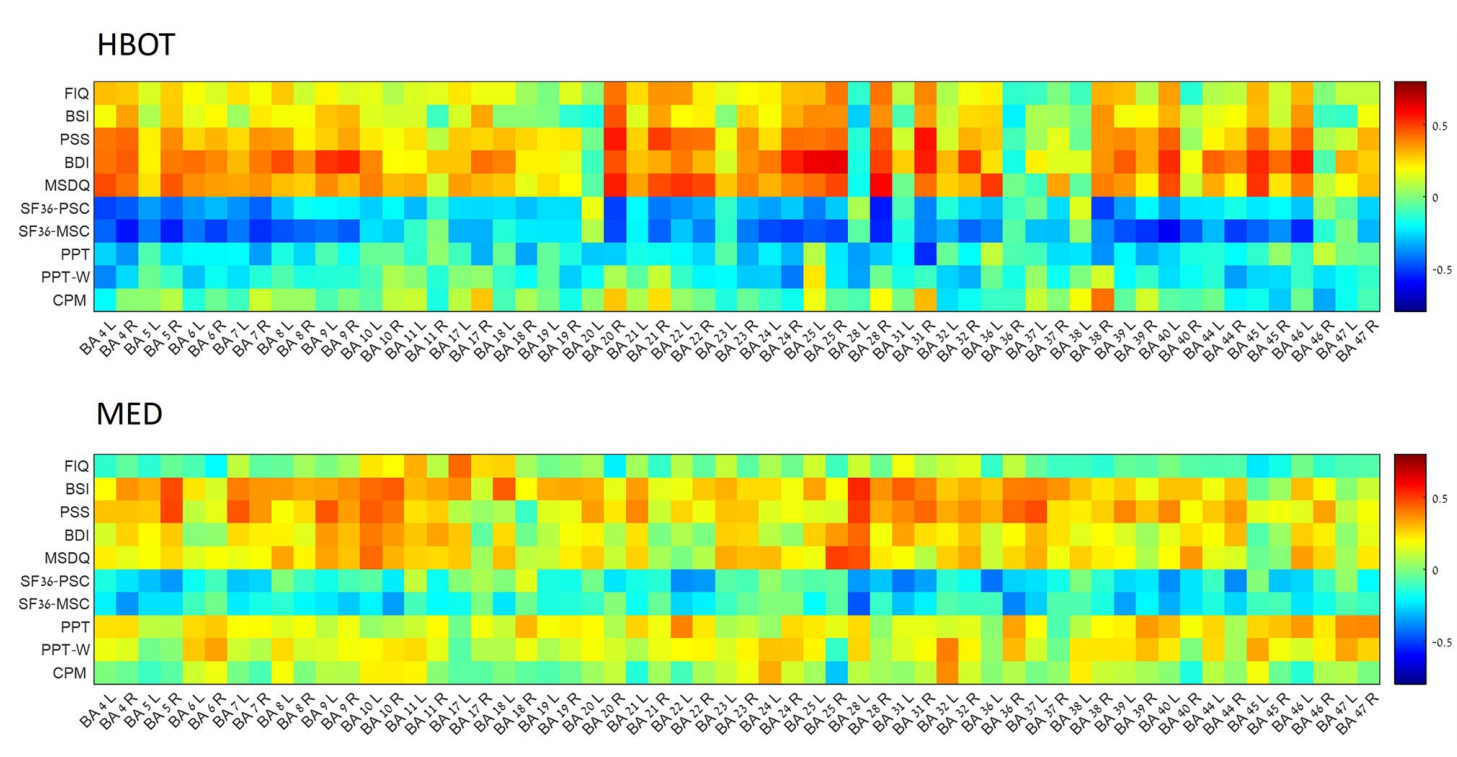
图5相关性热图。代表治疗后布罗德曼区域(BA)激活、疼痛测试和问卷得分在高压氧治疗(HBOT)和药物(MED)组中的变化的皮尔逊相关系数热图。FIQ纤维肌痛影响问卷,BSI简明症状量表,PSS创伤后应激障碍症状量表,BDI贝克抑郁量表,MSDQ医学身体分离问卷,SF36-PSC兰德健康状态调查简表-36——身体成分总结,SF36-MSC兰德健康状态调查简表-36——心理成分总结,PPT压力疼痛阈值,PPT-W水中压力疼痛阈值,CPM条件性疼痛调节。
治疗副作用和耐受性
在MED组中,根据临床判断,90%的参与者使用普瑞巴林治疗,10%使用度洛西汀。MED组最常见的副作用是增加的疲劳(37%)、增加的疼痛(29%)、增加的情绪困扰(25%)和消化/胃痛(20%)。其他副作用包括虚弱和晕厥、体重增加、头痛、四肢麻木和睡眠障碍。一些参与者经历了情绪改善(8%)。由于副作用,14名参与者(58%)无法耐受治疗,并决定在12周期间结束前停止服药(MED组平均用药时间:5.8±4.6周)。
在HBOT组中,最常见的副作用是轻度中耳炎气压伤(29%),经过几天的治疗休息后自行解决。其他副作用包括部分治疗过程中的情绪困扰(12.5%)和童年难以触及记忆的浮现(8%)。一名参与者在治疗期间经历了暂时的视力模糊。一名参与者因极度情绪困扰提前终止了治疗(治疗53/60),并且应她的要求停止了治疗。另一名参与者在六次治疗后请求停止治疗,因为压力升高时未解决的窦状疼痛。因此,92%的人按计划完成了60次HBOT治疗。
讨论
在这项前瞻性、随机化、双活跃臂试验中,我们旨在研究HBOT与当前标准药物治疗在有CSA历史的FMS年轻女性群体中的效果比较。我们的研究显示,HBOT在身体和情绪症状以及日常功能方面诱导了显著的改善,超越了药物治疗的效果。此外,这些临床益处与通过大脑SPECT评估观察到的神经可塑性效应一致。
越来越多的证据表明,由创伤事件引起的病理生理变化可能导致大脑结构和功能的持久改变。这些改变包括前额叶皮层(PFC)、前扣带皮层和边缘系统的异常,以及杏仁核、海马和额叶之间功能性和结构性连接的受损。CSA,以成熟期间的创伤暴露为特征,可以对大脑的发展、连接和功能产生负面影响,使其成为长期精神病理的风险因素。值得注意的是,据报道20-50%的FMS患者有性虐待史,相对风险比对照组高出2.5-3.1倍。
在我们的研究中,使用SPECT成像评估了大脑灌注活动。为了减轻氧气暴露对大脑潜在间歇效应的影响,最后一次HBOT会话后一周以上进行SPECT扫描。与药物治疗相比,HBOT后观察到的大脑灌注的主要变化主要出现在前额和颞区(图4)以及与HBOT组症状改善显著相关的脑区群集(图5)。这些发现与之前评估HBOT对其他FMS人群影响的研究一致,当与对照组比较时,观察到PFC和颞脑区代谢的类似改善。PFC和颞叶及其相互连接在情绪调节过程中起着核心作用。PFC通过其对颞边缘区域的影响来调节情绪体验和行为,包括杏仁核和岛叶,这最终影响幸福感。此外,PFC包含疼痛感知系统的组成部分,特别是与情绪调节、认知和与疼痛感知相关的注意力有关。因此,可以设想,这些大脑区域的代谢变化有助于HBOT后观察到的情绪和身体症状的显著改善。
除了疼痛相关症状的改善外,HBOT后观察到的情绪状态增强——表现为创伤后应激障碍(PTSD)症状和抑郁率及强度降低——可能进一步促进日常功能。这些结果与之前对遭受战斗相关PTSD的退伍军人以及与CSA相关的FMS研究结果一致。在对这些患有战斗相关PTSD的退伍军人进行的纵向评估中,证明了HBOT的有益效果即使在治疗两年后仍持续存在。目前正在进行一项纵向研究,以确定在当前CSA幸存者群体中观察到的神经可塑性和生活质量改善是否会持久。
疼痛是FMS中的一个关键元素,通过症状问卷和实验室对PPT和CPM的评估进行评估。与常规药物相比,HBOT在与压力和温度相关的疼痛测量(PPT和PPT-W)上显示出边缘显著性改善。尽管如此,与MED相比,参与者在主观疼痛感知方面注意到了临床可辨识的改善,同时还报告了功能能力的提升。这些观察结果表明,HBOT的影响可能主要在于改变疼痛感知及其对日常功能的影响,而不是影响疼痛的具体物理维度。这一假设在神经成像数据中找到了潜在支持,该数据显示PFC区域的大脑代谢改变涉及疼痛感知和情绪调节神经通路,如上所述。
此外,HBOT与MED在CPM测试中没有产生显著不同的效果。这些结果与Ablin等人的一项类似研究的发现不同,后者在HBOT和MED之间的比较中展示了有利于HBOT组的显著组别-时间交互作用。然而,Ablin的研究队列包括继发于TBI的FMS个体。研究之间不同的发现表明,FMS病因下可能存在不同的神经和生理机制。需要进一步的研究来全面探索FMS病因、临床表现和治疗益处之间的区别。
如结果中详述,HBOT在我们的研究中通常被良好耐受且安全。HBOT组观察到的最常见副作用是轻度中耳气压伤,发生在29%的参与者中。值得注意的是,这些病例通常在停止治疗几天后自行解决。所有使用HBOT治疗患者的医疗团队都应认识到文献中先前报道的一种现象。这种现象涉及童年时期难以获取的记忆浮出水面,我们研究中有8%的患者报告了这一点。当这些记忆重新浮现时,偶尔会伴随情绪困扰。然而,必须注意的是,这种情绪困扰通常在HBOT过程中得到缓解,并提供了适当的支持来解决任何心理问题。相比之下,药物治疗组表现出了不同的副作用特征。该组报告的最常见副作用包括增加的疲劳(37%)、增加的疼痛(29%)、情绪困扰(25%)和消化/胃痛(20%)。
这项研究有几个限制。首先,缺乏对HBOT效果的长期评估,目前正在通过对完成治疗的参与者进行为期1年的纵向评估来解决这一问题。其次,研究没有采用HBOT的剂量-反应协议。所使用的HBOT协议,包括每周5天,每天60次会话,每次90分钟,100%氧气,2 ATA,每20分钟休息一次,是基于过去的临床经验和关于HBOT在CSA、PTSD和其他脑部损伤中效果的研究确定的。未来的研究可以探索和比较不同的协议,并持续监测生物标志物,以确定对每个个体最有效的治疗方案,考虑到FMS患者群体内的异质性。此外,研究更大的样本量对于确定哪些患者最有可能从这种治疗中受益至关重要。
我们研究的局限性之一与药物管理的普及性有关。针对每位参与者的药物选择的临床决策过程包括了每位参与者展示的疼痛特征,以及情绪和治疗药理方案,这些方案超出了FMS的范围(如表1所示)。鉴于各种精神药物的普遍性,其中一些可能成为Duloxetine的禁忌症,而且主要目标是为FMS量身定制治疗,而不是参与者可能面临的其他共病,并接受药物治疗,因此,在当前研究队列中,大多数情况下医生在与患者讨论不同选项时的偏好是使用Pregabalin。
总之,HBOT显示出改善与CSA相关的FMS个体的情绪和身体症状以及日常功能的潜力。疼痛的缓解可能源于疼痛感知和情绪调节神经通路的改变,而不仅仅是物理疼痛感觉的变化。HBOT带来的改善幅度显著超过了通过当前推荐药物实现的改善。这些临床改善与HBOT诱导的大脑灌注和代谢增强密切相关。这项研究强调了HBOT作为FMS患者有效治疗干预措施的潜力。
方法
参与者
该研究包括有CSA史且被诊断为FMS的年轻成年女性(年龄18-45岁)。FMS的诊断由认证的风湿病学家根据2016年更新的诊断标准进行验证。排除标准包括:有创伤性脑损伤(TBI)史,过去一年内接受过Duloxetine(Cymbalta)或Pregabalin(Lyrica)治疗,或对该药物治疗有任何禁忌症;患有重大精神疾病如精神分裂症、双相情感障碍,或在过去一年内有自杀尝试/行为。其他排除标准包括:因任何其他原因接受HBOT;胸部病变(包括活动性哮喘);内耳疾病;幽闭恐惧症;无法进行清醒状态下的大脑MRI测试;慢性肾功能衰竭(eGFR<60 ml/min);以前的神经系统状况(例如癫痫、神经肌肉疾病、代谢性疾病、脑瘤等);无法签署知情同意书。在HBOT期间不允许吸烟。参与者必须在社区每周至少参加一次心理治疗。
试验设计
这是一项前瞻性、随机化的双活跃臂试验,于2020年至2023年间在Shamir医疗中心的Sagol高压氧医学和研究中心进行。在签署知情同意书后,参与者进行了基线评估,包括大脑成像、问卷、疼痛测试以及血液检查和认知测试。然后,参与者以1:1的比例随机分配到HBOT或MED干预组,由一位盲法研究者监督使用计算机化随机表。干预后的评估在HBOT会话结束后或MED协议中的3个月后进行。对所有完成评估的纳入参与者进行了意向治疗分析。
该研究获得了Shamir医疗中心机构审查委员会(IRB)的批准(编号0008-20-ASF),所有参与者在纳入前均签署了知情同意书。所有方法均按照相关指南和规定执行。该研究已在Clinicaltrials.gov注册,编号NCT04316702,注册日期为2020年3月20日。
程序
HBOT协议在多位置舱中进行,总共60次每日HBOT会话,每周五天。每次会话包括在2 ATA下通过面罩吸入100%氧气90分钟,每20分钟休息5分钟。
在MED协议中,基于临床判断,参与者被分配接受FDA批准并目前在以色列用于治疗FMS的两种药物之一的治疗,即Duloxetine或Pregabalin。Pregabalin治疗开始时剂量为每晚75 mg,而Duloxetine治疗开始时剂量为每天早晨30 mg。每两周对参与者进行评估,并根据需要和耐受情况调整剂量。根据以色列治疗指南,向所有参与者解释并推荐在FMS治疗中进行体育锻炼的重要性。
研究团队阐明了两种干预措施的优势,并努力保持两个队列的跟踪和监测平等。两组的参与者都被要求在治疗期间至少每周参加一次心理治疗课程,由他们社区中受过良好训练的心理健康专业人士进行。此外,两组的参与者都被要求每天写日记,表达他们在治疗中出现的想法和情绪,这些信息是与指定的陪同研究团队成员(心理健康专业人士)进行书面问答(通信)的基础,以便在治疗过程中提供进一步的支持。
主要终点
主要终点是纤维肌痛综合征影响问卷(FIQ,希伯来语版)的评分,这是一种评估和评价工具,旨在衡量FMS患者的状况、进展和结果。它被设计用来衡量健康状态中被认为最受FMS影响的组成部分。分数范围从0到100,更高的分数表明该综合征对个人的影响更大。希伯来语版的测试-重测可靠性很高(物理功能的r=0.96,FIQ其他项目的r=0.80-0.96)。
次要终点
问卷
自我报告问卷评估身体、情绪状态和生活质量:用于FMS诊断的广泛疼痛指数(WPI)和症状严重程度评分(SSS);简明症状清单-18(BSI-18);贝克抑郁量表(BDI-II);创伤后应激障碍症状量表访谈(PSS-I);医学躯体分离问卷(MSDQ);兰德健康状态调查,简短形式-36(SF-36)问卷;儿童期创伤问卷(CTQ),一种用于评估虐待和忽视历史的筛查工具,在基线评估时使用以评估儿童期创伤。每个问卷及其测量的进一步解释以及可靠性数据详见补充材料S4。
疼痛测试
疼痛特征评估包括通过手持式压力计对上斜方肌施加压力的压力疼痛阈值(PPT),使用圆形1 cm^2探头(AlgoMed, Medoc LTD, 以色列)。在上斜方肌处测量PPT三次。基线压力为0 kPa,每秒增加30 kPa,直到最大压力1000 kPa。参与者被指示在感觉从压力变为疼痛时报告,此时移除探头。进一步分析中使用第二次和第三次测量的平均值。
为了评估条件性疼痛调节(CPM),在非主导手浸入10°C冷水中(PPT-W)时重复PPT测试。通过计算冷水浸泡相反手之前和期间由压力刺激引起的平均疼痛强度的差异来评估CPM。因此,有效的疼痛抑制机制由较高的(正值)表示。
大脑灌注SPECT成像
使用925-1110 MBq(25-30 mCi)的锝-99m-乙基半胱氨酸二聚体(Tc-99m-ECD)进行大脑单光子发射计算机断层扫描(SPECT),注射后40-60分钟使用双探测器伽马相机(ECAM或Symbia T, Siemens Medical Systems)进行,配备高分辨率准直器。数据以3度步长采集,并通过Chang方法(μ=0.12/cm)衰减校正迭代重建。治疗前后的SPECT归一化为最大全脑活动。使用NeuroGam(Segami Corporation, Culombia, MS, USA)将SPECT图像重新定向到Talairach空间,用于识别Brodmann皮层区域,并计算每个BA的平均灌注。
本研究还包括的其他干预后终点有磁共振成像(MRI)和功能性磁共振成像(fMRI)、血液检查、自我形象和攻击绘图以及认知评估。结果将在未来的出版物中进行分析和包含。
统计分析
连续数据表示为均值±标准差(SD)。当根据Kolmogorov-Smirnov检验满足正态性假设时,执行两尾独立t检验以比较组间的变量。使用Cohen's d方法评估净效应大小,定义为从基线开始经过MED干预后的改善减去经过HBOT后的改善,除以综合得分的合并标准差。分类数据以数字和百分比表示,通过卡方/Fisher精确检验进行比较。为了评估HBOT与MED的效果,使用重复测量ANOVA混合模型比较治疗后和治疗前的数据。模型包括组别-时间交互作用。在问卷分析中,对多次比较使用Bonferroni校正。在SPECT分析中,每个BA的激活归一化到组中位数水平。对多次比较使用FDR校正。p值<0.05被认为是显著的。在治疗前后的得分或SPECT激活变化与问卷得分和疼痛测试的变化之间进行Pearson相关性分析。数据分析使用MATLAB R2021b(MathWorks, Natick, MA)统计和机器学习工具箱进行。
样本量计算
鉴于先前的发现,基于HBOT组在主要终点测量中减少30分,而药物治疗组减少10分,标准差为24,估算样本量。假设功效为80%,双侧显著性水平为5%,总共需要46名参与者,每组23名。考虑到20%的退出率,总共需要58名参与者。实际招募了60名签署知情同意书的参与者,退出率如预计为20%。
https://blog.sciencenet.cn/blog-41174-1448366.html
上一篇:线粒体内膜损伤后翻转外出的路径
下一篇:上师提出新概念:线粒体“生死”协调器