博文
癌症的气体疗法
||
本文介绍了癌症治疗的气体疗法,涉及的气体包括NO、CO、O2、H2等气体分子及其抗癌机制。使用气体治疗的方式有内源性和外源性刺激,以及联合应用其他方法。本文探讨了利用氧气和氢气改善肿瘤微环境,以及使用氢气生成器、酸响应性纳米药物载体和双响应性纳米粒子等方法提高肿瘤治疗效果。
内源性和外源性刺激响应式气体载体的发展使得气体治疗更加精确和可控。气体治疗与化学动力学疗法、光动力疗法等其他治疗方式结合,可以增强抗肿瘤效果,且具有较低的全身毒性。然而,气体治疗仍面临一些挑战,如具体分子机制尚不明确,刺激模式、气体释放载体和靶向策略仍需优化等。未来,气体治疗在临床应用中的发展前景广阔,值得关注和研究。
论文摘要:气体疗法目前在癌症治疗中受到欢迎,这归功于其可控性、有效性和生物安全性以及用于输送气体的载体的快速发展。在这里,我们介绍了具有确切抗癌效果的各种气体分子,包括一氧化氮(NO)、一氧化碳(CO)、氧气(O2)、氢气(H2)等,以及它们的抗癌机制。此外,还总结了刺激响应型输送系统在气体疗法方面的最新进展。就各种刺激方法而言,介绍了用于输送气体的系统设计。此外,还描述了气体疗法与其他治疗方法(包括化疗、放疗(RT)、光动力疗法(PDT)、光热疗法(PTT)等)相结合的策略。最后,讨论了当前气体输送平台的挑战和前景,以及气体疗法的未来发展和临床转化价值。
本文亮点:阐述了各种气体分子在癌症治疗中的应用,包括NO、CO、O2、H2等。
Liang, Danna, et al. "Application of gas molecules in cancer therapy." Biomedical Technology 6 (2024): 46-60.
引言
癌症是一种由于其高度异质性和复杂性而对人类健康构成威胁的疾病。癌症的治疗方法主要包括手术、化疗、放疗、免疫疗法等,但它们都有局限性。例如,手术无法完全切除癌症,残留的肿瘤细胞容易复发和转移,导致高死亡率。化疗的效果通常因药物耐药性和全身毒性而不令人满意。癌症细胞的快速能量代谢导致肿瘤微环境(TME)的独特特征,如缺氧、轻微酸性、过氧化氢(H2O2)的过度表达和血管通透性增加。这些因素使癌症对抗癌疗法产生抵抗。近年来,由于其可控性、有效性和生物安全性,气体疗法受到了广泛关注。通过利用生理气体分子如O2、NO、CO和H2等的独特治疗效果,气体疗法可以应用于治疗许多重大疾病,特别是癌症。在适当浓度下,气体通过逆转Warburg效应抑制癌细胞的存活能力,同时不影响正常细胞的存活。此外,气体分子由于其超低分子量可以自由扩散到肿瘤基质和生物膜中。得益于这些特性,气体疗法可以协同增强其他疗法的效果。例如,通过O2缓解缺氧可以提高化疗、PDT、RT和SDT的效果;通过NO和CO可以恢复对多药耐药(MDR)癌症的化疗药物敏感性。因此,无论是单独使用还是与其他疗法联合使用,气体在治疗肿瘤方面都具有不可估量的潜力(见表1)。
表1. 各种治疗气体的特性。
气体在体内难以用于治疗,因为它会在体内随机扩散并难以在目标组织中有效积累。因此,治疗效果有限,甚至存在气体中毒的风险。因此,正在开发具有可控尺寸和适当特性的载体,以通过主动和被动靶向途径实现气体分子的肿瘤靶向递送。可以使用各种载体进行气体递送。其中,刺激响应型气体递送载体已成为研究的重点。它们可以被内源性刺激物如谷胱甘肽(GSH)、H2O2、乳酸、葡萄糖、酶等和外源性刺激物如光、X射线、超声波、磁场、热等激活。此外,这些载体可以通过典型的增强渗透性和保留(EPR)特性有效地在肿瘤中聚集,并且还可以主动靶向和识别。此外,可以通过调节这些载体的结构、组成和功能来控制气体释放。基于刺激响应型载体的快速进步,可以实现具有特定结构和所需功能的各种所需载体的设计和制造。因此,气体载体的出现为气体开辟了广泛的治疗可能性,并为肿瘤提供了新的治疗模式或辅助疗法。特别是与传统疗法相比,气体疗法可以同时实现高效性和减少副作用,这归功于治疗气体的多个成员及其特定的抗肿瘤机制。目前,许多评论已经介绍了气体在肿瘤治疗中的研究。例如,Jing等人描述了产气纳米平台和气体的抗肿瘤机制。Chen等人回顾了刺激响应型气体递送在肿瘤成像和治疗中的应用。然而,很少有评论全面描述气体在肿瘤治疗中的具体机制、控制释放策略和基于气体的组合疗法。
在这里,我们专注于气体疗法在癌症领域的最新进展。此外,还描述了各种治疗性气体的内在抗肿瘤机制,以及刺激响应型气体载体的研究进展(图1)。进一步讨论了气体疗法的前景和临床转化价值。总的来说,这篇综述旨在提供关于气体疗法的概述,可能激发和促进气体疗法在癌症治疗中的发展和应用。
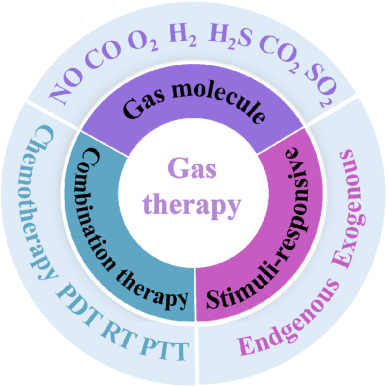
图1. 气体疗法的示意图,包括气体分子、内源性和外源性刺激以及肿瘤治疗中的组合策略。
2用于癌症治疗的各种气体
2.1. 一氧化氮(NO)
作为一种重要的气体传递物质,NO已被证明参与许多生理过程,如凋亡、免疫反应、血管生成、神经传递等。因此,NO在各种生物医学应用中被广泛探索,如心血管稳态、呼吸系统疾病、抗菌治疗、伤口愈合和癌症治疗。低浓度的NO可以促进肿瘤生长,但高浓度时可以抑制肿瘤生长。NO诱导的抗肿瘤效应涉及多种途径,如线粒体和DNA的亚硝化作用以及细胞呼吸的抑制。此外,NO可以通过降低P-糖蛋白(P-gp)表达水平来恢复MDR细胞对化疗的敏感性,通过与ROS相互作用产生过氧亚硝酸盐来增强PDT的治疗效果,并作为放射增敏剂协同提高放疗效果。目前,基于各种NO释放分子(NORMs)的刺激响应型NO递送系统正在开发中。 2.1.1. 使用NORMs递送NO 已研究并应用了各种NORMs进行NO递送,例如N-二氮烯二醇酸酯(NONOate)衍生物、S-亚硝基硫醇(SNO)、金属亚硝酰等。在质子存在下,NONOate衍生物可以自发释放NO。例如,Lin及其同事报道了一种NO培养器,它由含有NONOate的聚(乳酸-共-乙醇酸)(PLGA)空心微球(HM)和其水芯中的表面活性剂癸酸钠组成。Wang等人设计了装载二乙烯三胺二氮烯二醇酸酯(DETA NONOate)的光敏自由聚合物纳米胶囊(NO-NCP),它具有光声(PA)空化增强ROS和在酸性溶酶体中加速释放NO的能力(图2A)。通过将SNO偶联到硫代mSiO2壳上,开发了一种智能近红外(NIR)控制的NO纳米发生器,用于逆转MDR细胞(图2B)。另一个NO递送平台通过将叔丁基亚硝酸钾与Ag2S量子点(QDs)耦合设计,用于多功能癌症放疗。将2-(硝氧基)乙酸装饰的透明质酸与光热剂和化疗药物同时封装到纳米颗粒中。这种多功能纳米颗粒展示了透明质酸酶介导的收缩和NIR控制的NO释放行为。硝基苯衍生物是光响应性NO供体。Fraix等人详细研究了4-硝基-3-(三氟甲基胺)苯胺衍生物,并展示了光响应性NORMs在生物医学应用中的价值。为了进一步提高光控释NO的灵敏度,设计了N-亚硝胺衍生物。首次合成了一种有机的、NIR光激活的NO供体(PhotoNOD),由氮杂-BODIPY和N-亚硝胺组成。PhotoNOD展现出优异的NIR控制的NO释放和光声(PA)成像特性,用于肿瘤治疗(图2C)。
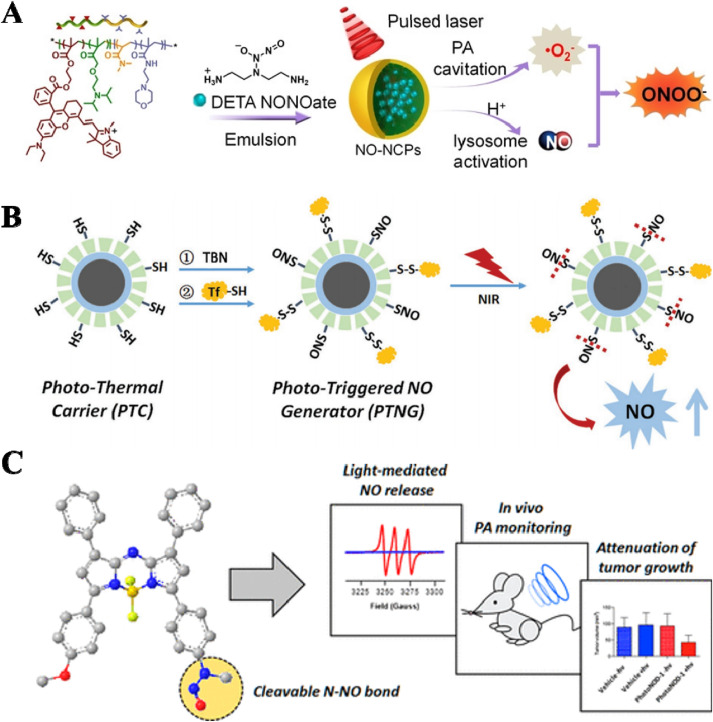
图2. 一氧化氮释放分子(NORMs)。(A) 酸性溶酶体响应性NO-NCPs,装载有DETA NONOate。(B) 光触发的NO发生器(PTNG)。(C) 近红外光激活的NO供体(PhotoNODs)。
2.2. 一氧化碳(CO)
CO的效果是浓度依赖性的。低浓度的CO在体内充当信使,通过CO/血红素氧合酶-1(HO-1)系统参与肿瘤的代谢和血管生成。相反,高浓度的CO可以降低血红蛋白携带O2的能力,甚至导致死亡。最近研究发现,适当浓度的CO可以通过增强线粒体活性和氧气消耗来诱导癌细胞死亡。CO输送的主要策略有两种:(i)使用刺激响应性一氧化碳释放分子(CORMs),和(ii)原位分解CO2为CO。
2.2.1. 使用CORMs输送CO
通常,CORMs被整合到各种刺激响应性纳米载体中,以实现目标/控制CO的输送。此外,已知的CORMs中大部分是金属羰基复合物,如钌羰基和锰羰基。He等人通过将锰羰基CORMs封装进石墨烯氧化物纳米片制备了近红外触发的CO纳米发生器(图3A)。通过将锰羰基(Mn2(CO)10,简称为MnCO)与先进的中空介孔二氧化硅纳米颗粒(hMSN)结合,开发了对H2O2响应的MnCO@hMSN纳米载体。

图3. 一氧化碳释放分子(CORMs)。(A) 近红外响应性CO发生器MnCO-GO。(B) 可见光至近红外激活的无过渡金属CORM(COR-BDP)。(C) 一种光催化CO释放纳米材料(HisAgCCN)。
为了减少在生物体内使用含有过渡金属的CORMs带来的副作用,已经开发了无金属有机小分子CORMs。基于硼酸盐和降冰片烯-7-酮衍生物的结构基元构建了自发性有机CORMs。此外,通过环状二酮、黄嘌呤羧酸和BODIPY结构基元构建了可见光触发的有机CORMs。Palao等人合成了一种新型的基于BODIPY发色团的有机CORM(COR-BDPs),具有光响应性能(图3B)。
2.2.2. 原位分解CO2为CO
通常,由于肿瘤细胞内高HCO3−浓度和低pH值,肿瘤中的CO2水平(pCO2 ≈ 80 mmHg)显著高于大气中的水平(pCO2 ≈ 0.2 mmHg)。因此,将Ag3PO4掺杂的碳点装饰在C3N4纳米材料上,构建了Z型系统,用于将肿瘤内的CO2转化为CO。这种光催化纳米材料(HisAgCCN)成功地将肿瘤内的CO2催化为CO,用于协同抗肿瘤治疗(图3C)。
2.3. 氧气(O2)
TME的缺氧被认为是导致肿瘤侵袭性表型和促进肿瘤进展的重要因素。大多数癌症治疗方法,如化疗、放疗、PDT和SDT,都因肿瘤中低氧水平而受到影响。因此,提高这些疗法的有效性,肿瘤充氧和缓解肿瘤缺氧具有重要意义。为了缓解肿瘤缺氧并提高各种治疗方法的效果,基于纳米医学技术的有效氧气输送系统已被广泛探索。改善肿瘤充氧的主要策略有两种:使用气体载体输送O2和使用催化剂在肿瘤中催化H2O2。
2.3.1. 使用气体载体输送O2
通常,使用能够运输自由O2分子并在适当刺激下控制O2释放的载体直接向肿瘤输送O2。目前,许多具有携带O2能力的载体,如全氟化碳(PFC)、Au2O3和金属-有机骨架(MOF)。Song等人成功制备了一种新型放疗增敏剂(TaOx@PFC-PEG)(图4A)。一方面,TaOx可以吸收X射线并增强DNA损伤。另一方面,PFC饱和氧气后,TaOx@PFC-PEG可以缓慢释放O2以增强肿瘤的充氧能力。基于PFC纳米颗粒合成了一种两阶段氧气输送系统(PFTBA@HSA),以改善肿瘤缺氧微环境。第一阶段是从PFC释放O2。而PFC增加了红细胞浸润,导致第二阶段的O2释放。为了进一步提高肿瘤积聚效率和减少免疫清除,使用了红细胞膜来包覆纳米颗粒。成功开发的PFC@PLGA-RBCM纳米颗粒具有高效的O2携带能力,以及由于RBCM涂层导致的延长的血液循环时间(图4B)。为了实现免疫逃逸和同源靶向,Fang等人设计了一种涂有癌细胞膜的仿生O2输送纳米探针,即CCm–HSA–ICG–PFTBA。人血清白蛋白(HSA)被用来增加吲哚青绿(ICG,一种近红外光敏剂)的稳定性并延长循环时间。更重要的是,与在水中或细胞内环境中相比,PFC中单线态氧(1O2)的寿命已得到证实延长。总之,可以基于PFC设计相应的载体,以克服与缺氧相关的抵抗并增强RT、PDT在体内的效果(图4C)。

图4. O2递送系统。(A) 多功能O2储存器(TaOx@PFC-PEG)。(B) 人造纳米级红细胞模拟器(PFC@PLGA-RBCM)。(C) 有机半导体光声纳米液滴(PS-PDI-PAnDs)。(D) O2自给生物模拟纳米系统(CAT-PS-ZIF@Mem)。
2.3.2. 在肿瘤中催化H2O2
TME中存在大量的H2O2。此外,H2O2可以被酶(如过氧化氢酶)或无机酶类似物(如基于Mn、Fe和Au的纳米颗粒)催化。例如,嵌入有过氧化氢酶(CAT)蛋白的O2自给生物模拟纳米颗粒(CAT-PS-ZIF@Mem)被开发出来(图4D)。在另一项工作中,制备了携带氯e6(Ce6)和阿霉素(DOX)的可生物降解的中空二氧化锰(H-MnO2)纳米颗粒。
具有过氧化物酶活性的铁基纳米材料,如Fe-原卟啉(血红素)、Fe3O4、锰铁氧体(MnFe2O4)和普鲁士蓝(KFe3+[Fe2+(CN)6]),可用于催化H2O2。开发了一种充满H2O2的聚合物H2O2/Fe3O4-PLGA,它可以通过Fe3O4与H2O2之间的芬顿反应产生O2和•OH用于癌症治疗。此外,Liu等人开发了一种末端氨基的PAMAM树枝状大分子,用于封装金纳米团簇(AuNCs-NH2)。该系统可以通过其固有的类似过氧化氢酶活性产生O2。与其他纳米酶相比,AUNCS-NH2在广泛的pH范围内显示出类似过氧化氢酶活性,特别是在pH 4.8−7.4范围内。
2.4. 氢气(H2)
氢气(H2)已被证明能选择性地清除自由基,如将羟基自由基还原为H2O。除了其典型的抗炎和抗氧化作用外,H2还正在被开发用于抗肿瘤应用,特别是与治疗性纳米药物结合使用(图5A)。然而,H2诱导的抗肿瘤作用机制仍在探索中。用于H2生成/释放的纳米平台的制备技术相对不成熟。目前,H2递送的策略是通过纳米载体在原位生成H2。
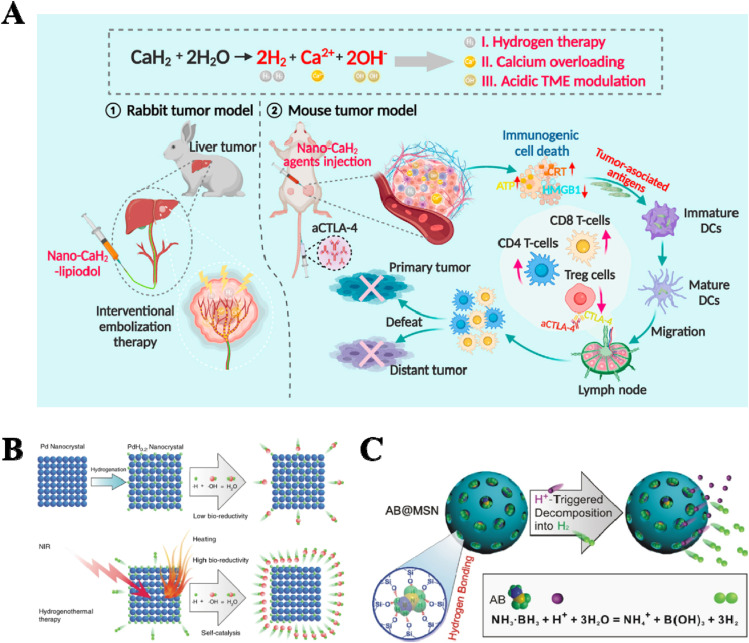
图5. 氢气递送纳米平台。(A) 纳米级CaH2材料。(B) 近红外控制的氢气释放纳米晶体(PdH0.2)。(C) 一种酸响应性H2释放纳米药物(AB@MSN)。
钯纳米晶体是一种卓越的氢气储存载体和加氢反应的理想催化剂,有潜力促进氢气疗法。如图5B所示,制备了一种用于靶向肿瘤的近红外触发钯氢化物(PdH0.2)纳米晶体,用于氢气热疗法。氨基硼烷(AB),一种典型的H2前体,被装载到介孔二氧化硅中。这个纳米平台不仅具有相当高的氢气储存能力(10 wt%),还可以以酸响应的方式分解为H2。Yang等人构建了酸触发的氨硼烷-MSN(AB@MSN)纳米载体,用于肿瘤内高负载量的H2递送(图5C)。
2.5. 其他气体
硫化氢(H2S)是重要的气体传递物质之一。内源性H2S主要从胱氨酸(Cys)产生,可由胱硫醚β合酶(CBS)、胱硫醚γ裂解酶(CSE)和3-巯基丙酮酸硫转移酶(MST)激活(综述)。据报道,H2S在癌症生物学中扮演双重角色。在超高生理浓度下,H2S诱导肿瘤细胞凋亡,表明其在抗肿瘤疗法中有潜在作用。为了克服直接吸入H2S的毒性,开发了各种H2S供体。通常,NaHS、二烯丙基三硫化物(DATS)、GYY4137和二硫仑衍生物是常见的H2S供体。Liu等人合成了一种刺激响应性磁性纳米脂质体(AML)递送系统,装载了茴香二硫仑(ADT)和超顺磁性纳米颗粒。该系统可以在肿瘤内生成H2S气泡用于肿瘤治疗。Woods等人报道了一种通过将GYY4137与光活性钌(II)骨架配位而触发的红光控制H2S释放分子。此外,基于树枝状介孔有机硅(DMOS)的快速降解纳米系统(指定为DCC-HA NCs),包含四硫键和H2S供体,被开发用于H2S气体治疗(图6A)。
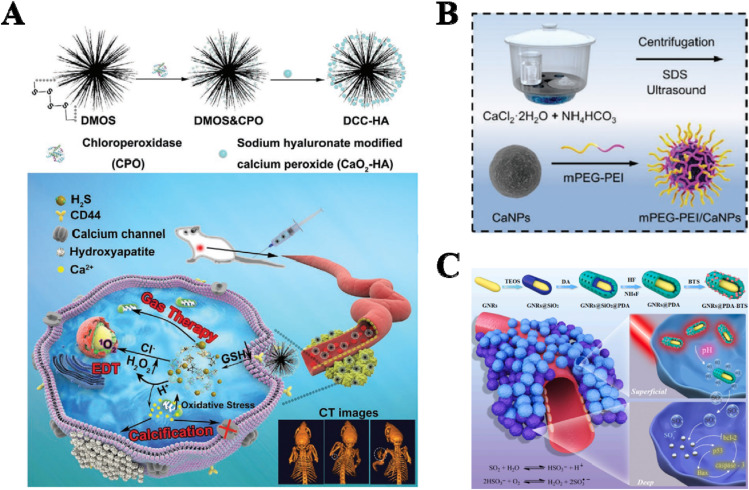
图6. 其他气体释放纳米平台。(A) 一种对TME响应的H2S递送纳米复合物(DCC-HA NCs)。(B) 一种肿瘤pH触发的CO2气泡发生器(mPEG–PEI/CaNPs)。(C) 双重响应性SO2释放纳米颗粒(GNRs@PDA-BTS)。
尽管二氧化碳(CO2)分子本身没有治疗效果,但它在临床腹腔镜手术中被广泛用作充气气体。最近,发现CO2爆炸产生的过程具有治疗效果并能增强成像能力。例如,通过嵌段共聚物模板化矿化方法制备了一种载有DOX的CaCO3混合纳米颗粒(DOX–CaCO3-MNP)。DOX–CaCO3-MNPs可以在酸性TME中产生多个CO2气泡用于US成像。此外,CO2产生的过程触发了同时的DOX释放。Xu等人构建了两种多功能纳米颗粒mPEG–PEI–AuNRs和mPEG–PEI/CaNP,用于联合PTT和UST(图6B)。pH响应性的mPEG–PEI/CaNPs将在TME中产生CO2气泡。这些气泡可以增强mPEG–PEI–AuNRs的光声成像并爆炸导致肿瘤细胞坏死。
二氧化硫(SO2)可以通过体内L-胱氨酸和L-蛋氨酸的代谢产生。SO2通过产生ROS和耗尽谷胱甘肽来破坏氧化还原平衡,从而诱导生理和病理生理效应。Shen等人设计了一种对GSH响应的SO2供体,它与DOX一起对MDR肿瘤细胞显示出协同治疗效果。通过SO2的产生,肿瘤细胞中的ROS水平升高,导致肿瘤细胞的氧化损伤并逆转MCF-7细胞的MDR。在另一个案例中,成功制备了一种负载苯并噻唑亚磺酸盐(一种SO2前药)的pH和光热双重响应性纳米载体(GNRs@PDA-BTS,GPBRs)。GPBRs以金纳米棒为核心,多孔聚多巴胺为壳的蛋黄壳结构对SO2显示出高装载效率。如图6C所示,GPBRs已被证明对治疗深部肿瘤有效。
3. 气体的可控释放原理
随着刺激响应性载体的快速发展,可以实现大量气体分子的靶向递送,用于肿瘤治疗且系统毒性最小。按刺激源分类,激活策略主要响应内源性刺激和外源性刺激。内源性刺激包括H2O2、GSH、葡萄糖、酸性和酶,而光、超声波、X射线、磁场和热量是代表性的外源性刺激。
3.1. 内源性刺激响应载体
3.1.1. H2O2
TME中H2O2的含量明显较高,这有利于开发H2O2响应性气体递送载体。首次发现MnCO可以通过与内源性H2O2发生类Fenton反应释放CO。因此,Jin等人构建了一种内源性H2O2响应性纳米药物(MnCO@hMSN)用于CO治疗(图7A)。
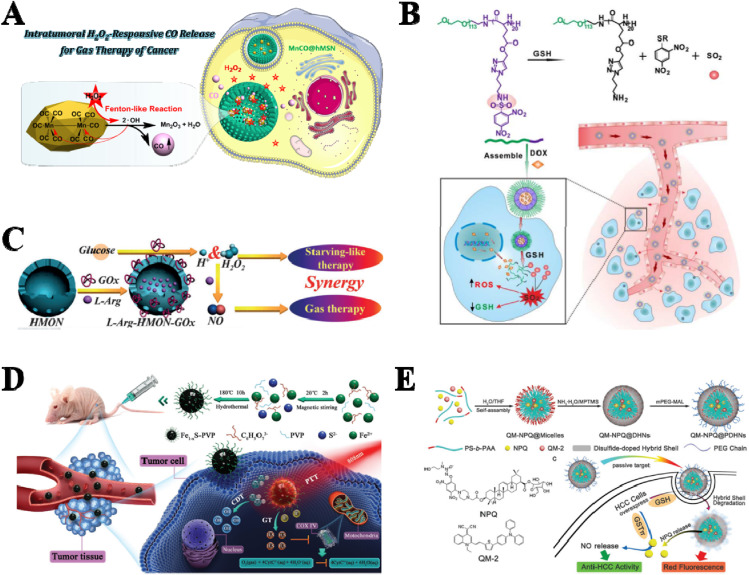
图7. 内源性刺激响应载体。(A) H2O2响应性纳米药物(MnCO@hMSN)。(B) GSH响应性纳米载体PEG-PLG(DNs)。(C) 葡萄糖响应性纳米药物(L-Arg-HMON-GOx)。(D) pH响应性纳米药物(Fe1−xS-PVP NPs)。(E) 酶响应性NORMs(QM-NPQ@PDHNs)。
3.1.2. GSH
肿瘤微环境(TME)中过表达的GSH是另一种可以用于刺激响应性气体载体的内源性刺激。在一个案例中,设计并合成了一种GSH响应性纳米载体PEG-PLG(DNs),用于DOX和SO2供体的共传递。在内源性GSH的激活下,PEG-PLG(DNs)可以同时释放DOX和SO2,对人乳腺癌MCF-7 ADR细胞显示出优异的协同治疗效果(图7B)。
3.1.3. 葡萄糖
葡萄糖是肿瘤细胞生长的主要能量物质,肿瘤细胞需要消耗更多的葡萄糖以支持其快速生长。研究发现,葡萄糖也可以作为内源性刺激。葡萄糖氧化酶(GOx)将葡萄糖氧化为葡萄糖酸和H2O2。此外,L-精氨酸(L-Arg)可以被H2O2氧化产生NO。因此,Fan等人首次构建了一种由葡萄糖触发的纳米药物(L-Arg-HMON-GOx),装载了GOx和L-Arg,用于癌症中的饥饿和气体联合治疗(图7C)。
3.1.4. 酸性
TME的弱酸性(pH = 6.5至6.8)是恶性肿瘤的一个重要特征,常用于构建pH响应性纳米药物。通过一步水热法成功构建了新型聚乙烯吡咯烷酮(PVP)修饰的硫化铁纳米颗粒(Fe1−xS-PVP NPs)。构建的Fe1−xS-PVP NPs可以在TME的弱酸性下释放S2−,S2−可以进一步与H+结合产生H2S气体(图7D)。
3.1.5. 酶
一些特定的酶在肿瘤细胞中过表达,包括DT-diaphorase、基质金属蛋白酶(MMPs)和谷胱甘肽S-转移酶(GSTs)。这些特定的酶作为内源性刺激,可以用于开发刺激响应性气体载体。因此,一种新型的双重氧化还原/酶响应性NORM(QM-NPQ@PDHNs)被成功设计,它可以响应肿瘤内的GSH和GST进行肿瘤特异性治疗(图7E)。
3.2. 外源性刺激响应载体
3.2.1. 光
光的外源性刺激(包括紫外线、可见光和近红外光)因其高空间和时间分辨率以及非侵入性而被广泛研究。金属羰基团(MeCO)可以被紫外光和/或可见光降解为CO。得益于这一特性,Kenta Fujita等人成功地使用突变体铁蛋白(Fr)-Mn-羰基复合物构建了一个光响应性CORM(Fr-MnCO),用于活细胞中的CO递送。通过调整可见光的照射时间,可以控制Fr-MnCO复合材料释放的CO量。然而,紫外光和可见光的组织穿透力弱,限制了它们在肿瘤治疗中的应用。相比之下,近红外光由于其强大的组织穿透能力,是作为气体释放分子的刺激开关的更好选择。Zhang等人合成了一种由硫化铋(Bi2S3)和双-N-亚硝基化合物(BNN)组成的近红外响应性NO释放系统,用于温和的光热疗法和NO疗法。在近红外照射下,Bi2S3显著提高了肿瘤细胞的局部温度,并触发BNN降解以释放NO。因此,实现了温和的光热疗法和按需NO释放(图8A)。
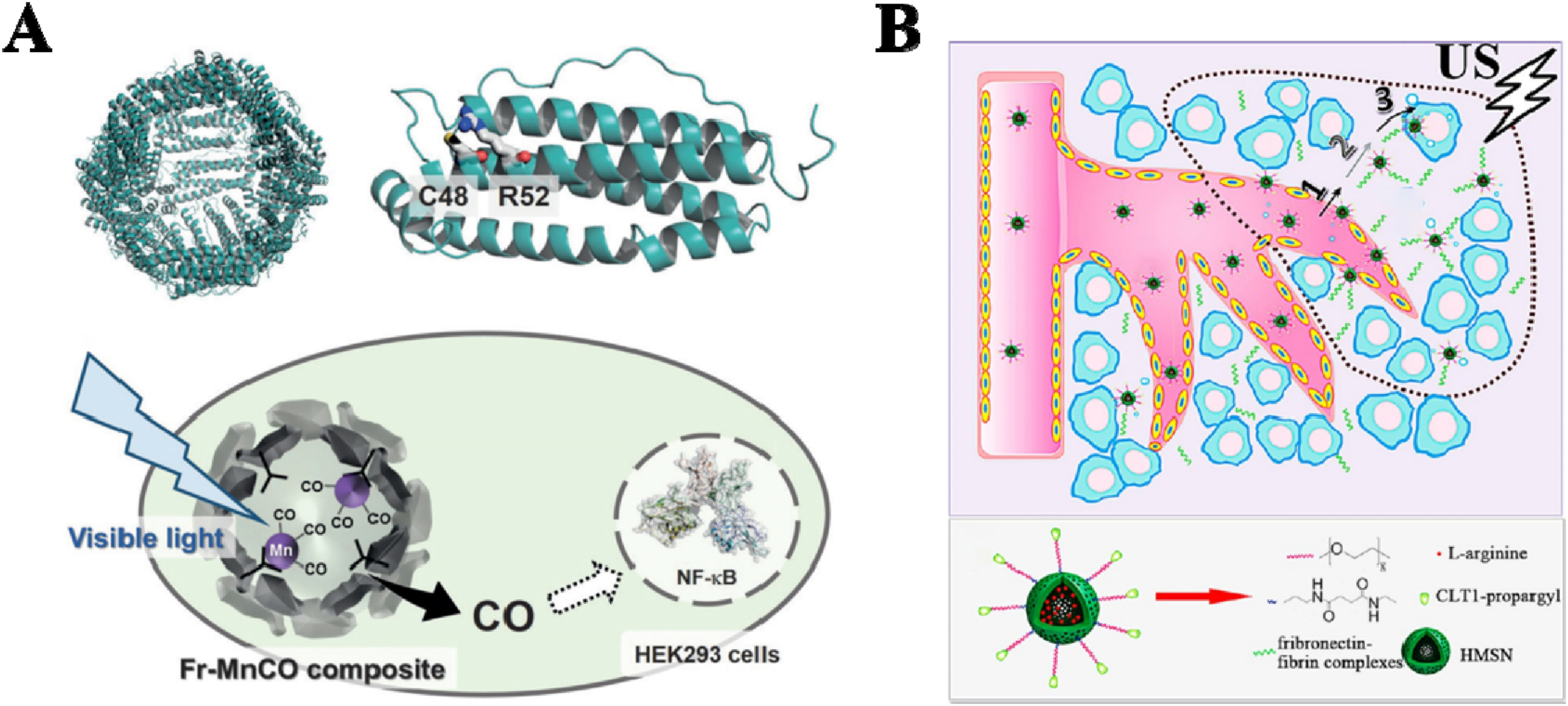
图8. 对外源性刺激响应的载体。(A) 光响应性CORM(Fr-MnCO)。(B) 超声波响应性NO传递系统(Peptide−HMSN−LA)。
3.2.2. 超声波(US)
超声波是一种出色的外源性刺激,具有非侵入性、高组织穿透力和易于操作的特点。最常用的超声波响应性气体递送纳米载体是载气脂质体,其中的气体可以通过超声波释放。然而,低气体装载效率和不稳定的结构限制了这些脂质体的进一步应用。一种策略是使用空心介孔二氧化硅纳米颗粒(HMSN)作为载体构建超声波响应性气体递送系统。构建了一个超声波响应性NO递送系统(Peptide−HMSN−LA),并利用Panc-1肿瘤中高浓度的H2O2和天然左旋精氨酸(LA)进行气体生成。在这项工作中,超声波可以通过能量转换激活H2O2产生ROS,进而氧化左旋精氨酸生成丰富的NO分子(图8B)。
3.2.3. X射线
X射线是一种具有高组织穿透力的外源性刺激,有利于开发X射线响应性载体。已经证明,SNO的S-N键可以被X射线切割产生NO分子。Fan等人通过用PEG和NO供体(SNO)修饰UCNP/二氧化硅结构,构建了一个X射线触发的NO递送载体(PEG-USMSs-SNO)。得益于X射线的高穿透力,PEG-USMSs-SNO实现了深度无关的NO释放和X射线控制的放射治疗增强。此外,由于它们都基于X射线,协同的X射线响应性气体疗法和放疗值得进一步研究(图9A)。
. 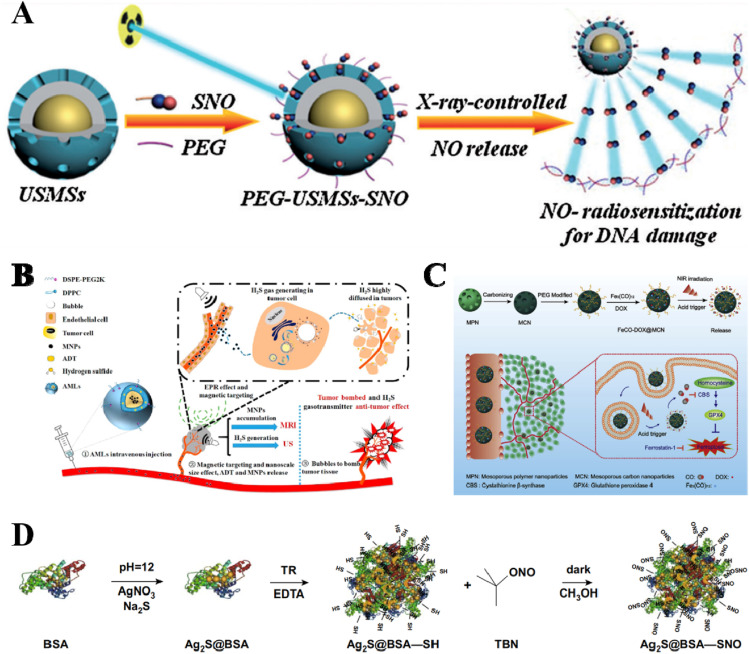
图9. 对外源性刺激响应的载体。(A) X射线触发的NO传递系统(PEG-USMSs-SNOs)。(B) 对磁场响应的磁性纳米脂质体(AML)。(C) 对光热响应的纳米平台(FeCO-DOX@MCN)。(D) 对光热响应的纳米平台(Ag2S@BSA-SNO)。
3.2.4. 磁场
磁场是另一种常用的外源性刺激。构建了一种核心含有磁性纳米颗粒、外壳含有ADT(H2S供体)的磁性纳米脂质体(AML)。在外部磁场导航和EPR效应的共同作用下,AMLs可以优先靶向肿瘤,并在肿瘤内将ADT转化为H2S气泡以产生协同抗肿瘤效果(图9B)。
3.2.5. 热
一些气体供体,如SNO、BNN和MeCO,对高温敏感,并能在特定温度下降解产生气体。将热敏性气体供体与产热纳米颗粒相结合,提供了一种构建热响应性气体递送系统的可行方法。最常见的产生热量的外源性刺激包括光和磁场。在两个案例中,FeCO-DOX@MCN和Ag2S@BSA-SNO纳米平台由于MCN和Ag2S的NIR吸收能力和光热转换效应,分别显示出NIR响应性的CO和NO释放特性(图9C和D)。
4. 基于气体疗法的组合策略
在过去的几年中,许多癌症疗法迅速发展,包括化疗、放疗、PTT、PDT、气体疗法和免疫疗法。由于多重药物抗性、药物副作用、肿瘤转移、复发等因素的影响,单一治疗模式无法满足当前的肿瘤治疗需求。气体疗法作为一种新颖的绿色治疗方法,可以显著提高现有疗法的抗癌效果。理解联合治疗的策略以及气体在其中的作用至关重要。因此,我们描述了基于气体的联合疗法,并更详细地分析了其机制。
4.1. 气体疗法与化疗的结合
化疗是一种常用的癌症治疗方式。然而,由于大多数化疗药物缺乏特异性,不可避免会对正常组织和血液产生副作用。此外,肿瘤细胞的多重药物抗性(MDR)是导致化疗失败的另一个因素。这是因为癌症细胞膜上P-gp转运蛋白的过度表达可以将细胞内的药物泵出细胞外,降低化疗药物的治疗效果。据报道,NO分子可以抑制P-gp的表达来逆转MDR。例如,Guo等人制造的近红外响应性NO纳米发生器成功抑制了P-gp的表达,并增加了DOX的积累,展现出优异的协同抗MDR肿瘤效果(图10A)。已经开发了多种用于NO分子递送的纳米平台,证明了NO可以提高MDR肿瘤细胞的治疗效果。
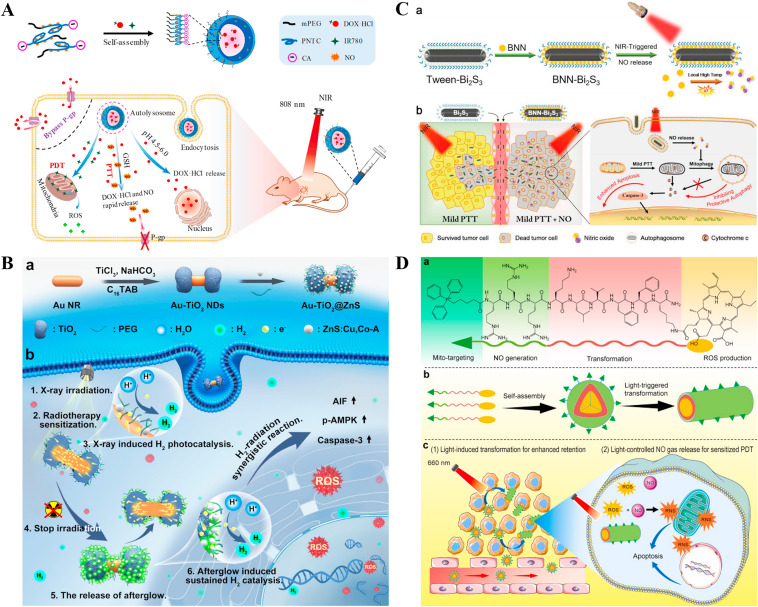
图10. 气体疗法与 (A) 化疗、(B) 放疗、(C) 光热疗法或 (D) 光动力疗法的结合。
SO2也被用于与化疗协同治疗MDR肿瘤。例如,Shen等人设计了一种GSH触发的SO2聚合物前药纳米载体,用于装载DOX。释放的SO2能对肿瘤细胞造成氧化损伤,并恢复MCF-7 ADR细胞对DOX的敏感性。
气体分子在联合治疗中还可以解决化疗遇到的其他挑战。例如,一种装载DOX的碳酸钙复合纳米颗粒(DOX-CaCO3-MNP)被设计用于肿瘤治疗。这些纳米颗粒通过实现瘤内pH响应性产生CO2气泡和释放DOX,展示了气体疗法和化疗的强大协同作用。此外,CO2气泡显示出强烈的回声信号和良好的超声成像持久性。
CO可以显著提高肿瘤细胞对化疗的敏感性,同时减少化疗对正常细胞的毒性。因此,Zheng等人设计了一种新型的光催化CO产生纳米材料,能在肿瘤中将内源性CO2转化为CO。研究表明,HisAgCCN和DOX的联合治疗在体内对肿瘤抑制具有显著的协同效应。
4.2. 气体疗法与放疗的结合
放疗是癌症治疗的常用方法,通过损伤细胞中的DNA来实现。然而,TME的低氧环境限制了放疗的效果。研究发现,O2和NO都可以作为放射增敏剂,捕获由电离辐射诱导产生的自由基,并形成超氧自由基,导致DNA损伤和抑制DNA修复。因此,通过补充O2和NO来增敏放射治疗是最关键的解决方案。
O2是最常用的有效放射增敏剂。因此,Song等人制备了PEG-Bi2Se3@PFC@O2纳米平台,通过将氧气饱和的PFC(一种放射增敏剂和氧气储存器)填充到空心Bi2Se3纳米颗粒中。在NIR照射下,PEG-Bi2Se3@PFC@O2引起O2的爆发性释放,并暂时改善肿瘤氧合,这有助于克服与放疗相关的低氧抵抗。然而,仍需要注意PFC中O2的溶解度低、载量低且易泄漏的问题。
除了O2,NO在低氧环境中是一种强效的放射增敏剂。为了调节NO释放的数量和持续时间,Yang等人设计了一个NO储存器(SupraNO)。该系统有潜力使异常的肿瘤血管正常化并充当放射增敏剂。特别是,SupraNO可以在β-Gal的催化下释放NO。因此,肿瘤中β-Gal的过表达可以恰当地作为NO释放的触发器。SupraNO为血管正常化提供了持续低剂量的NO供应,并为放射增敏提供了爆发性释放,显著抑制了B16肿瘤在体内的生长。
近年来,H2已被开发用于协同放射治疗。Wu等人设计了一种X射线触发的H2产生平台Au-TiO2@ZnS(图10B)。金纳米棒(Au NRs)作为平台的主要组成部分,可以提高放疗敏感性。此外,得益于H2的抗炎作用,RT引起的炎症副作用显著减少。Au-TiO2@ZnS是首个将H2疗法与放射治疗结合的报道平台,展示了H2在联合治疗中的光明前景。
4.3. 气体疗法与光热疗法的结合
PTT通过增加组织温度引起不可逆的蛋白质变性和损伤包括线粒体、溶酶体、细胞核等细胞器,从而发挥抗肿瘤作用,这是基于吸光纳米粒子的光热转换能力。然而,纳米粒子在固体肿瘤中的不均匀分散导致热量传播不均。高温常常损害肿瘤周围的正常组织。因此,PTT与气体疗法的结合策略具有前景,因为气体分子具有出色的扩散性。Zhang等人制备的BNN-Bi2S3纳米复合材料实现了NO和温和PTT的结合,并成功克服了PTT的困难(图10C)。
此外,发现几种气体,包括H2、NO和CO,可以保护正常细胞免受非特异性热伤害[17]。例如,Zhao等人制造了一种立方PdH0.2纳米晶体,具有肿瘤靶向递送、NIR触发的氢气释放和光热转换特性。重要的是,PdH0.2纳米晶体可以选择性增强细胞内ROS以诱导癌细胞凋亡,并持续清除热产生的ROS以保护正常细胞免受热损伤,展示了氢和光热疗法的协同效果,且系统毒性很小。
4.4. 气体疗法与光动力疗法的结合
PDT是一种基于光敏剂的治疗方法,可以产生大量ROS以诱导癌细胞凋亡。ROS还可以提高膜的通透性以促进纳米粒子的摄取。PDT与气体疗法的结合可以协同增强抗癌效果。光敏剂在光照下可以激活O2生成单线态氧(1O2)。Liang等人开发了一种金纳米笼@二氧化锰纳米颗粒(AuNC@MnO2, AM),作为TME触发的O2产生者和NIR响应性ROS产生者,用于O2增强的免疫原性PDT。
NO在低氧条件下是PDT的高效敏化剂。Jiang等人制备了基于自组装嵌合肽单体TPP-RRRKLVFFK-Ce6的光响应NO释放纳米颗粒。在光照下,生成的NO与ROS反应可以产生高毒性的过氧亚硝酸阴离子(ONOO−),进一步敏化PDT。NO和PDT的结合可以有效消除肿瘤(图10D)。
4.5. 气体疗法与其他疗法的结合
此外,气体疗法可以与化学动力学疗法(CDT)和声动力疗法(SDT)结合以增强抗肿瘤效果。例如,Zhao等人制备了一种酸敏感的纳米药物FeCO-MnO2@MSN,首次实现了CDT与气体疗法的协同抗肿瘤效果(图11A)。在癌细胞中,溶酶体中的酸触发MnO2产生ROS(·OH),这进一步驱动FeCO释放CO。此外,Feng等人制造了一种输送纳米系统TPZ/HMTNPs-SNO,使用空心介孔二氧化钛纳米颗粒(HMTNPs)装载替拉扎明(TPZ)并装饰S-亚硝基硫醇(R-SNO)(图11B)。在US刺激下,HMTNPs作为声敏剂可以产生ROS进行CDT,可以敏化R-SNO释放NO。TPZ/HMTNPs-SNO是一个有前景的抗肿瘤候选物,它结合了三种治疗模式。
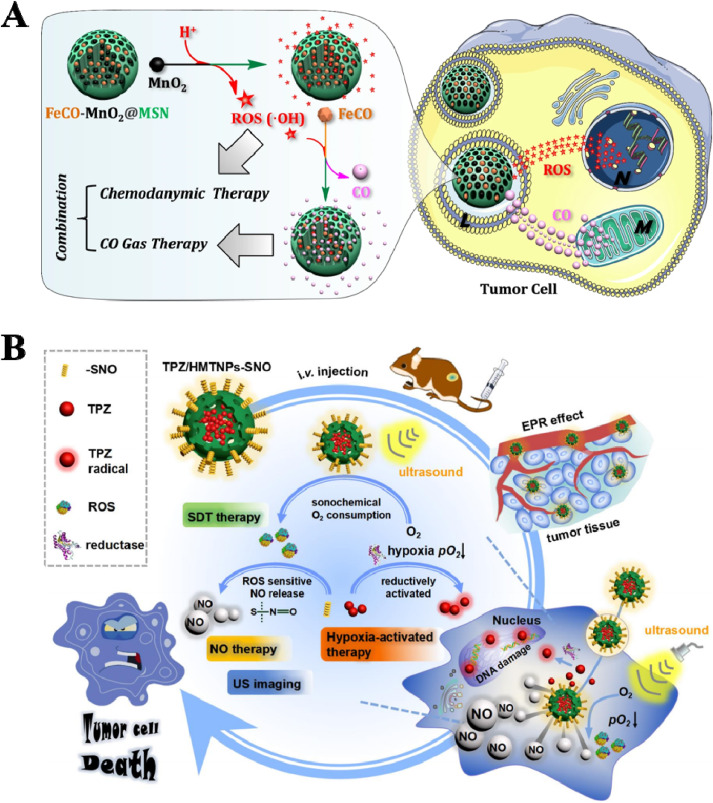
图11. 气体疗法与(A)CDT或(B)SDT的结合。
5. 结论与展望
气体疗法是一种新颖且有前景的肿瘤治疗方法。在这里,我们总结了各种气体在肿瘤治疗中的应用,如NO、CO、O2、H2、H2S、CO2和SO2。这些气体或其前体的递送是实现治疗效果的关键。近年来,用于气体和气体前体递送的刺激响应型载体在气体疗法中引起了极大的关注,它们可以精确且可控地将气体递送到肿瘤中。此外,气体疗法与其他治疗方式的结合有效增强了抗肿瘤效果,同时最小化了系统毒性。例如,NO可以通过抑制P-gp的表达来逆转MDR细胞,并协同提高化疗的效果。O2和NO可以增强PTT和RT的敏感性。尽管气体疗法的治疗结果令人鼓舞,但仍有许多挑战需要解决。首先,气体疗法的具体分子机制尚不清楚。其次,气体释放的刺激模式、递送载体和靶向策略仍需改进和扩展。第三,气体疗法在临床试验中的推广和应用很少。最后但同样重要的是,气体疗法的未来发展方向值得注意。
气体疗法的分子机制。一些气体分子(如H2、NO、CO、H2S)已知可以通过损伤细胞器来杀死肿瘤细胞。为了优化治疗效果,需要了解具体的分子机制。此外,各种气体的最佳治疗浓度仍然不清楚。而且,不同浓度的气体是否对不同阶段的肿瘤有效也不得而知。
刺激响应型气体载体。目前,各种刺激源如特定酶、微波、电场和磁场很少用于制备刺激响应型气体载体,这可以进行相应的功能开发。气体载体的不稳定性导致自发性气体释放仍是一个挑战。大多数气体递送系统的靶向途径集中在单一细胞器上。为了提高气体疗法的效率,应开发多种靶向递送方法。
气体疗法的临床应用。近年来,气体疗法发展迅速,但只有部分气体疗法在临床试验中得到普及。例如,高压氧结合放疗/化疗的临床试验正在进行中。此外,H2被用于结合放疗治疗肝脏恶性肿瘤,提高了患者的生活质量评分。NO已广泛用于心血管疾病的急性治疗,其在癌症治疗中的临床应用也在扩展。为了推进临床试验,应优先考虑气体载体的合成过程、稳定性、生物安全性和治疗效果。总的来说,气体在癌症临床治疗中的广泛应用仍需要大量的探索和努力。
气体疗法的未来方向。气体疗法的治疗效果已被广泛研究,但仍有进一步研究的空间。目前,气体疗法最常见的给药形式是静脉注射。新的局部递送方法,如微球、微针和凝胶,减少了系统毒性,同时实现了气体递送。然后,除了将气体与PDT、PTT、RT等结合外,还可以根据它们特定的抗肿瘤机制组合不同的气体。
https://blog.sciencenet.cn/blog-41174-1438424.html
上一篇:灵长类动物初级视皮层视觉工作记忆的神经元表示
下一篇:氢气补充能否增强运动员表现?系统综述和荟萃分析