博文
喝氢水治疗结肠炎的实验研究【2009年哈佛BBRC】
||
氢水对结肠炎的实验研究【2009年哈佛BBRC】
这是国际上首次报道氢水治疗结肠炎作用的实验结果。比较重要的是,研究发现氢水饮用后能维持一定浓度到达结肠,说明氢水的作用可能存在直接对抗结肠炎的可能。结合其他证据,这对于解释氢水治疗结肠炎有比较好的理由。氢水对胃肠道疾病有其优势,主要是属于局部用药的情况。后来有临床研究发现氢水对食管炎有一定作用,则更为直接。人体试验方面有研究发现氢水对便秘有一定效果,其主要因素是氢气具有促进肠道蠕动的作用,增加排便有其理论基础。对结肠炎的作用基础则在于氢水的抗炎症效应。另外,氢水饮用后,无论是在胃部还是在小肠大肠,都汇集到门静脉然后进入肝脏,因此氢水饮用后对肝脏的疾病有更大优势。但是对其他器官如大脑和皮肤,氢水的作用则有望洋兴叹的感觉。
通过其抗氧化作用,分子氢(H2)被报道能够保护器官免受缺血再灌注引起的组织损伤。为了评估其抗炎效果,我们建立了一个人类炎症性肠病(IBD)的小鼠模型,通过向小鼠提供含有以下物质的水:(1) 5% 右旋糖酐钠(DSS)、(2) 5% DSS和氢气、或(3) 仅氢气,持续7天。在第7天时,DSS诱导的病理结果,包括体重减轻、结肠炎评分增加、结肠长度的病理缩短、结肠病变中IL-12、TNF-α和IL-1β水平的升高,都因DSS溶液中加入氢气而显著受到抑制。组织学分析还显示,由DSS介导的结肠组织破坏伴随巨噬细胞浸润,在氢气的作用下明显受到抑制。因此,本研究表明氢气可以预防DSS诱导的小鼠结肠炎的发展。

氢气(H2)被认为具有抗氧化作用。以往的研究表明,以气体形式或溶解在水中的H2能够抑制缺血再灌注引起的大脑、肝脏和心脏组织的氧化应激损伤。与其他气体分子如NO或O2不同,小分子H2可以穿透固体物质,甚至是塑料。基于这种快速渗透性,虽然H2如何消除氧化应激的精确化学机制尚待阐明,但人们认为摄入pH值呈中性的H2水由于其极其负的氧化还原电位值[5],可作为强效的抗氧化剂。然而,H2对非缺血再灌注机制引起的炎症的影响仍需进一步研究。
硫酸右旋糖酐(DSS)诱导的啮齿动物结肠炎已被报告为人类炎症性肠病(IBD),特别是溃疡性结肠炎的动物模型。DSS是一种干扰上皮细胞屏障功能的硫酸化多糖。这使固有层暴露于腔内细菌抗原中,进而引发先天免疫的激活。当通过饮用水应用于小鼠时,DSS会诱导结肠炎,其特征为体重减轻、腹泻和/或明显的血便,以及肠道炎症的组织病理学特征,即隐窝糜烂。
DSS诱导的结肠炎中受损的抗氧化机制被认为是其发病原因之一[11]。由于炎症和氧化过程是相互关联的,因此,H2的抗氧化效果应该通过抑制在结肠炎病变中表达的促炎细胞因子(例如IL-1β、IL-12和TNF-α)来防止其发展。特别是,这些促炎细胞因子被认为是DSS诱导的小鼠结肠炎以及人类IBD中发生的组织破坏的原因。然而,目前尚不清楚摄入H2水是否能有效地预防或抑制DSS诱导的结肠炎的炎症结果,我们检查了溶解在水中的氢气对DSS诱导的小鼠结肠炎的影响。
材料与方法
动物。BALB/c小鼠(8-10周龄雄性,每组n=6)在无特定病原体(SPF)条件下饲养。动物被保持在常规房间内,有12小时的光暗周期,温度恒定。本研究采用的实验程序已获得Forsyth IACUC的批准。
氢气的测量。使用针型氢气传感器(Unisense A/S, Aarhus, Denmark)按照Hayashida等人发布的方法测量水或小鼠器官中的氢气(H2)。
生成溶解有H2的水。将高纯度H2气体(Airgas East, Salem, NH)注入水中、林格氏液或含5% DSS的水中,直到H2浓度达到饱和(0.78 mM,在25°C下)。
诱导DSS诱导的结肠炎。在第0天,对照组常规蒸馏水、溶于蒸馏水的DSS(5% [wt/vol], 30-40 kDa; Acros Organics, Morris Plains, NJ)加或不加饱和H2或仅含饱和H2的蒸馏水作为饮用水随意提供给小鼠,通过带有橡胶顶部和金属管的饲养玻璃瓶(Schott Duran, Mainz, Germany)饮用。含有饱和H2的新鲜水的生物物理性质显示(1)H2浓度,0.78 mM,(2)pH 7.43∼7.76,和(3)ORP -462至-511 mV。24小时后,这些值被测量为(1)H2浓度,0.39∼0.42 mM,(2)pH 7.34∼7.63,和(3)ORP -388∼-420 mV。每天准备新鲜的DSS溶液,加或不加氢气,以及仅含氢气的水。接下来7天内每天监测小鼠以测量体重和结肠炎评分。7天后,牺牲小鼠并收集结肠组织。结肠在最靠近回盲瓣和直肠的两个位置被移除,并测量长度。远端和近端结肠的部分(1 cm)被固定并嵌入OCT复合物用于组织学分析。剩余部分的结肠被称重并在液氮中冷冻用于检测细胞因子。
结肠炎评分。在DSS诱导期间,由经过训练且对治疗组别不知情的人员每天进行结肠炎评分。第0天确定基线结肠炎评分。简而言之,没有体重减轻的评分为0;从基线开始体重减轻1-5%的评分为1;5%至10%的评分为2;10%至20%的评分为3;超过20%的评分为4。对于粪便的一致性,成形良好的粪便得分为0,糊状半成形的粪便不粘附于肛门的得分为2分,液体粪便粘附于肛门的得分为4分。对于出血情况,无血的评分为0,隐血试验阳性的评分为2分,明显出血的评分为4分。这些分数相加后除以三,得出的总临床评分范围从0(健康)到4(结肠炎最大活动度)。
组织学评估。横结肠远端部分的组织切片(8μm)用苏木精和伊红(H&E)染色。根据炎症的数量和深度以及隐窝再生或损伤的程度进行组织学评分。简而言之,评分如下:(1)炎症数量:无,0;轻微,1;中度,2;重度,3(2)炎症深度:无,0;粘膜,1;粘膜和粘膜下层,2;全层,3(3)隐窝损伤:无,0;基底1/3受损,1;基底2/3受损,2;仅表面上皮完整,3;整个隐窝和上皮丢失,4。对每个特征分别评分,然后将分数相加以得出单个结肠标本的最终组织学评分。
F4/80阳性巨噬细胞的免疫荧光识别。将结肠组织切片用丙酮(50%)和甲醇(50%)的混合物固定。用抗F4/80单克隆抗体(Rat IgG2b, AbD Serotec, Oxford, UK)结合生物素染色结肠中的巨噬细胞,然后用FITC-Avidin(BD Pharmingen, San Diego, CA)显色。使用与生物素结合的无关大鼠单克隆抗体(BD Pharmingen)作为对照。使用Leica TCS/SP-2激光扫描共聚焦显微镜在×400倍放大下分析染色模式。
ELISA。将横切的结肠组织用含有0.05% Tween 20、苯甲基磺酰氟(1 mM; Sigma, St. Louis, MO)和蛋白酶抑制剂混合物(Sigma)的PBS用Dounce玻璃匀浆器均质化,然后以18,000 rpm离心10分钟。所得上清液用于ELISA测定TNF-α(Mouse TNF-α ELISA MAX™ Set, Biolegend, San Diego, CA),IL-1β或IL-12p40(Murine ELISA Development kit, Peprotech, Rocky Hill, NJ)。
结果
吸入H2气体可以抑制由同基因小肠移植介导的缺血再灌注引起的小肠氧化依赖性组织损伤。这表明通过气体给药可以达到小肠,但尚不清楚口服H2溶解水是否会影响结肠中H2的浓度。其效果取决于肠道细菌产生或吸收的H2与外源性供给的H2之间的相互作用。因此,监测了口服H2饱和水后小鼠胃(图1A)和结肠(图1B)中H2浓度的时序变化。在5分钟时测量,胃中的H2浓度为503.8±160.3μM,迅速降至10分钟时的200.8±106.6μM,并在60分钟时返回基线水平。相比之下,结肠中的H2浓度逐渐增加,在30分钟时达到最高值88.0±26.5μM,然后在60分钟时返回基线水平58.0±15.1μM。如图1所示,经口服用的H2似乎增加了结肠中已存在的H2浓度,这可能是通过跨上皮扩散和基于血管的运输过程的组合实现的。(这个结果说明,至少在大鼠身体上,喝水后氢气能保持一定浓度达到大肠)
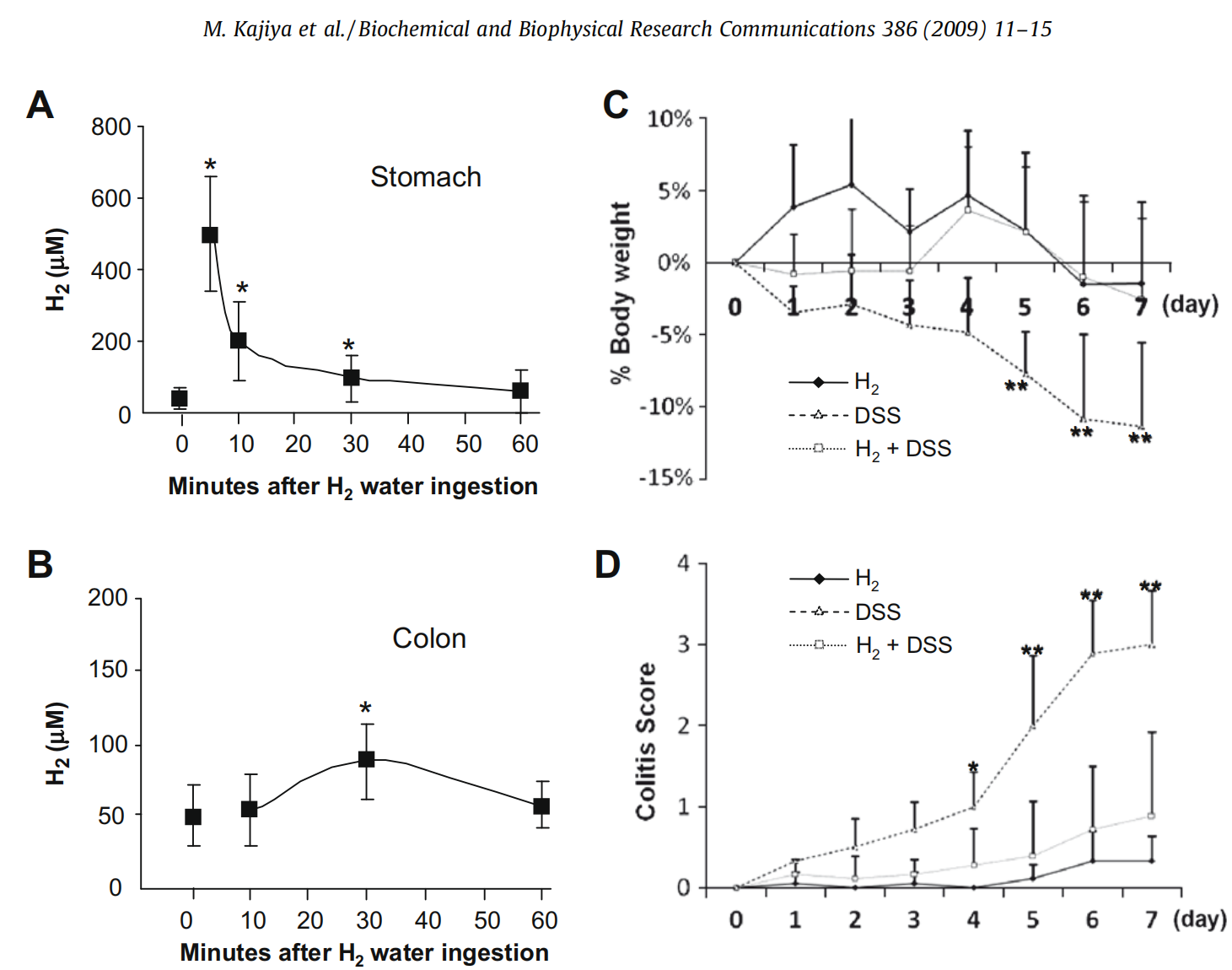
图1. 氢气(H2)对BALB/c小鼠DSS诱导结肠炎临床特征的影响。监测了给小鼠口服饱和氢水后胃(A)和结肠(B)中氢气浓度的时序变化(每个时间点n=5)。用Popper®喂食针将饱和氢气的蒸馏水(0.78 mM,ORP = -511 mV,pH 7.67)应用于小鼠(每只小鼠1ml)。在每个组的动物被处死后立即测量胃和结肠中液体物质的氢气浓度。为了检查氢气对DSS诱导结肠炎的影响,单独给予0.78 mM氢气水或含有或不含氢气水的5% DSS给小鼠(8周龄雄性,每组n=6)随意饮用7天。每天测量体重百分比变化(C)和结肠炎评分(D)。单独氢气水(♦)、单独5% DSS水(□)和含氢气的5% DSS水(△)的数据点和条形图表示平均值±标准差。∗p<0.05, ∗∗p<0.01: 与同一测量日仅接受DSS的对照组相比,值具有显著差异(t检验)。
为了研究氢气对IBD发展的可能预防效果,测试了氢气对BALB/c小鼠DSS诱导结肠炎的影响。连续给予DSS 5天后,观察到小鼠显著的体重减轻,持续到第7天动物被处死时(图1C)。相比之下,接受含有氢气的DSS溶液或单独氢气水的BALB/c小鼠没有体重减轻(图1C)。仅接受DSS的小鼠的结肠炎评分随时间增加,直到第7天。特别是,从第4天到第7天,单独供应DSS的小鼠与接受含氢气的DSS溶液的小鼠之间的结肠炎评分存在显著差异(图1D)。相比之下,接受对照常规水和溶解有氢气的水的小鼠之间没有显著差异(图1B)。这些数据表明,口服给予的氢气可以抑制DSS诱导结肠炎的发生。
根据第7天采样的结肠的宏观检查,单独给予DSS引起显著的结肠收缩(图2A)。相反,DSS溶液中的氢气防止了收缩。值得注意的是,单独氢气水对结肠长度没有任何影响(图2A)。如图2B所示,由DSS引起的结肠长度减少通过补充含氢气的DSS溶液而被抵消,两种变化都具有统计学意义。
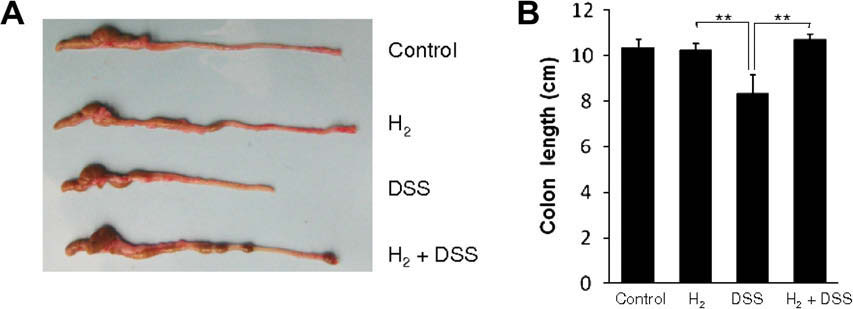
图2. 氢气介导的缓解DSS诱导的结肠收缩。为了评估结肠炎的严重程度,给予小鼠常规水、单独的0.78 mM氢气水或含有或不含氢气水的5% DSS 7天后测量结肠长度。(A)显示了用常规水(对照)、含氢气水(氢气)、5% DSS水(DSS)和含氢气的5% DSS水(氢气+DSS)处理的小鼠分离出的结肠的典型宏观特征。(B)描绘了第7天各组结肠长度的平均值±标准差。∗∗p<0.01: 括号指示的组间值具有显著差异(t检验)。
基于组织化学分析的结果(图3),单独用DSS处理的小鼠结肠组织切片的特征是粘膜中有炎症细胞浸润和上皮广泛损伤以及隐窝破坏(图3B和E)。值得注意的是,接受含氢气的DSS溶液的小鼠组织切片显示炎症减轻,表现为粘膜中炎症细胞浸润减少和上皮及隐窝结构得到保护(图3C和F)。此外,用对照常规水或单独氢气水处理的小鼠组织切片未显示炎症迹象(对照水,图3A和D;氢气水,数据未显示)。因此,用DSS和水中的氢气处理的小鼠的组织学评分显著低于仅用DSS处理的小鼠(图3G)。因此,氢气似乎通过调节炎症反应影响了小鼠对DSS诱导结肠炎的易感性。
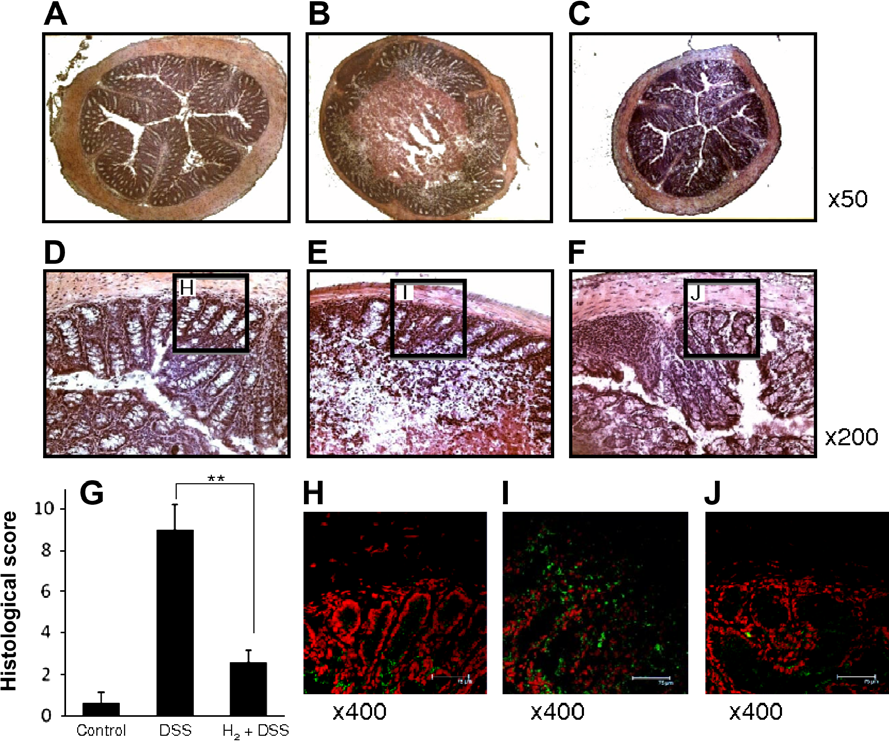
图3. 氢气的给予减轻了DSS诱导结肠炎的病理生理结果。为了评估结肠腺窝的组织学损伤,对照组常规水或含5% DSS的水溶液,无论是否含有氢气(0.78 μM),都被给予了小鼠7天。在第7天牺牲的小鼠中取样的结肠切片用H&E染色。(A-F)显示了用对照组常规水(A和D)、单独5% DSS水(B和E)以及含有氢气的5% DSS水(C和F)处理的小鼠的典型组织切片,放大倍数如图所示。(A-C)原始放大倍数×50;(D-E)原始放大倍数×200。(G)如材料和方法中所述对组织学评分进行分级。数据是每组五只小鼠的平均值±标准差。∗∗p<0.01:括号中指示的组间值具有显著差异(t检验)。(H-J)结肠上皮和粘膜中浸润的巨噬细胞用与生物素结合的抗F4/80 MAb染色,随后用FITC-avidin染色,然后用碘化丙啶进行核染色。接收对照组常规水(H)、单独5% DSS水(I)和含有氢气的5% DSS水(J)的小鼠的结肠切片如图所示。荧光染色是在D-F的连续切片上进行的。H-J中所示的荧光成像的相应位置在D-F的HE染色图像中用方框标出。
氢气溶解在DSS溶液中可能直接影响DSS的生化活性,从而导致DSS诱导结肠炎的病理生理结果减弱。为了排除这种可能性,通过腹腔注射(i.p.)给予接受口服DSS溶液的小鼠林格氏溶液中的氢气(H2, 0.78 mM; 每天每只小鼠1 ml)(H2-ip + DSS-po组)。作为阴性对照,接受口服DSS溶液的小鼠应用无氢林格氏溶液(每天每只小鼠1 ml, [i.p.])(对照组DSS-po组)。在第8天,比较了这两个组的临床结果如下:体重(−3.40±3.02%和−9.42±6.74%;t检验;P<0.05);结肠炎评分(0.944±1.04;DSS-po和2.77±0.86%;t检验;P<0.01);以及结肠长度(10.35±0.59和7.13±2.08 cm;t检验;P<0.01),分别为。因此,即使氢气是通过与DSS给药途径不同的途径(i.p.)给予的,氢气仍然显著预防了DSS诱导的结肠炎的发生,这表明氢气介导的减轻DSS诱导结肠炎的病理生理结果是与氢气对结肠中存在的组织和细胞的作用有关。
DSS造成的粘膜屏障破坏被认为是将固有层暴露于腔内细菌抗原,反过来,这会招募并激活包括中性粒细胞和巨噬细胞在内的先天免疫细胞[8],[9]。据报道,结肠粘膜中F4/80阳性巨噬细胞浸润的增加与小鼠DSS诱导结肠炎的严重程度相关[25]。因此,我们通过免疫荧光显微镜监测F4/80阳性巨噬细胞浸润的存在,以确定氢气给药的效果。与对照小鼠相比(图3H),仅接受DSS的小鼠结肠中观察到F4/80阳性巨噬细胞浸润显著增加(图3I)。然而,DSS溶液中加入氢气具有抑制作用(图3J),表明氢气减少了先天免疫巨噬细胞迁移到结肠粘膜中。
为了检查DSS给药引起的结肠促炎细胞因子表达受氢气水影响的情况,使用ELISA评估了结肠组织匀浆中存在的IL-1β(图4A)、IL-12(图4B)和TNF-α(图4C)。仅接受DSS的小鼠结肠组织中这些促炎细胞因子水平的增加被加入氢气显著抑制,而单独氢气水不影响任何测试的细胞因子水平,表明氢气介导的减轻DSS诱导结肠炎的病理生理结果似乎来源于氢气对炎症反应的下调。
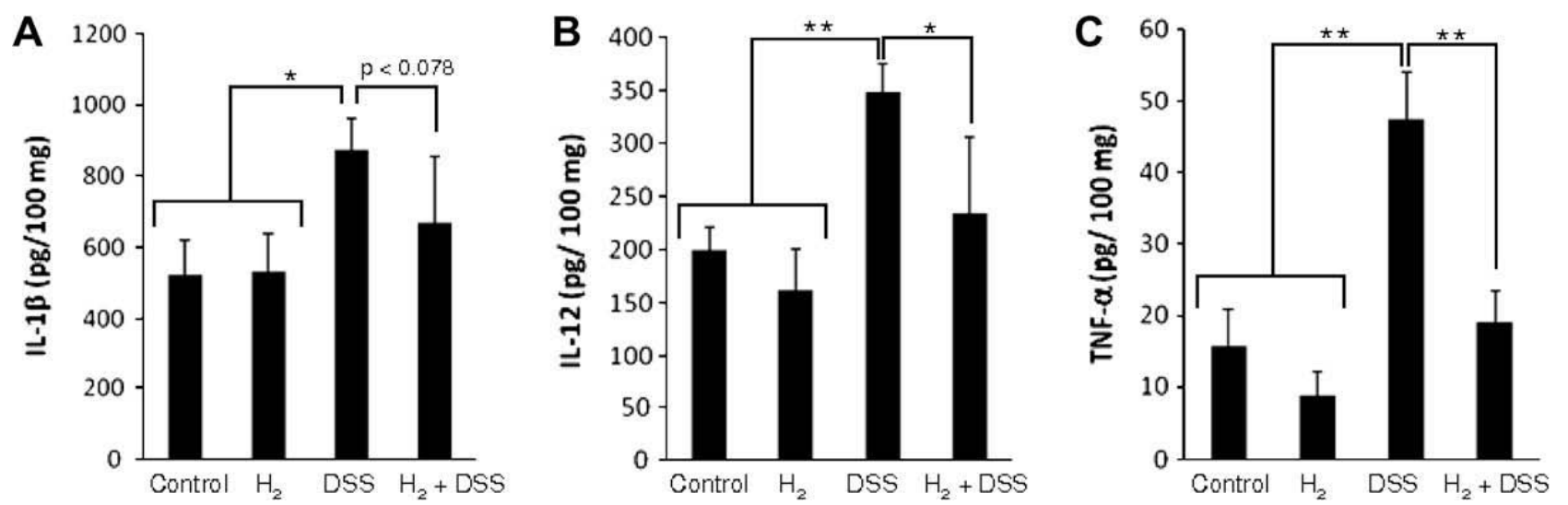
图4. 氢气对DSS诱导结肠炎小鼠结肠中产生的促炎细胞因子的影响。为了调查氢气水是否抑制了DSS引起的炎症细胞因子产生,对整个结肠组织匀浆进行了ELISA分析。(A-C)从用对照常规水(Control)、氢气水、单独5% DSS水(DSS)或含氢气的5% DSS水(H2+DSS)处理7天的牺牲小鼠中取样的结肠组织匀浆。通过ELISA定量结肠组织匀浆中的IL1-β(A)、IL-12(B)和TNF-α(C)。数据为每组三只小鼠的平均值±标准差。∗p<0.05, ∗∗p<0.01: 括号中指示的组间值具有显著差异(t检验)。
讨论
本研究证明了氢气可以通过下调促炎细胞因子的表达以及抑制结肠病变中巨噬细胞的浸润来减轻DSS诱导的结肠炎。氢气的给药显著减少了DSS诱导结肠炎的临床症状,即体重减轻、粪便可见血液和腹泻、结肠炎评分以及结肠长度缩短。组织病理学评估进一步支持了氢气预防DSS介导的上皮隐窝结构破坏的效果。因此,这是第一个证明氢气可以抑制包括IL-1β、IL-12和TNF-α在内的组织破坏性促炎细胞因子在结肠中的产生的研究。
然而,活性氧(ROS)可以通过上调NF-κB信号通路来激活TNF-α表达,同时,它还可以激活NADPH氧化酶(NOX)的表达,该酶从NADPH产生ROS。因此,炎症和氧化过程是相互关联的。ROS与促炎介质之间的这种复杂交叉反应表明,氢气介导的促炎细胞因子抑制作用,如在DSS诱导的结肠炎中所表现的,可能也涉及氢气的抗氧化作用。尽管如此,由于已建议各种炎症介质,特别是IL-1β、IL-12和TNF-α,参与人类和小鼠结肠炎的发病机制和恶化,氢气对这些细胞因子的抑制似乎在减轻DSS诱导的结肠炎中发挥了作用。
此外,氢气的给药似乎抑制了巨噬细胞的活化,因为接受DSS的小鼠中F4/80阳性巨噬细胞的迁移被氢气显著抑制(图3)。巨噬细胞也是人类IBD中产生促炎细胞因子的主要炎症细胞之一。在体外用LPS刺激下,RAW264.7细胞(一种小鼠巨噬细胞系)表达TNF-α的能力被溶解在培养基中的氢气显著抑制(未发表数据)。因此,假设氢气介导的减轻DSS诱导的结肠炎源于氢气对响应于腔内细菌抗原(如LPS)的巨噬细胞活化的抑制作用。
https://blog.sciencenet.cn/blog-41174-1442556.html
上一篇:极限户外技能增强科学考察工作
下一篇:宠物同情主人是和人类共同进化的结果