博文
细菌通过氢气影响肠道激素代谢《细胞》
||
该研究非常明确地证明,氢气是甾体激素21去羟基化酶的底物,虽然这种酶在动物和人的细胞内没有,但这种酶的同工酶或类似酶应该存在,那么这种同工酶就可能是我们希望找到的氢气效应分子。利用21-去羟基化作为工具,研究氢气在这个酶活性中的作用方式,本身也可以有利于我们寻找氢气目标分子的参考,因为这个酶已经初步确定就是一种细菌的氢气效应分子。
对氢气使用的影响。孕妇能否使用氢气,这一研究不能给出肯定答案,至少需要进一步研究,要了解补充氢水等方式是否会干扰这种内分泌通路,是促进还是抑制,当然初步估计是促进。那么促进这一通路对孕妇和胎儿是否有不良作用,这都需要研究来回答。由于孕妇一般不会出现孕激素过量,但会出现孕激素不足的问题,且孕激素不足可能是黄体功能不全、先兆流产、甲状腺功能减退等因素导致的,孕妇可以通过吃富含植物雌激素的食物、口服黄体酮药物等方式进行治疗。因此我们可以推测,孕激素水平改变可能是正面影响,当然是最好的,但为了慎重考虑,仍然需要进一步研究。
本研究的重点是细菌21脱羟酶,氢气是这种酶的底物,虽然具体作用的分子过程仍然不了解,但这种现象就足够重大。我们知道羟化酶,本质是氧化酶,在生物体系中具有非常重要的作用。例如低氧诱导因子的脯氨酸羟化酶就是氧气感受器,类似的脯氨酸羟化酶也是胶原蛋白代谢的核心分子。羟基化和脱羟基是逆过程,但真核细胞似乎只有羟化,没有发现脱羟化,这显然并不自然。本研究证明了脱羟基过程可用氢气作为辅基,和羟化酶用氧气作为辅基,氧气氧化,氢气还原,是天然特征,生物系统巧妙地利用了这两种分子,实现对目标分子的氧化和还原。这是自然之美的体现。
McCurry MD, D'Agostino GD, Walsh JT, Bisanz JE, Zalosnik I, Dong X, Morris DJ, Korzenik JR, Edlow AG, Balskus EP, Turnbaugh PJ, Huh JR, Devlin AS. Gut bacteria convert glucocorticoids into progestins in the presence of hydrogen gas. Cell. 2024 May 21:S0092-8674(24)00514-2.
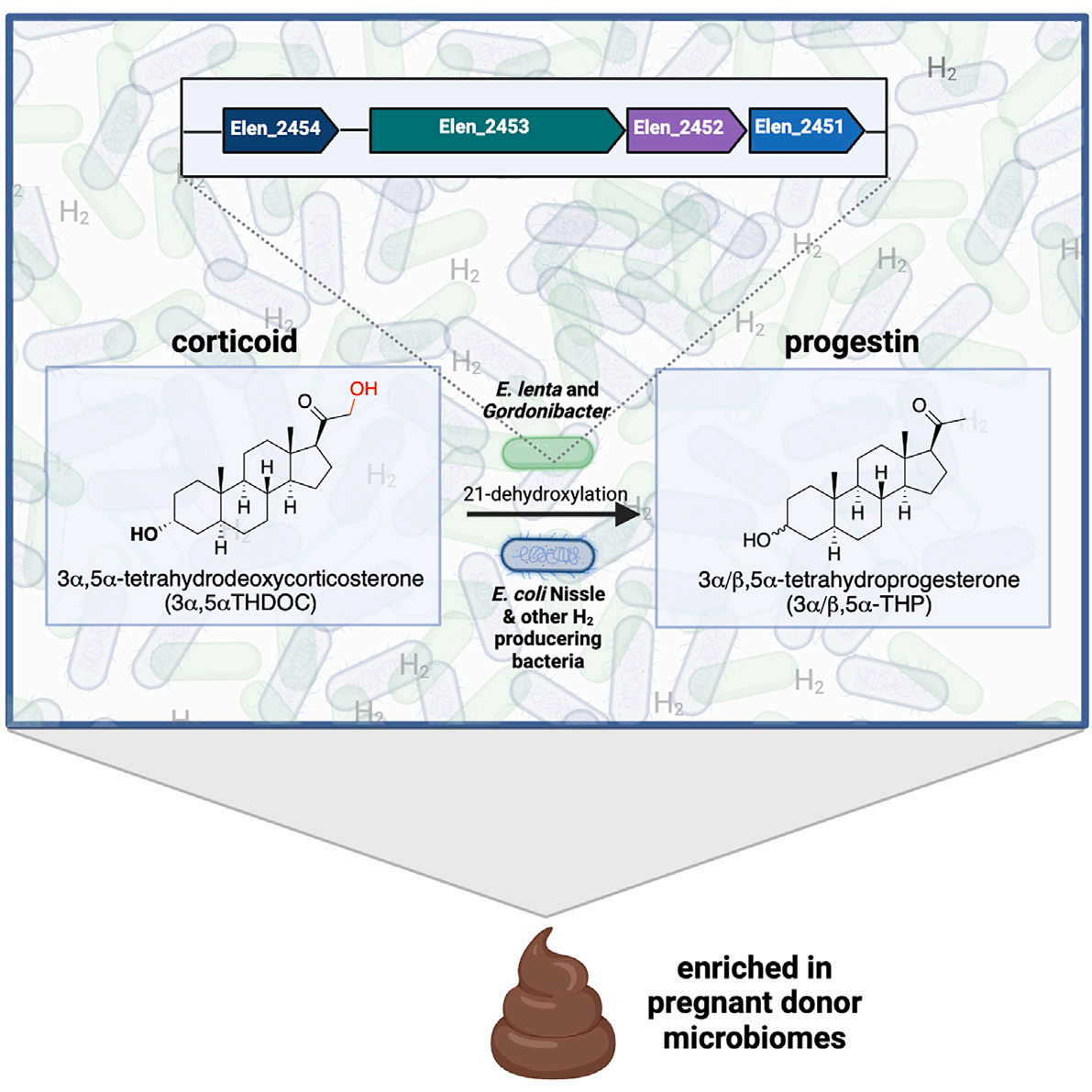
最近的研究表明,人类相关细菌与宿主产生的类固醇相互作用,但这种相互作用的机制和生理影响仍不清楚。在这里,我们表明人类肠道细菌 Gordonibacter pamelaeae 和 Eggerthella lenta 通过 21-脱羟基化将丰富的胆汁皮质激素转化为孕激素,从而将一类免疫和代谢调节类固醇转化为一类性激素和神经类固醇。使用比较基因组学、同源表达和异源表达,我们鉴定了进行 21-脱羟基化的细菌基因簇。我们还发现了肠道共生体产生氢气在促进21-脱羟基化方面的意想不到的作用,这表明氢调节肠道中的次级代谢。某些细菌性孕激素的水平,包括别孕酮,更广为人知的是brexanolone,一种FDA批准的产后抑郁症药物,在孕妇的粪便中显着增加。因此,细菌将皮质激素转化为孕激素可能会影响宿主生理机能,特别是在怀孕和妇女健康的情况下。
一、前言
肠道细菌直接作用于宿主生理,并在人类健康和疾病中扮演重要角色。同样地,类固醇激素调节关键生理过程,包括代谢和应激反应、性发育和生殖、盐和水的平衡以及行为。(肠道菌群和类固醇代谢激素对人类健康极其重要)
最近的研究表明,肠道细菌组成与宿主表型以及性别和应激相关的类固醇激素水平之间存在相关性。人类的肠道微生物组在青春期和怀孕期间发生变化,多囊卵巢综合征(PCOS)女性的雄激素过量与肠道微生物多样性的减少有关。也有报道指出,肠道细菌与类固醇调节的宿主表型之间存在因果关系。例如,使用抗生素清除微生物群可以解决大鼠中的皮质酮诱导的高血压,引入人类共生细菌乳酸杆菌可以减少应激诱导的皮质酮水平并限制小鼠的抑郁样症状。然而,肠道细菌如何化学修饰类固醇以及由此产生的代谢物如何影响宿主健康仍然不清楚。
尽管循环血液中类固醇研究比较充分,但许多这些化合物也分泌到胆汁中进入胃肠(GI)道,在那里它们可能受到常驻微生物群的次级代谢作用。这些代谢物然后可以与宿主受体相互作用,无论是局部还是全身,从而影响宿主功能。
大多数进入胆汁的类固醇是硫酸化或葡萄糖醛酸化的。细菌拥有葡萄糖醛酸酶和硫酸酶,它们将类固醇解离成自由形式以进行进一步的化学修饰。肠道细菌对类固醇的其他转化也已观察到,包括水解、酯化、脱羟基、脱氢、芳构化和侧链裂解。因为已知类固醇结构的微小变化会导致激素功能的巨大变化,这些细菌修饰很可能会改变这些分子的活性。同样,由于类固醇非常有效,纳摩尔或更低数量的这些分子可能会对宿主受体和下游过程产生显著影响。
在这里,我们关注肠道细菌将糖皮质激素转化为孕激素的过程。糖皮质激素是一类结合糖皮质激素受体(GR)的皮质类固醇,从而调节葡萄糖代谢和免疫系统功能方面,包括炎症。相比之下,孕激素既作为性激素,调节月经周期和怀孕,又作为神经类固醇,通过调节诸如γ-氨基丁酸(GABA)受体和N-甲基-D-天冬氨酸(NMDA)受体等神经活性受体发挥作用。据报道,大鼠和人类的粪便浆液可以通过还原去除C21羟基团的过程将糖皮质激素转化为孕激素,这个过程称为21-脱羟基化。以前的工作确定,来自常规大鼠的粪便含有孕酮醇但没有皮质类固醇(21-羟基化类固醇),而来自无菌(GF)大鼠的粪便含有皮质类固醇但没有孕酮醇,这进一步表明肠道中的孕激素形成依赖于微生物群。(基础:细菌帮助类固醇转化,产生孕激素是几十年前就明确的结论,当时采用有和无的证据,当然检测技术灵敏度分辨率的限制,显然相对粗糙。)
这种将一类免疫和代谢调节类固醇转化为一类性激素和神经类固醇的引人注目的转换机制及其潜在的生理影响尚不完全了解,尽管有一些有趣的线索。微摩尔量的糖皮质激素四氢可的松(THB)和四氢去氧可的松(THDOC)存在于健康人类的胆汁中。在孕妇中,这些代谢物的胆汁水平高出5到10倍(这是现象,为什么会这样,是因为孕妇血液中这类激素水平高?)。一旦分泌到肠道,这些细菌可以化学修饰糖皮质激素以产生不同的代谢物集合,包括孕激素。一些潜在的细菌产物是生物活性化合物。例如,神经类固醇异丙诺龙(3α5α-四氢孕酮,或3α5αTHP)和异异丙诺龙(3β5α-四氢孕酮,或3β5αTHP)不存在于GF小鼠血清中,但在常规、特定无病原体(SPF)小鼠血清中存在。目前,异丙诺龙是FDA批准的治疗产后抑郁症的治疗方法,异异丙诺龙正在临床试验中用于治疗图雷特综合症。这些数据表明,微生物群在产生这些神经活性孕激素代谢物中发挥作用。肠神经系统(ENS)遍布整个胃肠(GI)道。因此,有可能神经活性孕激素能够调节膜结合GABA和NMDA受体在接触肠道的感觉神经元中的活动,从而影响宿主中的神经信号传导路径。
21-脱羟基化尚未在真核生物中观察到,这表明这种酶活性完全由微生物执行。在这里,我们调查了肠道微生物群如何执行还原性的21-脱羟基化并将人类胆汁中的丰富糖皮质激素,特别是THDOC,转化为孕激素,特别是四氢孕酮(THPs)。受到我们在最终三个月孕期的人的粪便中发现THPs水平比非孕期人高两个数量级的初步观察的启发,我们揭示了微生物群形成THP的机制。我们展示了人类肠道细菌Gordonibacter pamelaeae和Eggerthella lenta将3α5αTHDOC转化为THPs。值得注意的是,我们还发现氢气(H2)气体的产生是必要且足以促进强烈的21-脱羟基化。我们的结果表明,由肠道细菌产生的主要气体H2,可以促进高度还原的代谢和肠道微生物群产生次级代谢物。我们使用比较基因组学以及同源和异源表达来识别在THP产生菌株中的一个基因簇,该基因簇负责体外和体内在共培养的GF小鼠中的21-脱羟基化活性。此外,我们发现含有该基因簇的细菌在晚期妊娠期间增加。总的来说,这些研究揭示了肠道细菌如何将一类宿主产生的类固醇转化为另一类具有不同生物学功能的类固醇的机制。它们还为未来研究细菌孕激素生产如何影响宿主生理,特别是在妊娠期间和之后奠定了基础。
二、研究结果
1、人类和小鼠的微生物组将胆汁中的糖皮质激素3α5αTHDOC进行21-脱羟基化
为了研究21-脱羟基化,我们首先需要开发分析化学方法来定量复杂基质中的类固醇。先前研究中应用的方法需要大量的材料(例如,5-50毫升的胆汁)并依赖于涉及提取、化学去结合、树脂基纯化、衍生化和气相色谱质谱联用(GC-MS)的复杂工作流程。在我们手中,化学衍生化通过GC-MS导致代谢物浓度的批次间变异。为了克服这些方法呈现的重大技术障碍,包括与水的不兼容性,我们开发了一种基于超高效液相色谱(UHPLC)的方法来定量生物流体和组织中的糖皮质激素和孕激素。通过使用大气压力化学电离(APCI)更有效地电离中等至低极性化合物,离子阱质量分析仪(Orbitrap),以及单离子监测(SIM)和串联质谱(MS/MS)质谱联用(UHPLC-MS/MS),我们能够在复杂基质中和有限样本量(例如,100毫升的人胆汁)中定量感兴趣的类固醇,实现的检测极限(LODs)比在GC-MS上低两个到三个数量级。重要的是,我们的方法能够分离皮质类固醇和孕激素异构体,允许在生物样本中分别定量THDOC和THP异构体。
使用我们的UHPLC-MS/MS方法,我们试图证实肠道中21-脱羟基化产物的存在依赖于微生物组(作者为什么会试图证实这个过程?)。我们发现,与SPF雌鼠相比,GF雌鼠粪便中的THP总水平显著降低(图1A),这与早期关于GF大鼠的报告一致。然后我们使用这些方法通过针对人胆汁的皮质类固醇剖面来确定21-脱羟基化的生理相关底物(图1B)。3α5αTHDOC和3α5βTHDOC是胆汁中丰富的皮质类固醇,并且其平均浓度高于3β5αTHDOC、3β5βTHDOC、11-脱氢皮质酮和皮质酮(图1B)。人胆汁中皮质类固醇和小鼠粪便中THPs的生物学变异与先前分别在人胆汁和粪便中的报告一致。这些数据表明,肠道细菌暴露于生理相关浓度的3α5αTHDOC和3α5βTHDOC。
据报道,在孕妇的胆汁中以微摩尔浓度存在3α5αTHDOC(在胆囊胆汁的单硫酸盐和双硫酸盐部分中为12-52 mM)。由于3α5αTHDOC的21-脱羟基化产物在妊娠和女性健康背景下的潜在生物活性,我们选择专注于这种皮质类固醇进行我们的研究(从生物学效应角度考虑)。我们假设3α5αTHDOC可以被21-脱羟基化为3α5αTHP或别孕烯诺龙。或者,3α5αTHDOC可以通过3α-羟基类固醇脱氢酶(3α-HSDH)和3β-羟基类固醇脱氢酶(3β-HSDH)的顺序作用在C3位置发生异构化,形成3β5αTHDOC。然后这个化合物可以被21-脱羟基化形成3β5αTHP(异别孕烯诺龙)。最后,两种THP异构体可以通过3α-HSDH和3β-HSDH的作用相互转换(图1C)。
为了测试肠道细菌是否可以将3α5αTHDOC转化为THPs,我们在3α5αTHDOC存在下培养了来自怀孕的GF和SPF小鼠的粪便,并使用UHPLC-MS(SIM模式)和针对性的UHPLC-MS/MS测定了孕激素产生。我们观察到SPF怀孕小鼠粪便浆料中产生了大量的3α5αTHP和3β5αTHP,而来自怀孕的GF小鼠的粪便浆料没有产生THPs(图1D)。这些结果表明,雌性小鼠的微生物群落执行21-脱羟基化。接下来,我们检测了来自健康人类受试者的微生物群落的21-脱羟基化活性。所有三个来自女性捐赠者的粪便培养都产生了THPs(图1E)。来自健康男性人类粪便的四个微生物群落中的三个也对3α5αTHDOC进行了21-脱羟基化(图1F)。
这些结果表明,小鼠和人类的肠道细菌都可以将3α5αTHDOC 21-脱羟基化为产生孕激素。THPs在孕妇捐赠者的粪便中富集,几种THP异构体调节GABAA受体活性。此外,低血清水平的3α5αTHP与较高的产后抑郁症发生率相关联。肠道细菌产生的21-脱羟基化代谢物可能通过局部作用于胃肠道的受体并向肠外组织发送信号,或者通过进入全身循环并调节肝肠轴外的受体来影响宿主。
尽管在怀孕、产后和非孕期人群中血液中报告了THPs的水平,但这些代谢物在妊娠期间人类胃肠道中的浓度尚未进行研究。因此,我们对来自17名非孕捐赠者和7名晚期妊娠捐赠者的粪便进行了针对性的类固醇剖面分析。引人注目的是,与男性和非孕期女性受试者的粪便相比,第三孕期孕妇的粪便中THP水平高两个数量级(图1G)。也检测到了孕酮和孕烯醇酮,尽管浓度要低得多(图S1)。这些发现表明,孕妇的粪便中有高水平的THPs(大约是低微摩尔浓度)。
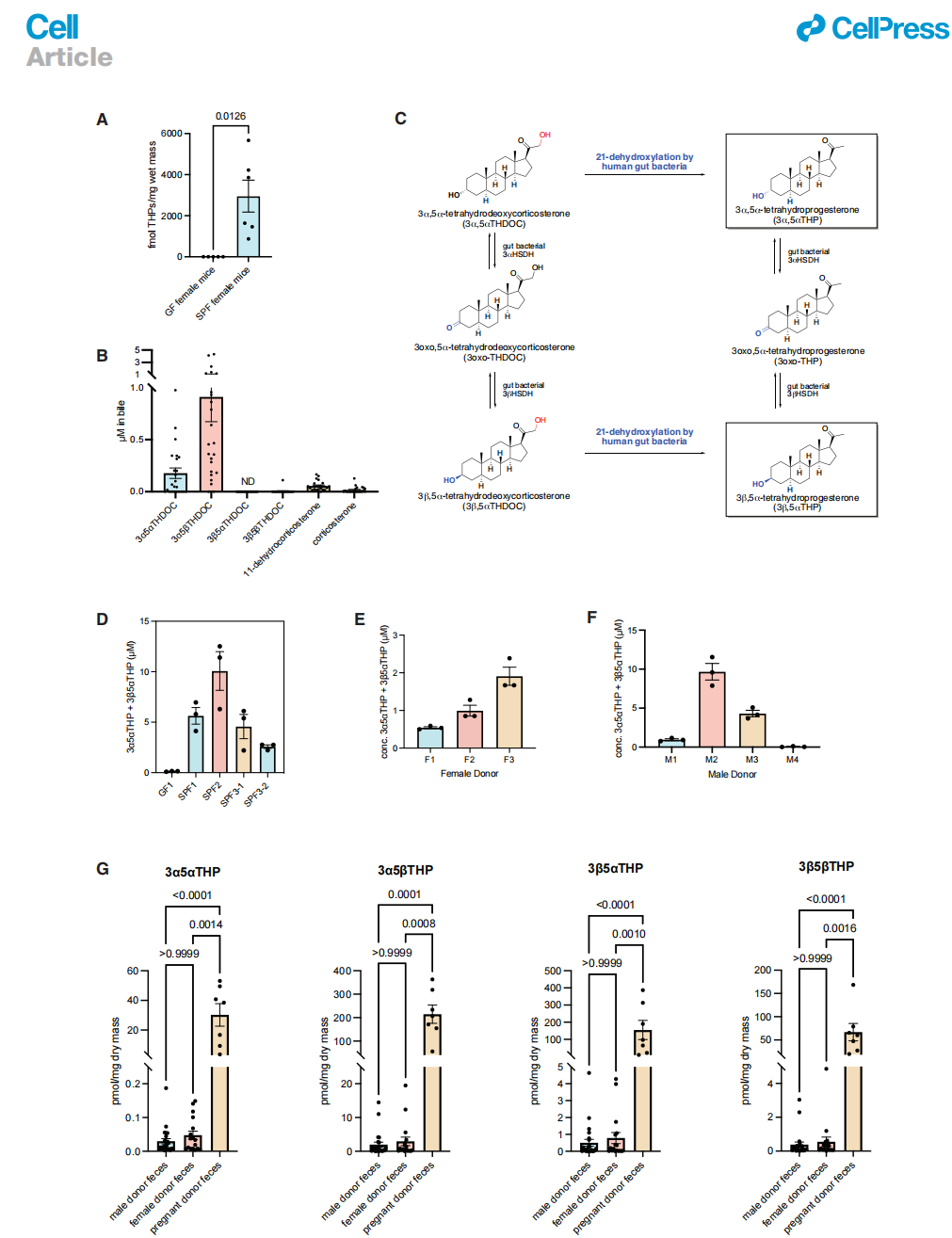
图 1. 类固醇分析揭示肠道微生物组和怀孕状态影响胃肠道中的孕激素水平。(A)SPF(无特定病原体)C57BL/6雌性小鼠的粪便中THP(四氢孕酮)的浓度高于GF(无菌)小鼠(每组分别有5只和6只GF和SPF雌性小鼠,采用Welch's t检验)。(无菌小鼠四氢孕酮水平低,有和无的差异,说明肠道细菌是影响孕激素的重要因素)(B)患有原发性硬化性胆管炎(PSC)或胆道狭窄的患者的胆汁中皮质类固醇3α5αTHDOC、3a5bTHDOC、3β5αTHDOC、3β5βTHDOC、11-脱氢皮质酮和皮质酮的浓度(n = 24个样本,每个患者一个样本)。(C)从丰富的胆汁类固醇3α5αTHDOC形成3α5αTHP(异孕烯醇酮)和3β5αTHP(异异孕烯醇酮)的提议途径。HSDH,羟基类固醇脱氢酶。(D)SPF怀孕雌性小鼠的粪便匀浆对3α5αTHDOC进行了21-去羟基化,而GF雌性小鼠的粪便匀浆没有显示这种活性。粪便匀浆与3α5αTHDOC孵育48小时。通过UHPLC-MS(超高效液相色谱-质谱)量化THP的形成(每个粪便丸剂3个生物重复,测试了SPF小鼠3的两个粪便丸剂)。(E和F)来自健康女性(E)和男性(F)的人类粪便培养池对3α5αTHDOC进行了21-去羟基化。粪便与3α5αTHDOC孵育7天,并通过UHPLC-MS量化THP的形成(每位捐献者3个生物重复)。(G)来自怀孕人类捐献者的粪便中THP的水平显著高于未怀孕人类的粪便(n = 24个男性样本,17个非怀孕女性样本,7个怀孕样本,采用Kruskal-Wallis检验和Dunn's多重比较检验)。所有数据均以平均值±SEM表示。
2、Gordonibacter和Eggerthella物种将3α5αTHDOC 21-脱羟基化
鉴于THPs的潜在生理意义,我们寻求识别执行21-脱羟基化的细菌。在现代遗传学出现之前的早期工作中,已经分离出一种21-脱羟基化分离株,“培养物116”,暂时鉴定为与细菌Eubacterium lentum相似的物种。没有确定这个分离株是包含单一菌株还是混合菌株,并且由于没有将其存入培养物集合中,这个分离株随后丢失了。此外,由于当时还没有遗传工具,负责的基因没有被鉴定出来。Eubacterium lentum物种后来被重新命名为Eggerthella lenta。我们测试了几种E. lenta菌株(E. lenta DSM 2243, DSM 15644, Valencia和A2)的21-脱羟基活性,但没有观察到THP的形成。因此,我们寻求从人类粪便微生物群落中分离和表征一个21-脱羟基化物种。
精氨酸(Arg)刺激E. lenta及其密切相关生物的生长。为了富集一个21-脱羟基化菌株,我们在Arg存在下培养了一个来自非孕妇女捐赠者(F3)的细菌培养物,该捐赠者的粪便从3α5αTHDOC产生了最多的THPs(图1E)。我们发现21-脱羟基化活性依赖于培养基中Arg的存在(图2A)。然后我们将培养物池的连续稀释液涂布到富含Arg(1%)的高Arg琼脂平板上(见STAR方法)。
挑选菌落没有产生活跃的21-脱羟基化菌。然而,通过将连续稀释平板分成四个象限并培养所得象限细菌池(图2B),我们发现一个来自10^5稀释平板的象限池能够将3α5αTHDOC 21-脱羟基化,而其他三个象限池显示无活性(图2C)。对四个象限进行宏基因组测序和比较分析揭示,Gordonibacter pamelaeae是唯一一个存在于活跃培养池中但未出现在三个非活跃培养池中的细菌物种(图2D)。由于G. pamelaeae在象限池中的丰度较低,作为进一步挑选菌落的替代方法,我们使用了一种正交测定法并获得了这种细菌的模式菌株,G. pamelaeae DSM 19738。这种细菌将3α5αTHDOC 21-脱羟基化为3α5αTHP和3β5αTHP,尽管水平较低(图2E)。先前的文献报道,与未指定的E. coli菌株共培养的培养物116增加了21-脱羟基化。将G. pamelaeae DSM 19738与肠道共生菌E. coli Nissle 1917(EcN)共培养导致了活性显著增加(图2E)。EcN本身无法进行21-脱羟基化,这表明它不负责这种转化。
为了确定Eggerthellaceae家族中21-脱羟基化活性的普遍性,我们测试了一个包含26种人肠道E. lenta和Gordonibacter物种的菌株库,以单培养和与EcN共培养的形式进行活性测试。尽管这些菌株在单培养中没有进行21-脱羟基化,但有12种菌株在共培养中产生了不同水平的THP(图2F)。其余14种菌株在共培养中没有产生THPs。这些结果表明,Eggerthellaceae家族的成员能够将3α5αTHDOC 21-脱羟基化,并暗示这种活性是由EcN诱导的。然而,有可能在其他更复杂的微生物群落中,其他细菌也可能有助于21-脱羟基化。由于E. lenta而非G. pamelaeae具有可用的遗传工具,我们使用E. lenta进行了后续的体外研究。
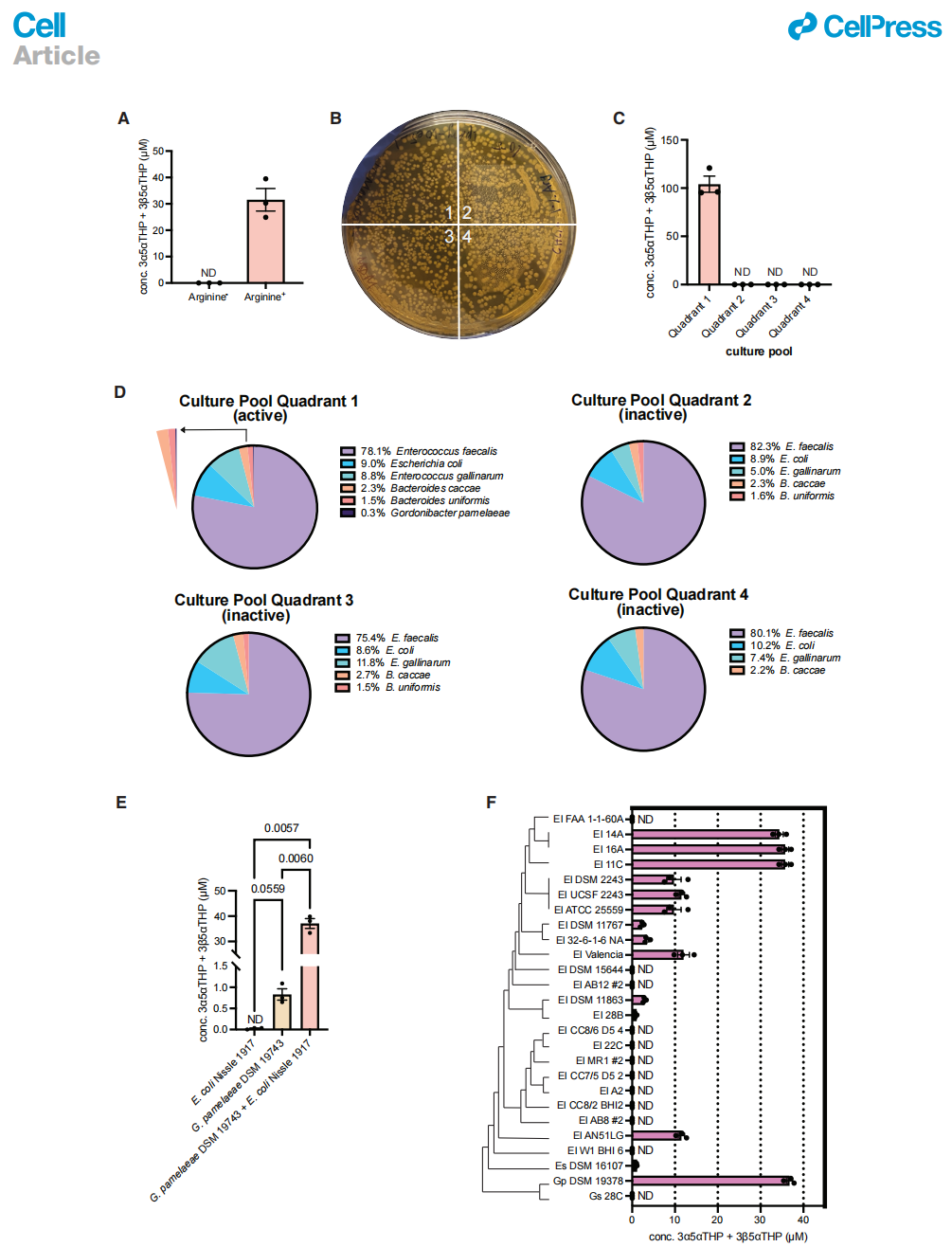
图2. 与人类相关的Gordonibacter和Eggerthella菌株对3α5αTHDOC进行21-去羟基化
(A-D)从女性捐献者F3中分离出的一个培养池在含有0.5%精氨酸的培养基中生长,并在96小时后测定3α5αTHDOC(100 mM)的21-去羟基化作用(A),(每组3个生物重复)。通过将单个连续稀释板分成四个象限来创建四个培养池(B)。象限池1进行了21-去羟基化,而池2-4缺乏这种活性(C),(每组3个生物重复)。对每个象限的比较宏基因组学分析揭示了G. pamelaeae作为一种潜在的21-去羟基化酶,因为它是活性象限中唯一存在的物种,但在非活性象限中不存在(D)。
(E)G. pamelaeae DSM 19738微弱地对3α5αTHDOC(100 mM)进行了21-去羟基化。当与E. coli Nissle(EcN)共培养时,这种活性显著增加。EcN单培养并未进行这种转化(每种条件下3个生物重复,使用Browne-Forsythe ANOVA与Dunnett's多重比较测试和Welch's校正)。
(F)对放线菌菌株库的筛选显示了在21-去羟基化活性方面的菌株水平差异。Gordonibacter和与之密切相关的E. lenta菌株在与EcN共培养时,对3α5αTHDOC进行了21-去羟基化(每种条件下3个生物重复)。N.D.,未检测到。所有数据均以平均值±SEM表示。
3、EcN产生的H2气体促进E. lenta中的21-脱羟基化
我们接下来寻求确定E. coli诱导21-脱羟基化的基础。先前的文献报道,21-脱羟基化活性与培养基还原电位(Eh)呈负相关。为了测试E. coli降低还原电位从而促进21-脱羟基化的假设,我们首先测量了有和无EcN的E. lenta 14A培养物的还原电位。与早期报告相似,共培养物的还原电位比单培养物显著更负(图S2A)。这种还原电位的差异也与21-脱羟基化活性相关,与先前的报告一致(图S2B)。为了确定较低的还原电位是否导致21-脱羟基化,我们筛选了还原性的E. lenta培养条件。首先,我们测试了钛(Ti)(III)柠檬酸盐,一种降低细菌培养基还原电位而不干扰生长的氧化还原剂。尽管Ti(III)柠檬酸盐将E. lenta 14A培养物的还原电位降低到与共培养相当的水平,但它无法促进21-脱羟基化(图S2C和S2D)。添加Oxyrase,一种去除培养基中氧化产物的酶,也没有导致21-脱羟基化(图S2E和S2F)。因此,尽管生长介质的还原电位与活性相关,但它不能使E. lenta 14A实现21-脱羟基化。
接下来,我们调查了EcN是否产生了一个促进21-脱羟基化的因素。由于微生物之间的物理相互作用可以在协同代谢过程中发生,我们对E. lenta 14A和EcN单培养和共培养进行了48小时孵育后的扫描电子显微镜(SEM)成像,这是一个我们在共培养中一致观察到21-脱羟基化的时间点。到了48小时,EcN已经进入稳定期,许多细胞已经裂解并呈现为“幽灵”细胞。相比之下,E. lenta 14A看起来是活的(图3A和3B)。在共培养中,E. lenta 14A和EcN之间没有可见的物理相互作用(图3C)。这些结果表明,两个细菌物种之间的接触并不是诱导21-脱羟基化所必需的。
为了进一步调查EcN是否释放了一种细胞外诱导因子,我们将EcN 48小时单培养物的真空过滤和注射器过滤的无菌用过的培养上清液添加到E. lenta 14A中。有趣的是,只有EcN的注射器过滤过的上清液诱导了E. lenta的21-脱羟基化(图3D)。由于溶解的气体可以通过真空过滤去除,但通过注射器过滤则不会,我们假设EcN产生了一种气体,导致E. lenta中的21-脱羟基化。
健康个体的肠道菌群每天产生0.2-1.5升气体,其中H2、二氧化碳(CO2)和甲烷(CH4)占大部分(70%-99%)体积(图S3A)。H2是人类肠道微生物产生的主要气体,并且是通过结肠中不可消化有机化合物的细菌发酵专门生成的。E. coli使用甲酸氢化酶复合体将甲酸,碳水化合物发酵中的一个中间体,转化为H2和CO2。这个复合体产生H2气体发生在负还原电位下。此外,E. coli在其生长的稳定期产生H2,这是当我们开始观察到大量21-脱羟基化的时候。此外,H2(g)抑制了E. lenta对胆汁酸的氧化,有人提出,在高H2分压下,E. lenta进行还原性代谢反应。此外,肠道微生物已知在厌氧条件下使用H2作为电子供体来驱动如硫酸盐还原和产甲烷等过程。因此,我们假设EcN在共培养中产生的H2气体促进21-脱羟基化,可能是通过提供这种高度还原性转化所需的还原等价物。
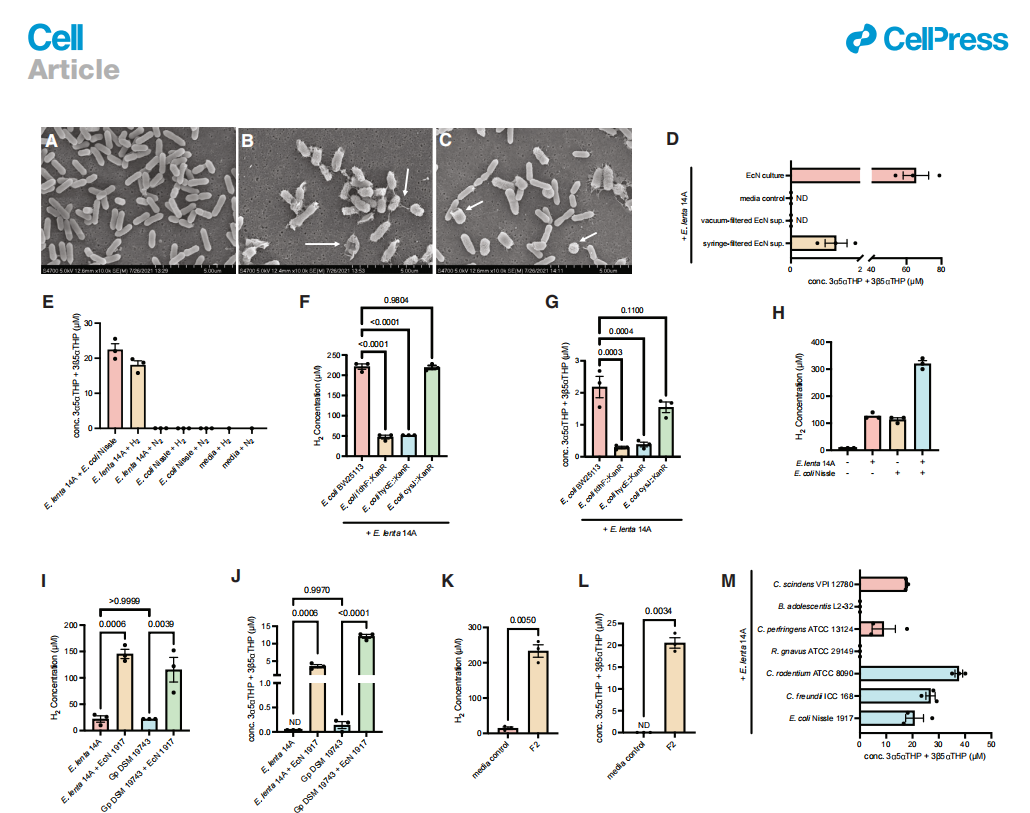
图3. 氢气是诱导E. lenta中强烈21-脱羟基化的必要和充分条件
(A-C) 通过扫描电子显微镜(SEM)成像的E. lenta 14A单培养物(A),EcN单培养物(B),以及E. lenta 14A和EcN共培养物(C)。显示了代表性图像。白色箭头指示裂解(幽灵)细胞。
(D) EcN的注射器过滤过的用过的培养上清液在7天内诱导了E. lenta 14A中的21-脱羟基化,而真空过滤过的上清液没有这种能力,这表明气体可能是诱导因素(每个条件n = 3个生物重复)。
(E) 在氢气气氛下的E. lenta 14A单培养物在72小时内将3α5αTHDOC 21-脱羟基化为与厌氧室条件下的E. lenta 14A和EcN共培养物相似程度。使用氮气作为非还原性大气对照。在氮气气氛下,没有观察到来自E. lenta 14A或EcN单培养物的21-脱羟基化活性,EcN单培养物在氢气气氛下,或在氢气或氮气气氛下的介质单独(n = 3个生物重复每个培养条件,n = 1个介质对照重复)。
(F和G) 含有氢产生途径缺失的E. coli BW25113突变株产生的氢气较少(F),并且与E. lenta 14A共培养时促进的21-脱羟基化较少
(G)比E. coli亲本菌株。在8和48小时后,分别定量了溶解H2水平和从3α5αTHDOC产生的THP产量(每个培养条件n = 3个生物重复,单向ANOVA与Dunnett多重比较测试)。
(H) E. lenta 14A和EcN在共培养中协同产生H2气体。在48小时后,量化了E. lenta 14A和EcN单培养和共培养中的溶解氢气浓度(每个条件n = 3个生物重复)。
(I和J) E. lenta 14A和G. pamelaeae DSM 19743与EcN的共培养物协同产生H2 (I)并执行21-脱羟基化 (J)(每个条件n = 3个生物重复,单向ANOVA后跟Tukey多重比较测试)。
(K和L) 来自孕妇捐赠者F2的粪便培养物在48小时内产生了H2 (K)和THPs (L)(每个条件n = 3个生物重复,Welch的t检验)。
(M) 革兰氏阳性(粉红色)和革兰氏阴性(蓝色)肠道微生物都促进了E. lenta 14A中的21-脱羟基化(每个条件n = 3个生物重复)。N.D., 未检测到。所有数据均以平均值±SEM表示。
为了测试这个假设,我们在氢气气氛下培养了E. lenta 14A。在这些条件下,E. lenta 14A单培养物表现出与E. lenta 14A和EcN共培养物相当的21-脱羟基化活性(图3E)。相比之下,在氮气气氛下生长的E. lenta 14A单培养物没有显示出21-脱羟基化活性。在氢气气氛下生长的EcN也没有进行21-脱羟基化,这进一步支持了E. lenta含有此反应的酶机制的发现。这些结果表明,氢气足以促进E. lenta中的21-脱羟基化。在大肠杆菌甲酸氢酶复合体中的关键催化蛋白是FdhF,或甲酸脱氢酶,它将甲酸转化为CO2和H+,以及HycE,它是从H+形成H2所需的电子双分叉的氢化酶催化亚基。58,62大肠杆菌Keio集合63突变株hycE::KanR和fdhF::KanR产生的H2较少58,并且在与E. lenta 14A共培养时显著减少了21-脱羟基化,比大肠杆菌Keio亲本菌株BW25113少(图3F和3G)。作为进一步的控制,我们显示通过缺失cysJ,即大肠杆菌中亚硫酸盐还原酶的NADH:黄素氧化还原酶,64不影响21-脱羟基化(图3G),这与H2产生无关的还原途径被破坏。突变株hycE::KanR和fdhF::KanR与亲本菌株相比,在共培养中没有表现出生长缺陷,表明减少的H2产生和21-脱羟基化不是由于生长不足(图S3B)。这些结果表明,大肠杆菌产生的H2是该细菌促进E. lenta中强大的21-脱羟基化的主要驱动力。然而,与缺乏H2的突变株共培养时,21-脱羟基化并没有降低到无法检测的水平,留下了EcN可能产生诱导该反应的其他因素的可能性。E. lenta还包含注释但未经确认的氢化酶(数据S1),这表明这种细菌也可以产生H2气体。有趣的是,尽管E. lenta 14A和EcN都在单培养中产生了H2,但共培养产生的H2是任一单培养的三倍(图3H)。在G. pamelaeae和EcN的共培养中也观察到了协同H2产生(图3I和3J)。因此,共培养中产生的更高水平的H2可能会促进E. lenta中的21-脱羟基化活性。未来的工作需要研究这种协同H2产生的机制,并确定它是否发生在更复杂的微生物群落中。鉴于在复杂群落中,肠道细菌既消耗又产生气体,我们在人类粪便群落中量化了H2气体的产生。来自捐赠者F2的粪便培养物在48小时内产生了H2,我们已显示这可以促进共培养中的21-脱羟基化,并产生了THPs(图3K和3L)。这些结果表明,与先前的文献一致,人类微生物组群落可以是H2气体的净生产者57,65–67,并进行21-脱羟基化。
4、除了EcN之外的肠道细菌在E. lenta中诱导21-脱羟基化
我们接下来筛选了一小群革兰氏阳性和革兰氏阴性肠道细菌,以确定它们在E. lenta中诱导此活性的能力。革兰氏阳性菌株Clostridium scindens VPI 12780和C. perfringens ATCC 13124,以及革兰氏阴性菌株Citrobacter rodentium ATCC 8090和C. freundii ICC 168,在E. lenta 14A中诱导了21-脱羟基化(图3M)。
这些结果表明,一系列革兰氏阴性和革兰氏阳性肠道细菌可以促进21-脱羟基化。大多数诱导菌株根据已发布的数据集(数据S1)包含注释的氢化酶。61对于缺乏注释氢化酶的菌株,我们使用已知的氢化酶作为查询序列,在这些微生物的基因组中进行了BLAST-P搜索。我们在其他诱导菌株中识别出了氢化酶同源物(数据S1)。对于其中一部分可以测量溶解H2的肠道细菌,我们发现产生较少H2的细菌(图S3C)也诱导了较少的21-脱羟基化(图3M)。这些结果表明,21-脱羟基化的细菌诱导剂具有产生H2气体的能力。
5、Elen_2451–Elen_2454基因簇负责21-脱羟基化
接下来,我们对来自放线菌株库的生产菌株和非生产菌株的基因组序列进行了比较基因组学分析,以识别可能参与21-脱羟基化的候选基因。我们发现所有15个生产菌株都含有四个基因的簇Elen_2451–Elen_2454(图4A)。除了两个分离株,E. lenta DSM 15644和E. lenta FAA1-1-60A,它们含有该簇但不能执行21-脱羟基化外,13个非生产菌株缺乏这个簇。E. lenta DSM 15644在Elen_2453同源物的编码序列中包含一个两碱基插入,预计会产生一个截短的蛋白质,这可能解释了为什么E. lenta DSM 15644缺乏活性(图4B)。此外,E. lenta DSM 15644和E. lenta FAA1-1-60A与EcN共培养时产生的H2显著少于生产菌株(图4C),尽管共培养显示出类似的氧化还原水平(图4D)。这些结果与这些菌株不产生THPs的情况一致(图4E)。基于这些分析,我们选择了簇Elen_2451–2454进行进一步研究。
Elen_2453被注释为一种钼蝶呤氧化还原酶(pfam: pf00384),其蛋白质序列表明它具有氧化还原酶活性、钼蝶呤辅因子结合和4Fe-4S簇。为了确定21-脱羟基化活性是否依赖于钼,我们将顶级生产菌株之一,E. lenta 14A,与EcN共培养,添加或不添加钨酸盐,已知钨酸盐可以在钼辅因子生物合成过程中替代钼酸盐,从而抑制酶活性。70 21-脱羟基化活性被钨酸盐显著抑制(图4F)。重要的是,先前的工作证明E. lenta的生长不受钨酸盐或钼酸盐的影响。71因此,这些结果证实E. lenta中的21-脱羟基化活性依赖于钼,并表明钼蝶呤氧化还原酶可能是簇中的主要酶单元。
簇中的其他基因包括,Elen_2452被注释为4Fe-4S铁硫结合域蛋白(pfam: pf12800和pf13247),可以作为向氧化还原酶转移电子的电子载体。72 Elen_2451被注释为甲酸脱氢酶家族辅助蛋白FdhD(pfam: pf02634)。这个成分可能是FMNH2等辅因子的运载蛋白。它包含核苷酸辅因子结合的结构域,可能涉及接受电子。Elen_2454被注释为SPFH结构域带7家族蛋白(pfam: pf01145)。带7结构域与膜整合相关。74先前的研究建议这个蛋白质是与膜相关的,而Elen_2453不包含跨膜结构域。46,47,52
以前尝试在大肠杆菌中异源表达来自E. lenta的含钼脱羟基化酶未获成功。71尽管最近报道了E. lenta的遗传缺失和同源表达系统,但在这个生物体中同源表达更一致地成功。75因此,我们选择在E. lenta DSM 2243中在cumate控制下表达Elen_2451–2454簇。在与EcN共培养的E. lenta DSM 2243中诱导这个簇的表达足以增加21-脱羟基化活性,与未诱导的培养物和lacZ对照相比(图4G)。在E. lenta中同源表达额外的推定含钼蝶呤氧化还原酶簇(Elen_3048–3051和Elen_2917–2921)没有导致21-脱羟基化活性的增加(图4G)。为了进一步证明所识别的基因簇足以进行21-脱羟基化,我们采用了一种可诱导表达系统来在G. urolithinfaciens DSM 27213(G. uro)中异源表达E. lenta基因,G. uro是E. lenta的一个近亲,缺乏Elen_2451–2454的同源物并且不能执行21-脱羟基化(图4H)。我们发现,在G. uro中诱导含有Elen_2451–2453的稳定构建体的表达,导致从THDOC产生大量的THP(图4I)。这些结果表明,Elen_2451–2453编码的蛋白质使非生产型的G. uro能够执行21-脱羟基化,而Elen_2454对该生物体中的21-脱羟基化活性不是必需的。
为了进一步确认簇活性,我们使用活性指导的蛋白质分馏法来识别表达细胞裂解物中的活性酶。通过结合离子交换、疏水相互作用和大小排阻色谱法,我们识别出了大小在350到450 kDa之间的活性蛋白质复合物。然后,我们通过胰蛋白酶消化蛋白质组学确认,由Elen_2451–2454编码的蛋白质存在于21-脱羟基化部分中(数据S1和S2)。综上所述,我们的数据显示Elen_2451–2454负责E. lenta中的21-脱羟基化。
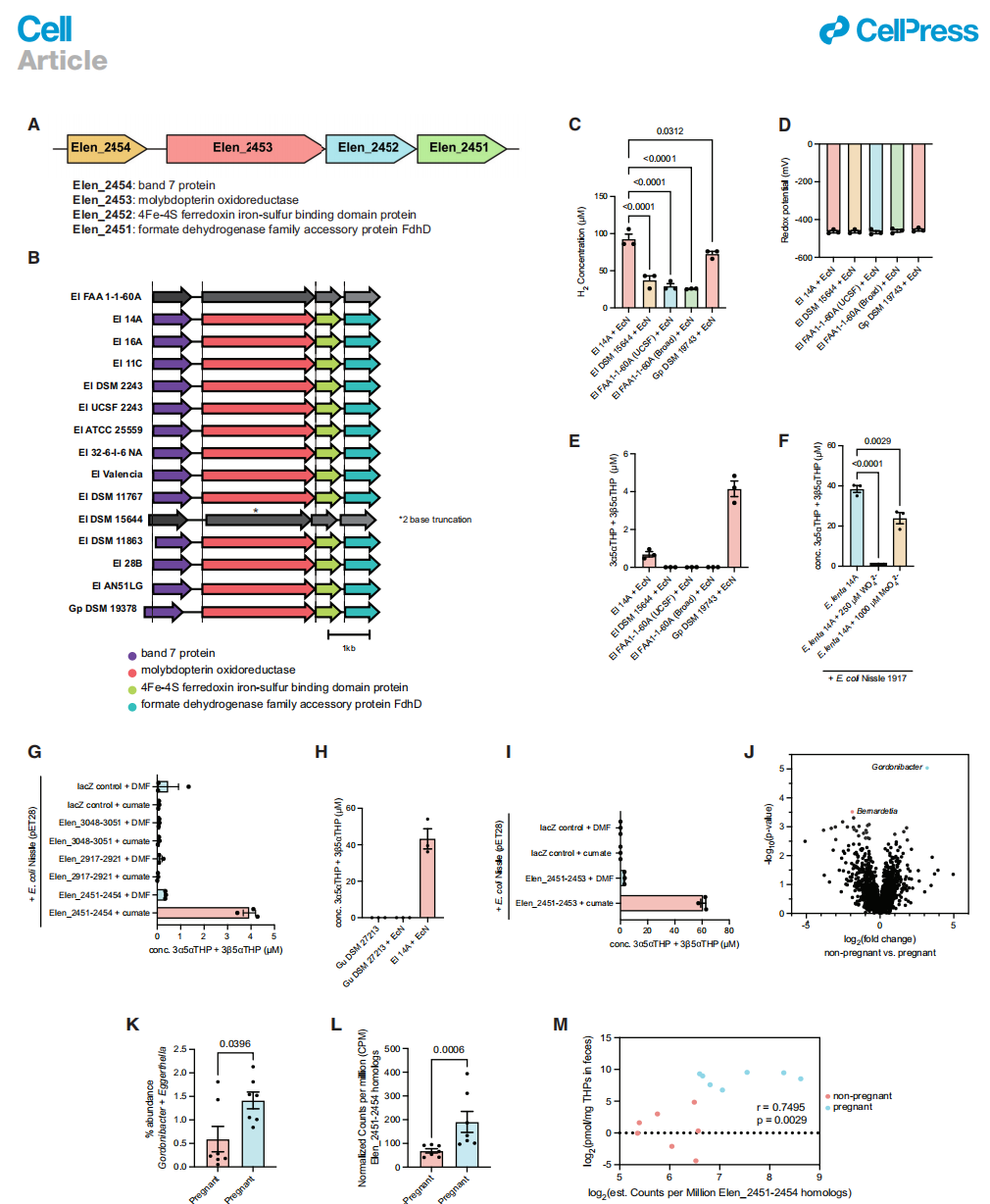
图4. Elen_2451–2454基因簇编码钼依赖性的21-脱羟基酶活性
(A) 通过比较基因组学在放线菌株库中鉴定出一个预测的钼蝶呤氧化还原酶(Elen_2453)编码的21-脱羟基酶基因簇。
(B) 该基因簇在具有21-脱羟基化能力的Coriobacteriaceae中是保守的。使用clinker pipeline对Eggerthella和Gordonibacter菌株中的预测21-脱羟基化基因簇进行了遗传比对。非产生菌株中的基因以灰色阴影显示。
(C-E) 与EcN共培养的E. lenta非产生菌株产生的氢气比E. lenta产生对照少。在与EcN共培养的E. lenta菌株中,48小时后定量了H2产量(C)、氧化还原电位(D)和3α5αTHDOC产生的THP产量(E)(每个培养条件n = 3个生物重复,单向ANOVA与Dunnett多重比较测试)。
(F) 钨酸盐抑制了21-脱羟基化活性。向E. lenta 14A + E. coli Nissle共培养物中加入钨酸盐或钼酸盐,并在7天后测量21-脱羟基化活性(每个培养条件n = 3个生物重复,单向ANOVA与Dunnett多重比较测试)。
(G) Elen_2451–2454的同源表达导致了3α5αTHDOC的21-脱羟基化。将选定的含有钼蝶呤氧化还原酶的基因簇转化到E. lenta DSM 2243中,并用50 mM cumate诱导表达。在cumate诱导和未诱导(DMF)对照组中,8小时后定量了THP产量(每个条件n = 3个生物重复)。
(H) G. urolithinfaciens (Gu)在7天内不能对3α5αTHDOC进行21-脱羟基化,并且其基因组中不包含Elen_2451–2454同源物。
(I) 在非产生菌株Gu DSM 27213中异源表达含有Elen_2451–2453的稳定构建体导致了3α5αTHDOC的21-脱羟基化。在cumate诱导和未诱导(DMF)对照组中,8小时后定量了THP产量(每个条件n = 3个生物重复)。
(J) Gordonibacter是唯一一种在孕妇捐赠者的粪便样本中丰度显著增加的属,而Bernardetia在非孕妇捐赠者中显著增加(使用ALDEx2进行组成差异丰度分析,Benjamini Hochberg假发现率校正的Welch's t检验<0.1被描述为统计学显著)。
(K和L) 孕妇捐赠者的粪便中含有更高百分比的Gordonibacter和Eggerthella属(K)以及更高估计的每百万计数(CPM of summed genera, normalized by gene length, determined by gene-based taxonomic profiling)的Elen_2451–2454同源物(L),而不是健康非孕妇捐赠者的粪便(每组n = 7名受试者,Mann-Whitney检验)。
(M) Elen_2451–2454的CPM与孕妇和非孕妇人类粪便中总THPs浓度相关(每组n = 7名受试者,Spearman相关性)。所有数据均以平均值±SEM表示。
6、来自孕妇的粪便中富含含簇细菌
与非孕妇相比,孕妇胆汁中的THDOCs水平高出5到10倍。25,26孕期胆汁中THDOCs水平的提高不能完全解释粪便中THPs增加100倍的现象,这表明怀孕期间微生物组的变化可能有助于肠道中THP水平的增加。为了调查这种可能性,我们对孕妇和非孕妇捐赠者的粪便进行了宏基因组测序。尽管两组都表现出相对较高的分类复杂度(图S4A),但孕妇粪便中的细菌分类多样性(Shannon多样性)有所提高,尽管差异不具有统计学意义(图S4B)。在孕妇和非孕妇捐赠者的粪便样本之间注意到了显著的群落组成差异(Bray-Curtis相异性的PERMANOVA,图S4C)。平均捐赠者年龄在两组之间有显著差异,这可能是导致群落组成差异的因素之一(图S4D)。对不同属级别丰度的差异组成分析表明,Gordonibacter是唯一在孕妇捐赠者样本中显著富集的属,而Bernardetia,属于拟杆菌门的成员,在非孕妇捐赠者的粪便中的丰度显著更高(图4J)。在差异丰度的补充测试中,通过基于组装的分类分析确定的Eggerthella和Gordonibacter属的总水平在孕妇与非孕妇之间显著更高(图4K)。我们还发现,孕妇捐赠者的粪便中Elen_2451–2454同源物的标准化基因丰度显著更高(图4L)。此外,THPs浓度与Elen_2451–2454同源物的丰度呈正相关(图4M)。这些数据显示,在晚期妊娠期间存在较高水平的含Elen_2451–2454簇的细菌。此外,这些结果表明,微生物组可能有助于观察到的晚期妊娠人群胃肠道中THPs的高浓度。
7、来自孕妇捐赠者的FMT在体内产生THP
我们试图调查来自孕妇捐赠者的微生物群是否能在体内执行21-脱羟基化。我们对雌性无菌小鼠进行了来自孕妇捐赠者P7的粪便微生物移植(FMT)(图5A)。在第28天对盲肠内容物中的E. lenta进行定量,表明这种微生物已成功定植(数据S1)。接受妊娠微生物组的小鼠在第10、16和28天的粪便中THPs水平显著更高,表明随着时间的推移,微生物持续产生THPs,且E. lenta定植一致(图5B和S5)。这些结果表明,来自孕妇的微生物组足以在胃肠道中生成THPs。
8、E. lenta和EcN在体内产生THPs
为了研究细菌是否能使用内源性类固醇作为底物在体内执行21-脱羟基化,我们将生产菌株E. lenta 14A和EcN共同定殖于无菌雌性小鼠(图5C)。7天后,共定殖小鼠的粪便中THPs含量显著高于无菌对照组(图5D),这表明当与EcN共定殖时,E. lenta 14A在体内对宿主产生的THDOC进行21-脱羟基化。为了确定体内21-脱羟基化活性对Elen_2451–2454基因簇的依赖性,我们将生产型E. lenta 14A(含簇菌株)和EcN或非生产型E. lenta A2(无簇菌株)和EcN共同定殖于无菌小鼠(图5E)。我们观察到,与非生产型定殖小鼠相比,生产型定殖小鼠的粪便中总THPs和3α5βTHP的水平显著更高(图5F和5G)。这些数据为Elen_2451–2454基因簇负责21-脱羟基化活性的假设提供了额外的支持。
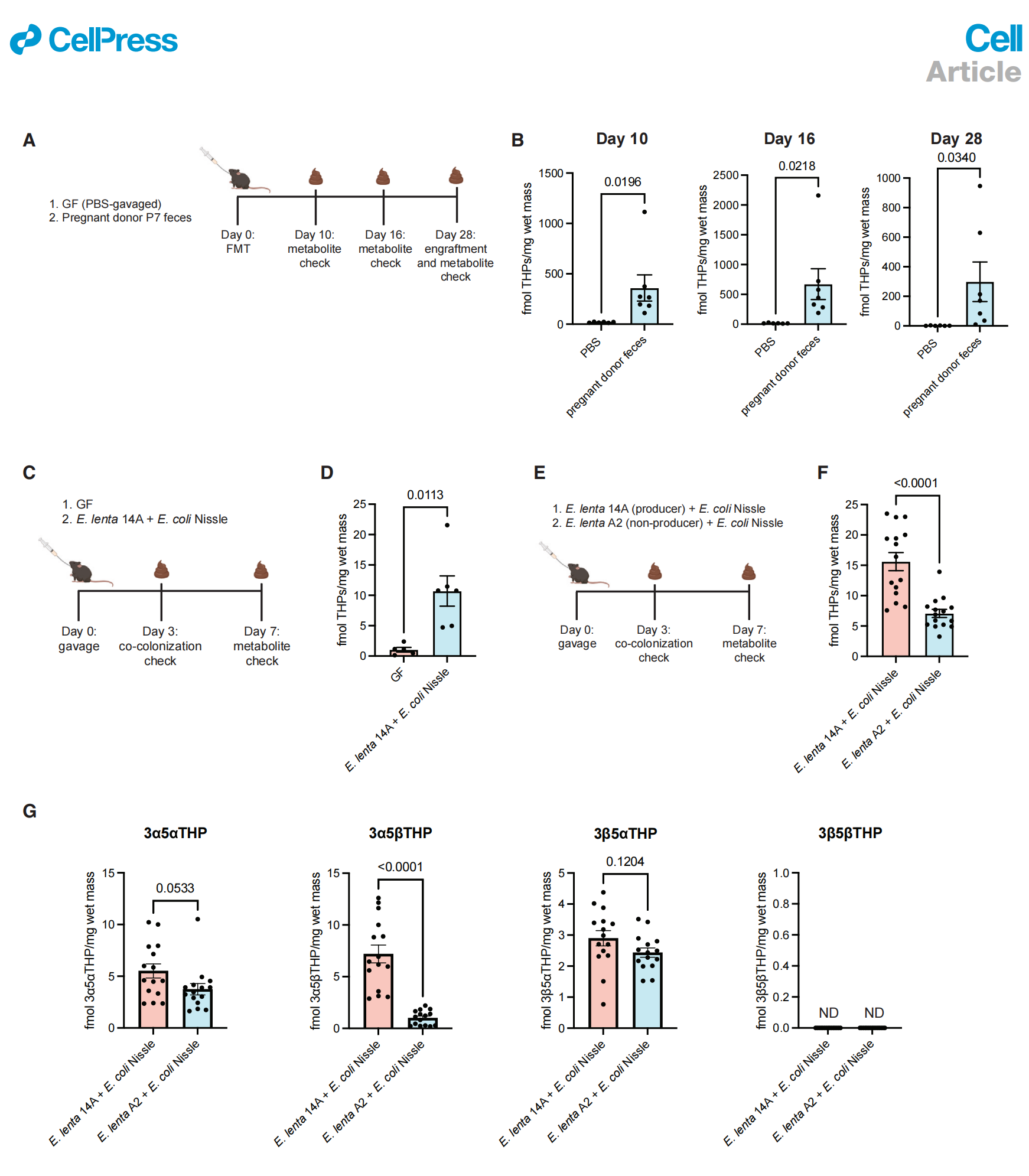
图5. 21-脱羟基化在体内发生,并且依赖于Elen_2451–2454簇
(A) C57BL/6雌性无菌小鼠通过胃管给予来自孕妇捐赠者P7的粪便浆液或PBS。在10、16和28天时对粪便中的THPs进行定量。
(B) 与接受PBS胃管的小鼠相比,接受捐赠者P7的FMT的小鼠在第10、16和28天的粪便中观察到更高的总THPs浓度(分别有6只和7只接受PBS和P7浆液胃管的小鼠,单尾Welch's t检验)。
(C) C57BL/6雌性无菌小鼠要么定殖了E. lenta 14A(含有簇)+ EcN,要么保持无菌状态。
(D) 与无菌雌性小鼠相比,共定殖小鼠在第7天的粪便中观察到更高的总THPs浓度(分别有5只和6只无菌和E. lenta 14A + EcN共定殖小鼠,Welch's t检验)。
(E) C57BL/6雌性无菌小鼠要么定殖了E. lenta 14A(含有簇,生产者)+ EcN,要么定殖了E. lenta A2(缺乏簇,非生产者)+ EcN。
(F) 与共定殖E. lenta A2 + EcN的小鼠相比,共定殖E. lenta 14A + EcN的小鼠在第7天的粪便中观察到更高的总THPs浓度(每组15只小鼠,Welch's t检验)。
(G) 共定殖小鼠在第7天粪便中个别THPs的浓度(每组15只小鼠,Welch's t检验)。N.D., 未检测到。所有数据均以平均值±SEM表示。
三、讨论
在这里,我们报告了人类肠道细菌E. lenta和密切相关的放线菌执行21-脱羟基化并将丰富的胆汁类固醇3α5αTHDOC转化为THPs。我们还提供了证据,我们已经识别出一个执行21-脱羟基化的基因簇,Elen_2451–2454。
这些研究揭示了一种机制,通过该机制,肠道细菌将调节葡萄糖代谢和免疫稳态的糖皮质激素转化为孕激素,孕激素既作为调节月经周期和妊娠的性激素,又作为调节GABA受体信号传导的神经类固醇。40,76
基于我们发现Elen 2451–2454基因簇编码了依赖钼的氧化还原酶和含铁硫结合域蛋白,我们假设皮质激素的21-脱羟基化是通过单电子化学发生的。72,77未来的研究需要使用纯化的酶复合体来阐明精确的反应机制。
值得注意的是,通过我们对21-脱羟基化的探索,我们发现了H2的作用,H2是人类肠道微生物产生的三种主要气体之一,57在促进肠道细菌的次级代谢中发挥作用。我们展示了E. lenta对糖皮质激素的强效21-脱羟基化需要与E. coli共培养提供的H2。当E. lenta与缺乏H2产生的E. coli突变株共培养时,21-脱羟基化显著减少。此外,将E. lenta单培养物保持在H2气氛下足以促进21-脱羟基化,而N2气氛则没有这种效果。最后,含有Elen_2451–2454簇的E. lenta非生产者菌株在H2产生方面有缺陷,这表明H2气体生成和这些基因都是21-脱羟基化活性所必需的。总的来说,我们的研究表明,产H2的肠道微生物与E. lenta之间的合作代谢导致了孕激素的产生。
细菌对上消化道未消化的碳水化合物、蛋白质和脂肪的发酵为细菌提供了能量以及代谢产物,如短链脂肪酸、有机醇和气体,包括H2和CO2。78为了维持肠道中的氧化还原平衡,H2被肠道微生物产生和消耗,这一过程被称为H2交叉喂养。61然而,很少有报告讨论H2气体如何影响肠道微生物代谢,除了乙酸生成、甲烷生成和硫酸盐还原途径之外。79,80此外,尽管人们假设H2分压可以影响E. lenta代谢,60但这些假设尚未在体外得到验证。
我们的数据显示,H2产生影响了肠道细菌的次级代谢。此外,这些研究提出了可能存在其他由气体驱动的酶活性由肠道微生物群执行的可能性。未来研究的一个问题是H2气体如何促进21-脱羟基化。H2可能直接为21-脱羟基酶提供还原等价物。或者,H2可能作为形成还原铁氧还蛋白辅因子所需的电子供体,该辅因子是21-脱羟基化所必需的。H2也可能通过为多种辅因子生成机制提供还原等价物,从而将E. lenta的代谢方向转向还原。确实,可能发生一种“切换”或“阈值”现象,即一旦肠道腔内达到一定的H2分压,如21-脱氢这样的还原过程就会在E. lenta中变得有利。59,60未来的研究需要在严格的厌氧条件下使用纯化的酶复合体来确定H2促进21-脱羟基化的确切机制。
我们的数据还表明,将雌性小鼠与E. lenta的生产菌株共同定殖会导致粪便中THPs水平显著升高。其中一种孕激素,3α5βTHP,也称为eltanolone,40,76也是GABAA受体的正异构调节剂和甘氨酸受体的负异构调节剂。81,82 3α5βTHP具有麻醉作用,并在妊娠、胎儿镇静、经前烦躁障碍中发挥作用,并且具有抗焦虑作用。76,83这些结果表明,除了神经类固醇药物3α5αTHP和3β5αTHP外,代谢物3α5βTHP虽然目前不是治疗药物,也可能对宿主的神经系统产生影响。
更广泛地说,我们的研究激励了未来工作调查细菌类固醇代谢对宿主的影响。怀孕人群中胃肠道中THPs的浓度显著更高,这表明微生物组有助于THP水平的激增。因此,我们的研究提出了一个可能性,即源自胃肠道的THPs可能会对宿主产生生理效应,特别是在妊娠的背景下。通过分析分娩前后的粪便中的类固醇和微生物组变化以及动物行为实验,将有助于分别确定细菌孕激素与宿主行为和神经功能之间的相关性和因果关系。我们的数据进一步支持了人类肠道微生物组作为一个额外的内分泌器官的假设,84其中肠道细菌产生生物活性代谢物,影响激素稳态和宿主信号过程。
四、本研究的局限性
在本研究中,我们关注了单一类固醇的代谢,但胆汁中也存在其他类固醇,合成皮质激素药物也会进入胃肠道。E. lenta可能也能转化这些类固醇激素和药物。此外,微生物组本质上是复杂的,额外的细菌活动可能会抑制21-脱氢(例如由Bifidobacterium adolescentis L2-3285,86等细菌在20位还原THDOC,或消耗H2)。这样的活动可以解释为什么一个男性捐赠者的粪便样本没有进行21-脱羟基化。同样,肠道微生物可以将THDOC或THPs转化为额外的代谢物,这或许可以解释为什么在某些情况下我们观察到THDOC的减少,但THPs的水平低于预期。需要进一步的研究来全面描述可能减少或抑制21-脱羟基化的潜在因素,以及探索除Eggerthella和Gordonibacter之外的其他细菌是否可以执行21-脱羟基化。
E. lenta和E. coli之间产生H2协同作用的机制尚不清楚。未来的生化和遗传研究将有助于揭示肠道微生物产生协同气体的起源,以及这种气体产生对细菌代谢的影响。
此外,需要进一步验证孕期微生物组在THP生产中的作用,因为FMT实验中只使用了一个孕妇捐赠者,并且没有包括非孕妇捐赠者样本。尽管细菌产生的THP可能是孕期粪便THP水平增加100倍的原因,但其他宿主和微生物组介导的因素也可能促成这种增加。来自额外微生物因素的贡献也可以解释为什么与非生产者菌株E. lenta A2共定殖的无菌雌性小鼠在粪便中有更多可量化的THPs比无菌对照组。最后,目前还不清楚E. lenta产生的孕激素是否留在胃肠道中,或者被吸收到肠肝循环或全身循环中。未来追踪细菌产生的孕激素的生物分布研究将有助于确定这些化合物是在局部起作用还是在肠外组织中发挥作用。
https://blog.sciencenet.cn/blog-41174-1436707.html
上一篇:在豆类根瘤菌共生关系中氢加速四氯联苯转化的新机制
下一篇:结肠炎实验小鼠肠道氢气持续增多