博文
结肠炎实验小鼠肠道氢气持续增多
||
本研究结果提示,氢气可能不仅能作为疾病治疗的工具,也是某些肠道疾病的无创诊断工具。
氢气对人没有毒性,这已经有非常充分的研究证据。但不等于氢气对人没有副作用,这个研究虽然不能说明氢气就是导致结肠炎的原因,但是动物结肠炎模型时,小鼠肠道内产生氢气的能力显著提高。从目前对氢气效应的研究来说,这种升高对结肠炎是有利的,因为氢气消除炎症的作用非常明确。但是也不能完全确定没有害处,例如氢气大量产生会不会是导致肠道胀气的因素。
Fujiki Y, Tanaka T, Yakabe K, et al. Hydrogen gas and the gut microbiota are potential biomarkers for the development of experimental colitis in mice. Gut Microbiome. 2024;5:e3.
摘要
炎症性肠病(IBD)是一种慢性疾病,其特点是反复的复发和缓解,即使在症状解决后仍有高复发率。IBD的主要诊断方法是内窥镜检查;然而,这种方法昂贵、侵入性强,且连续使用不便。因此,需要更便捷、非侵入性的IBD诊断方法。在这项研究中,我们旨在识别肠道炎症发展的生物气体标志物。使用硫酸右旋糖酐钠(DSS)诱导的结肠炎小鼠模型,分析了五种生物气体以识别肠道炎症发展的预测标志物。此外,评估了气体组成变化、肠道微生物组和炎症标志物之间的相关性。发现氢气(H2)水平与脂质运载蛋白-2(LCN2)水平呈负相关,LCN2是肠道炎症的生物标志物,也与DSS诱导的结肠炎引起的体重减轻呈负相关。此外,属于Rikenellaceae和Akkermansiaceae家族的肠道微生物与LCN2水平和体重减轻呈正相关,而Tannerellaceae的丰度与LCN2水平和体重减轻呈负相关,并与H2水平呈正相关。这项研究为IBD诊断提供了新的见解;生物气体中的H2水平是肠道炎症的潜在生物标志物,特定的肠道微生物与H2水平变化有关。
前言
炎症性肠病(IBD),包括溃疡性结肠炎(UC)和克罗恩病(CD),是一种慢性炎症性疾病,其发展涉及遗传、免疫、环境和微生物因素间的复杂相互作用。IBD 的发病率在全球范围内都在增加,带来了重大的健康、社会和经济负担。可以设想,在疾病过程中更早的干预,可能在无症状阶段,将更有效地重置失调的免疫途径和其他病理过程,这些过程推动疾病从临床前阶段发展到临床阶段。然而,IBD 的特点是复发和缓解期,即使在症状解决后复发率也很高,这使得预测其复发变得困难。
内窥镜是监测炎症性肠病(IBD)患者的金标准;然而,这种方法耗时、昂贵且侵入性。此外,内窥镜评分的可重复性差,且高度依赖于内窥镜医生的经验。因此,迫切需要确定更可靠的非侵入性替代生物标志物并建立测量方法,以减轻患者负担和成本。
血清和粪便炎症标志物、血清抗体和呼出气体等几种生物样本作为生物标志物引起了注意。临床上使用血清C反应蛋白(CRP)、红细胞沉降率(ESR)、抗酵母菌抗体(ASCA)、核周中性粒细胞胞浆抗体(pANCA)和粪便钙保护素。除了这些与炎症相关的生物标志物外,由于易于快速测量允许重复采样以及其分析的非侵入性,呼气气体也可以是潜在的生物标志物(Das等人,引用Das, Pal和Mitra2016)。以前的研究已经证明了IBD和呼出气体之间的关系。例如,UC和IBD患者呼吸中的乙烷和戊烷浓度分别显著高于健康个体。此外,机器学习已被用于根据挥发性有机物(VOCs)区分健康对照组、活动期CD患者和缓解期患者。因此,呼气分析可能是诊断IBD的实用策略。然而,大多数研究只关注了具有大分子量且易于量化的挥发性化合物,而其他分子包括低分子量化合物没有得到足够的评估。此外,人类研究在年龄、饮食因素以及抗生素和其他药物使用历史方面具有异质性。因此,IBD病理对呼出气体的影响仍然不清楚。此外,大多数研究集中在活动期IBD患者身上,而使用这些呼吸气体作为发展或复发IBD的可能预测性生物标志物尚未完全阐明。
下一代测序和宏基因组分析技术的进步表明,肠道微生物组这一环境因素与IBD发病机制密切相关。多项研究记录了IBD患者与健康个体之间肠道微生物组组成、多样性和代谢产物的差异。一些来自肠道微生物组的代谢产物被宿主吸收,通过血流到达血-肺屏障,并通过呼吸道迅速排出为呼出气体,而其他代谢产物则以粪便和尿液的形式从体内排出。因此,呼出气体、粪便、尿液和汗液等生物样本反映了肠道微生物组的多样性和代谢,从而反映了人体中发生的异常炎症过程。
在这项研究中,使用了硫酸右旋糖酐钠(DSS)诱导的结肠炎小鼠模型来识别肠道炎症发展的潜在生物气体标志物。在实验性结肠炎的发展过程中,连续分析了五种生物气体成分的变化,即氢气(H2)、氨气(NH3)、硫化氢(H2S)、甲硫醇(CH3SH)和乙硫醇(C2H5SH)。此外,还检查了肠道微生物组和炎症标志物随时间的变化,以评估生物气体组成、肠道微生物组和炎症标志物变化之间的相关性。
结果
测量生物气体的设备
使用安装在由隔膜泵通风的空气流线中的传感器气相色谱仪对笼中的生物气体H2、NH3、H2S、CH3SH和C2H5SH进行采样和测量(图1a,b)。气体浓度的采样率取决于每次测量中气柱和传感器气相色谱仪中的气体传感器的刷新时间,平均采样率为每小时10个点。采样的气体浓度反映了小鼠的呼吸和皮肤气体以及粪便中的气体。
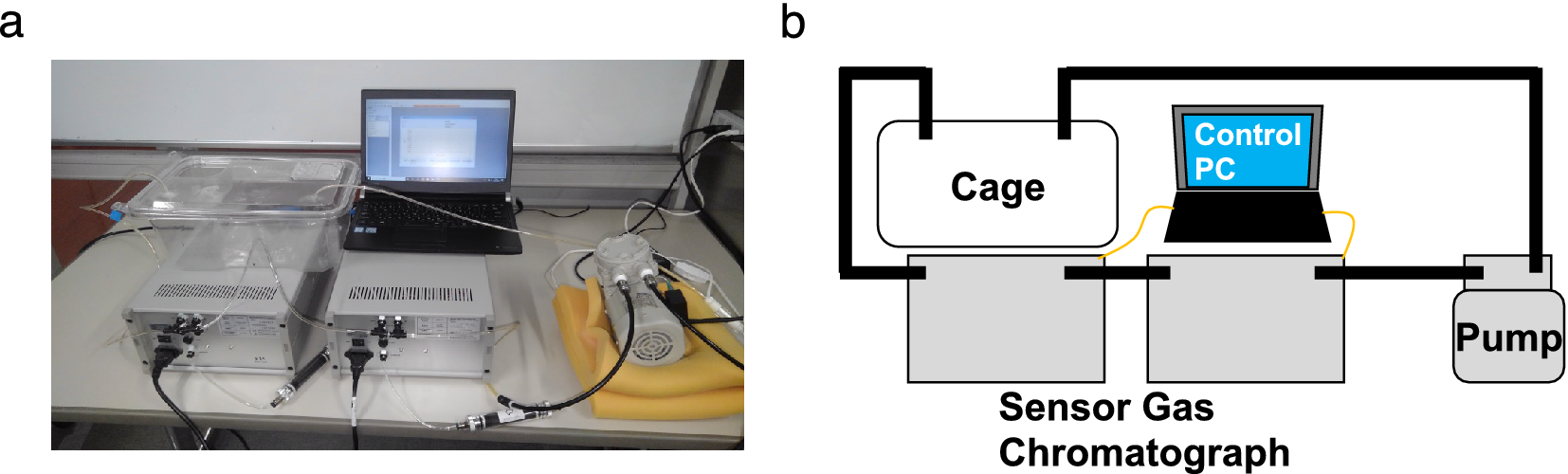
图1. (a) 呼吸采样系统的实物照片和(b)示意图。笼内的空气通过泵循环。在循环路径中使用传感器气相色谱仪,测量了(H2)、氨气(NH3)、硫化氢(H2S)、甲硫醇(CH3SH)和乙硫醇(C2H5SH)的浓度。传感器气相色谱仪由一个气柱和一个金属氧化物半导体气体传感器组成,能够进行选择性和敏感的气体传感。
生物气体的测量,使用隔膜泵 DAP-15 (ULVAC KIKO) 对笼子和传感器气相色谱仪之间连接的空气流线进行通风。H2 和 NH3 浓度使用传感器气相色谱仪 ODNA-P3-C (Nissha FIS) 测量。传感器气相色谱仪由气体采样器、气柱和半导体气体传感器组成。使用气柱分离取样气体,并进行高选择性气体检测。H2 和 NH3 的检测限 (LOD) 为 1000 ppb。使用传感器气相色谱仪 ODSA-P3-A (Nissha FIS) 测量 H2S、CH3SH 和 C2H5SH 浓度。H2S、CH3SH 和 C2H5SH 的 LOD 分别为 2 ppb、5 ppb 和 5 ppb。
H2波动与肠道炎症相关
为了检查DSS诱导的结肠炎中炎症水平与生物气体组成变化之间的相关性,首先监测了15天内体重和粪便脂质运载蛋白-2(LCN2)水平的变化。所有小鼠都接受了DSS或右旋糖酐的处理,后者作为阴性对照(图2a)。在DSS处理的小鼠中,从第5天开始体重下降,到第9天时恢复(图2b)。粪便LCN2水平逐渐增加,在第7天达到峰值,并保持高水平直到第15天(图2c)。相反,在右旋糖酐处理的小鼠中,15天内体重没有显著变化,粪便LCN2水平也保持不变(图2d,e)。这些结果表明,DSS而不是右旋糖酐,导致了体重减轻和粪便炎症标志物水平的增加。
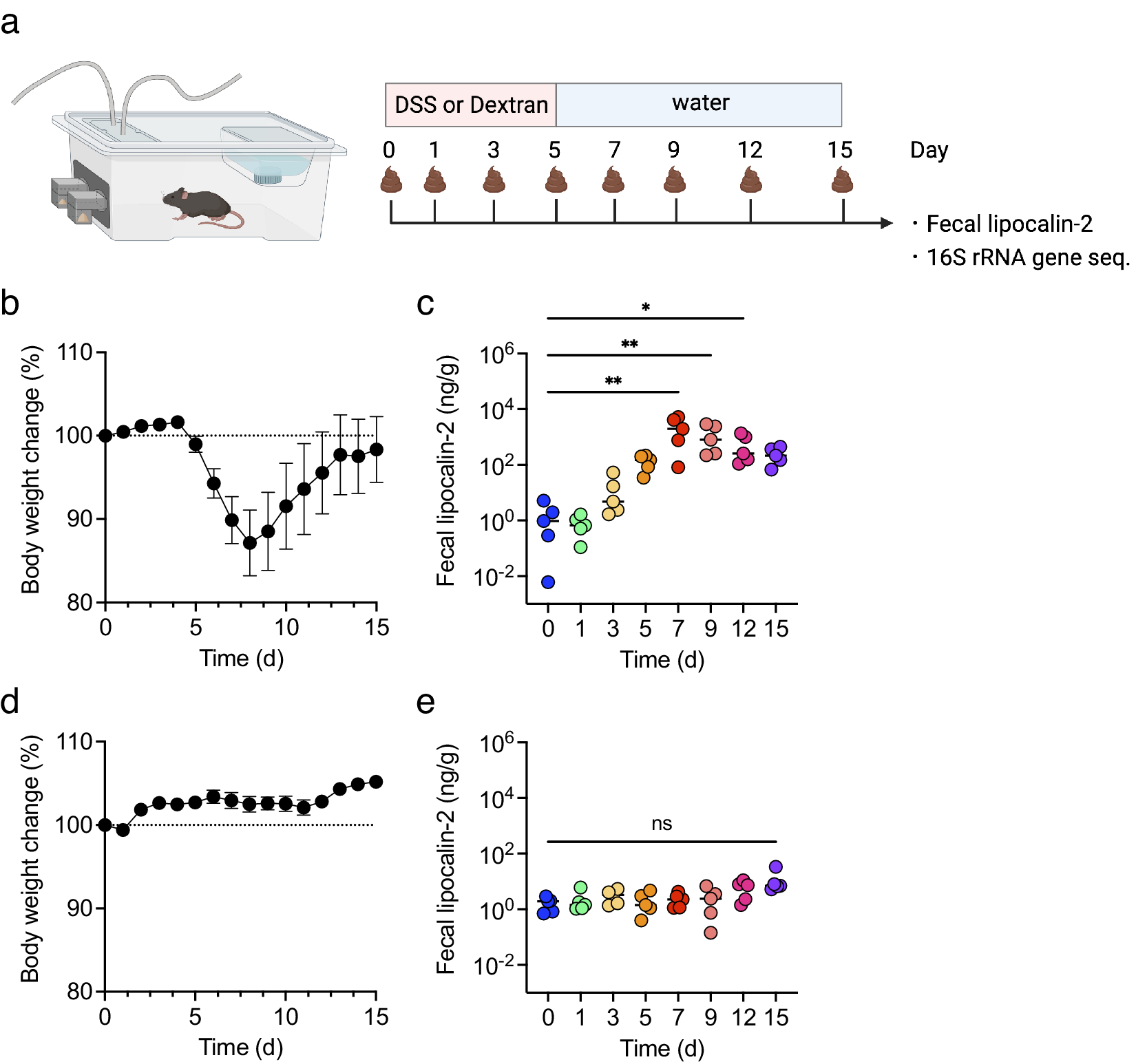
图2. 小鼠接受硫酸右旋糖酐钠(DSS)或右旋糖酐处理5天,并监测15天(n = 5)。(a) 实验设计。(b和d) DSS-(b)或右旋糖酐处理小鼠(d)的体重变化。(c和e) DSS-(c)或右旋糖酐处理小鼠(e)在第0、1、3、5、7、9、12和15天的粪便脂质运载蛋白-2(LCN2)水平。在(c)和(e)中使用了弗里德曼检验。*p < 0.05; ** p < 0.01; *** p < 0.001; ns., 不显著。所有实验均独立进行了三次。
接下来,检查了实验性结肠炎诱导期间生物气体水平的变化。在DSS处理的小鼠中,H2水平最初短暂增加,从第4天开始下降,在第7到8天之间进一步下降,然后从第8天开始逐渐增加。相反,在右旋糖酐处理的小鼠中,H2水平在第1天显示出类似的短暂峰值,但继续波动并呈现相同的峰值形状(图3a)。同样,氢气浓度的标准差从第1天开始逐渐减小,在第6到8天触底,然后在DSS处理的小鼠中开始增加(补充图1a)。相反,H2的标准差在右旋糖酐处理的小鼠中表现出周期性波动和类似的峰值形状(补充图1b)。这种趋势与平均值的行为相似,但标准差的变化更为明显。在DSS处理的小鼠中,NH3水平保持高水平稳定直到第5天,然后开始下降。在第5天后停止DSS处理后,NH3水平迅速下降。NH3水平从第8天开始增加,然后在降低的水平上继续波动。相反,在右旋糖酐处理的小鼠中,NH3水平增加到第3天并在之后保持稳定(图3b)。考虑到DSS处理后硫化合物水平的变化,H2S、CH3SH和C2H5SH水平从第10天开始缓慢增加(图3c-e)。此外,CH3SH和C2H5SH水平在第6到9天之间下降(图3d,e)。关于右旋糖酐处理后硫化合物的水平,C2H5SH在短暂的增加和减少之间保持稳定。
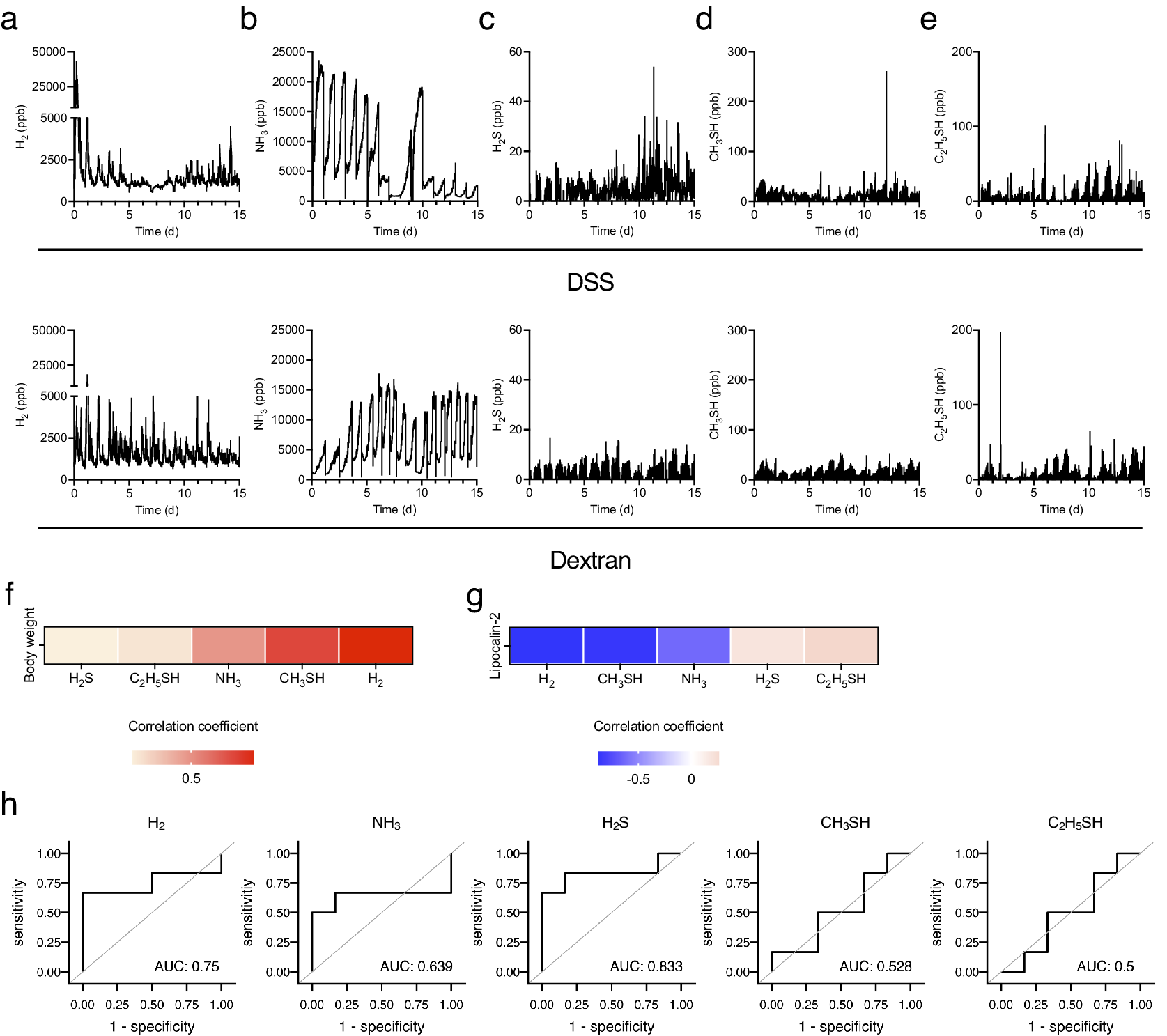
图3. 使用图1中介绍的仪器检测了15天内五种生物气体。(a-e)15天内(a)H2、(b)NH3、(c)H2S、(d)CH3SH和(e)C2H5SH的动力学。(f和g)平均体重变化(f)或粪便LCN2水平(g)与几种生物气体之间的热图相关性。(h)每种气体在诊断结肠炎发展中的接收者操作特征(ROC)曲线。粪便脂质运载蛋白-2水平的常用对数(以10为底)截止值设为1.1。所有实验均独立进行了三次。
此外,分析了生物气体与结肠炎表型之间的相关性,包括体重和粪便LCN2水平的变化。鉴于气体水平代表了五只小鼠的总和,因此使用了每只小鼠24小时的平均气体水平和每只小鼠的粪便LCN2水平来分析相关性。H2水平与LCN2水平呈最负相关,并与体重呈正相关(图3f,g)。CH3SH水平也与LCN2水平呈负相关(图3g)。此外,绘制了接收者操作特征(ROC)曲线来评估每种气体检测实验性结肠炎发展的能力。粪便脂质运载蛋白-2水平的常用对数(以10为底)截止值设为1.1。ROC分析显示,H2S的ROC曲线下面积(AUC)很高(AUC:0.833),H2的AUC也较高(AUC:0.75),表明这些气体可以作为实验性结肠炎的预测标志物。总之,这些结果表明H2是与DSS诱导的结肠炎的结果和发展强烈相关的气体。
Rikenellaceae和Akkermansiaceae的相对丰度与实验性结肠炎的结果水平和H2水平强烈相关
检查了肠道微生物组的变化,观察到的ASVs和α多样性在结肠炎发展过程中逐渐减少(图4a)。β多样性从第0天到第1天迅速变化,并在此后逐渐改变(图4b)。从第3天开始(此时粪便LCN2水平开始增加),到第7天(此时粪便LCN2水平达到峰值),Akkermansiaceae、Erysipelotrichaceae和Rikenellaceae的相对丰度逐渐增加,而Tannerellaceae的相对丰度从第3天到第7天减少(图4c,d)。
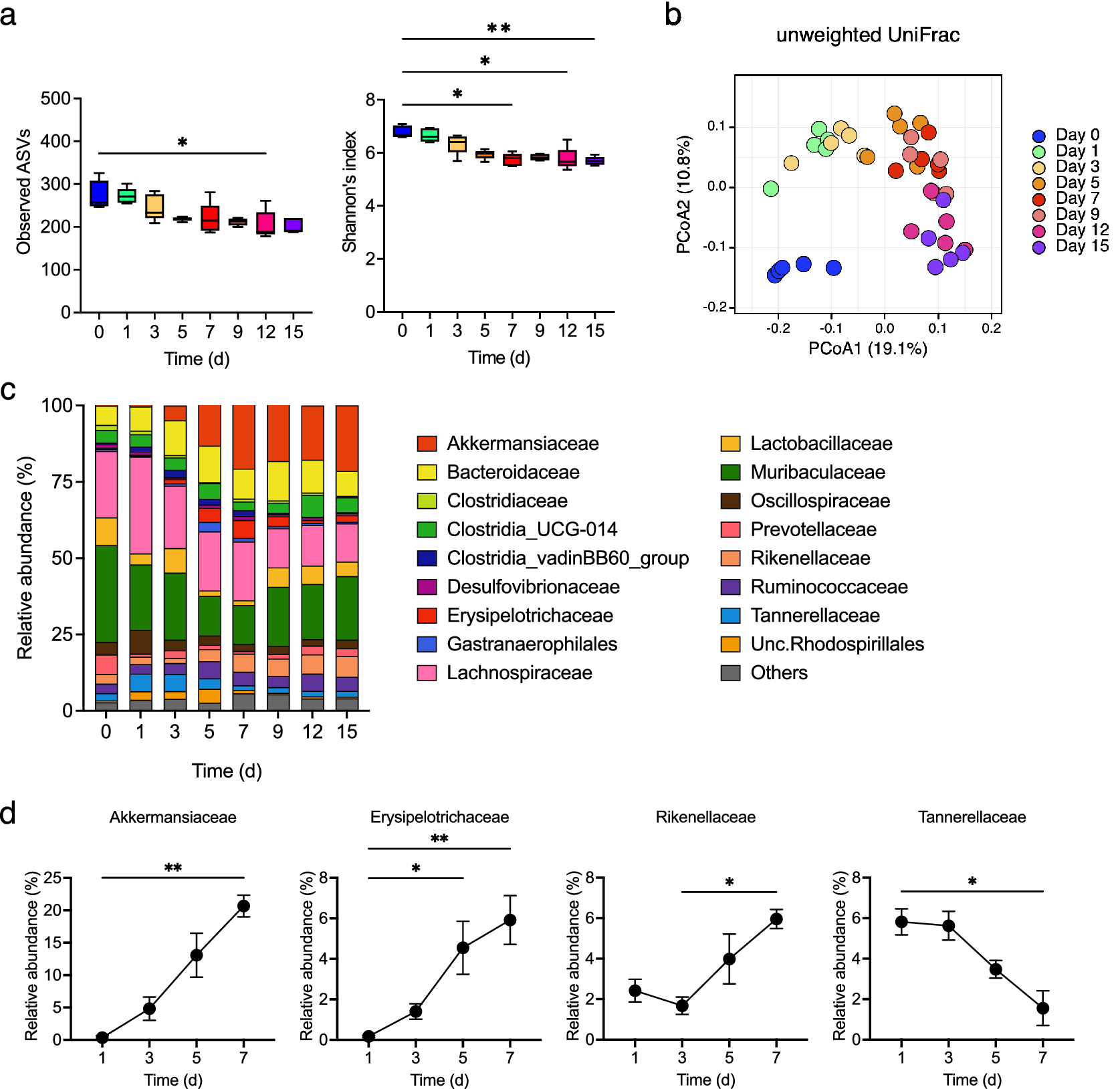
图4. (a) 不同时间点的观察到的扩增子序列变体(ASVs)(左面板)和α多样性(右面板),箱线图显示了中位数、四分位数范围和1.5四分位数范围。(b) 所有样本在所有时间点的β多样性。根据图中的图例显示了不同时间点的未加权UniFrac距离矩阵的主坐标分析(PCoA)。(c) DSS处理小鼠粪便样本中ASVs的平均相对丰度分析是在0、1、3、5、7、9、12和15天进行的。颜色对应于每个细菌家族。(d) DSS处理小鼠在第1、3、5和7天的粪便Akkermansiaceae、Erysipelotrichaceae、Rikenellaceae和Tannerellaceae的平均相对丰度。在(a)和(d)中使用了弗里德曼检验。* p < 0.05; ** p < 0.01; *** p < 0.001; ns., 不显著。所有实验均独立进行了三次。接下来,评估了肠道微生物组变化与结肠炎表型和H2水平之间的相关性。Akkermansiaceae和Rikenellaceae的相对丰度与LCN2水平呈正相关,与体重变化呈负相关。相反,Tannerellaceae的相对丰度与LCN2水平呈负相关,与体重变化呈正相关(图5a,b)。此外,Tannerellaceae和Oscillospiraceae的相对丰度与H2水平呈正相关;Tannerellaceae与H2水平的正相关性最强。相比之下,Akkermansiaceae和Rikenellaceae的相对丰度与H2水平呈负相关(图5c)。这些结果表明,Tannerellaceae的相对丰度与H2水平和体重呈正相关,与LCN2呈负相关。然而,Akkermansiaceae和Rikenellaceae的相对丰度与H2水平呈负相关,与LCN2水平呈正相关(图5d)。
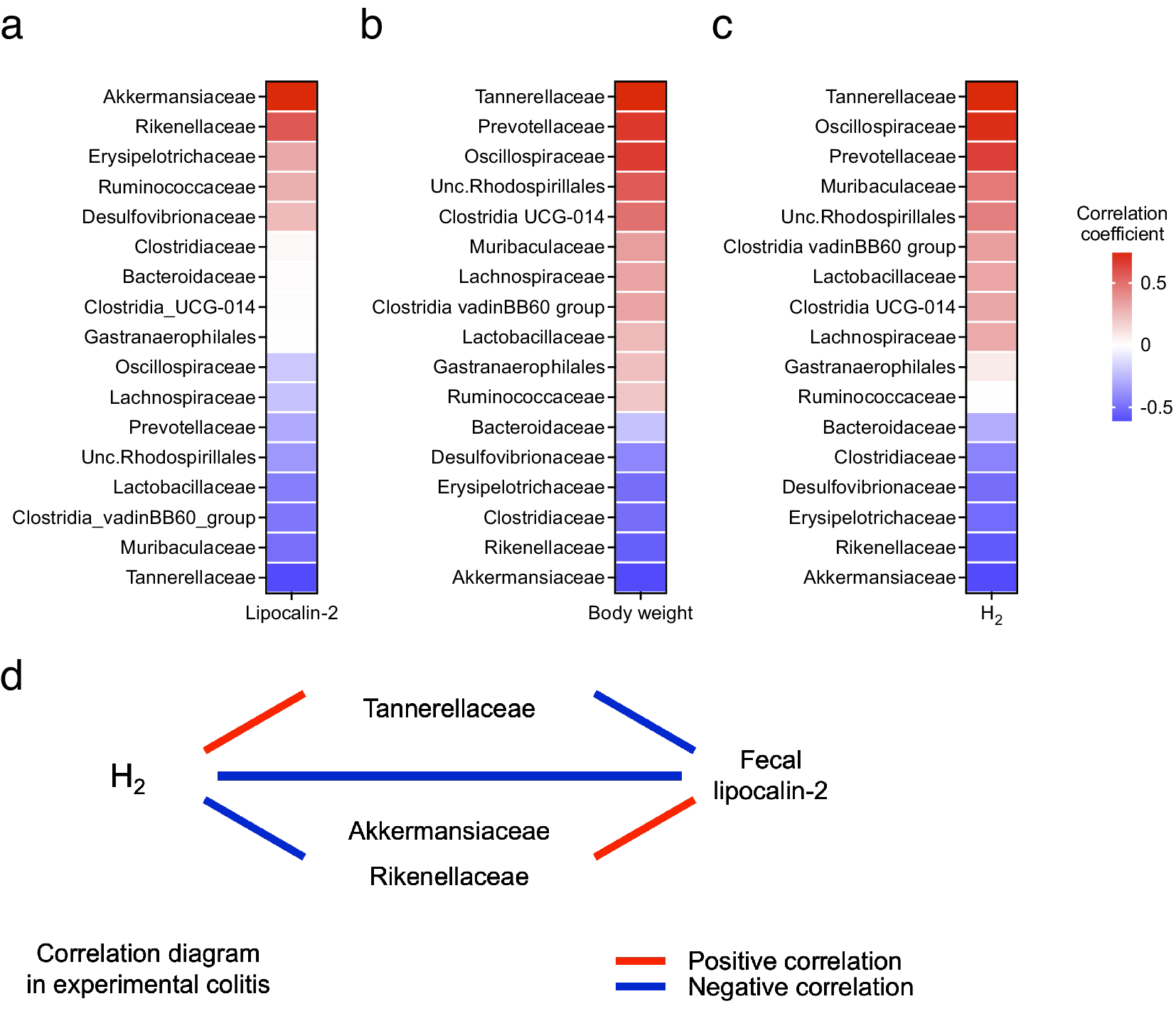
图5. (a) 平均H2水平与几种肠道微生物家族相对丰度之间相关性的热图。(b-c) 粪便LCN2水平或体重变化与几种肠道微生物家族相对丰度之间相关性的热图。(d) H2水平、LCN2水平和细菌之间的关系图,显示了(a-c)中热图的高或低相关系数。
讨论
在这项研究中,测量了DSS诱导的结肠炎期间五种低分子量生物气体的变化、体重减轻、粪便LCN2水平和肠道微生物组组成,发现H2水平与结肠炎结果的相关性最强。此外,某些肠道细菌的相对丰度与结肠炎病理和H2水平变化相关联。
鉴于DSS代谢可能通过肠道微生物组而非结肠炎表型影响生物气体水平,使用右旋糖酐作为DSS处理的阴性对照。在DSS和右旋糖酐给药后立即观察到H2水平的短暂而迅速的增加。因此,这种变化可能是由于肠道微生物组消耗了这两种化合物都含有的右旋糖酐。NH3水平在DSS和右旋糖酐给药期间持续增加,并在每24小时立即下降。这种减少可能是由于测量时打开盖子造成的。尽管笼中的生物气体通过空气过滤器循环,但NH3可能在盖子打开前在笼内积聚。ROC分析显示,H2S的AUC最高。H2S不仅由人类产生,还由肠道中的硫酸盐还原细菌(SRB)产生。事实上,在UC患者的粪便样本中发现了更高的SRB活性和H2S水平。因此,除了H2外,H2S可能是另一个预测结肠炎发展的生物标志物。
在实验性结肠炎的发展过程中,随着结肠炎严重程度的增加,Tannerellaceae的相对丰度成比例减少,这一趋势与IBD患者中Tannerellaceae相对丰度较低的报告一致。此外,Tannerellaceae的丰度与H2水平呈正相关。属于Tannerellaceae家族的Parabacteroides产生氢气。最近的一项研究报告称,通过改善肠道屏障功能,增加肠道中的H2水平可以缓解DSS诱导的结肠炎症状。除了H2作为IBD的潜在治疗剂外,这项研究还展示了其作为IBD生物标志物的可能性。
此外,Akkermansiaceae和Rikenellaceae的相对丰度随着结肠炎的严重程度增加并随后稳定下来,尽管在IBD患者中Akkermansiaceae的相对丰度下降。然而,在小鼠研究中,Akkermansiaceae与结肠炎之间的关联仍然存在争议。Akkermansia涉及炎症和抗炎效应,如通过短链脂肪酸产生诱导Treg细胞或通过粘液降解引发炎症反应。随着结肠炎的恶化,观察到Akkermansia的相对丰度增加,表明这种细菌可能参与结肠炎的发展。然而,鉴于Akkermansia与结肠炎之间复杂的相互作用,有必要详细分析肠道微生物组并确定细菌的特征。
在这项研究中,使用小鼠模型连续测量与体重、LCN2水平和肠道微生物组组成相关的生物气体成分,从实验性结肠炎的开始到症状解决。然而,这项研究由于样本量小而受到限制,与临床研究相比。此外,尽管在临床实践中希望检测呼出气体成分作为生物标志物,但重要的是要注意,本研究中测量的气体是生物气体,其成分是各种因素的综合产物,包括小鼠呼出的气体、肠胃气胀和粪便。所有这些因素都受到肠道微生物组的影响。此外,H2和CO2是肠道细菌的二次代谢产物,它们以呼出的气体和肠胃气胀的形式从体内排出,代谢产物和粪便强烈反映了肠道微生物组的变化。这些结果表明,DSS给药引起的生物气体成分变化可能是由肠道微生物组引起的。因此,在未来,我们将建立一个能够连续测量仅呼出气体成分的实验模型。
总之,这项研究建立了实验性结肠炎严重程度与H2水平之间的负相关关系,这可能由肠道细菌介导。这项研究是有价值的,因为它关注了低分子量的呼出气体成分,这表明H2作为IBD生物标志物的潜在实际应用。
https://blog.sciencenet.cn/blog-41174-1436822.html
上一篇:细菌通过氢气影响肠道激素代谢《细胞》
下一篇:氢水治疗便秘的实验研究