博文
双气体纳米药物在青光眼治疗中的潜力
||
双气体纳米药物在青光眼治疗中的潜力
挖掘光响应性双气体纳米药物在青光眼治疗中尚未开发的潜力

青光眼是全球范围内导致不可逆失明的主要原因之一,其特征为视神经损伤,且常伴有眼内压(IOP)升高。尽管气体疗法在青光眼治疗方面颇具前景,但单一气体策略的局限性制约了其治疗效果。在此,我们研发出一种光响应性双气体纳米药物,用于靶向治疗青光眼。这种名为PdH-D-S的纳米药物的制备过程如下:先合成具有高效储氢(H₂)能力和丰富孔道的介孔氢化钯(meso-PdH),然后用二硬脂酰磷脂酰乙醇胺-聚乙二醇(DSPE-mPEG)对其进行表面修饰,并负载硝普钠(SNP)作为一氧化氮(NO)供体。PdH-D-S能够穿透角膜,抵达包括小梁网和施莱姆氏管在内的调节眼内压的组织。在808纳米激光激发下,PdH-D-S可实现对氢气和一氧化氮的可控释放。氢气能够激活AKT/p-AKT/eNOS/sGC信号通路,而一氧化氮则与可溶性鸟苷酸环化酶(sGC)结合,将三磷酸鸟苷(GTP)转化为环磷酸鸟苷(cGMP),使小梁网细胞松弛,促进房水流出。这种双气体系统在降低眼内压方面展现出了高效的治疗效果,并通过协同气体疗法在青光眼治疗的机制上取得了进展。
1. 引言
青光眼作为不可逆失明的首要病因,给全球健康带来了严峻挑战。这种疾病具有进行性的特点,以眼内压升高和视神经损伤为特征,会导致视力逐渐下降,且往往在病情发展到晚期直至最终失明时才会被察觉。[1] 氧化应激被认为在青光眼的进展过程中起着重要作用,它会损伤小梁网(TM),影响房水流出,进而导致眼内压升高。然而,目前的治疗策略主要集中在降低眼内压以防止视神经进一步受损,却不足以解决推动疾病进展的潜在氧化应激和血管功能障碍问题。[2]
氢气(H₂)是一种具有强大抗氧化特性的分子,[3] 已在多种眼部疾病中表现出抗氧化作用,如白内障和糖尿病视网膜病变。[4] 鉴于氧化应激在青光眼病理生理过程中所起的作用,氢气的抗氧化特性或许具有治疗潜力;然而,支持其对青光眼疗效的直接证据仍然有限。与传统抗氧化剂不同,氢气能够选择性地中和活性氧(ROS),且不会干扰细胞的基本生理过程,这使得它特别适合减轻与青光眼损伤相关的氧化应激。[5] 与此同时,另一种明星气体分子一氧化氮(NO)以及能够释放一氧化氮的药物最近已被研发出来,并在临床上获批用于降低眼内压,[6] 这使得一氧化氮成为青光眼治疗中的明星治疗分子。[7] 这两种气体的结合提供了一种多维度的新方法,不仅能降低眼内压,还能解决青光眼潜在的氧化应激问题。
双气体系统已通过协同作用机制在治疗复杂疾病方面展现出巨大潜力。[8] 一种结合了氢气和一氧化碳(CO)的双气体吸入系统已被证明可以减轻氧化应激,并改善缺血再灌注损伤中的肾功能,与单独使用氢气相比,显示出更优异的细胞保护效果。[9] 同样,已开发出能够同时递送氧气(O₂)和一氧化氮的线粒体靶向、超声响应型纳米颗粒(PIH-NO),增强了声动力疗法的效果,并激发免疫反应以抑制肿瘤生长,改善癌症免疫治疗的效果。[10] 这些研究凸显了双气体系统通过协同机制在治疗复杂疾病方面的治疗潜力。尽管取得了这些成果,但双气体系统在青光眼治疗中的应用仍未得到探索,这是一个关键的知识空白领域。
当涉及多种气体时,将气体输送到眼内的靶组织所面临的挑战进一步加剧了这一知识空白。治疗性气体的低溶解度、通过呼吸或循环的快速清除以及较短的留存时间限制了其生物利用度,而以精确比例同时递送和控制释放多种气体则需要复杂的纳米载体系统。[11] 以所需比例同时且可控地释放多种气体尤其具有挑战性,因为不同气体常常会竞争纳米载体的结合位点,从而降低负载效率。[12] 稳定性是纳米药物的另一个关键考量因素,因为它直接影响药物的包封、靶向递送和治疗效果。[13] 稳定的纳米药物能够提高生物利用度,减少非特异性分布,并将毒性降至最低,满足了对更安全、更有效的治疗方案日益增长的需求。
在本研究中,我们采用了一种巧妙的策略来构建用于青光眼治疗的光响应性双气体纳米药物(示意图1)。在这一设计中,首先合成介孔氢化钯(meso-PdH),它不仅具有高效的储氢能力,还拥有丰富的孔道。随后,用N-(羰基-甲氧基聚乙二醇2000)-1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺(DSPE-mPEG)对介孔氢化钯进行功能化处理以增强其稳定性,同时利用其多孔结构包封硝普钠(SNP)——一种一氧化氮(NO)供体,从而形成稳定的纳米药物PdH-D-S。PdH-D-S能够穿透角膜,并在小梁网和施莱姆氏管(SC)中积累,这二者是参与眼内压(IOP)调节的主要组织。在808纳米激光激发下,PdH-D-S会因热刺激而释放氢气和一氧化氮。氢气和一氧化氮协同激活AKT/p-AKT/eNOS/sGC信号通路,这是眼内压的关键调节途径。我们对这种双气体治疗机制进行了全面的表征,证明了PdH-D-S作为青光眼有效治疗药物的潜力。
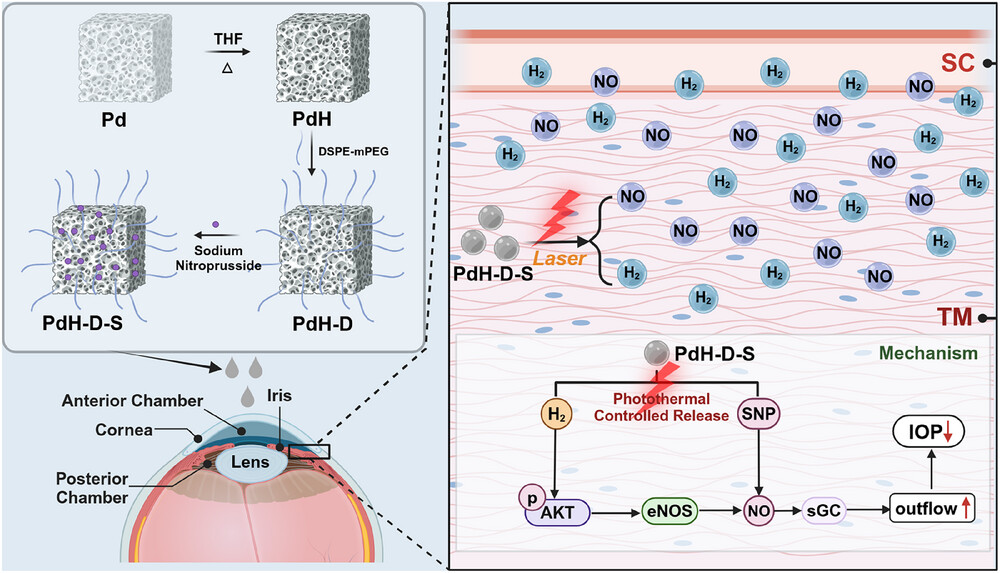
示意图1
PdH-D-S治疗青光眼机制的示意图。在808纳米激光激发下,PdH-D-S产生热刺激,引发氢气和一氧化氮的可控释放。这种双气体的释放促进了房水流出,有效地降低了眼内压,为青光眼提供了一种新的治疗方法。
2. 结果与讨论
2.1 PdH-D-S的合成与表征
青光眼治疗药物PdH-D-S的合成过程如图1a所示。最初,我们通过原位还原与由十六烷基三甲基氯化铵形成的有序柱状胶束相关联的钯前体来合成单金属介孔钯纳米颗粒,使用氯离子(Cl⁻)作为封端剂。介孔钯在四氢呋喃中于高温下进行氢化反应,从而形成介孔氢化钯。在用DSPE-mPEG进行修饰后,再负载硝普钠。通过透射电子显微镜(TEM)观察发现,PdH-D-S的粒径均一,平均粒径约为76.42纳米(图1b;支持信息图S1)。此外,PdH-D-S具有丰富的孔结构,为药物递送提供了合适的结构域(图1c、d;支持信息图S2)。图1e和支持信息图S3中的X射线衍射(XRD)数据表明,与钯的标准峰相比,合成的PdH-D-S的特征峰向较低角度略有偏移。这一观察结果意味着氢原子被纳入了钯晶体的晶格结构中,从而形成了氢化钯。图1f中的傅里叶变换红外(FTIR)光谱显示了PdH-D-S中DSPE-mPEG和SNP的独特峰,表明了DSPE-mPEG的修饰以及SNP的负载。测得的PdH、PdH-D和PdH-D-S的Zeta电位分别为-13.53、-17.87和-26.17毫伏,这进一步证明了DSPE-mPEG修饰的成功以及SNP的负载(图1g)。尽管研究表明,与带负电荷的药物相比,带正电荷的药物通常更易穿透角膜,但其他因素,如药物的大小及其黏膜粘附特性,也会影响其角膜穿透性。[14] 在我们的研究中,该药物的纳米颗粒制剂粒径约为76.42纳米,并且我们用DSPE-mPEG对药物表面进行了修饰以形成纳米胶束。这种表面修饰提高了药物在眼表的留存率,因此尽管纳米颗粒带负电荷,仍有助于其有效地穿透角膜。[15] 通过动态光散射测定,PdH-D-S的平均直径约为168.9纳米(图1h)。高角度环形暗场扫描透射电子显微镜的元素映射图像为PdH-D-S中存在钯、钠、铁、氮、磷、氧和碳元素提供了额外的证据(图1i;支持信息图S4)。如图1j和支持信息图S5所示,通过X射线光电子能谱(XPS)也鉴定出了所有这些元素。这些发现表明,青光眼治疗药物PdH-D-S已成功研发出来。

图1 PdH-D-S的表征。a)青光眼治疗药物PdH-D-S的合成。b、c)PdH-D-S的透射电子显微镜(TEM)图像和d)高倍透射电子显微镜图像,(b)、(c)和(d)中的比例尺分别为50、10和5纳米。e)X射线衍射(XRD)图谱,f)傅里叶变换红外(FTIR)光谱,g)Zeta电位,h)流体动力学直径,i)元素映射图像,以及j)PdH-D-S的X射线光电子能谱(XPS)全谱图。
2.2 光热性能、光响应性氢气释放以及一氧化氮产生能力
为了验证PdH-D-S的性能,我们使用了紫外-可见分光光度计、温度探测器和电子自旋共振(ESR)光谱仪(图2a)。如图2b所示,PdH-D-S在400至900纳米范围内具有广泛的吸收范围,这使得它在受到808纳米激光照射时能够产生光热效应。为了研究PdH-D-S的光热能力与其浓度之间的关系,我们在808纳米激光照射下对不同浓度(0、12.5、25和50微克/毫升)的PdH-D-S水溶液进行了测量。PdH-D-S水溶液的温度随着浓度和时间的增加而逐渐升高,这表明PdH-D-S能够有效地将近红外能量转化为热量,这有利于促进氢气和一氧化氮的释放,加速房水流出,从而降低眼内压(图2c;支持信息图S6)。此外,图2d表明,PdH-D-S的光热性能在几个激光开关循环中保持一致,证明了其出色的光热稳定性。
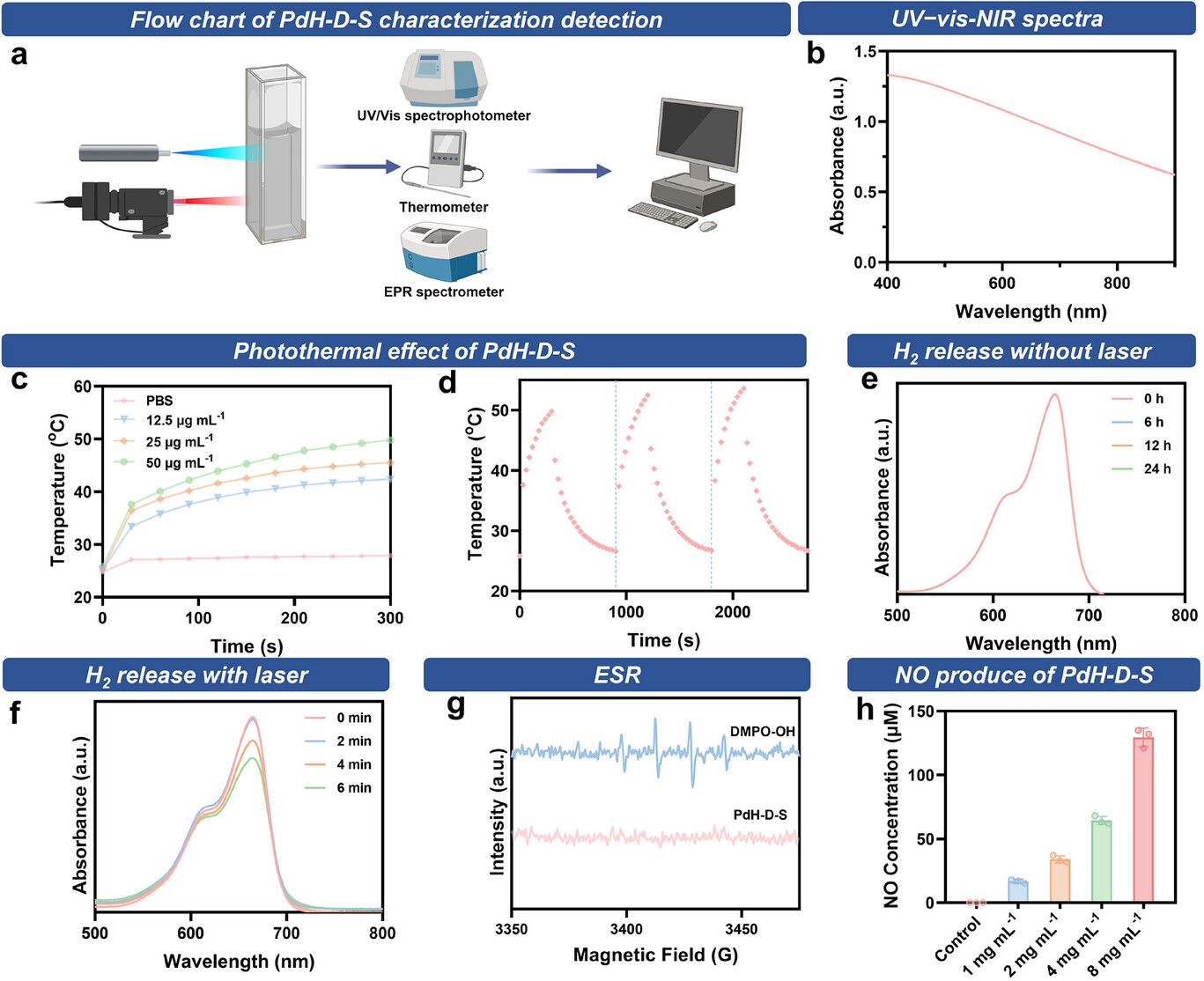
图2 PdH-D-S的光热性能、光响应性氢气释放以及一氧化氮产生能力。a)PdH-D-S表征检测流程图。b)PdH-D-S水悬浮液的紫外-可见-近红外光谱。c)不同浓度的PdH-DS水溶液在近红外激光照射5分钟时的光热曲线。d)PdH-D-S水分散液在3个照射循环中的光热曲线。PdH-D-S + 亚甲基蓝(MB)溶液在e)无近红外照射和f)有近红外照射时的随时间变化的吸收光谱。g)使用5-二甲基-1-吡咯啉-N-氧化物(DMPO)作为自旋捕获剂捕获各种羟基自由基(•OH)的电子自旋共振(ESR)光谱曲线。h)不同浓度的PdH-D-S产生的一氧化氮含量。
在四氢呋喃(THF)环境中,钯(Pd)发生反应后,氢气被引入钯的晶格中形成氢化钯(PdH)。为了表征PdH-D-S中氢气的光响应性释放,我们使用亚甲基蓝(MB)作为氧化探针来检测氢气。亚甲基蓝可用作活性氢气的氧化探针,以进一步分析在近红外辐射下从PdH-D-S中释放出的氢气。根据亚甲基蓝探针的氢气检测机制以及比尔-朗伯定律,亚甲基蓝在664纳米处的特征吸收峰的吸光度变化可用于量化释放的氢气(支持信息图S7)。通过实时监测有无808纳米激光照射下亚甲基蓝的紫外-可见吸收光谱,来评估PdH-D-S的氢气释放情况。在808纳米激光照射下,含有PdH-D-S的亚甲基蓝溶液在664纳米处的紫外-可见吸收光谱显著下降。相比之下,在没有808纳米激光照射时,光谱没有明显变化,这表明PdH-D-S具有响应近红外光释放氢气的特性(图2e、f)。此外,如图2g所示,在808纳米激光照射后,羟基自由基(•OH)的特征电子自旋共振(ESR)峰消失了,这表明氢气可以清除活性氧(ROS)。得益于PdH-D-S丰富的介孔结构,它能够有效地负载硝普钠(SNP),从而大量递送一氧化氮(NO)。如图2h和支持信息图S8所示,一氧化氮的产生量随着PdH-D-S浓度的增加而增加,并且在激光照射条件下加速产生,这表明一氧化氮的产生既与浓度相关,又具有光响应性。此外,图2e、f和支持信息图S8表明,在没有激光照射的情况下,PdH-D-S释放的氢气和一氧化氮极少,而在激光激活时则能实现氢气和一氧化氮的响应性可控释放。这表明PdH-D-S具有优异的稳定性,这确保了它能够将药物分子递送到靶细胞或组织,提高药物的生物利用度和治疗效果,并减少毒性反应。上述数据表明,PdH-D-S具有光热性能以及光响应性释放氢气和一氧化氮的能力,这为其在体内的应用奠定了基础。
2.3 生物相容性
我们使用CCK-8法评估了PdH-D+L和PdH-D-S+L的细胞毒性,重点关注房水流出通路中的关键细胞。在使用不同浓度的PdH-D和PdH-D-S处理24小时后,人小梁网细胞(HTMCs)和人角膜上皮细胞(HCECs)的细胞存活率保持在95%以上(支持信息图S9)。在用不同浓度的PdH-D-S处理48小时和72小时后,人小梁网细胞和人角膜上皮细胞的细胞存活率仍保持在80%以上,这表明PdH-D和PdH-D-S的细胞毒性极小(支持信息图S10)。为了确认激光照射的安全性,我们评估了其对细胞存活率的影响,结果显示没有显著影响,进一步证明了这种治疗方法的安全性(图3a、b)。这些发现表明,PdH-D+L和PdH-D-S+L具有良好的生物相容性,使其成为青光眼治疗应用的合适候选药物。在关键眼细胞中观察到的高细胞存活率,再加上激光照射没有产生不良影响,突显了这些纳米药物在不损害细胞功能的情况下安全融入青光眼治疗方案的潜力。
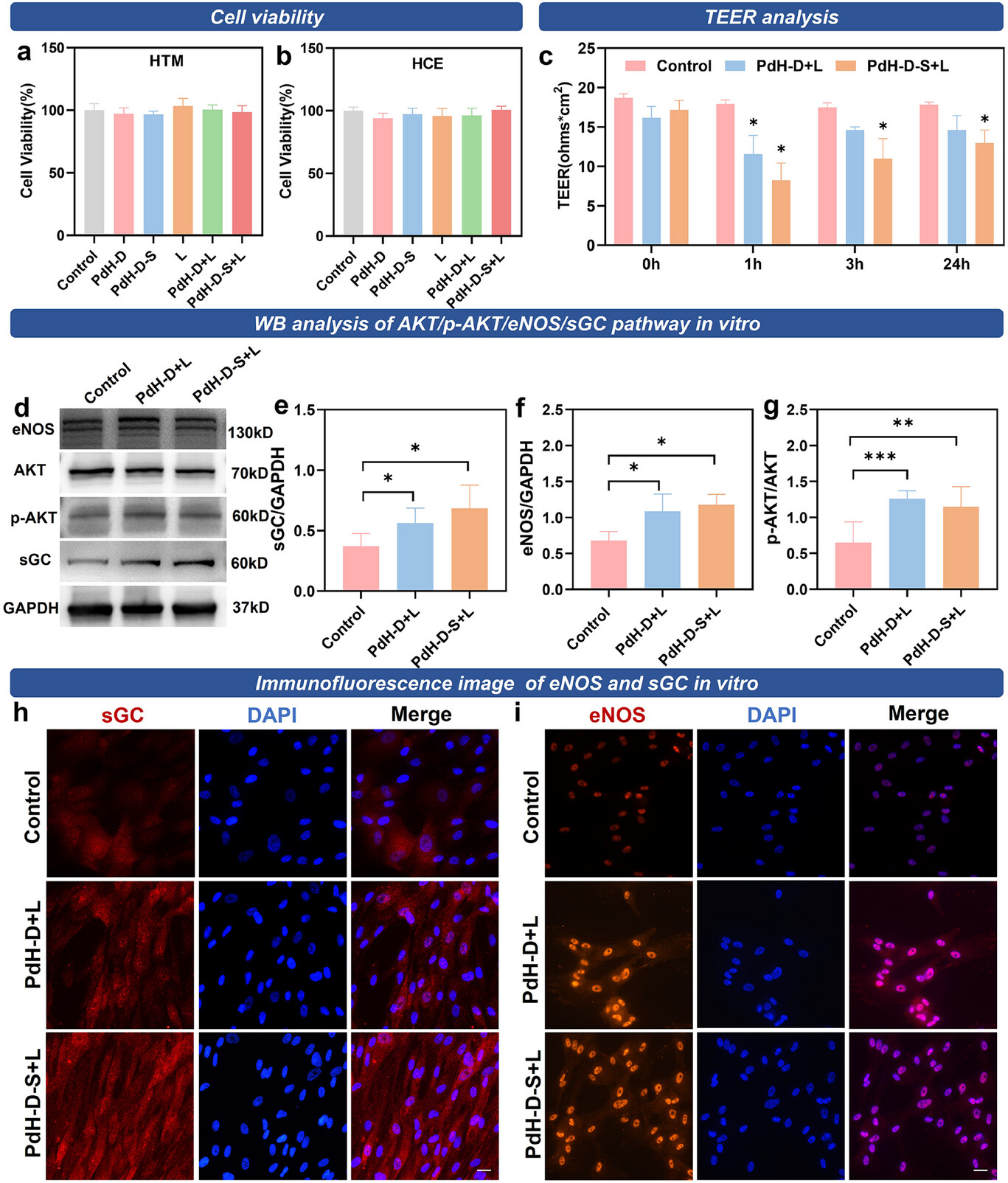
图3 PdH-D和PdH-D-S对细胞功能的影响。a)不同处理后人小梁网细胞(HTMCs)的细胞存活率。n = 6。b)不同处理后人角膜上皮细胞(HCECs)的细胞存活率。n = 6。c)用PdH-D+L和PdH-D-S+L处理0、1、3和24小时后,角巩膜缘房水静脉丛(AAP)细胞的跨内皮电阻(TEER)。n = 3,* p <0.05。d–g)人小梁网细胞中可溶性鸟苷酸环化酶(sGC)(n = 7,* p <0.05)、内皮型一氧化氮合酶(eNOS)(n = 3,* p <0.05)、蛋白激酶B(AKT)/磷酸化蛋白激酶B(p-AKT)(n = 7, p <0.01,* p <0.001)蛋白表达的蛋白质免疫印迹分析。h)人小梁网细胞中可溶性鸟苷酸环化酶免疫荧光的代表性图像。蓝色,4',6-二脒基-2-苯基吲哚(DAPI)。红色,可溶性鸟苷酸环化酶。比例尺 = 100微米。i)人小梁网细胞中内皮型一氧化氮合酶免疫荧光的代表性图像。蓝色,4',6-二脒基-2-苯基吲哚(DAPI)。红色,内皮型一氧化氮合酶。比例尺 = 100微米。
2.4 PdH-D-S在人小梁网细胞中的摄取情况
PdH-D-S均匀的小尺寸结构有利于细胞摄取。随后,我们评估了异硫氰酸荧光素(FITC)标记的PdH-D-S在人小梁网细胞中的摄取情况(支持信息图S11)。在细胞摄取实验中,在暴露于FITC标记的PdH-D-S后的前3小时内,人小梁网细胞内的荧光强度显著增加,这表明这些纳米药物被有效地摄取。荧光强度的显著增强表明FITC-PdH-D-S被细胞内化并在细胞内积累。3小时后,荧光强度逐渐下降,到24小时时几乎检测不到,这表明人小梁网细胞成功内化并代谢了这些颗粒。这一结果支持了FITC标记的PdH-D-S在人小梁网细胞中被有效摄取和随后代谢的结论。
2.5 通过增强角巩膜缘房水静脉丛细胞的通透性来调节房水流出
为了了解PdH-D+L和PdH-D-S+L在调节房水流出方面的潜在作用,我们评估了它们对角巩膜缘房水静脉丛(AAP)内皮细胞通透性的影响,这些细胞在功能上类似于人施莱姆氏管内皮细胞(图3c)。据推测,角巩膜缘房水静脉丛细胞通透性的增强有助于增加房水流出,从而可能有助于降低眼内压。[16]
在暴露于PdH-D+L 1小时后,角巩膜缘房水静脉丛细胞的跨内皮电阻(TEER)下降了35.58%,这表明细胞通透性显著增加。对于PdH-D-S+L,暴露1小时、3小时和24小时分别导致跨内皮电阻下降53.98%、37.11%和27.16%。这些结果表明,PdH-D+L和PdH-D-S+L都能有效地增加角巩膜缘房水静脉丛内皮细胞的通透性,从而增强房水流出,并有可能降低眼内压。这一机制突显了这些纳米药物通过调节内皮细胞通透性来治疗青光眼的潜力。[17]
研究表明,一氧化氮对细胞屏障功能的影响相对短暂。[16] PdH-D-S激活磷酸化蛋白激酶B(pAKT)/蛋白激酶B(AKT)信号通路,进而激活内皮型一氧化氮合酶(eNOS)并刺激一氧化氮的产生。产生的一氧化氮可以通过可溶性鸟苷酸环化酶(sGC)信号通路调节施莱姆氏管的通透性。具体而言,一氧化氮可能通过使血管松弛、调节细胞间的紧密连接、减小细胞体积以及增加细胞间孔隙的密度来增加施莱姆氏管的通透性,从而影响房水流出。[18, 19] 这一机制似乎是可逆的。[20] 具体来说,在PdH-D-S+L条件下,1小时、3小时和24小时后,跨内皮电阻分别下降了53.98%、37.11%和27.16%。这种逐渐恢复表明,跨内皮电阻最初的下降确实是可逆的。此外,CCK-8实验证实细胞存活率没有受到影响,这表明跨内皮电阻的下降并非由细胞损伤引起。体内研究也证实了这些发现,揭示出PdH-D-S降低眼内压的效果是暂时的,持续时间约为3小时。这种短暂性支持了PdH-D-S引起的跨内皮电阻变化是可逆的,且不会永久性损害细胞屏障完整性的假设。
2.6 对细胞功能相关关键蛋白的调节
AKT/p-AKT/eNOS/sGC信号通路在眼内压的调节中起着关键作用,在青光眼的病理生理学和治疗中至关重要。该信号通路的激活是促进细胞存活、代谢、血管舒张以及小梁网松弛的关键调节机制,小梁网是负责将房水排出眼球的主要组织。[21] 可溶性鸟苷酸环化酶的下游激活会放大这一信号级联反应,导致环磷酸鸟苷(cGMP)的产生增加,从而增强小梁网中平滑肌细胞的松弛。一些研究表明,氢气激活AKT信号通路,促进细胞存活和修复,同时通过减轻氧化应激和炎症发挥神经保护作用。[22] 因此,我们推测氢气是否也可以通过激活AKT信号通路来调节眼内压。
基于上述假设,我们进一步研究了PdH-D+L和PdH-D-S+L对细胞功能的分子机制。蛋白质免疫印迹分析显示,用PdH-D+L和PdH-D-S+L处理后,人小梁网细胞中可溶性鸟苷酸环化酶的表达分别增加了1.51倍和1.83倍(图3d、e、f、g)。此外,PdH-D+L和PdH-D-S+L处理使这些细胞中内皮型一氧化氮合酶的表达分别提高了1.58倍和1.73倍。此外,这些处理还导致人小梁网细胞中磷酸化蛋白激酶B/蛋白激酶B的表达比值分别上调了1.49倍和1.36倍。
免疫荧光进一步证实了这些结果,结果显示可溶性鸟苷酸环化酶的荧光定位于质膜内(图3h、i)。暴露于PdH-D+L和PdH-D-S+L后,可溶性鸟苷酸环化酶的荧光显著增加。此外,在内核和质膜中均观察到了内皮型一氧化氮合酶的荧光。在用PdH-D+L和PdH-D-S+L处理后,内皮型一氧化氮合酶的荧光也显著增强。这些发现表明,PdH-D+L和PdH-D-S+L显著增强了人小梁网细胞中可溶性鸟苷酸环化酶和内皮型一氧化氮合酶等眼内压关键调节蛋白的表达,以及AKT信号通路的激活。
2.7 异硫氰酸荧光素标记的PdH-D-S在眼内的分布情况
异硫氰酸荧光素(FITC)标记的PdH-D-S的分布研究为这种新型纳米药物在眼内的药代动力学提供了重要信息,这对于其在青光眼治疗中的应用至关重要(图4)。PdH-D-S固有的负电位有助于其穿透角膜屏障,使其能够有效地定位于前房内,尤其是在小梁网处。这一特性显著提高了它将治疗药物精确递送到负责房水流出的主要部位的能力,突显了其在推进青光眼治疗策略方面的潜力。[11, 23]
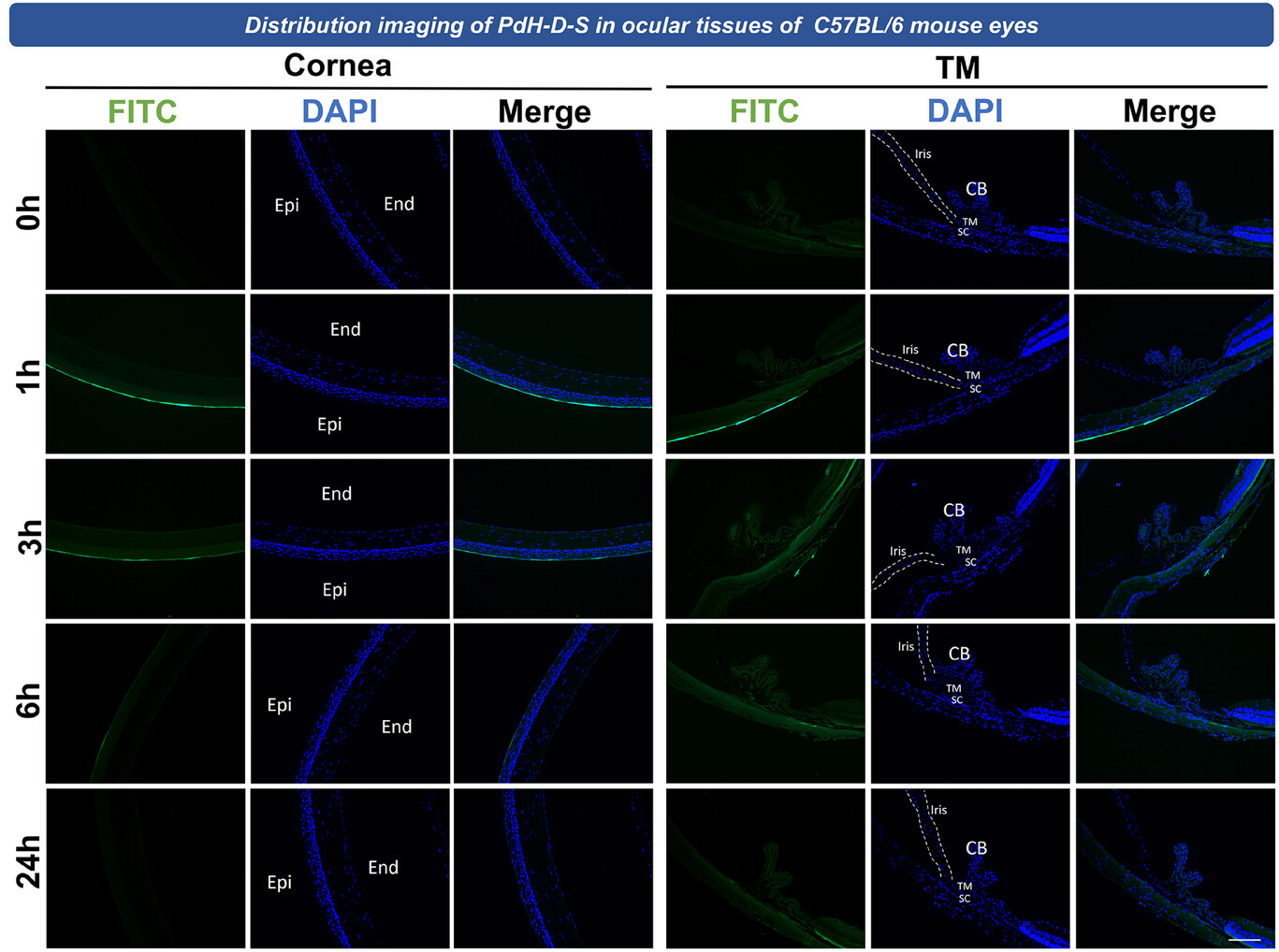
图4 异硫氰酸荧光素(FITC)标记的PdH-D-S在角膜和小梁网的分布。在局部应用FITC标记的PdH-D-S后的0、1、3、6和24小时收集眼睛并切片,以检查纳米药物在眼组织内的分布情况。这一时间过程分析突出了FITC标记的PdH-D-S在角膜和小梁网(眼内压调节的关键区域,也是治疗干预的靶点)中的存在和持续情况。比例尺 = 100微米。
在应用后1小时内,荧光在角膜和小梁网中最初的积累表明,PdH-D-S能够迅速到达预期的眼组织。这种快速穿透很可能是由PdH-D-S的介孔结构促进的,该结构可能增强了它穿过角膜上皮的扩散能力。纳米药物在小梁网中的存在尤为重要,因为这是参与调节房水流出、进而调节眼内压的关键组织。通过到达这一部位,PdH-D-S能够更直接、有效地发挥其预期的治疗效果。
在24小时内荧光逐渐下降,这表明PdH-D-S会随着时间的推移在眼组织内进行代谢和清除。这一时间特征对于理解其作用持续时间以及在临床环境中重复给药的必要性至关重要。荧光下降还表明,PdH-D-S不会在眼组织内无限期地留存,从而降低了长期积累和潜在毒性的风险。这一特性可能允许进行可控的、可重复的给药,这对于像青光眼这样需要持续管理的慢性疾病来说至关重要。此外,PdH-D-S能够穿透角膜并定位于小梁网,随后被清除,这表明这种纳米药物非常适合局部应用——这是一种在临床环境中更可取的非侵入性给药途径。
2.8 PdH-D-S降低眼内压(IOP)的作用
氢气在青光眼研究中的主要关注点在于其抗氧化特性。鉴于青光眼通常涉及由于眼内压升高导致的视神经损伤,分子氢的抗氧化和抗炎作用可能是有益的。[5, 24] 然而,在治疗环境中递送氢气面临着挑战。
为了解决这一问题,我们设计并合成了能够递送氢气的介孔氢化钯。[25] PdH-D溶液作为眼药水使用时,有效地降低了一氧化氮合酶3基因敲除(NOS3 KO)小鼠的眼内压。小鼠是除灵长类动物外少数拥有真正施莱姆氏管的动物模型之一,尽管它们的眼睛较小且存在一些解剖学差异,但这使得它们在青光眼研究中具有独特的价值。此外,由于小鼠具有遗传易处理性和成本效益,它们作为实验模型具有明显的优势。[26] 在浓度为400微克/毫升时,PdH-D在1小时时使眼内压降低了5.39%(眼内压变化量ΔIOP = -0.88 ± 0.64毫米汞柱,p = 无显著性差异,n = 5),在3小时时降低了2.32%(ΔIOP = -0.38 ± 0.42毫米汞柱,p = 无显著性差异,n = 5)(图5a)。值得注意的是,在808纳米激光照射10分钟后,PdH-D在1小时时使眼内压降低了8.43%(ΔIOP = -1.42 ± 0.53毫米汞柱,*p <0.05,n = 5),在3小时时降低了5.44%(ΔIOP = -0.92 ± 0.56毫米汞柱,p = 无显著性差异,n = 5)(图5b)。此外,我们的研究表明,给予氢水(0.6–2毫克/升,氢气压缩于水中,1毫升×3次)会导致眼内压轻微且暂时的降低。在肌球蛋白样蛋白(MYOC)基因敲除小鼠中,这种效果在1小时时仅持续7.02%(n = 8,*p <0.05),在3小时时为4.15%(n = 8,p = 无显著性差异);在小凹蛋白1(CAV1)基因敲除小鼠中,1小时时为6.44%(n = 7,*p <0.05),3小时时为6.63%(n = 7,p = 无显著性差异)(支持信息图S12)。

图5 PdH-D-S+L降低眼内压的情况
a–d)PdH-D和PdH-D-S对一氧化氮合酶3基因敲除(NOS3 KO)小鼠的降眼压作用。给NOS3 KO小鼠的一只眼睛滴入浓度为400微克/毫升的PdH-D和PdH-D-S眼药水,对侧眼睛滴入磷酸盐缓冲液(PBS)作为对照。一部分小鼠接受10分钟的激光照射(L),另一部分则不做处理。在处理后1小时和3小时使用回弹式眼压计测量眼内压(n = 6,*p <0.05)。数据以平均值±标准差(SD)表示。NOS3 KO小鼠在不同处理条件下的眼内压变化分别在e)1小时和f)3小时进行统计。g)PdH-D-S+L调节眼内压的分子机制示意图。h–k)蛋白质免疫印迹分析显示,在PdH-D+L和PdH-D-S+L处理后,可溶性鸟苷酸环化酶(sGC)(n = 3, p <0.01)、内皮型一氧化氮合酶(eNOS)(n = 3, p <0.01)、蛋白激酶B(AKT)/磷酸化蛋白激酶B(p-AKT)(n = 4,* p <0.05)的蛋白表达情况。i)房水流出组织中内皮型一氧化氮合酶和可溶性鸟苷酸环化酶的代表性免疫荧光图像。比例尺 = 100微米。
氢气除了具有降低眼内压的作用外,还以其抗炎和抗氧化特性而闻名,它被引入作为治疗青光眼的新型治疗剂。[4] 这种双气体系统在激光激活下与一氧化氮协同作用,提供了一种独特且创新的治疗方法。通过将氢化钯(PdH)与一氧化氮供体硝普钠(SNP)结合,PdH-D-S在降低眼内压方面取得了更好的效果。在浓度为400微克/毫升时,PdH-D-S溶液在1小时时使眼内压降低了6.80%(眼内压变化量ΔIOP = -1.12 ± 0.61毫米汞柱,p = 无显著性差异,n = 5),在3小时时降低了5.18%(ΔIOP = -0.86 ± 0.57毫米汞柱,p = 无显著性差异,n = 5)(图5c)。在激光照射后,400微克/毫升的PdH-D-S在1小时时有效地使眼内压降低了15.80%(ΔIOP = -2.74 ± 0.48毫米汞柱,p <0.005,n = 5),在3小时时降低了7.25%(ΔIOP = -1.26 ± 0.39毫米汞柱,*p <0.05,n = 5)(图5d)。在没有激光照射的情况下,PdH-D和PdH-D-S在调节眼内压方面没有显著差异,这可能是因为在这些条件下没有氢气和一氧化氮的释放(图5e、f)。我们的相关论文介绍了RhNO-Ab,它为原发性开角型青光眼(POAG)的治疗提供了一种新颖且更安全的方法,具有精确的、组织特异性的一氧化氮释放和实时监测的特点(adhm.202404221)。相比之下,本研究将氢气(H₂)引入作为青光眼治疗中的一种新的治疗分子。通过在双气体纳米药物系统(PdH-D-S)中结合氢气和一氧化氮的递送,这种方法代表了一种开创性的策略,超越了单一气体的作用机制。
在PdH-D-S平台内同时释放氢气和一氧化氮代表了青光眼治疗的重大进展。这种综合方法解决了青光眼管理中几个关键且尚未满足的需求,包括高眼压、眼部血流受损和视网膜神经退行性变。[27] 传统的降低眼内压的疗法,如前列腺素类似物和β受体阻滞剂,主要侧重于降低眼内压,但未能针对青光眼的血管因素,也无法提供对氧化应激和神经退行性变的保护。[28] 这些局限性突显了需要更全面的治疗策略,能够同时应对青光眼的多因素性质。PdH-D-S在808纳米激光照射下产生的光热效应通过促进氢气/一氧化氮气体的释放,进一步增强了这些治疗效果。
将这些协同效应整合到一个单一的治疗平台中,PdH-D-S为青光眼的管理提供了一种新颖且全面的方法。这个平台不仅能有效地控制眼内压,还能解决导致疾病进展的血管缺陷和氧化应激问题。通过提供机械和神经保护方面的益处,PdH-D-S有潜力显著改善患者的治疗效果,特别是对于那些现有疗法效果不佳的晚期青光眼患者。因此,这种创新策略代表了青光眼治疗向前迈出的有意义的一步,以传统疗法无法做到的方式应对这种疾病复杂的病理生理学。
2.9 降低眼内压的分子机制
我们在小梁网(TM)这个调节眼内压的关键房水流出组织上进一步验证了降低眼内压的机制(图5g)。蛋白质免疫印迹分析显示,用PdH-D和PdH-D-S处理后,磷酸化蛋白激酶B/蛋白激酶B(p-AKT/AKT)的表达比值分别增加了1.35倍和1.59倍(图5h、i、j、k)。此外,这些处理分别使内皮型一氧化氮合酶(eNOS)的表达显著上调了3.23倍和2.97倍。而且,用PdH-D处理使可溶性鸟苷酸环化酶(sGC)的表达提高了1.45倍,用PdH-D-S处理则使其表达提高了1.86倍。这些发现表明,PdH-D和PdH-D-S的降眼压作用是通过激活AKT/p-AKT/eNOS/sGC信号通路来介导的。
免疫荧光分析进一步支持了这些观察结果(图5l)。用PdH-D和PdH-D-S处理后,在小梁网和施莱姆氏管(房水流出的关键组织)中,内皮型一氧化氮合酶的荧光强度明显增加。此外,在用PdH-D和PdH-D-S处理后,均观察到可溶性鸟苷酸环化酶的荧光显著增强。这些结果共同表明,PdH-D和PdH-D-S有效地激活了AKT/p-AKT/eNOS/sGC信号通路,从而促进了眼内压的调节,并为青光眼的管理提供了一种新的治疗方法。活性可溶性鸟苷酸环化酶催化三磷酸鸟苷(GTP)转化为环磷酸鸟苷(cGMP)。环磷酸鸟苷作用于蛋白激酶G(PKG),蛋白激酶G使各种靶点磷酸化,从而导致小梁网细胞和施莱姆氏管内皮细胞松弛。这种松弛降低了房水流出的阻力,从而降低了眼内压。这种双气体系统不仅增强了房水流出,还解决了潜在的氧化应激问题,为疾病干预提供了一个全面的策略。PdH-D和PdH-D-S能够有效地激活这一信号通路,突显了它们作为创新治疗剂针对青光眼潜在机制的潜力。
2.10 PdH-D-S的体内安全性评估
为了确保PdH-D-S与眼组织的相容性,我们评估了PdH-D-S结合808纳米激光照射10分钟的体内安全性。通过裂隙灯检查和苏木精-伊红(H&E)染色来评估角膜的完整性。H&E染色结果表明,在PdH-D-S+L处理后,角膜上皮或基质的厚度没有明显变化,内皮细胞的数量也没有减少(图6)。此外,在PdH-D-S+L给药后的1至10天内进行的裂隙灯检查显示,没有出现明显的病理状况,如角膜溃疡、糜烂、充血、水肿或结膜出血(图6;支持信息图S13)。小鼠角膜的荧光素钠染色也没有显示出可见的荧光点或点状染色,证实了角膜上皮没有缺损。这些发现共同表明,当PdH-D-S与激光照射结合使用时,不会损害角膜的完整性,并且在体内具有良好的耐受性,支持了它作为青光眼治疗的安全治疗选择的潜力。

图6 体内安全性评估
局部应用PdH-D-S并经808纳米激光照射10分钟后10天,C57BL/6小鼠眼睛的荧光素钠染色图像。局部应用PdH-D-S+L后10天,C57BL/6小鼠眼睛的大体图像(比例尺 = 625微米)、角膜图像和小梁网图像的苏木精-伊红(H&E)染色,比例尺 = 200微米。
在查阅相关文献后,我们认识到当温度高于约45°C时,可能会发生眼部热损伤。[29] 在对PdH-D-S平台的光热性能评估中,我们在室温下对浓度分别为0、12.5、25和50微克/毫升的1毫升样品进行了808纳米激光照射(1.0瓦/平方厘米,照射5分钟)的测试。具体剂量分别相当于每毫升中含有0、12.5、25和50微克的PdH-D-S。对于浓度为12.5、25和50微克/毫升的样品,产生的温度分别测量为42.4°C、45.5°C和49.8°C。然而,体内应用的剂量显著减少,仅为6微升(400微克/毫升),含有2.4微克的PdH-D-S。与体外实验设置相比,这个极小的量产生的热量要少得多,因此大大降低了眼表达到有害温度的可能性。此外,在体内应用过程中,眼部生理固有的散热机制进一步减轻了温度升高的影响。泪液流动有助于散热,而周围环境的吸收进一步缓和了任何潜在的热影响。这些安全性实验结果进一步支持了我们的观点,即体内实验中观察到的温度升高始终保持在安全范围内,从而防止了对眼组织的热损伤。
钯的不可生物降解性可能会引发对其在组织中长期积累的潜在担忧。然而,在本研究的背景下,剂量和治疗持续时间相对较短,这可能有助于减轻与积累相关的风险。未来的研究将评估更长时间(几个月或更长时间)的安全性,以进一步了解其潜在的长期影响。
3. 结论
总之,本研究提出了一种巧妙的策略,用于构建用于青光眼治疗的光响应性双气体纳米药物。当纳米药物穿透角膜并到达小梁网和施莱姆氏管时,在808纳米激光激发下,PdH-D-S产生的热刺激会促使氢气和一氧化氮以可控的方式双重释放,使纳米药物能够有效地降低眼内压,并激活AKT/p-AKT/eNOS/sGC信号通路。这种创新方法巧妙地整合了双气体疗法,为青光眼的管理提供了一条充满希望的新途径。
https://blog.sciencenet.cn/blog-41174-1479240.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:禁食减肥风靡一时:对健康有什么好处?