博文
神经元中的表观遗传标记设定昼夜节律  精选
精选
|
神经元中的表观遗传标记设定昼夜节律
大脑中源自神经递质分子的化学物质可作为组蛋白上的表观遗传标记,调控基因表达。这些标记控制着生物钟基因并影响行为。
遗传信息编码在DNA中,但这些信息的表达取决于转录机制对DNA的可及性。对包裹DNA的组蛋白进行化学修饰会影响DNA的可及性及转录过程。在过去几十年里,人们已经发现并描述了几种此类修饰,即表观遗传标记,包括组蛋白的乙酰化、甲基化和磷酸化。这些标记由“书写”酶添加,由“擦除”酶去除,并由介导下游细胞反应的“读取”蛋白识别。表观遗传标记的水平在细胞生命过程中或对外界刺激作出反应时常常会发生波动,但若它们在错误的时间出现在错误的位置,就会改变基因表达程序,错误地开启或关闭基因,进而引发健康问题。在《自然》杂志上,郑等人对在神经元中发现的一种表观遗传标记进行了表征,并探究了其在调控行为模式方面的作用。
多年来,利用常规细胞模型研究组蛋白修饰一直是表观遗传学研究的重点,但在神经元中对其进行研究却极具挑战性。直到2019年,开创性的研究才确定了通常被视为大脑中化学信使的分子——单胺类物质血清素和多巴胺——是组蛋白修饰的来源。而表观遗传机制如何调控这些源自单胺的组蛋白修饰仍不清楚。
在目前这项工作中,郑等人确定了一种源自组胺(一种调节神经元功能的单胺分子)的表观遗传标记在神经元信号传导中的作用。作者表明,组蛋白H3的第五个谷氨酰胺氨基酸残基(H3Q5)上添加组胺基(组胺化作用)是由一种名为转谷氨酰胺酶2(TG2)的酶“书写”的。
作者发现,TG2不仅可充当“书写”酶,还能作为“擦除”酶。由于TG2既能添加又能去除表观遗传标记,它实际上起着一种“交换”酶的作用,介导组蛋白组胺化、血清素化和多巴胺化之间的转换。这种交换机制涉及一个化学反应,即TG2的半胱氨酸氨基酸残基与H3Q5发生反应,形成一种中间化合物,该化合物再与单胺神经递质的氨基发生反应,产生单胺化的H3Q5。对TG2的半胱氨酸进行突变会使该反应失效,这证实了这个残基对TG2的交换活性至关重要。这是首次报道此类交换酶,它将已知的表观遗传学相关因子的网络扩展到了书写酶、擦除酶和读取蛋白之外。是否存在其他交换酶是一个有待进一步研究的成熟课题。
用甲基对组蛋白H3的第四个赖氨酸残基(H3K4)进行修饰是一种广泛存在的与转录激活相关的表观遗传标记。由于赖氨酸4与发生组胺化作用的谷氨酰胺5位点相邻,郑及其同事探究了这些位点之间是否存在功能性的相互作用。他们发现,组胺化的H3Q5(H3Q5his)会阻止“书写”酶MLL1对H3K4进行甲基化(产生一种名为H3K4me的标记)。此外,与能增强“读取”蛋白WDR5与组蛋白H3结合的血清素化H3Q5(H3Q5ser)不同,H3Q5his会减弱WDR5的结合。
作者提出,带正电荷的组胺基与WDR5的H3结合口袋中带正电荷的赖氨酸残基之间的排斥作用是导致结合减弱的原因,对WDR5进行的突变证实了这一推测。在基因组中富含H3Q5his的区域发现了高水平的突变型WDR5,这种共定位与这些位置上基因表达的增加相关。
大脑中唯一富含释放组胺神经元的区域是下丘脑结节乳头核(TMN)。作者发现,H3Q5his在该大脑区域富集。由于TMN参与昼夜节律(即身体内部的生物钟,控制着在24小时周期内某些生理功能出现的时间),郑等人接下来研究了TMN中的神经元是否呈现节律性基因表达,以及这是否依赖于H3Q5his。
对在24小时内定期采集的小鼠TMN组织进行基因组分析,结果显示出节律性的基因表达模式,以及H3Q5his水平的显著波动。在小鼠清醒且活跃时检测到的水平最高,而在小鼠不活跃时水平最低。值得注意的是,这些波动在生物钟基因中尤为突出,生物钟基因编码的蛋白质可控制昼夜节律。此外,当郑等人用镇静剂对活跃的小鼠进行处理以人工诱导其不活跃阶段时,基因组中(尤其是在一组受转录因子CLOCK和BMAL1调控的生物钟基因处)的H3Q5his、H3Q5ser和WDR5的水平都降低了。
单胺化的H3Q5标记在昼夜节律中是否具有因果作用呢?郑等人将一种缺乏谷氨酰胺5的组蛋白H3突变体(因此无法被单胺基团修饰)引入小鼠的TMN神经元中。尽管在表达正常H3的小鼠中能观察到大量基因(包括已确定的生物钟基因)呈现节律性基因表达,但在突变样本中,转录节律性丧失了。最后,作者检测了动物行为:通过测量小鼠一整天在笼子里移动的距离来评估其自发活动能力。携带突变型H3的小鼠在白天的自发活动能力受损,并且在活跃与不活跃阶段转换时存在明显的运动缺陷。
郑及其同事阐明了一种依赖组胺化作用的复杂机制,通过该机制,TMN控制着昼夜节律(图1)。未来的研究仍存在几个问题。除了H3Q5之外,其他谷氨酰胺位点是否会发生组胺化作用?除了H3K4me之外,相邻的表观遗传标记对组胺化作用有何影响,反之亦然?H3Q5his如何影响针对H3K4me的众多书写酶、擦除酶和读取蛋白家族的结合及活性?
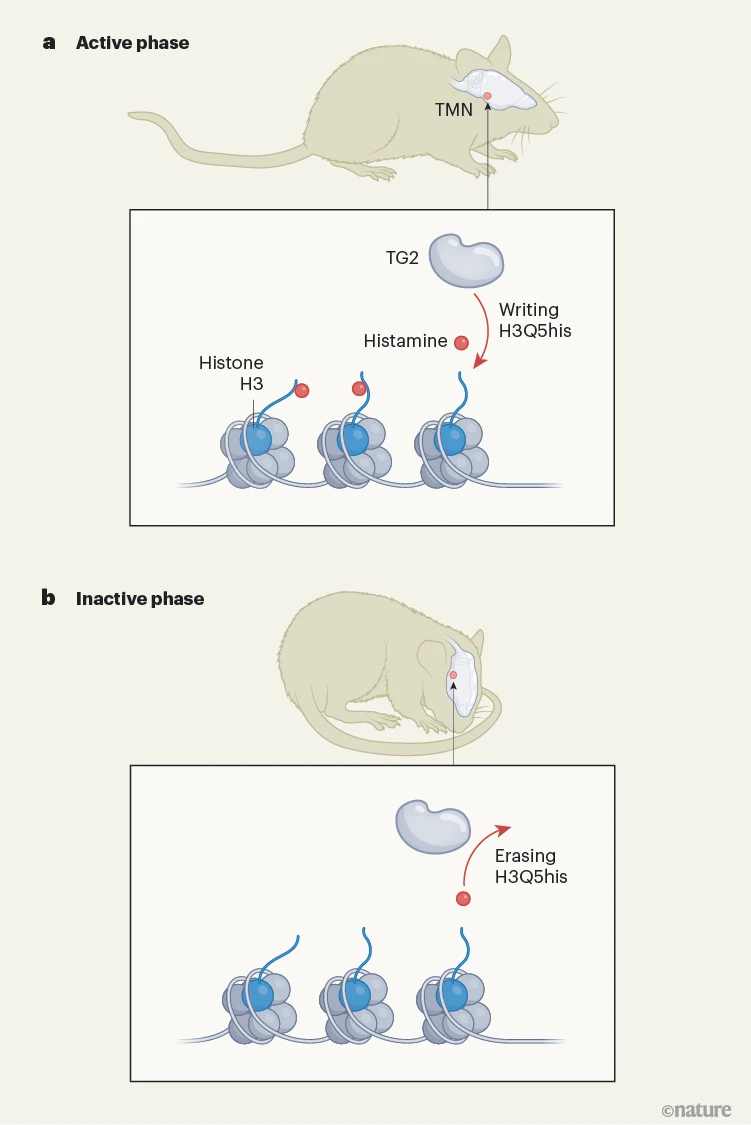
图1 | 一种神经元表观遗传标记。a,大脑中一个名为结节乳头核(TMN)的区域参与昼夜节律,即身体的24小时生物钟。该区域富含释放神经递质分子组胺的神经元。郑等人表明,组胺能够修饰包装DNA的组蛋白,产生一种影响基因表达和行为的表观遗传标记。转谷氨酰胺酶2(TG2)可充当“书写”酶,将一个组胺基添加到组蛋白H3的第五个谷氨酰胺残基上(产生一种名为H3Q5his的标记)。当小鼠清醒且处于活跃阶段时,基因组中H3Q5his的水平较高。b,TG2也可去除H3Q5his,充当“擦除”酶。当小鼠处于不活跃阶段时,H3Q5his的水平较低。郑及其同事发现,H3Q5his的节律性波动与控制昼夜节律的基因的节律性表达相关。
当细胞内单胺浓度不足以进行单胺化时,发现TG2能催化组胺化的谷氨酰胺(H3Q5his)转化为谷氨酸残基(H3E5)。这种转化影响很大,因为该位置的电荷会从正(组胺化的谷氨酰胺)变为负(谷氨酸),而且H3E5无法再被单胺修饰。因此,需要探究与这一现象相关的生理及疾病后果。
未来研究最具挑战性的方向将是阐明H3Q5his和H3Q5ser如何与抗抑郁药物以及感觉处理行为相关联,以及多巴胺化的H3Q5如何参与成瘾和行为适应性。解决这些问题将拓宽科学家对大脑中动态表观遗传过程与决定行为的通路之间联系的理解。
https://blog.sciencenet.cn/blog-41174-1467995.html
上一篇:为何孩子需要更多冒险:科学揭示野外自由玩耍的益处
下一篇:揭秘:软骨内的“气泡垫”脂肪细胞