博文
“有害胆固醇”的结构备受关注  精选
精选
|
“有害胆固醇”的结构备受关注
对携带胆固醇的低密度脂蛋白(LDL)的结构以及它们如何与受体相互作用进而进入细胞的深入了解,有助于阐明这些颗粒在心血管疾病中所起的作用。
被称为“有害胆固醇”的低密度脂蛋白颗粒是由脂肪和蛋白质构成的球体,它们携带胆固醇并在血液中循环。在《自然》杂志上,伯恩德森(Berndsen)和卡西迪(Cassidy)以及赖蒙德(Reimund)等人描述了低密度脂蛋白的一个关键成分及其受体的结构,而这些结构曾让科学家们数十年来都难以捉摸。
1985年,迈克尔·布朗(Michael Brown)和约瑟夫·戈尔茨坦(Joseph Goldstein)因发现能将低密度脂蛋白颗粒从血液中清除的受体而获得诺贝尔生理学或医学奖。自20世纪50年代起,人们就已经知道血液中低密度脂蛋白及其所携带的胆固醇含量过高与动脉壁中斑块(动脉粥样硬化)的堆积有关,而这正是心脏病发作和中风的前兆。低密度脂蛋白受体的发现引发了一系列突破,阐明了循环中的低密度脂蛋白与细胞胆固醇代谢之间的机制关系。事实上,目前作为心血管疾病治疗主要手段的他汀类药物,就是通过增强低密度脂蛋白受体的活性来降低血液中的胆固醇。
伯恩德森和卡西迪以及赖蒙德等人的研究表明,载脂蛋白B - 100(apoB - 100)经过精妙的调适,能够将多种疏水性脂质包装到在血液中循环的颗粒里,以便将它们输送到远处的组织。载脂蛋白B - 100在肝脏中被整合到极低密度脂蛋白(VLDL)中。这些直径为30 - 80纳米的颗粒,每个都含有一个载脂蛋白B - 100,里面装满了被称为甘油三酯的富含能量的脂肪,然后被释放到血液中。当它们将甘油三酯输送到组织后,颗粒会缩小至18 - 30纳米,转变成以胆固醇为主要脂质的低密度脂蛋白。载脂蛋白B - 100的结构变化增强了它与低密度脂蛋白受体的结合能力,使颗粒的作用转变为输送胆固醇。
作者们构建的结构模型显示,载脂蛋白B - 100呈现出一种延伸的梯状结构,环绕整个低密度脂蛋白颗粒,就像棒球上的缝线一样。这条“腰带”将颗粒分成两个半球。穿插在“腰带”中的是杆状片段,它们分支出来与载脂蛋白B - 100的其他结构域建立长距离连接,将脂肪分子固定在一个笼状结构中。伯恩德森和卡西迪认为,这些连接在较大的极低密度脂蛋白颗粒中是不存在的,但在颗粒浓缩成低密度脂蛋白时会形成,这会增加低密度脂蛋白与其受体的亲和力。
赖蒙德及其同事更进一步,对低密度脂蛋白与低密度脂蛋白受体的配体结合结构域所形成的复合物进行了可视化观察。该受体包含带有负电荷区域的细胞外结构域,此前人们认为这些区域会与载脂蛋白B - 100上带正电荷的位点对齐。一旦结合,低密度脂蛋白颗粒就会被细胞内化进入细胞内的小室。随后,低密度脂蛋白会从受体上解离,受体则循环回到细胞表面。低密度脂蛋白被降解,其所含的胆固醇被细胞利用或储存起来。
结构数据揭示了这一机制中一些新的情况。就像鞭子一样,具有柔韧性的低密度脂蛋白受体环绕着低密度脂蛋白,其带负电荷的模块与载脂蛋白B - 100上分布的一连串位点相结合。令人惊讶的是,受体以成对的方式发挥最佳作用,每个受体都与两个结合的低密度脂蛋白颗粒相结合(图1)。作者们推测,这提高了细胞摄取低密度脂蛋白的效率。
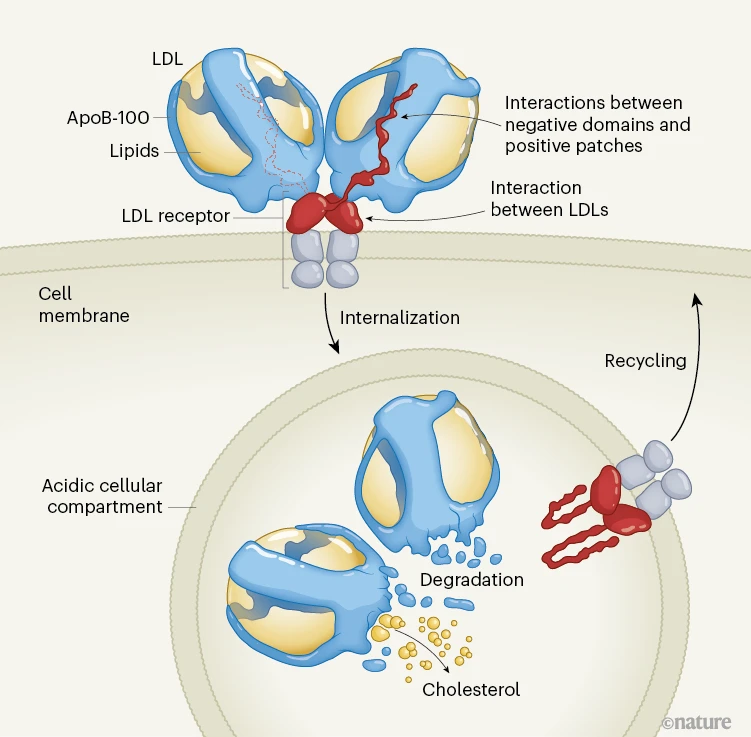
图1 | 低密度脂蛋白的细胞摄取过程
低密度脂蛋白是由脂质(主要是胆固醇)和一份载脂蛋白B - 100(apoB - 100)组成的球形颗粒。当载脂蛋白B - 100与低密度脂蛋白受体那鞭子状的细胞外结构域(红色)结合时,所形成的复合物会被细胞内化进入小室,小室酸化后会使细胞外结构域呈现闭合构象,从而释放出低密度脂蛋白所含物质。受体循环回到细胞表面,载脂蛋白B - 100被降解,胆固醇得以释放供细胞使用。伯恩德森和卡西迪以及赖蒙德等人解析了载脂蛋白B - 100自身以及它与低密度脂蛋白受体结合形成复合物的详细结构。作者们确定了低密度脂蛋白受体上与载脂蛋白B - 100带正电荷区域相互作用的精确带负电荷结构域,并且发现有证据表明受体成对发挥作用,其细胞外结构域协同作用捕获两个低密度脂蛋白颗粒——这种排列方式可能会提高细胞摄取低密度脂蛋白的效率。右侧受体的“尾巴”延伸到左侧低密度脂蛋白颗粒的后方,用红色虚线勾勒出来。
这些发现是通过一种名为冷冻电镜(cryo - EM)的技术实现的。低密度脂蛋白颗粒被冻结在一层薄冰中,并暴露在电子束下。来自数千个处于随机取向的单个低密度脂蛋白颗粒的电子“阴影”随后被重新组合,以构建出三维结构。冷冻电镜正在改变生物分子结构生物学,它能在接近生理条件下从极少量的样本中提供详细的数据。这些论文中所报道的结构是迄今为止利用这种方法解析出的最大的脂质 - 蛋白质复合物结构中的一部分。
这两项研究都存在一个受到质疑的地方,那就是所获得的分子细节程度。想象一下从两个不同距离观察一头大象,比如100米和1米的距离。在100米处,可以清楚地看到大象的外形,分辨出它的耳朵、鼻子、腿等等。但在1米处能看到的细节,比如皮肤上的皱纹,在100米处就看不到了。低密度脂蛋白的结构就类似于从远处看到的景象,缺少诸如特定氨基酸取向等精细细节。这可能是由于单个低密度脂蛋白颗粒之间即便经过精心分离,仍存在细微的结构差异,从而在图像分析过程中使某些细节被平均化了。
两个研究团队都通过使用诸如阿尔法折叠(AlphaFold)这类人工智能辅助的蛋白质折叠建模工具来解决这一问题,以填补冷冻电镜未能呈现的细节。这些算法在过去几年里在准确性方面取得了飞速进步,当与来自冷冻电镜数据的限制条件相结合时,它们能够生成可信度很高的模型。事实上,尽管两项研究采用了独立的方法和样本,但两篇论文中低密度脂蛋白结构模型之间高度吻合,这使得相关结论极具可信度。此外,两个团队都考虑了来自非显微镜方法的数据。最后,这些模型与过去三十年里利用其他结构技术以及对天然和实验室生成的突变蛋白进行研究时所做的大多数实验观察结果相符。
这些进展有着令人振奋的意义。一种罕见的遗传性疾病——家族性高胆固醇血症,其特征是低密度脂蛋白胆固醇水平极高,它是由载脂蛋白B - 100或低密度脂蛋白受体发生突变,致使低密度脂蛋白清除功能受损而引发的。因此,患有这种疾病的个体对标准的降低低密度脂蛋白疗法没有反应,往往在年轻时就面临心血管疾病的困扰。结构模型中发现的载脂蛋白B - 100上的两个受体结合位点,解释了载脂蛋白B - 100和低密度脂蛋白受体中几乎所有已知突变是如何影响它们之间相互作用的。这些见解可能会开启旨在恢复家族性高胆固醇血症患者体内低密度脂蛋白清除功能的治疗策略。
这些研究也为从结构层面理解其他脂蛋白,比如与载脂蛋白B - 100相关的载脂蛋白(a)奠定了基础。载脂蛋白(a)会形成一种被称为脂蛋白(a)的低密度脂蛋白变体,它与动脉粥样硬化的关联性比低密度脂蛋白更强,但疾病进展的分子机制仍不清楚。脂蛋白(a)的冷冻电镜结构或许能够揭示减轻这些颗粒影响的方法。
此外,有证据表明,未能完全转变成低密度脂蛋白的“残余”极低密度脂蛋白颗粒也会导致动脉粥样硬化,尤其是在糖尿病患者中。了解载脂蛋白B在这些极低密度脂蛋白颗粒上的结构转变情况,能够指导旨在加速清除极低密度脂蛋白残余物以防其损害血管的干预措施。总体而言,这些研究标志着利用冷冻电镜去揭示脂蛋白生物学及其与慢性疾病关联中此前难以触及的结构奥秘的时代的开端。
https://blog.sciencenet.cn/blog-41174-1467885.html
上一篇:关节炎微环境调控的产氢纳米颗粒
下一篇:神经元中的表观遗传标记设定昼夜节律