博文
下一代针对胶质母细胞瘤的CAR T细胞疗法
|
两项第一阶段试验的中期结果显示,使用嵌合抗原受体(CAR)T细胞疗法治疗复发性胶质母细胞瘤(GBM)取得了进展。
鉴于胶质母细胞瘤(GBM)是成人中最常见的侵袭性原发性脑肿瘤,其所带来的巨大挑战,优先发展新的治疗策略至关重要。大多数患者在标准治疗方案下的结果仍然不尽人意,该方案包括最大安全的手术切除、替莫唑胺化疗和放疗。这一临床现实凸显了创新和采用新的治疗方法和策略治疗GBM的必要性。最近发表在《自然医学》上的Bagley等人的一项第一阶段临床试验(1),以及发表于《新英格兰医学杂志》的Choi等人的另一项第一阶段临床试验(2),展示了使用双价CAR T细胞克服GBM所带来治疗障碍的新CAR T细胞疗法方法。
早期使用单价CAR T细胞治疗GBM的试验
CAR是一种合成设计的分子,旨在通过识别特定抗原来激活并重定向细胞毒性T细胞对癌细胞的活动。这使得CAR T细胞能够克服诸如肿瘤的免疫抑制微环境等障碍,这些障碍阻碍了原始和旁观者T细胞发挥其抗肿瘤作用。自诞生以来,CAR T细胞疗法在治疗血液恶性肿瘤方面取得了显著成功。一个值得注意的里程碑是,2017年美国食品和药物管理局批准了第一种CAR T细胞疗法tisagenlecleucel用于治疗急性淋巴细胞白血病(3)。早期使用单价CAR T细胞的临床试验结果揭示了CAR T疗法在GBM中的潜力(4),但也显示出有限的成功。Brown等人(4)评估了65名患有复发性高级别神经胶质瘤(大多数为GBM)的患者中使用针对白细胞介素13受体α2 (IL13Rα2) 的CAR T细胞,报告了整体生存期分别为7.7个月和10.2个月,这是在接受优化制造平台的联合脑室内和肿瘤内给药的一组患者中观察到的。另一个值得关注的例子是Majzner等人(5)在儿科神经肿瘤学中的研究发现,通过脑室给药的针对二唾液酸神经节苷脂GD2的CAR T细胞疗法在治疗四名患有桥脑或脊髓弥漫性中线胶质瘤(DMGs)的儿童中显示出安全性和可行性。尽管这些结果令人鼓舞,但使用单价CAR T细胞的成功持久性仍然有限。这可以归因于几个关键因素,包括GBM的免疫抑制肿瘤微环境、目标肿瘤抗原的潜在稀缺或丢失、肿瘤异质性,以及CAR T细胞到达肿瘤部位的运输和渗透困难(6),以及克隆耗竭。为了解决限制当前一代单价CAR T细胞疗法候选物在GBM中有效性的挑战,研究人员正在探索与其他免疫治疗方法协同使用CAR T细胞或针对多个抗原的策略。
双价CAR T细胞策略
Bagley等人(1)在《自然医学》发表的第一阶段中期结果报告中介绍的一种方法是使用针对表皮生长因子受体(EGFR)表位806和IL13Rα2的双价CAR T细胞(CART-EGFR-IL13Rα2)(1)。这种构造针对两个抗原,旨在克服肿瘤异质性并增强抗肿瘤反应(7)。Bagley等人(1)通过Ommaya储库向六名患有复发性多灶性GBM的成年患者脑室内输注CART-EGFR-IL13Rα2细胞,并对患者进行了中位数为2.5个月的随访。该试验采用了3 + 3剂量递增设计(在这里是指三组患者接受增加剂量的治疗,分别是:1 × 107、2.5 × 107和5 × 107双价CAR T细胞),当前报告中包含了前两剂量组(共六名患者)的中期结果。所有患者在48小时内都观察到了肿瘤磁共振成像对比增强和大小的减少。在发表时有超过2个月随访期的四名患者中,有三人在治疗后2个月显示出病情稳定。此外,六名患者中有三名显示出≥30%的肿瘤减少。然而,这些令人鼓舞的结果应该谨慎解读。例如,没有患者满足使用修改后的神经肿瘤响应评估(mRANO)标准定义的客观放射学响应标准,即>28天垂直增强病变减少≥50%。重要的是,CART-EGFR-IL13Rα2细胞疗法还与所有评估剂量的最初六名患者报告中的肿瘤炎症相关神经毒性和免疫效应细胞相关神经毒性综合征有关。然而,这些并发症使用高剂量地塞米松和IL-1受体拮抗剂anakinra有效管理。
同时发表在《新英格兰医学杂志》上,Choi和同事介绍了他们第一阶段临床试验的中期结果,该试验名为INCIPIENT,“胶质母细胞瘤患者接受脑室内CARv3-TEAM-E T细胞治疗”(2)。与Bagley等人(1)使用双价CART-EGFR-IL13Rα2细胞以克服抗原丢失和异质性所提出的挑战类似,Choi等人(2)开发了一种靶向两种抗原的CAR T细胞构造(CARv3-TEAM-E),即EGFRvIII和野生型EGFR。称为TEAMs(也称为双特异性T细胞接合器或BiTEs)的T细胞接合抗体分子是连接CD3在T细胞上的两个单链可变片段,将它们桥接到肿瘤抗原上,从而提高针对肿瘤细胞的免疫反应的特异性和有效性(8)。GBM治疗的一个挑战是某些抗原如EGFRvIII的选择性表达,其在约30%的GBM肿瘤中存在,相比之下,野生型EGFR在约80%的GBM肿瘤中被发现,但重要的是,它也由正常组织表达。因此,该结构利用了CAR T细胞首先局部靶向EGFRvIII的能力,随后分泌针对野生型EGFR的TEAMs,确保覆盖更广泛的肿瘤细胞范围,同时最小化脱靶效应(8)。在临床前环境中,TEAMs不仅改善了更多CARv3-TEAM-E T细胞对肿瘤的招募,还招募了其他针对野生型EGFR的旁观者T细胞(8)。在INCIPIENT试验中,通过脑室向三名复发性GBM患者单次输注了CARv3-TEAM-E T细胞。其中一名患者确实接受了第二剂。所有三名患者在第一剂后的几天内都出现了肿瘤消退,其中一名患者在输注后最后一次随访(>150天)时继续显示出持久的反应(图1)。在这两项临床试验中,尽管CART-EGFR-IL13Rα2细胞和CARv3-TEAM-E T细胞被输送到脑室,但在脑实质疾病中都观察到了迅速的肿瘤反应,这支持了脑室内输送CAR T细胞是一种可行的输送方法的观点(1, 2)。与CART-EGFR-IL13Rα2细胞试验的初步结果类似,鉴于两名患者仍然经历了疾病进展,Choi等人(2)的初步结果应谨慎解读。此外,一名患者出现了3级脑病,所有三名患者在输注后2天发烧达到高峰,这通过使用anakinra进行了管理。然而,令人鼓舞的是,没有报告剂量限制性毒性或大于3级的不良事件(根据国家癌症研究所常见不良事件术语标准)。
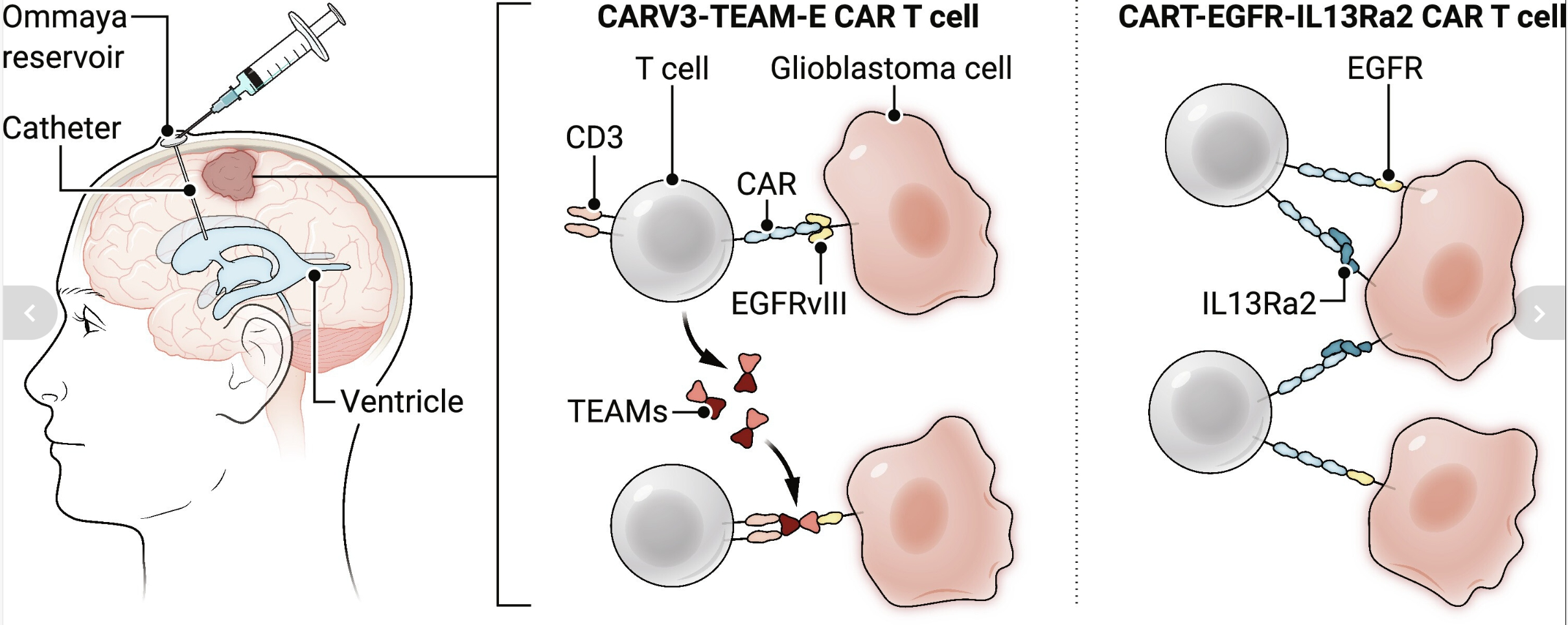
图1. 复发性GBM中的双价CAR T细胞策略。
在两项不同的第一阶段临床试验中(1, 2),通过Ommaya储库将CARv3-TEAM-E T细胞(三名患者)(2)或CART-EGFR-IL13Rα2细胞(六名患者)(1)输送给复发性GBM患者。双价CARv3-TEAM-E T细胞靶向EGFR(在正常和肿瘤细胞上表达)和EGFRvIII(仅在GBM细胞上表达)。CARv3-TEAM-E T细胞与GBM细胞表达的肿瘤抗原EGFRvIII形成桥梁。然后CAR T细胞被激活并分泌称为TEAMs的抗体,这些抗体在T细胞上的CD3与EGFR之间建立桥梁。鉴于EGFR不仅在约80%的GBM细胞上表达,也在正常细胞上表达,局部分泌的TEAMs能够实现特定而集中的免疫反应。双价CART-EGFR-IL13Rα2细胞也有两个目标(IL13Rα2和EGFR表位806),这同样有助于通过激发更广泛的免疫反应来克服肿瘤防御机制。IL13Rα2在50至75%的GBM患者中表达。通过针对一个以上的抗原,这两种方法都有助于解决使用CAR T细胞治疗GBM的挑战,例如抗原丢失、克隆耗竭和肿瘤异质性。制作:A. FISHER/科学转化医学
为了检查对治疗的肿瘤反应,Choi等人(2)测量了患者血液和脑脊液(CSF)样本中的EGFR和EGFRvIII浓度,Bagley等人(1)同样测量了CSF中的干扰素-γ、IL-2、肿瘤坏死因子–α和IL-6的细胞因子浓度。这些及其他标记物(例如,IL13Rα2、PD-L1(程序性死亡配体1)和转化生长因子–β)的实用性应在未来的试验中结合连续组织活检来评估,以观察肿瘤及其微环境的演变。
下一代组合免疫疗法
这些发现强调了双价CAR T细胞策略的潜力,但挑战仍然存在。尽管Bagley等人(1)和Choi等人(2)的研究报道了迅速的肿瘤消退,但进展仍然发生,这部分可能是因为GBM的免疫逃逸,这可能通过组合免疫疗法得到解决。最近一项研究调查了静脉注射EGFRvIII靶向CAR T细胞疗法与pembrolizumab(一种免疫检查点抑制剂)联合使用的安全性和有效性,为GBM组合免疫疗法的复杂性提供了一个细致的视角(6)。这种联合方案是安全的,但没有为患者提供有意义的临床益处(6)。几个因素可能导致这种疗效缺乏,包括在CAR T细胞输注之前缺少淋巴清除化疗,这被认为可以增强CAR T细胞的扩张和持久性。肿瘤异质性和残留肿瘤组织的有限存在也可能发挥关键作用,可能限制了CAR T细胞定位和消除癌细胞的能力。此外,同时给予程序性死亡蛋白1(PD-1)抑制剂可能对治疗效果产生不可预见的影响。然而,在CRISPR-CAS9敲除PD-1的GBM小鼠模型中施用EGFRvIII CAR T细胞时,免疫检查点阻断已证明是成功的(9)。尽管很有吸引力,但对CAR T细胞进行基因编辑可能会加剧对CAR T治疗后二次恶性肿瘤现有担忧。减轻此类风险的可能策略包括诱导凋亡的安全开关(10)。疫苗、干细胞、细胞因子、免疫检查点抑制剂、溶瘤病毒以及组合免疫疗法等治疗手段的结合可能有助于克服GBM中CAR T细胞疗法面临的挑战。这些方法应特别定制以缓解每种构建的内在局限性。
总之,Bagley等人(1)和Choi等人(2)的研究为多模式免疫治疗策略在CAR T细胞疗法治疗GBM中的潜力提供了宝贵的洞见。这些进步可能导致更有效的GBM及其他癌症治疗方法,为历来难以治疗的肿瘤带来改善的结果希望。
https://blog.sciencenet.cn/blog-41174-1448622.html
上一篇:氢中医:氢医学领域一个新兴的研究方向【科技导报】
下一篇:人类大脑最新进化也最容易老化