博文
大脑的垃圾处理系统
|
淋巴引流从组织中移除代谢废物和毒素,对于维持组织健康至关重要。在中枢神经系统(CNS)中,淋巴引流依赖于位于硬脑膜中的脑膜淋巴管以及最近阐明的胶质淋巴系统,该系统负责脑脊液(CSF)循环和废物清除。胶质淋巴流动与脑膜淋巴之间的相互作用也确保了警觉的免疫监测,而不干扰神经元环境。了解CSF如何通过复杂的血管和血管周围途径流动,以及CSF流动动力学与大脑代谢需求之间的相互作用,对于理解大脑健康很重要,并可能导致开发治疗方法,这些方法可能会改变各种神经疾病的治疗方式。
传统上,CNS被认为是“免疫特权的”,意味着它被认为与免疫系统隔离,缺乏适当的免疫监视,并且没有典型的淋巴引流。的确,健康的脑实质不包含淋巴管。大脑被脑膜包裹,这是一个由三层组成的膜状覆盖物,包括最外层的硬脑膜(最靠近颅骨)、附着在大脑上的软脑膜,以及将它们分开同时形成蛛网膜下腔的蛛网膜,CSF通过此腔流动。大约十年前,重新发现了位于硬脑膜中的脑膜淋巴管网络(1);脑膜淋巴管最初在200多年前被描述,但科学界忽视了它们。尽管脑膜淋巴管不在脑实质内,但它们仍然执行着大脑淋巴引流的重要功能(1)。
硬脑膜中存在脑膜淋巴管完美地定位了这一点,作为大脑免疫监视发生的地点,因为来自大脑的抗原在淋巴引流之前到达硬脑膜。确实,特别是在围绕硬脑膜窦的部位,硬脑膜高度聚集了各种免疫细胞,包括抗原呈递细胞。硬脑膜抗原呈递细胞从CSF中摄取抗原,以供巡逻T细胞识别,这些T细胞可以通过硬脑膜窦相对容易地进入硬脑膜。T细胞穿越硬脑膜窦的迁移得益于血液流动相对较慢、窦内皮细胞上高表达的粘附分子以及位于硬脑膜窦附近的硬脑膜成纤维细胞表达的趋化因子和保留分子(1)。在硬脑膜进行免疫监视可以监测大脑的威胁和疾病,而无需免疫细胞直接进入脑实质,从而避免干扰神经元。
可以说,大脑“免疫密码”[即在主要组织相容性复合体I类(MHCI)和MHCII分子上呈现的肽]在疾病发生之前会在硬脑膜抗原呈递细胞上发生变化。因此,检测这种代码的变化可能作为早期诊断工具。硬脑膜呈现的大脑抗原也可能导致异常的免疫激活,例如由于病毒模仿,从而导致有害的炎症反应[在患有神经退行性和炎症性疾病的患者CSF中发现的病毒特异性淋巴细胞(2,3)支持这一假设],最终导致实质炎症。解开大脑组织的免疫密码并在硬脑膜中改变它(例如,通过添加缺失的肽、改变抗原呈递细胞或干扰蛋白质处理和呈现)可能导致开发新的治疗神经炎症和神经退行性疾病的方法,如阿尔茨海默病,其中适应性免疫细胞似乎起着作用。
尽管在理解脑膜免疫及其与大脑免疫监视的关系方面取得了进展,但仍有几个问题。例如,大脑中的抗原如何到达硬脑膜?人们认为CSF主要提供大脑浮力并帮助清除废物产品。然而,除此之外,最近的研究表明CSF的生理复杂性和重要性。在脉络丛产生后,干净的CSF通过脑室网络和蛛网膜下腔流动。在大皮质动脉进入大脑的水平,CSF遇到称为Virchow-Robin空间的血管周围结构,这是蛛网膜下腔的延伸,伴随着进入脑实质的血管。随着动脉深入大脑,这些空间变得更窄,但它们贯穿于大脑的血管(不包括毛细血管)。动脉脉冲使CSF能够沿着动脉推进,也能够穿过星形胶质细胞末端进入脑实质(4)。水通道蛋白4(AQP4)在星形胶质细胞上表达,并极化到它们的末端,这在一定程度上促进了液体从血管周围空间转移到实质,反之亦然(5)。一旦进入大脑,这种液体被认为在密集的脑实质中产生对流,直到它到达静脉周围空间。CSF沿着动脉流动,穿过大脑,然后沿着静脉流出构成了胶质淋巴系统或胶质淋巴流动,其中“g”代表胶质细胞(星形胶质细胞)在此过程中的作用,类似于“淋巴”流动。
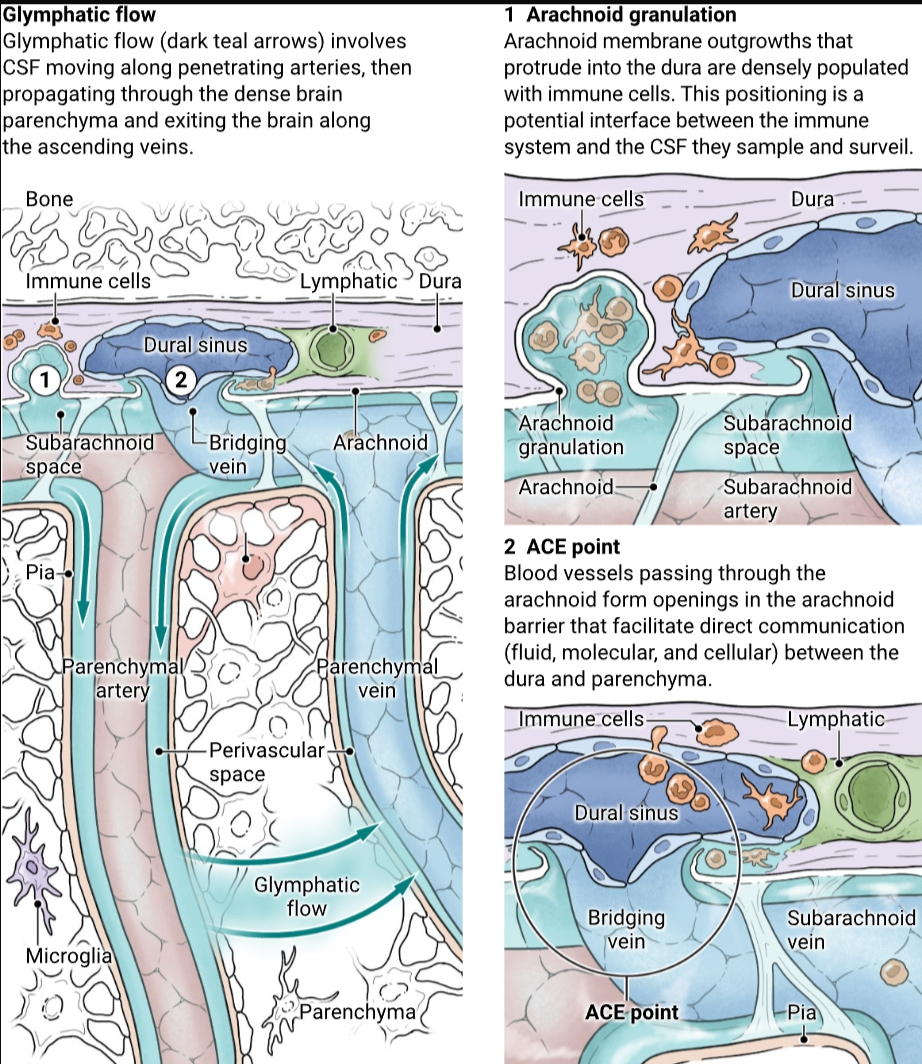
脑膜层包围大脑,包括丰富的硬脑膜免疫环境、脑膜淋巴管以及允许在硬脑膜中的脑脊液(CSF)进入颅骨骨髓的通道。两个解剖结构——蛛网膜颗粒和蛛网膜袖口出口(ACE)点——通过CSF允许从大脑实质中进行免疫监测和有毒废物的清除。
胶质淋巴系统和脑膜淋巴管是相连的,因为一旦CSF离开大脑,它就会排入硬脑膜,被脑膜淋巴管吸收,然后进入大脑引流的颈部淋巴结。为了完全理解胶质淋巴-淋巴连接,需要澄清一些点:例如,CSF是如何沿着动脉流动的,什么力量促进大脑实质内的对流流动,以及CSF是如何到达位于硬脑膜中的脑膜淋巴管的。
在小鼠和人类中,大脑动脉的搏动是推动CSF沿动脉流动的力量,其中磁共振成像(MRI)显示了CSF流动与动脉脉动性之间的强烈相关性。此外,血管周围和软脑膜巨噬细胞(统称为实质边界巨噬细胞,或PBMs)不断降解血管周围空间中的细胞外基质,允许CSF通过(6)。消除或功能障碍的PBMs导致细胞外基质积累,物理阻塞血管周围空间并干扰CSF流动。
要识别和理解驱动大脑实质内CSF流动的力量,需要考虑实质是多么密集。由于几乎没有间质空间,某种力量对于驱动液体穿过实质至关重要。此外,仅凭扩散不足以解释CSF通过大脑组织的灌注率。一项优雅的研究使用人类的第四脑室MRI展示了血液动力学和电生理活动与CSF流动的耦合,表明CSF动力学与神经和血液动力学节奏性交织在一起(7)。在小鼠和人类中也显示出神经活动与CSF流动相关(8, 9)。然而,直到最近才有直接证据(在小鼠模型中)表明神经活动通过大脑实质驱动CSF流动(10)。抑制特定大脑区域的神经活动会中断该区域的流体流动,而增强神经活动则导致灌注增加。尽管对流体流动的影响局限于神经活动改变的区域(10),但仍然有趣的可能是存在一个调节整个大脑液体流动的中央回路。
上述机制遇到的一个难题来自于经验发现,即在睡眠期间,当较少的神经元活跃时,通过大脑组织的流体流动相对于清醒时的流动有所增强。一种可能的解释是睡眠期间发生的同步神经活动(11)。皮层脑电图记录显示睡眠的不同阶段与不同波长的神经活动相关联。最慢的波(δ波,范围从0.5到4Hz)在深度睡眠期间被检测到(最休息的阶段)。产生δ波的同步神经活动可能产生足够的力量和方向性,以驱动间质液通过大脑组织(10)。这种机制克服了与睡眠-清醒周期中的废物产生(12)和移除有关的矛盾。因此,在睡眠期间较少的神经元活跃(产生的废物较少),但它们的活动是同步的,它们产生的波具有足够的势能来推动CSF通过实质的流动。尽管这个假设及其初步证据很有希望,但需要进一步的实验工作和新的工具来直接测量组织中水分子的运动,以确认这一机制。
CSF如何到达硬脑膜?来自大脑的静脉血通过桥接静脉输送到硬脑膜窦。这些静脉穿过蛛网膜到达硬脑膜窦。当桥接静脉穿透蛛网膜时,它们带着一层层蛛网膜(13)。进入硬脑膜时,沿着桥接静脉的蛛网膜套筒以称为“蛛网膜袖口出口”(ACE)点的袖口状结构结束。ACE点是由蛛网膜和硬脑膜成纤维细胞以及各种免疫细胞组成的复杂结构。这些是内皮细胞表型从血-脑屏障(例如,具有专门的紧密连接)变为外围血管的重要部位,因为它们继续进入硬脑膜。不仅流体和悬浮分子,而且免疫细胞也可以通过ACE点运输,这使得这些位点的调节对大脑健康至关重要。在神经炎症性疾病中,大脑实质的最初侵袭可能通过ACE点发生(13),在废物积累的疾病中,这些位点可能被堵塞,限制了有毒产品(如阿尔茨海默病中的淀粉样β蛋白)的移除。ACE点的识别提供了一种合理的解剖学解释,说明大脑衍生的分子如何到达硬脑膜前往脑膜淋巴管,以及硬脑膜免疫衍生的分子(细胞因子)如何到达大脑并影响大脑功能(1)。
由于老鼠和其他许多具有光滑脑皮质的小动物没有蛛网膜颗粒,人们可能会认为ACE点仅仅代表原始的、类似蛛网膜颗粒的结构。然而,人类中也存在ACE点,它们促进了硬脑膜与大脑实质之间的分子交换(13)。这引发了关于ACE点和蛛网膜颗粒在CSF引流中作用的问题。传统上,人们认为CSF通过突入静脉窦的蛛网膜颗粒离开大脑,从而直接流入血液循环。然而,如果颗粒直接突入窦内,如何密封穿透区域以防止血液泄漏则不清楚。此外,这样的系统意味着携带大脑抗原和代谢物的CSF直接排入血液而不是淋巴循环,从而逃避了免疫监视。最近在小鼠和人类的研究表明,CSF在达到血管系统之前被引流到硬脑膜(13, 14),并且蛛网膜颗粒虽然与窦密切相关,但并不突入其中(尽管一小部分颗粒位于窦内,但它们被窦内皮与血液隔离),并密集地由免疫细胞占据(15)。这表明蛛网膜颗粒可能充当CSF和脑膜免疫之间的界面。随着大脑的进化和体积增大,对其免疫代码的有效监视需求也随之增加,蛛网膜颗粒的进化可能正是为了这一目的。
最近发现的CSF流动路径、允许CSF退出的解剖结构以及推动CSF通过大脑实质的力量为大脑清洁和免疫监视提供了新的概念框架(见图)。理解这一复杂过程——包括许多功能分区,每个分区都影响液体流动——预计会促进开发新的治疗干预类别以增强大脑清洁。这些干预措施——例如,针对沿着血管居住的巨噬细胞或星形胶质细胞表达和功能的AQP4——以及诱导同步神经活动,可能会影响那些积累碎片或免疫功能障碍是因素的神经系统疾病。使用神经刺激增加CSF流量以从阿尔茨海默病患者的大脑中消除致病性淀粉样β蛋白的治疗干预已有先例(NCT05637801)。更好地理解大脑清洗的解剖学会促进进一步开发有效方法,不仅增强大脑清洁,还改善免疫监视并在包括脑肿瘤在内的脑部疾病中有效地调动免疫系统,其中免疫辅助可能是一个有力的解决方案。
https://blog.sciencenet.cn/blog-41174-1443787.html
上一篇:控制温室气体的要点:减少牛打嗝
下一篇:发现新生小鼠与妈妈建立联系的脑细胞