博文
镁合金血管支架通过释放氢气产生脑保护作用
||
 摘要图
摘要图腹腔注射对脑中动脉闭塞再灌注损伤小鼠Mg2+/H2的评价。.
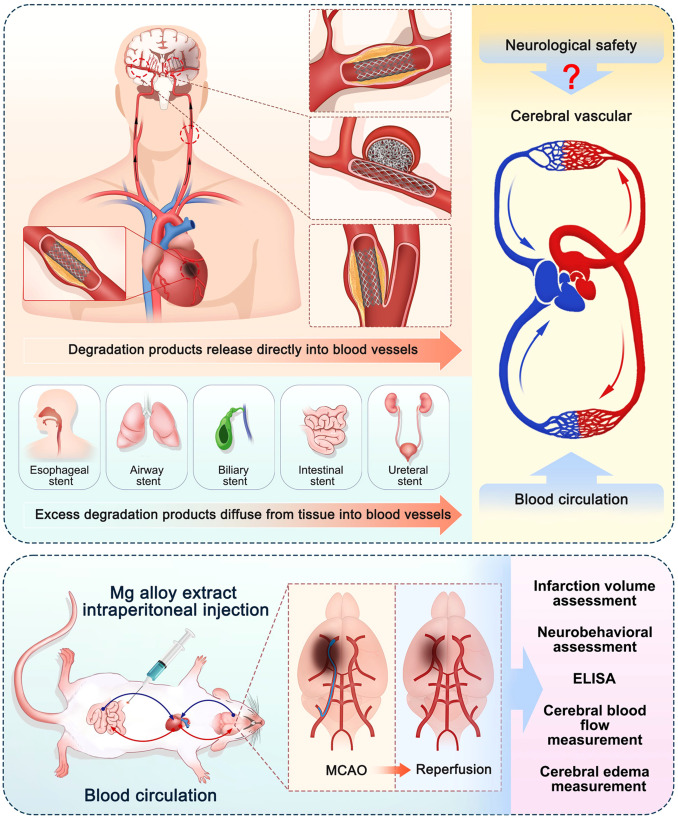
1. 前言缺血性心脏病和中风是全球两大主要死因,严重危害人类健康和生命[1]。将支架植入狭窄的冠状动脉和颅内/颅外动脉对于防止血管再狭窄和确保及时再通具有重要意义[2]。近几十年来,与永久性金属支架相比,生物可降解支架受到了广泛关注。特别是,由于其出色的生物相容性和可降解性,镁(Mg)合金在生物可降解心血管支架的应用已被广泛研究和快速发展[3,4]。到目前为止,已有一些大规模的临床研究和商业化的镁合金心血管支架产品[5,6]。
在神经学领域,镁合金已被制作成颈动脉支架、弹簧圈、神经传导支架和神经传感器的关键模块[[7], [8], [9], [10]。大多数研究集中在其降解行为和生物相容性上,但其降解产物的神经活性研究仍然有限。此外,关于镁合金用于脑血管支架的可行性研究也很少[8]。因此,在探索镁合金作为脑血管支架的有效性之前,必须评估镁合金提取物的神经安全性。
镁合金在水环境中降解,产生Mg2+以及氢气(H2)[11,12]。对大鼠和沙鼠的动物实验表明,Mg2+(MgSO4或MgCl2)在脑缺血中具有保护作用[13]。这些研究提供了证据,表明通过腹腔、静脉或动脉内给予Mg2+溶液可以减小动物的脑梗死体积和脑水肿[[14], [15], [16], [17]。然而,作为一种生理惰性气体,H2的医学价值长期以来一直被忽视[18]。2007年,Ohsawa等人证明H2可以通过减少羟基自由基发挥抗氧化作用,并发现大鼠在MCAO后吸入H2显著改善了神经功能[19]。此后,H2的神经保护作用越来越受到认可[20]。除了吸入外,H2疗法还可以通过饮用富氢水和注射富氢盐水进行[21]。临床研究表明,脑池内Mg2+输注结合静脉内H2疗法可以改善蛛网膜下腔出血患者的日常生活活动[22]。饮富氢水也被报道有助于缓解创伤性脑损伤后的脑损伤和抑制炎症反应[23]。
值得注意的是,对各种器官的介入治疗受到了越来越多的关注。除了心血管支架外,镁合金支架还被研究和应用于其他重要器官,如食道、气道、胆道、肠道和输尿管[24]。在支架降解过程中,释放的Mg2+和H2可能通过血液循环被运输到全身。然而,目前的安全性和有效性研究仅关注局部区域,并未考虑其潜在的神经保护作用。
因此,在本研究中,选择了纯镁和WE43作为实验材料,MCAO小鼠用作缺血性中风模型。研究设计的理由如图1所示。为了研究体内植入的生物可降解支架的神经保护作用,我们在MCAO小鼠中腹腔注射镁合金提取物,以探索其降解产物的神经保护作用。
2. 材料与方法2.1. 材料准备由湖南稀土材料研究所提供的纯镁(99.95 wt.%)和Lifetech科技有限公司提供的WE43合金。将纯镁和WE43坯料加工成直径为φ39.6 × 50 mm的圆柱体,然后在450 °C下进行固溶处理4小时,水冷。在400 °C预热20分钟后,将这些圆柱体以2 mm/s的挤压速率和10:1的挤压比挤压成直径为10 mm的棒材。纯镁和WE43的挤压温度为450 °C,经过单次挤压得到棒材。通过激光切割将挤压后的纯镁和WE43棒材加工成直径为φ10 mm × 2 mm的圆片。通过电感耦合等离子体原子发射光谱法(ICP-AES)确定WE43合金和纯镁中的成分含量。2.2. 微观结构表征使用5000目SiC砂纸和0.5 µm金刚石抛光膏对纯镁和WE43圆片进行抛光。然后在绝对乙醇中超声清洗后,在4%硝酸酒精溶液或硝酸溶液中腐蚀样品。使用带有能量色散谱仪(EDS)附件的SEM(S-4800冷阴极场发射扫描电子显微镜,日立)检测金相微观结构。通过X射线衍射仪使用Cu Kα辐射,在室温下以40 kV和100 mA的条件,以10°−90°的扫描范围和2°/min的扫描速率来确定样品的相组成。使用Jade软件分析结果以确认相组成。从Casa XPS软件中的总积分XPS峰强度获取表面化学成分。应用Shirley型背景和高斯/洛伦兹峰形进行分析。2.3. 浸泡试验为了检查纯镁和WE43合金降解过程中释放的H2水平,进行了体外浸泡试验。用于测量氢气释放的实验装置参考了先前的研究[30]。根据ASTM G31–72标准(金属实验室浸泡腐蚀测试的标准实践),将尺寸为φ10 × 2 mm的样品浸泡在生理盐水溶液中24小时,暴露比为20 ml/cm2。在测试前记录每组抛光清洗后的样品重量。浸泡后,将样品从盐水溶液中取出并干燥。然后根据ASTM G1–90标准(制备、清洁和评估腐蚀测试试样的标准实践),使用溶解CrO3于去离子水中制备的浓度为200 g/L的铬酸去除腐蚀产物。2.4. 镁合金提取物将尺寸为φ10 × 2 mm的纯镁和WE43圆片分为两组,每组6片,抛光至2000目。然后分别用丙酮、无水乙醇和去离子水超声清洗样品各10分钟。接着,用紫外线照射圆片两面各2小时进行消毒。根据ISO 10993-5:2009(医疗器械生物评价,第5部分:体外细胞毒性测试),将圆片以1.25 cm²/mL的提取比例浸入生理盐水中,然后置于含有5% CO2的细胞培养箱中24小时。通过感应耦合等离子体光学发射光谱法(ICP-OES, iCAP6300, Thermo)估计样品提取物中的Mg²⁺浓度。将提取物小心转移到密封瓶中,并超声处理30分钟。然后,溶解在溶液中的分子氢(H2)被释放到厌氧瓶中,并使用气相色谱仪(gc9790plus, FULI INSTRUMENTS)进行测量。2.5. 实验动物及方案本文描述的实验方案经首都医科大学宣武医院动物护理和使用委员会审查批准,并按照美国国立卫生研究院指南执行。共有72只雄性C57BL/6小鼠(8周龄,体重20-22克,北京四合福生物技术有限公司提供)随机分配到以下组别(每组18只):MCAO加生理盐水组、MCAO加纯镁提取物组、MCAO加WE43提取物组和MCAO加去除H2的WE43提取物组。动物用5%异氟醚在一氧化二氮和氧气混合物(N2O/O2,70%/30%)中麻醉。通过恒温加热垫将直肠温度持续保持在37°C ± 0.5°C。在小鼠颈部中间切开一个口子。将颈总动脉、外颈动脉(ECA)和内颈动脉(ICA)从相邻的组织和神经中彻底分离。将一根6-0尼龙单丝(Doccol, USA;直径0.21±0.01 mm,长度5-6 mm)插入右侧ICA,直到阻塞大脑中动脉(MCA)的起始处。MCAO 45分钟后,小鼠重新麻醉,缓慢撤回线栓。立即在MCAO和再灌注后,这四组小鼠分别腹腔注射生理盐水、纯镁提取物、WE43提取物和去除H2的WE43提取物(75 mL/kg)。2.6. 神经行为评估利用修改后的神经功能缺损评分(mNSS)测试、梁行走测试和Zea Longa行为评分量表评分,在缺血后24小时对小鼠(每组9只)的神经功能缺损进行评估。mNSS测试包含一系列任务,用于评估不同的神经功能,包括运动、感觉、反射和平衡功能[31]。分数在1到6之间表示轻度损伤,7到12之间表示中度损伤,13到18之间表示重度损伤。梁行走测试用于检查小鼠的平衡和运动技能。根据平衡和运动协调能力给每只小鼠打分,分数在0到6之间,分数越低表明小鼠的运动和平衡能力越差[32]。Longa量表(0-4分)用于计算小鼠的神经缺陷,神经缺陷分数越高表明脑损伤越严重[33]。2.7. 梗死体积评估我们迅速取出脑组织并将其切成冠状切片,然后用2%的2,3,5-三苯基氯化四唑(TTC)溶液染色以评估梗死形成。通过将所有切片的梗死区域面积相乘来计算梗死区域,使用Image J V1.8(美国国立卫生研究院,贝塞斯达,马里兰州)进行测量。
2.8. 酶联免疫吸附测定
在手术24小时后,将小鼠深度麻醉并处死,迅速取出脑组织。脑样本储存于-80°C,解冻至室温后,通过超声(50%振幅)在磷酸盐缓冲盐水(PBS)中匀浆15秒。为了评估小鼠缺血脑组织中促炎细胞因子(白细胞介素[IL]-1β,CXC趋化因子受体类型2 [CXCR2])、抗炎细胞因子(IL-4,转化生长因子[TGF]-β1)和氧化应激指标(丙二醛[MDA],超氧化物歧化酶1 [SOD1])的表达,进行了酶联免疫吸附测定(ELISA),并在450 nm波长下使用多孔板阅读器(AMR-100, Aosheng, 中国)对吸光度进行量化:CXCR2(小鼠CXCR2 ELISA试剂盒;货号:EM1613;FineTest;武汉,中国),IL-1β(小鼠IL-1β ELISA试剂盒;货号:EM0109;FineTest;武汉,中国),IL-4(小鼠IL-4 ELISA试剂盒;货号:EM0119;FineTest;武汉,中国),TGF-β1(小鼠TGF-β1 ELISA试剂盒;货号:EM0176;FineTest;武汉,中国),SOD1(小鼠SOD1 ELISA试剂盒;货号:EM0419;超氧化物歧化酶[Cu-Zn];FineTest;武汉,中国),MDA(小鼠MDA ELISA试剂盒;货号:EM1723-1;丙二醛;FineTest;武汉,中国)。
2.9. 脑血流测量
利用激光散斑血流成像仪(LDF, PeriFlux System 5000;Perimed, 瑞典)在术前、MCAO后立即、再灌注后立即、MCAO后30分钟以及MCAO后24小时测定小鼠的脑血流(CBF)。
2.10. 脑水肿测量
通过湿重和干重法在MCAO后24小时量化脑水肿[34]。这也可以反映血脑屏障(BBB)完整性损害。小鼠的双侧大脑半球在取出后立即称重,并在干燥48小时后再次称重。脑水肿计算为100 × (湿重 - 干重) / 湿重。
2.11. 细胞研究
使用小鼠中枢神经元细胞系HT-22来评估镁合金提取物的细胞毒性效应。通过将φ10 mm × 2 mm的WE43圆片浸泡在补充有10%胎牛血清和1%青霉素/链霉素的杜尔贝科改良伊格尔培养基(DMEM)中获取提取物。随后,细胞在37°C、5% CO2气氛下,在对照培养基(DMEM)或WE43提取物中培养1、3和5天。然后,用CCK-8溶液处理细胞1小时。使用分光光度计记录450 nm处的光吸收密度(OD)值。
为了在体外模拟缺血/再灌注损伤,细胞经历了氧-葡萄糖剥夺后进行复氧(OGD/R)。为了诱导缺氧,将细胞在37°C下在无糖培养基中孵育四小时,环境为95% N2/5% CO2气氛。然后,在37°C、5% CO2的标准培养基或WE43提取物中再氧化24小时。对照组在含有葡萄糖的常规DMEM中,在37°C、5% CO2环境下培养相同时间。随后,使用CCK-8试剂盒评估细胞活力。
2.12. 统计分析
结果的统计分析是使用GraphPad Prism版本9.4.0(GraphPad Software Inc., San Diego, CA, USA)进行的。使用Kolmogorov-Smirnov检验来确定连续变量是否呈正态分布。然后,变量表示为均值±标准差(SD)或中位数(四分位距,IQR)。两组之间的比较采用未配对t检验或Mann-Whitney U检验(如适用)。多组之间的比较使用方差分析(ANOVA)的秩和检验。双侧P值<0.05被认为是统计学显著的。
3. 结果
3.1. 镁合金和提取物分析
先前的研究证据表明,Mg2+和H2对神经功能的保护作用是浓度依赖性的[17,18]。因此,在探索其在神经科学领域的潜在应用之前,揭示镁合金的腐蚀机制具有重要的意义,这与它们的微观结构密切相关。通过SEM观察的Mg和WE43合金的金相显微结构(图2A)表明,第二相主要沿晶界沉淀和分离。EDS分析结果(图2B)显示,沿晶界的第二相(区域3和区域4)中的Y和Gd含量明显高于α-Mg基质(区域1)。尽管WE43合金富含Y和Nd(表1),但在提取物中检测到了Gd,这与其它研究一致[[35], [36], [37], [38]]。图S1的XRD图谱表明,纯Mg中存在单相α-Mg和WE43合金中的Mg24Y5除了α-Mg外,这可以加速WE43合金的腐蚀[25,26]。
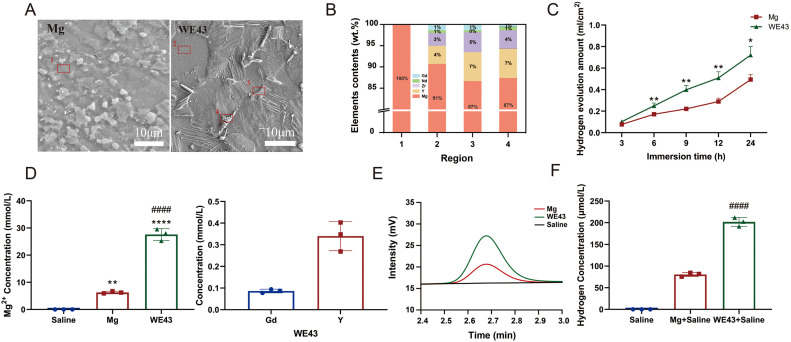
图2. 纯Mg和WE43合金的特性分析:(A)通过SEM观察得到的纯Mg和WE43合金的金相显微结构,(B)纯Mg和WE43合金不同区域的元素组成,(C)纯Mg和WE43合金随浸泡时间的氢气释放量,(D)纯Mg和WE43合金提取物中的元素浓度,(E-F)纯Mg和WE43合金提取物中的氢谱和氢浓度。数值表示为均值±标准差。“*, **, ****”代表生理盐水组与Mg组和WE43 Mg组的比较。“####”代表Mg组与WE43 Mg组之间的比较。
表1. 通过感应耦合等离子体原子发射光谱法(ICP-AES)测定的所研究WE43材料的化学成分(以重量百分比计)。
Material | Composition (wt.%) | ||||
Empty Cell | Y | Nd | Gd | Zr | Mg |
WE43 | 4.1 | 2.5 | 0.5 | 0.37 | balance |
纯镁和WE43合金在生理盐水中浸泡24小时后。图2C显示,在浸泡过程中WE43合金的H2生成速率比纯镁快。WE43提取物中的Mg元素浓度也远高于纯镁,这意味着WE43合金的腐蚀速率要高得多。除了Mg2+外,WE43合金提取物中还观察到了Y和Gd元素,尽管含量非常低(Y和Gd元素分别为0.333 ± 0.012和0.0864 ± 0.0082 mmol/L)。WE43提取物中的溶解氢气量(图2E,F)为201.79 µmol/L,高于纯镁提取物的81.02 µmol/L,这与氢气释放分析一致。
3.2. WE43合金的神经保护作用及其潜在机制
小鼠在缺血45分钟和再灌注24小时后出现了显著的右半球梗死。与生理盐水组相比,Mg组的梗死体积并没有明显减小。然而,值得注意的是,与生理盐水组(P < 0.05)和Mg组(P < 0.05;图3A和B)相比,使用WE43提取物处理减少了梗死体积。同时,WE43组的体重变化不明显(P < 0.05;P = 0.2973;图3C)。
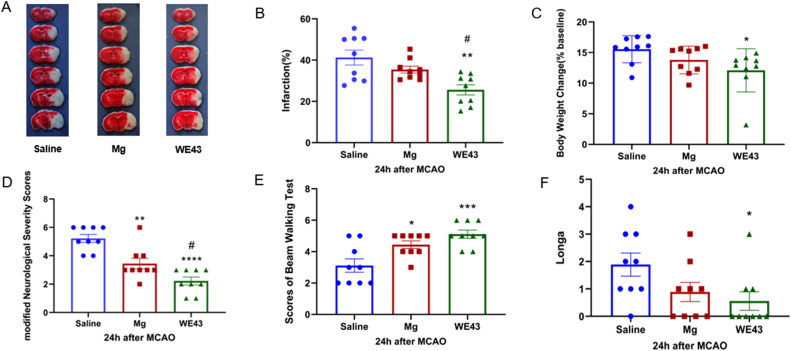
图3. 镁合金提取物处理对小鼠梗死体积和神经功能缺陷的影响。(A) MCAO后24小时小鼠大脑各组的梗死体积,通过TTC染色可视化。(B) 各组大脑梗死百分比(n = 9)。(C) 各组小鼠的体重变化(n = 9)。(D-E) 在MCAO后24小时评估各组小鼠的mNSS评分、横梁步行测试和Longa评分(n = 9)。数值表示为均值±标准差。* P < 0.05, ** P < 0.01, *** P < 0.001, # P < 0.05。“*, **, ***”代表生理盐水组与Mg组和WE43组的比较。“#”代表Mg组与WE43组之间的比较。
通过mNSS评分对小鼠的神经功能进行全面评估显示,Mg组和WE43组的评分低于生理盐水组(P < 0.01; P < 0.0001),并且WE43组的评分最低(P < 0.05; 图3D)。横梁步行测试测量小鼠在狭窄横梁上移动的能力,结果显示WE43组、Mg组和生理盐水组的小鼠运动技能依次下降(P < 0.05; P < 0.001; P = 0.3193; 图3E)。此外,WE43组的Longa评分显著降低(P < 0.05; 图3F)。这些发现共同证明,使用WE43提取物治疗可以显著改善小鼠因中风引起的神经功能缺陷。
为了确定WE43提取物治疗是否可以通过调节炎症反应和氧化应激来改善神经功能,我们在MCAO后24小时测量了脑组织中的促炎细胞因子(IL-1β, CXCR2)、抗炎细胞因子(IL-4, TGF-β1)以及氧化应激指标(MDA, SOD1)。图4A-D显示,与生理盐水组和Mg组相比,注射WE43提取物的小鼠梗死脑组织中IL-4(P < 0.01; P < 0.05)和TGF-β1(P < 0.05; P = 0.8639)的表达增加,而IL-1β(P < 0.01; P < 0.01)和CXCR2(P < 0.001; P < 0.01)的表达明显减少。与生理盐水组相比,Mg组中TGF-β1的表达增加(图4D, P < 0.05)。此外,在注射WE43提取物的小鼠非梗死脑组织中,IL-1β(P < 0.01; P < 0.05)和CXCR2(P < 0.05)的表达也减少(图4A, B)。结果表明,使用WE43提取物治疗减少了MCAO后小鼠的炎症反应。图4E显示,在MCAO后的WE43组小鼠梗死脑组织中,MDA的表达显著减少(P < 0.001; P < 0.01),非梗死脑组织中也显示了相同的结果(P < 0.01; P < 0.05)。与生理盐水组相比,WE43提取物治疗显著提高了梗死(P < 0.05)和非梗死脑组织(P < 0.01)中SOD1水平。Mg组中也观察到类似的变化(P < 0.05; P < 0.05; 图4F)。这些现象表明,WE43提取物可以抑制脑缺血损伤后的氧化应激。
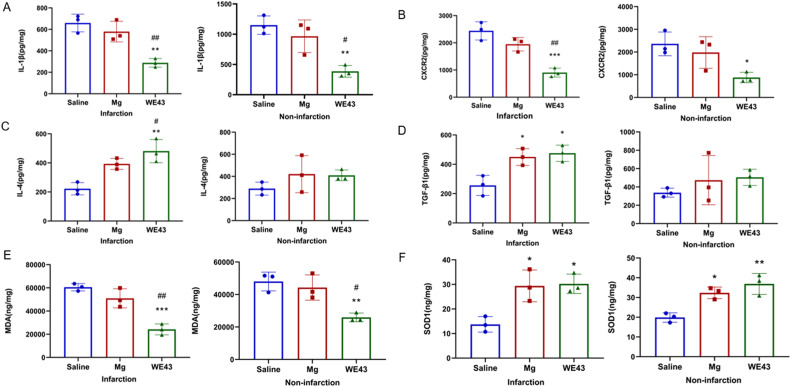
图4. 镁合金提取物处理对炎症反应和氧化应激的影响。使用ELISA在MCAO后24小时测量(n = 3)(A) IL-1β, (B) CXCR2, (C) IL-4, (D) TGF-β1, (E) MDA, (F) SOD1在梗死组织和非梗死组织中的水平。数值表示为均值±标准差。* P < 0.05, ** P < 0.01, *** P < 0.001, # P < 0.05, ## P < 0.01。“*, **, ***”代表生理盐水组与Mg组和WE43 Mg组的比较。“#, ##”代表Mg组与WE43 Mg组之间的比较。
3.3. 氢气在WE43合金神经保护效应中的作用
由于WE43合金在上述实验中表现出优异的神经保护效果,为了验证提取物中的H2是否在此发挥作用,我们进一步通过腹腔注射经过超声处理的WE43合金提取物到MCAO小鼠中。通过超声处理和气相色谱法可以去除液体中溶解的H2 [19]。腹腔注射无H2的WE43提取物后的梗死体积明显大于WE43提取物组(P < 0.05; 图5A, B)。并且WE43组的体重变化相对不明显(P < 0.05; 图5C)。mNSS评分、横梁步行测试和Longa评分均显示,WE43-H2组的神经功能更差(P < 0.0001; P < 0.001; P < 0.001; 图5D-F)。这些结果证实,来自WE43合金的H2和Mg2+协同发挥在MCAO小鼠中的神经保护作用。接受WE43合金提取物的小鼠脑水肿明显减轻(P < 0.01; 图5G),表明H2在MCAO后保持了BBB的完整性。
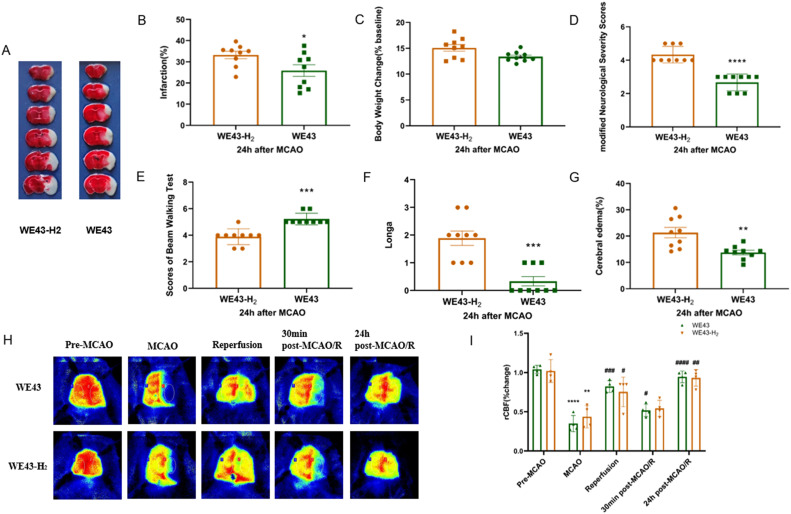
图5. H2对小鼠梗死体积、神经功能、脑水肿和CBF的影响。(A) 通过TTC染色可视化的WE43组和H2缺失的WE43组(WE43-H2)的梗死体积。(B) 脑梗死百分比的量化(n = 9)。(C) 两组小鼠在MCAO后24小时的体重变化(n = 9)。(D) 测量了脑水肿(n = 9)。(D-F) 评估了两组小鼠的mNSS评分、横梁行走测试和Longa评分(n = 9)。(G) 测量了脑水肿(n = 9)。数值为平均值±标准差。* P < 0.05, ** P < 0.01, *** P < 0.001, **** P < 0.0001。“*, **, ****, *****”代表WE43组与H2缺失的WE43组之间的比较。(H)在手术前、MCAO后立即、再灌注后立即、MCAO后30分钟和MCAO后24小时,使用激光散斑成像测量两组的CBF。(I)两组在多个时间点的CBF量化(n = 4)。数值为平均值±标准差。** P < 0.01, **** P < 0.0001, # P < 0.05, ## P < 0.01, ### P < 0.001, #### P < 0.0001。“**, ****”代表与基线CBF的比较。“#, ##, ###, ####”代表与MCAO后立即的CBF的比较。
为了探索MCAO后小鼠神经功能的改善是否与缺血区域CBF的增加有关,我们在不同时间点测量了小鼠的CBF。从基线开始,CBF在闭塞后显著下降,并在再灌注后恢复,这表明两组中MCAO小鼠模型的成功。在再灌注后30分钟,WE43组的CBF明显比MCAO后更充足(P < 0.05)。然而,在用WE43-H2提取物处理的小鼠中,再灌注后30分钟的CBF与MCAO后相比没有显著变化(P = 0.2716)。这一结果支持H2可能在短时间进入脑组织并扩张脑血管,从而增加CBF的观点。此外,两组在再灌注后24小时的CBF恢复(P < 0.0001; P < 0.01),这可能是由于侧支循环的补偿和Mg2+的血管扩张作用(图5H和I)。
为了评估H2是否通过调节炎症反应和氧化应激发挥神经保护作用,比较了WE43组和H2缺失的WE43组之间脑组织中炎症因子和氧化应激指标的表达。图6A-D显示,与WE43-H2组相比,WE43组小鼠梗死脑组织中IL-4(P < 0.05)和TGF-β1(P < 0.05)的表达显著升高,而IL-1β的表达降低(P < 0.01),这表明来自WE43提取物的H2减少了MCAO后小鼠的炎症反应。与WE43-H2组相比,MDA水平在WE43组小鼠MCAO的梗死(P < 0.05)和非梗死脑组织(P < 0.05)中显著降低(图6E)。并且,SOD1水平在WE43组小鼠梗死脑组织中显著升高(P < 0.01; 图6F)。这些结果表明,来自WE43提取物的H2可以抑制脑缺血和再灌注损伤后的氧化应激。除了动物研究外,还通过体外细胞实验评估了提取物。图S2表明,未经处理和超声处理的WE43合金提取物都对氧-葡萄糖剥夺/再氧化损伤的HT-22细胞显示出神经保护作用。
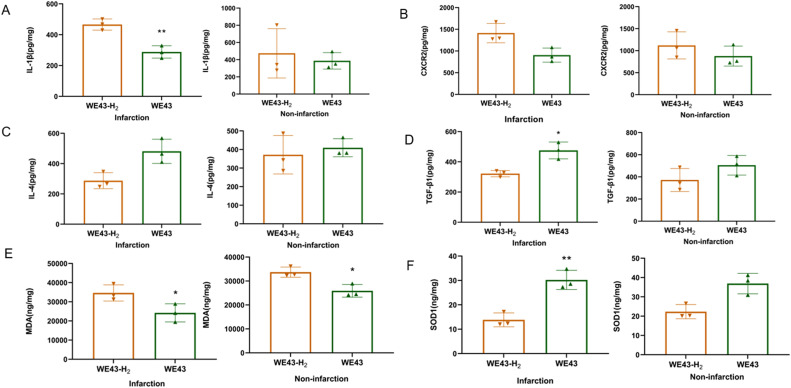
图6. H2对炎症反应和氧化应激的影响。(A) IL-1β, (B) CXCR2, (C) IL-4, (D) TGF-β1, (E) MDA, (F) SOD1在MCAO后24小时使用ELISA测量梗死组织和非梗死组织中的表达(n = 3)。数值为平均值±标准差。* P < 0.05, ** P < 0.01。“*, **”代表WE43组与H2缺失的WE43组之间的比较。
4. 讨论
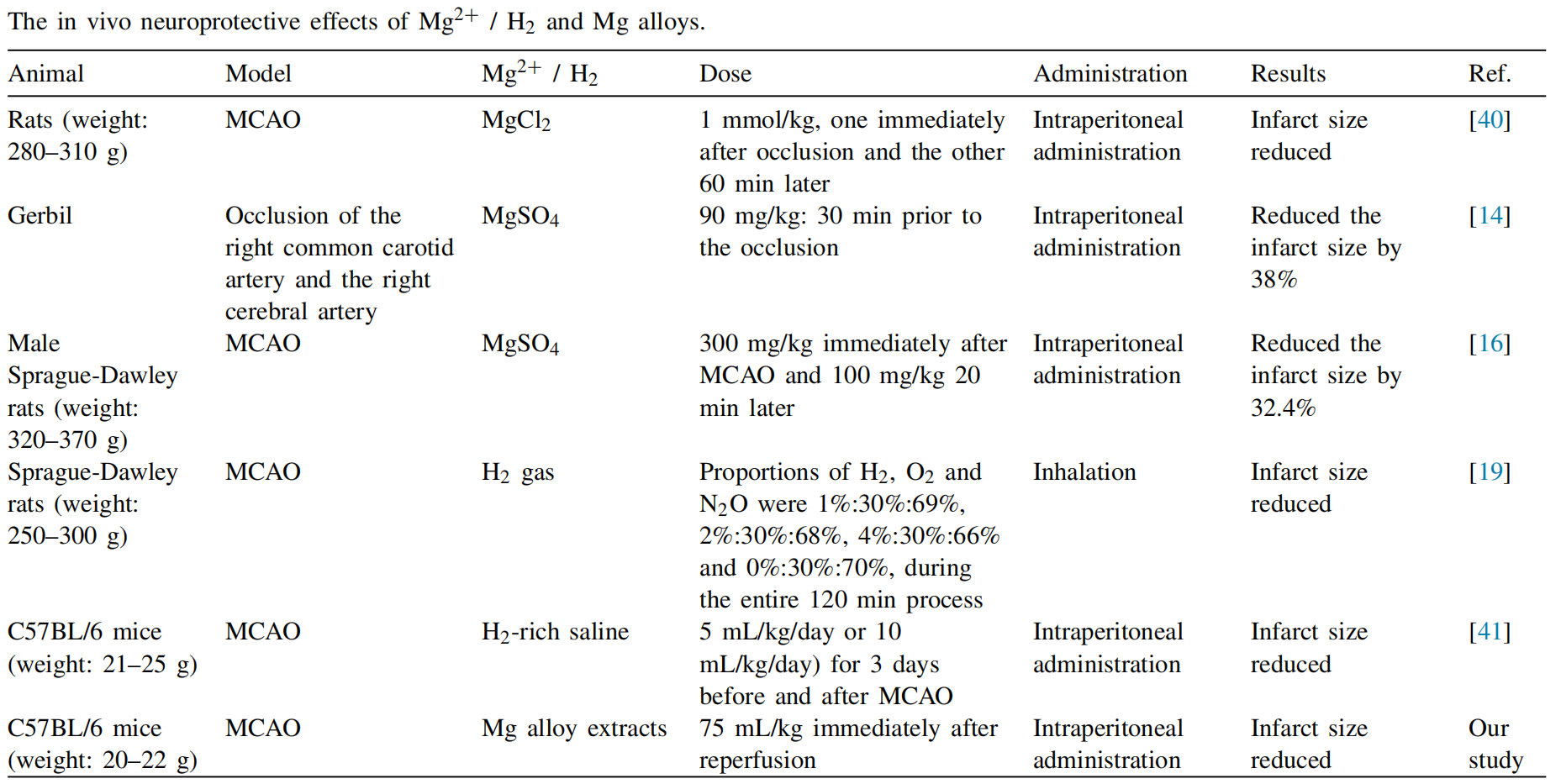
Mg2+ [39]和H2 [20,21]的单独神经保护作用已被广泛研究(表2)。镁合金在其腐蚀过程中可以同时产生这两种物质。我们的开创性研究证实了WE43合金降解产物在小鼠脑缺血和再灌注损伤后的腹腔注射具有神经保护作用。具体来说,我们发现:(1)WE43提取物在MCAO后24小时的再灌注中显著减少了脑梗死体积并改善了小鼠的神经功能;(2)来自WE43提取物的Mg2+和H2减少了炎症反应和氧化应激;(3)来自WE43的H2和Mg2+协同增加了CBF并恢复了BBB的完整性。
4.1. Mg2+作为神经保护剂的实验和临床证据
Mg2+通常在妊娠期间用于治疗先兆子痫和子痫,并恢复早产儿的神经功能,这是因为其具有神经保护效果[42]。同时,Mg2+在脑缺血保护方面显示出巨大的应用前景。许多动物实验都显示了积极的结果。Izumi等人首次研究发现,大鼠在MCAO后立即或1小时后腹腔注射氯化镁(MgCl2, 1 mmol/kg)后,脑梗死体积减少[40]。Lin等人在闭塞前30分钟向沙鼠腹腔注射硫酸镁(MgSO4, 90 mg/kg),观察到接受MgSO4的沙鼠的梗死体积显著减少[14]。结果还证明,MgSO4通过抑制谷氨酸释放和调整大脑能量状态发挥神经保护作用[14]。此外,Shadman等人发现,在MCAO后立即腹腔注射MgSO4(300 mg/kg)并在20分钟后再次注射(100 mg/kg)的大鼠,其梗死体积显著减少,并证明Mg2+可以通过增强抗氧化酶活性和下调脂质过氧化来保护BBB完整性和减少脑水肿[16]。
然而,Mg2+在中风临床治疗中的神经保护作用仍然存在争议。在FAST-MAG试验中,接受静脉注射MgSO4的患者与接受安慰剂治疗的患者在症状出现后2小时内的平均改良Rankin量表评分相似,这表明MgSO4治疗在超急性中风患者中3个月的功能预后没有改善[43]。这项研究结果有两个可能的解释。首先,动物模型无法完全模拟人类脑缺血损伤后的BBB开放[44]。尽管血清Mg2+浓度迅速增加,但Mg2+在短期内无法穿透人类的BBB[45]。因此,脑组织中的Mg2+浓度不能显著增加以达到有效的脑保护。其次,单独使用Mg2+作为神经保护剂可能无法阻断脑缺血损伤分子机制中的足够途径[46]。因此,可能需要联合使用神经保护剂,这需要进一步的实验研究。
4.2. 镁合金提取物的神经保护作用
与Mg2+溶液相比,镁合金提取物还含有其他微量元素。镁合金可以在水环境中降解,主要产生Mg2+并同时释放H2[11]。不仅Mg2+,H2也在神经保护中发挥作用[19]。植入体内的镁合金将持续与体液接触,释放Mg2+和H2。由于Mg2+的神经保护作用以及镁合金的良好生物相容性和可降解性,镁合金在神经科学中的应用,如神经电极、血管支架、神经修复和再生等方面已进行了初步研究[8]。然而,关于镁合金与神经细胞相互作用的研究很少。
Fei等人证明,ZN20(Mg-2Zn-Nd)和Mg-10Li合金提取物对背根神经节(DRG)神经元的轴突形态没有明显影响,这表明没有严重的神经毒性[47]。Liu等人确认,AZ91D提取物增加了轴突及其分支的数量,表明AZ91D具有促进DRG神经元轴突生长的作用[48]。另一项研究评估并确认,生物可降解的AZ31B Mg合金对神经细胞是安全的,因为体内神经细胞的实际死亡率低于体外细胞毒性评估[49]。在这项研究中,我们通过在MCAO后的再灌注立即对小鼠腹腔注射Mg合金提取物,检查了Mg合金降解产物在脑缺血中的安全和神经保护作用。本研究中观察到的脑梗死体积减少和神经功能的改善表明,Mg合金对小鼠脑缺血有神经保护作用。4.2.1. Mg合金提取物减少炎症反应并抑制氧化应激脑缺血激活炎症反应,导致包括血脑屏障破裂和脑水肿在内的严重损伤,进一步加重损伤[50]。更重要的是,在脑组织的缺血和再灌注过程中,活性氧物种(ROS)迅速大量产生[51,52]。ROS的过量产生破坏了氧化还原平衡,触发各种损害机制破坏抗氧化防御系统,导致氧化应激[53]。本研究证实,WE43提取物可以在小鼠缺血性中风的早期阶段减少炎症反应和氧化应激。之前的证据支持Mg2+能够穿过BBB[54]。Mg2+主要通过腹膜中的血管和淋巴管进入循环系统,然后对脑组织产生影响。作为天然的钙拮抗剂,Mg2+发挥调节神经传递和协调神经肌肉的作用,并通过各种机制发挥神经保护作用[39]。Mg2+通过抑制N-甲基-D-天门冬氨酸型谷氨酸受体的持续激活来保护神经细胞免受死亡[55]。Mg2+还可以通过调节线粒体活动来抑制凋亡[56]。此外,Mg2+可以减少炎症[57]和氧化应激[58]。Koning及其同事在大鼠单侧缺氧缺血前给予MgSO4治疗,发现MgSO4预处理减少了ROS产生和促炎细胞因子[59]。与之前的研究一致,我们观察到在小鼠腹腔注射Mg合金提取物后,脑缺血组织中促炎细胞因子IL-1β和CXCR2的表达减少,抗炎细胞因子IL-4和TGF-β1的表达增加,脂质过氧化物MDA减少而SOD1增加,表明氧化应激被抑制。因此,我们可以得出结论,Mg合金具有抗炎特性。除了Mg2+,我们还检测到Mg合金的降解也释放了H2。由于H2是电中性的且分子量极小,因此能够轻松穿透生物膜并进入细胞和细胞器[60,61]。H2可以轻松穿过BBB并发挥神经保护作用[41,62]。研究人员发现,H2减少了羟基自由基并有效保护神经元免受氧化应激[19]。此外,他们发现,吸入H2后,MCAO大鼠动脉血中的溶解H2(10∼40 ng/mL)可以抑制氧化应激,从而抑制缺血再灌注引起的脑损伤并显著改善神经功能[19]。另外,H2通过减弱促炎细胞因子的释放而表现出抗炎效果[21]。Yang等人证实,H2通过抑制核因子kappaB(NF-κB)的磷酸化,在糖尿病大鼠MCAO后显著减少炎症反应[63]。与他们的研究一致,我们发现促炎细胞因子IL-1β和CXCR2的表达减少,抗炎细胞因子IL-4和TGF-β1的表达增加。脂质过氧化物MDA减少而SOD1增加。因此,这些结果使我们得出以下结论:来自WE43合金的H2和Mg2+通过减少炎症反应和抑制氧化应激协同发挥神经保护作用。4.2.2. 镁合金提取物增加脑血流量
我们的研究结果显示,与去氢的WE43提取物相比,使用WE43提取物治疗显著改善了小鼠在再灌注后30分钟的脑血流量(CBF)。之前的研究已经提供了证据表明,体内的H2交换发生得非常迅速[12,64]。Kuhlmann等人在无毛小鼠皮下注射了H2(99.999%),并发现H2浓度在1小时后大幅下降,12小时后几乎完全交换完毕[12]。Ono等人检测到,患者在吸入H2(3%或4%)30分钟后终止吸入,动脉和静脉中的H2浓度在6分钟和18分钟内分别骤降至终止前的10%[64]。此外,吸入H2后,H2在不同组织中分布,其中脑组织中的H2浓度最高[65]。因此,基于这些之前研究的结果,我们推测WE43提取物进入小鼠腹腔后,H2迅速释放,进入脑组织后扩张脑血管,增加了CBF。Du等人的结果也支持我们的推断[41]。他们阐明,腹腔注射富含H2的盐水可以明显增加CBF,同时改善MCAO小鼠的神经功能[41]。
此外,Chi等人发现,MgSO4能够抑制脑血管收缩和痉挛,产生脑血管扩张,从而增加MCAO大鼠脑缺血区域的CBF[66]。因此,Mg2+的血管扩张作用可以部分解释两组在再灌注后24小时CBF恢复的原因。而且,MCAO后再灌注后侧支循环的良好代偿也有助于缺血脑组织血流灌注的恢复[67]。
4.2.3. 镁合金提取物恢复血脑屏障完整性并减少脑水肿
脑缺血和再灌注损伤导致血脑屏障(BBB)破坏,增加血管通透性和血浆蛋白外渗到大脑间质空间,从而导致脑水肿[68,69]。本研究显示,与去氢的WE43组小鼠相比,注射WE43提取物的小鼠在MCAO后24小时的脑水肿显著减轻,这表明H2对抑制脑水肿形成具有显著影响。根据一项研究,吸入高浓度H2(66.7%)的小鼠在MCAO后24小时的大脑含水量显著减轻[70]。然而,关于H2疗法是否减少脑缺血后的脑水肿的研究证据相对较少,当前研究的结果可能为此提供了证据。此外,Shadman等人发现,Mg2+在MCAO后显著减少了脑水肿并增加了BBB完整性[16]。因此,Mg2+可能与H2协同作用,参与恢复BBB完整性和减少脑水肿[71]。
4.2.4. 镁合金提取物的其他神经保护机制
考虑到之前的工作已经暗示Mg2+和H2可能还通过其他机制诱导神经保护。Mg2+可以通过阻碍N-甲基-D-天门冬氨酸受体(NMDA)受体通道来抑制钙离子内流,从而减少细胞内钙超载导致的神经损伤[13]。并且已证明Mg2+能增强突触可塑性并调节神经元活动[72,73]。Mg2+有助于调节三磷酸腺苷(ATP)浓度,改善线粒体功能障碍和能量代谢紊乱[74]。此外,Mg2+还能抑制细胞凋亡并防止细胞损伤[[75],[76],[77]]。值得注意的是,不仅是Mg2+,H2也可能有助于保持线粒体功能并增强ATP的产生[78,79]。研究已报告H2能够改善神经细胞焦亡并对神经损伤产生抗凋亡效果[80,81]。另外,H2可以防止神经自噬,从而减少神经细胞死亡[82]。总之,Mg2+和H2通过多种机制协同发挥神经保护作用(图7),这仍然需要进一步研究来验证和探索更详细的机制途径。
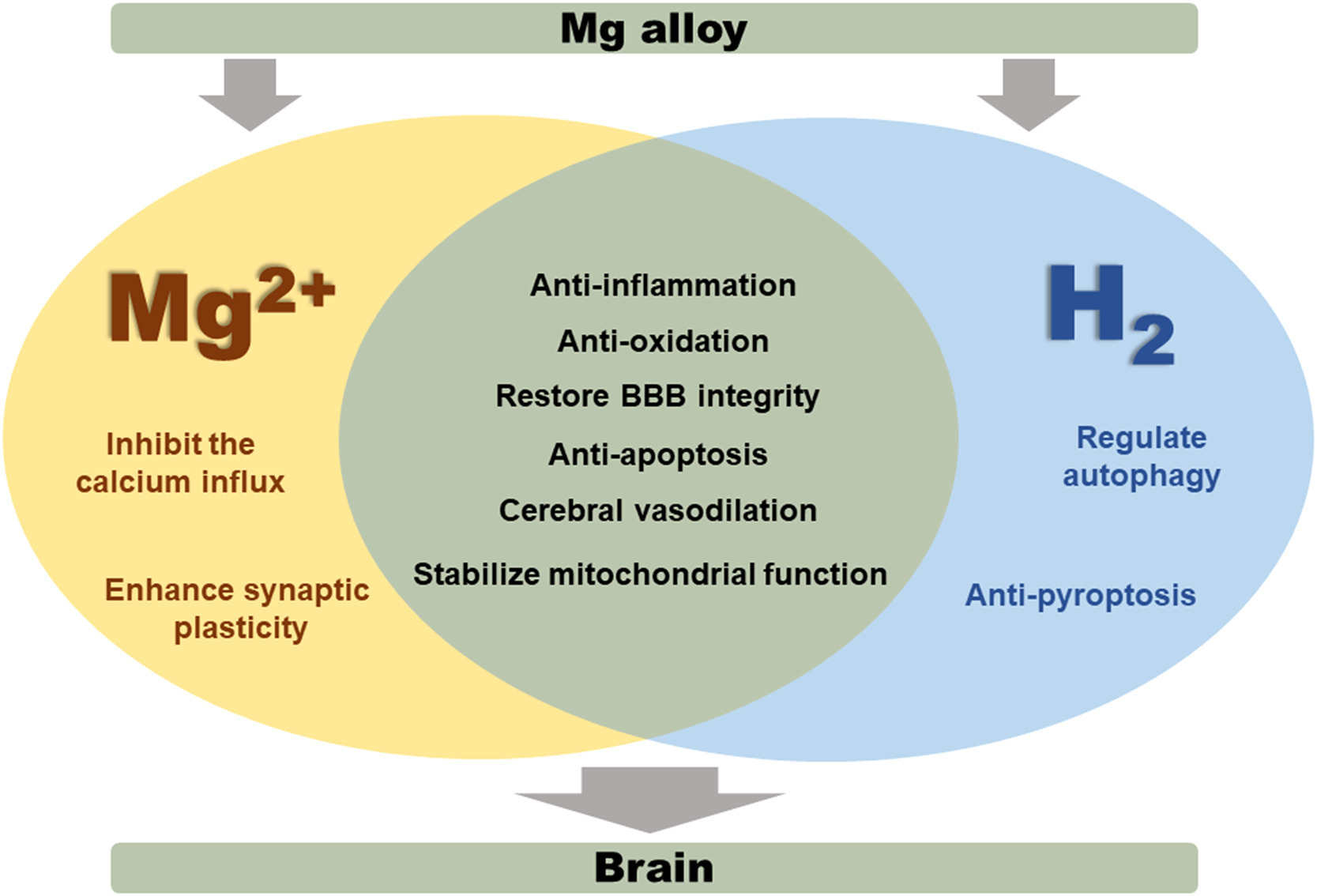
图7. Mg2+和H2的神经保护机制。Mg2+和H2都可以通过抗炎、抗氧化、恢复血脑屏障(BBB)完整性、抗凋亡、脑血管扩张、稳定线粒体功能来发挥神经保护作用[13,16,41,59,62,66]。此外,Mg2+能抑制钙离子内流并增强突触可塑性[13]。H2能够防止焦亡并调节神经自噬[62]。
4.3. 镁与WE43的比较
在镁合金支架中[[83],[84],[85]],只有基于WE43的药物洗脱支架Magmaris(BIOTRONIK, 德国)获得了CE标志认证[84]。部分原因是WE43具有出色的机械性能,这对于支撑病变血管足够长的时间是必要的[85]。WE43合金的极限抗拉强度(UTS)经过多轴拉伸后可以达到300MPa,总延伸率达17%[86],而纯镁的挤压状态的UTS通常低于200MPa[87]。从生物安全性的角度来看,尽管WE43合金在降解过程中会释放Y和Gd元素,这些元素对人体并非原始元素,但低剂量下的安全性已得到证实[88];但其神经兼容性仍需进一步研究。
WE43合金的长期腐蚀速率比纯镁慢[89],这有助于在愈合期间保持机械完整性[85]。然而,WE43在生理盐水中的早期腐蚀速率高于纯镁[89,90]。这主要是因为WE43中存在第二相,在晶界处的Mg24Y5和Gd及Y的氧化物比镁基体更稳定,导致在WE43中第二相与镁基体之间形成电偶[91,92]。作为电偶中的阳极,α-Mg基体降解得更快,短期内产生更多的镁离子和氢气。而纯镁的细化晶粒尺寸可以说明腐蚀层的稳定性和对镁基材的粘附性改善[93],这被认为是本研究中纯镁具有更好抗腐蚀性能的原因。M. Ascencio的研究发现,在前48小时内氢产生速率下降,由于形成多孔腐蚀层,直到24小时观察到Mg浓度线性增加[90]。同时,在Yang Liu的研究中,WE43在前2天内表现出更快的氢气产生速率,这是由多相结构导致的[89]。我们的研究与其他长期研究之间的腐蚀速率差异可以通过高Y含量的共晶网络的存在来解释,这在我们的短期研究中并未发生[91]。
WE43和纯镁的神经保护作用可能与镁离子和H2的浓度有关。研究表明,神经保护是剂量依赖性的,可以通过改善神经预后、减少梗死体积和减少缺血边缘区的组织学神经损伤证据来证明[94,95]。它们的神经反应可能通过控制镁合金的腐蚀速率通过表面涂层或合金元素来调整。WE43在短期内的高腐蚀速率比纯镁产生更多的镁离子和氢气[96]。因此,从神经保护功能的角度来看,WE43比纯镁更适合作为颅内植入物。
5. 结论
基于镁的生物可降解支架已在其生物降解性和生物相容性方面得到了广泛研究。在本研究中,我们通过腹腔注射验证了来自WE43合金的主要降解产物(Mg2+和H2)对MCAO小鼠缺血脑组织的神经保护作用。mNSS评分、光束行走测试和Longa评分显示,WE43提取物能显著恢复MCAO小鼠的神经功能缺损。来自WE43提取物的Mg2+和H2被证实通过增加IL-4、TGF-β1、SOD1的表达和减少IL-1β、CXCR2、MDA的表达来发挥抗炎和抗氧化作用。同时,Mg2+和H2有助于增加CBF和恢复BBB完整性。因此,本研究为镁合金支架在颅内血管中的应用提供了一定的理论依据。
https://blog.sciencenet.cn/blog-41174-1440012.html
上一篇:肿瘤微生物组学《自然》重要论文撤稿
下一篇:看见食物就感觉饱的神经元