博文
体液免疫的抗肿瘤贡献受B细胞成熟轨迹影响
|
B细胞是适应性免疫的关键参与者。在典型的反应中,抗原特异性的 B 细胞在称为生发中心 (GC) 的瞬时结构中被激活和增殖,其中它们的 B 细胞受体 (BCR) 经历多轮突变,并选择具有更牢固地结合抗原的 BCR 的克隆。然后,选定的GC B细胞成为记忆细胞,准备应对未来的挑战,或分化为分泌抗体的浆细胞。这一过程是自然获得和疫苗诱导的感染保护的基础。相比之下,B 细胞对抗癌免疫应答的重要性在很大程度上被忽视了,并且在检查时产生了相互矛盾的结果 (1, 2)。在本期第524页,马等人(3)解码了B细胞浸润多种人类肿瘤的功能,并表明决定体液免疫对癌症结果影响的是反应的轨迹,而不是肿瘤类型。
马等人的研究提供了一种相对公正的方法来解决体液免疫对癌症进展的重要性。作者从20种不同的人类癌症类型和250多个个体中对肿瘤浸润性B细胞进行了采样,并使用单细胞方法测量基因转录和染色质结构。该分析与肿瘤浸润B细胞之间的克隆关系的确定(通过对每个细胞的BCR进行测序)和免疫细胞解剖组织的免疫组织学分析相结合。这项工作的广度和规模使作者能够忽略每个肿瘤微环境的特殊性,而是专注于免疫反应的共性并确定主要的B细胞亚群。
抗肿瘤B细胞的两种成熟途径
生发中心通路需要形成成熟的 TLS 和经典记忆 B 细胞,导致浆细胞分泌高亲和力肿瘤特异性抗体。或者,谷氨酰胺可以促进非典型记忆 B 细胞和未成熟 TLS 的发育,这些细胞产生分泌低亲和力(通常不是肿瘤特异性)抗体的浆细胞。任何一种途径的患病率都会影响多种癌症类型的临床结果。
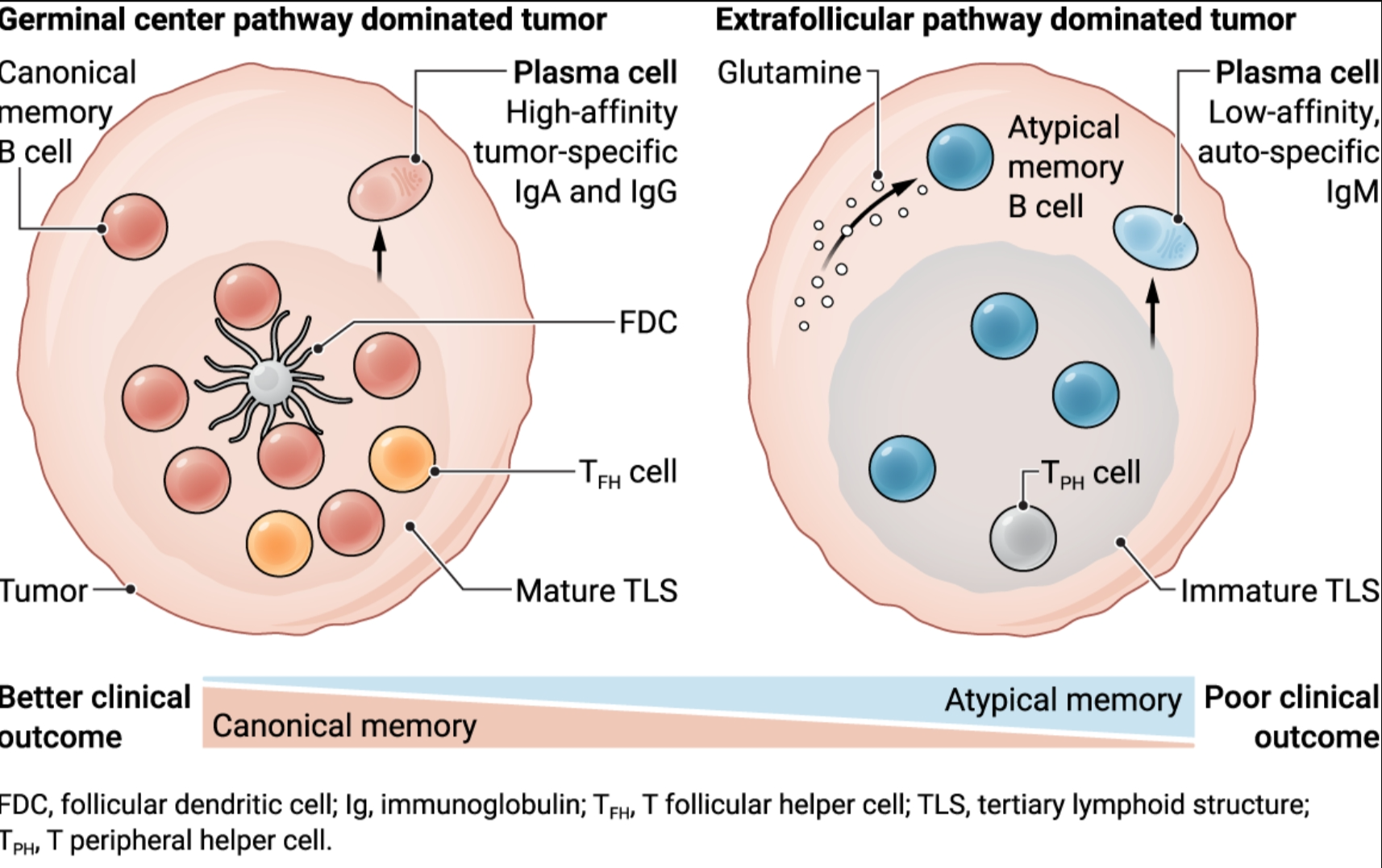
有效的体液反应与次级淋巴器官(如淋巴结)滤泡中GC的形成以及高度特异性抗体的产生有关。然而,B 细胞也可以通过滤泡外 (EF) 通路产生,该通路引导细胞远离 GC 和突变驱动的 BCR 亲和力增加。肿瘤还可以支持称为三级淋巴结构(TLS)的有组织的免疫细胞簇,其类似于次级淋巴器官中发现的免疫细胞簇。尽管最成熟的TLS通常与良好的患者预后相关,但许多B细胞浸润的肿瘤仅显示紊乱或没有TLS,这意味着存在替代分化途径(见图)。
马等人区分了肿瘤浸润B细胞的两种成熟轨迹。除了产生经典记忆和高亲和力肿瘤特异性抗体的经典GC通路外,他们还描述了存在于未成熟TLS中的非典型记忆(AtM)B细胞群,这些细胞显示出EF反应的特征。这些 AtM 细胞表达 CD11c、FCRL4(Fc 受体样蛋白 4)和 T-BET 等标志物,这些标记物先前报道过与衰老、自身免疫和慢性感染相关的小鼠和人 AtM B 细胞的特征 (4, 5)。AtM B 细胞的 EF 起源与它们与未成熟 TLS 的关联一致,并引发了一个“先有鸡还是先有蛋”的问题:AtM B 细胞是否无法参与 GC 反应从而限制 TLS 的成熟,还是未成熟的 TLS 驱动了 AtM B 细胞的发育?
使用BCR序列作为独特的细胞条形码,马等人发现了与自身免疫和衰老相关的AtM B细胞的其他共同特征:BCR突变很少,它们更有可能识别健康组织。至关重要的是,GC 和 EF 成熟途径之间的这种明确分离排除了 AtM 和 GC 衍生的记忆 B 细胞之间的任何前体-后代关系,这意味着向 AtM B 细胞分化途径的分支发生在免疫反应的早期。值得注意的是,尽管每个发育轨迹都以分泌抗体的浆细胞的产生而告终,但AtM B细胞衍生的浆细胞表现出更有限的多样性和抗体分泌能力,这表明它们在功能上存在缺陷。除了产生较差的抗体反应外,AtM B 细胞还可能通过表达抑制性表面受体和细胞因子来损害其他抗肿瘤免疫细胞的活性。AtM B 细胞与患者预后不良和治疗耐药性的关联支持这些细胞可能具有抑制作用,值得进一步研究。
尽管在大多数癌症类型中,两种潜在的 B 细胞发育轨迹共存,但某些肿瘤类型强烈偏向于 GC(甲状腺癌、胆囊癌和结肠癌)或 EF(卵巢癌、肾癌和膀胱癌)通路。这种偏好表明肿瘤微环境会影响两种轨迹之间的决定。马等人一致地发现,代谢编程是GC和EF途径之间变化的关键特征,氨基酸谷氨酰胺在诱导AtM B细胞分化中起着重要作用。谷氨酰胺已被确定为免疫细胞中的免疫调节营养素 (6, 7),尤其是在 T 细胞和树突状细胞中,它也是癌细胞生长的重要营养素。此外,谷氨酰胺衍生的代谢物 α-酮戊二酸是一种介导组蛋白和 DNA 去甲基化的表观遗传辅因子 (8),可将代谢与转录网络联系起来,从而将细胞身份联系起来。因此,谷氨酰胺限制性限制可能是一种有吸引力的治疗策略,可以调节癌症中的 B 细胞成熟通路,因为它可能同时增强抗肿瘤反应并限制肿瘤生长 (9, 10)。未来在肿瘤模型中阻断谷氨酰胺的工作应考虑检查体液反应和 AtM B 细胞,以充分涵盖这一有前途的策略的影响。
总的来说,马等人的研究结果加强了体液免疫在癌症控制中新兴但复杂的作用。现在似乎很清楚,影响B细胞是否在癌症结果中发挥作用的是个体肿瘤微环境和由此产生的肿瘤免疫浸润组成,而不是肿瘤类型本身。这些发现为开发一类新型免疫疗法提供了理论依据,该疗法专门促进肿瘤特异性B细胞反应的最有效轨迹。
A blueprint for tumor-infiltrating B cells across human cancers
结构化摘要
介绍
肿瘤浸润性B细胞已成为癌症免疫的重要参与者,并作为免疫治疗反应的预测因子。这些B细胞表现出多种功能,主要是通过它们分化成浆细胞产生抗体的能力,但在不同的癌症类型中时空有所不同。剖析不同癌症类型中B细胞的丰度和分化状态有望改善免疫治疗反应。
理由
为了编制全面的泛癌B细胞图谱,我们对不同癌症类型患者的配对肿瘤、淋巴结转移、邻近正常组织和外周血进行了单细胞RNA测序(scRNA-seq),并纳入了大量已发表的scRNA-seq数据集。在校正批量效应后,该图谱包含来自 20 种癌症类型的 269 名患者的 scRNA-seq 数据。我们组装了具有基因表达谱的单个 B 细胞的 B 细胞受体 (BCR) 测序,以表征 B 细胞和抗体分泌细胞 (ASC) 之间的动态转变。我们整合了来自不同癌症的 B 细胞的单细胞染色质可及性景观,以剖析在微调 B 细胞发育中起作用的表观基因组调控网络。我们在成熟与未成熟的三级淋巴结构 (TLS) 中对 B 细胞进行了空间定位,并研究了引导 B 细胞产生特定反应的潜在调节因子。
结果
我们揭示了 B 细胞和浆细胞内的大量异质性,鉴定了 15 个 B 细胞亚群和 10 个浆细胞亚群。我们通过计算推导并验证了通过经典生发中心 (GC) 和替代滤泡外 (EF) 途径获得 ASC 的两种独立发育途径,并证明了明显的癌症类型偏好。结肠腺癌和肝肝细胞癌分别是富集GC和EF通路的两种代表性癌症类型。我们确认EF显性癌症与免疫反应失调和较差的临床结果相关。然后,我们确定了动态代谢-表观遗传-信号网络,这些网络参与微调肿瘤浸润 B 细胞分化并管理 EF 和 GC 通路之间的平衡。非典型记忆 (AtM) B 细胞是 EF 衍生 ASC 的主要祖细胞,表现出疲惫和旁观者表型,并且独立于 GC 通路发育。我们发现AtM B细胞位于未成熟TLS的中心,并在TLS成熟期间在空间上重新定位到外围。最后,我们从机制上将这些发现与特定的转录因子和表观基因组调控联系起来。我们证明了谷氨酰胺衍生的代谢物α-酮戊二酸 (α-KG) 可以增加 AtM B 细胞相关转录因子 T-bet 和 BATF 的表达并促进它们的分化,同时激活哺乳动物雷帕霉素复合物 1 靶标 (mTORC1) 信号传导。因此,AtM B 细胞获得免疫调节功能,抑制抗肿瘤 T 细胞反应并促进免疫抑制微环境。
结论
我们编制了人类癌症中B细胞异质性和两种动态分化途径的蓝图,为未来的研究提供了ASC分化轨迹的基础参考。EF和GC通路的系统比较揭示了不同癌症类型中B细胞状态的异同,突出了与EF通路相关的AtM B细胞免疫抑制微环境相关的不利临床结果。代谢-表观遗传网络非常灵活,可以重新配置B细胞的命运,从而促进B细胞靶向免疫疗法的发展。
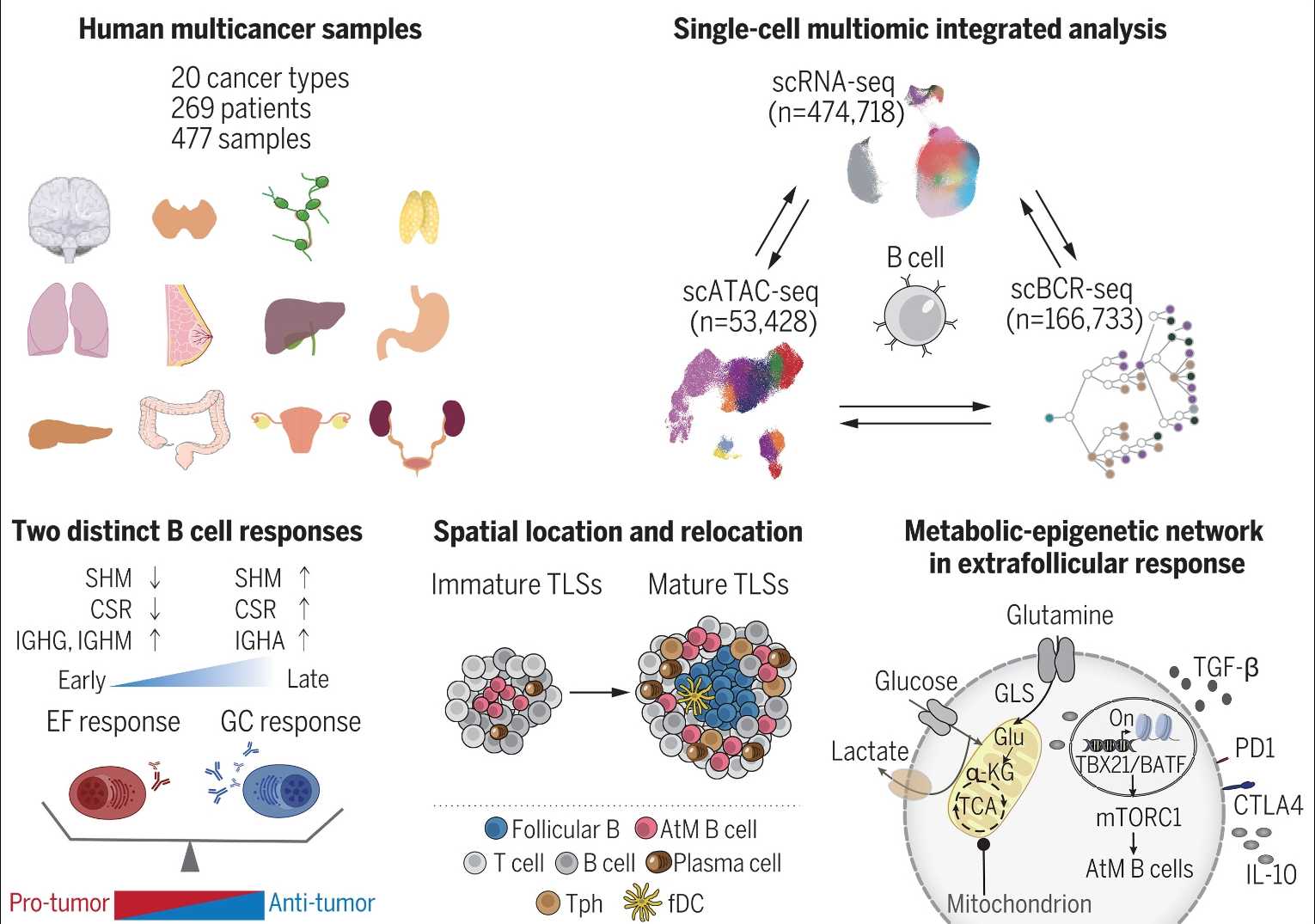
人类泛癌B细胞图谱的系统分析。
我们使用单细胞测序数据分析了来自20种癌症类型的269名患者的474,718个B细胞。通过结合基因表达谱、BCR 序列和染色质可及性,我们研究了肿瘤浸润 B 细胞的多样性和可塑性,并对癌症类型之间的 EF 和 GC 反应性浆细胞进行了多层次比较。我们可视化了它们在TLS成熟过程中的动态空间位置,并确定了调节B细胞分化的潜在代谢表观遗传机制。
https://blog.sciencenet.cn/blog-41174-1432625.html
上一篇:氢气吸入改善运动疲劳的作用【北体+哈佛】
下一篇:骨内给氢组织再生技术【24章】