博文
物理储氢技术进展  精选
精选
|
随着可靠能源的枯竭以及污染能源对环境和气候的影响成为全球性挑战,许多国家开始采用包括氢能在内各种可再生能源。氢能是未来全球能源系统中的能源载体,并有潜力实现零碳排放。在非化石能源中,氢和电被认为是提供终端用户服务的主要能源载体,因为它们能满足大多数消费者的需求。因此,开发氢气生产和储存技术以满足“氢经济”的标准是必要的。在固体储存材料中物理和化学吸收氢气是一种有前景的储氢方法,因为其具有高储存和运输性能。本文回顾了诸如空心球、碳基材料、沸石和金属-有机框架等物理储氢材料。我们总结并讨论了这些材料的性质、在不同温度和压力下的氢气储存密度,以及这些材料的制造和改性方法。同时也讨论了与这些物理储氢材料相关的挑战。
Le TH, Kim MP, Park CH, Tran QN. Recent Developments in Materials for Physical Hydrogen Storage: A Review. Materials (Basel). 2024 Jan 29;17(3):666.
1. 引言
不可再生的能源(化石燃料),如煤炭、石油和天然气,在过去150多年的全球经济中发挥了至关重要的作用。化石燃料约占全球能源需求的80%。然而,预计化石燃料资源将会耗尽,并且需要补充。此外,由于化石燃料的主要成分是碳,因此燃烧化石燃料以产生能量时,会向大气中释放二氧化碳,引起各种环境和气候问题。人口和经济的快速增长导致化石燃料资源的快速枯竭以及严重的环境和气候影响。因此,许多国家的政府正在争相转向替代和可再生能源,以确保自身的能源供应并为“净零排放”承诺做出贡献。
到2020年,超过110个国家已承诺到2050年实现nZEC目标;中国作为排放大量二氧化碳的国家之一,已承诺到2060年实现这一目标。这些国家必须在2050年之前拥有“净零能耗建筑”,这意味着一栋建筑每年使用的能源量必须等于现场产生的可再生能源量。“零排放”或“碳中和”意味着即使排放了碳,也会捕获并将排放的碳气体储存在其他地方或用于某种用途。使用可再生能源结合碳捕获利用系统可以帮助解决能源不足和全球变暖的问题。
氢气是轻的、能量密集且可储存的,可以从化石燃料、生物质、水或它们的组合中生产出来。使用氢能源不会直接产生污染物或排放温室气体;因此,氢被认为是最清洁的能源之一。氢对于实现零碳排放做出了重大贡献,可以被视为未来清洁、安全且负担得起的能源。
此外,氢可以促进可再生能源的发展和扩张,例如太阳能和风能,并不总是能够匹配需求。氢是可再生能源转移和储存的最佳选择之一,也是长期电力储存的最低成本选择。氢气和基于氢的燃料可以将能源从拥有丰富太阳能和风能资源的地区输送到距离数千公里远的能源贫乏地区。因此,许多国家正在实施支持投资氢产业的政策和项目。此外,可以改进、开发和扩大氢气生产和储存技术,以允许在未来广泛使用氢气。
当前,氢气储存在氢能源应用中仍然是一个挑战。除了压缩和液化的氢气外,氢气储存材料在促进氢行业广泛应用中扮演着重要角色。与压缩和液化方法相比,储存材料可以安全地存储更高密度的氢气;因此,使用这些材料的系统可以灵活操作。此外,储存材料最适合车载和固定式应用 [12]。
氢气储存材料分为化学吸附和物理吸附类型,各有优缺点。理性地讲,氢气储存材料需要满足丰富、安全、低成本、快速动力学、易于处理、适宜的热力学性质(可逆)以及高重量和体积密度的氢气的要求 [13]。图 1 显示了氢气储存材料的分类。化学储存材料具有高能量密度潜力和易用性,尤其是涉及液体的系统,使用与当今燃气管道加气站类似的基础设施。然而,由于化学材料的几种不可逆储存方法,脱氢过程相对具有挑战性 [14]。由于产生诸如氮氧化物和碳氧化物等气态污染物,它不适合与氨和其他储存化合物一起使用。此外,金属氢化物储存材料的动力学性能差且热力学稳定性不足,尽管它们可以在低压和常温下操作,并且具有较高的体积能量密度 [15]。另一方面,物理储存系统可以分为控制条件(压力/温度)和选择吸收剂。用于氢气的控压或温控储存系统,如低温液化和高压压缩技术已经成熟。然而,这些方法存在安全问题、高成本和低储存容量的限制 [16]。作为物理氢气储存方法中的高效氢气吸收剂,新型多孔材料的利用指向了克服当今物理储存系统关键限制的未来,展现出高储存密度、快速充放电动力学和低成本的优势 [17]。在本综述中,我们首先关注用于在中空结构中存储压缩氢气或在纳米或介孔结构中吸收氢气的物理储存吸收剂,例如金属-有机框架(MOFs)、碳基材料或沸石。
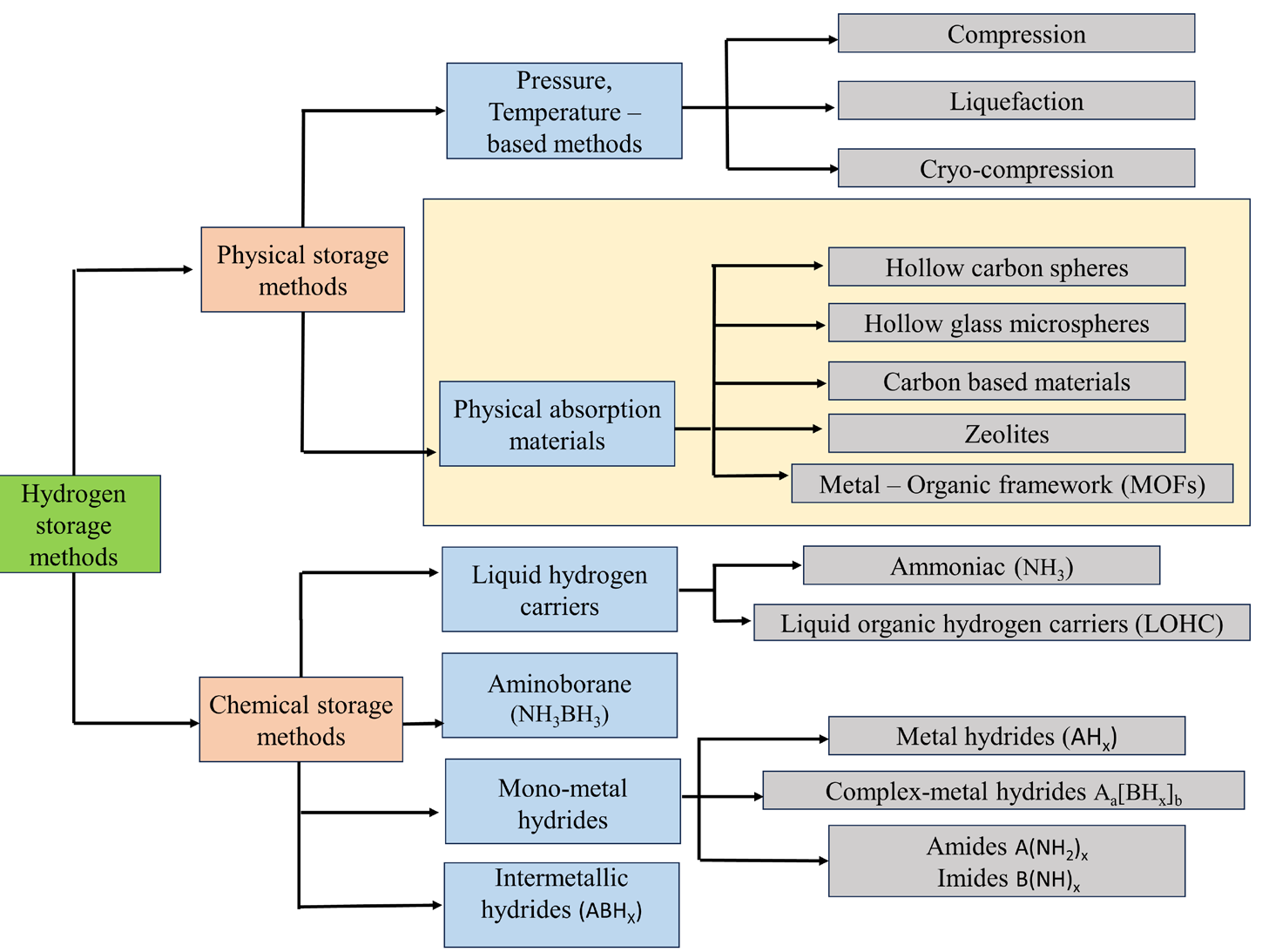
图 1. 氢气储存材料的分类。
2. 物理氢气储存材料
2.1. 压缩氢气储存材料
氢气压缩是使用最广泛的技术来储存和利用氢气作为能源,具有几个突出的优点 [18,19]。首先,压缩技术已经发展得相当成熟,可以实现高速度的氢气填充和释放。此外,氢气释放不需要能量 [19,20]。在各种储存材料中,中空球体最广泛用于压缩氢气储存。中空球体不仅提供高表面积,还可以将氢气封装在孔隙内。此外,高表面积和多孔性允许通过表面或孔隙中的结合位点与其他材料杂化 [21]。因此,可以显著增加中空球体的吸收和催化活性。另外,中空球体良好的机械强度和低比重使它们成为良好的氢气容器 [22]。控制不同的条件,如反应时间、pH值、温度和反应物比例,可以简化均匀尺寸的中空球体的制造。在中空纳米球中,氢气可以以原子和分子形式被吸收 [23]。
平均大小从微米到纳米不等的中空球体吸引了相当大的研究关注。已经开发了各种不同大小和材料的中空球体,包括碳、玻璃、金属和非金属。在本综述中,我们主要讨论一直备受关注的中空碳球和中空玻璃微球。
2.1.1 中空碳球(HCSs)
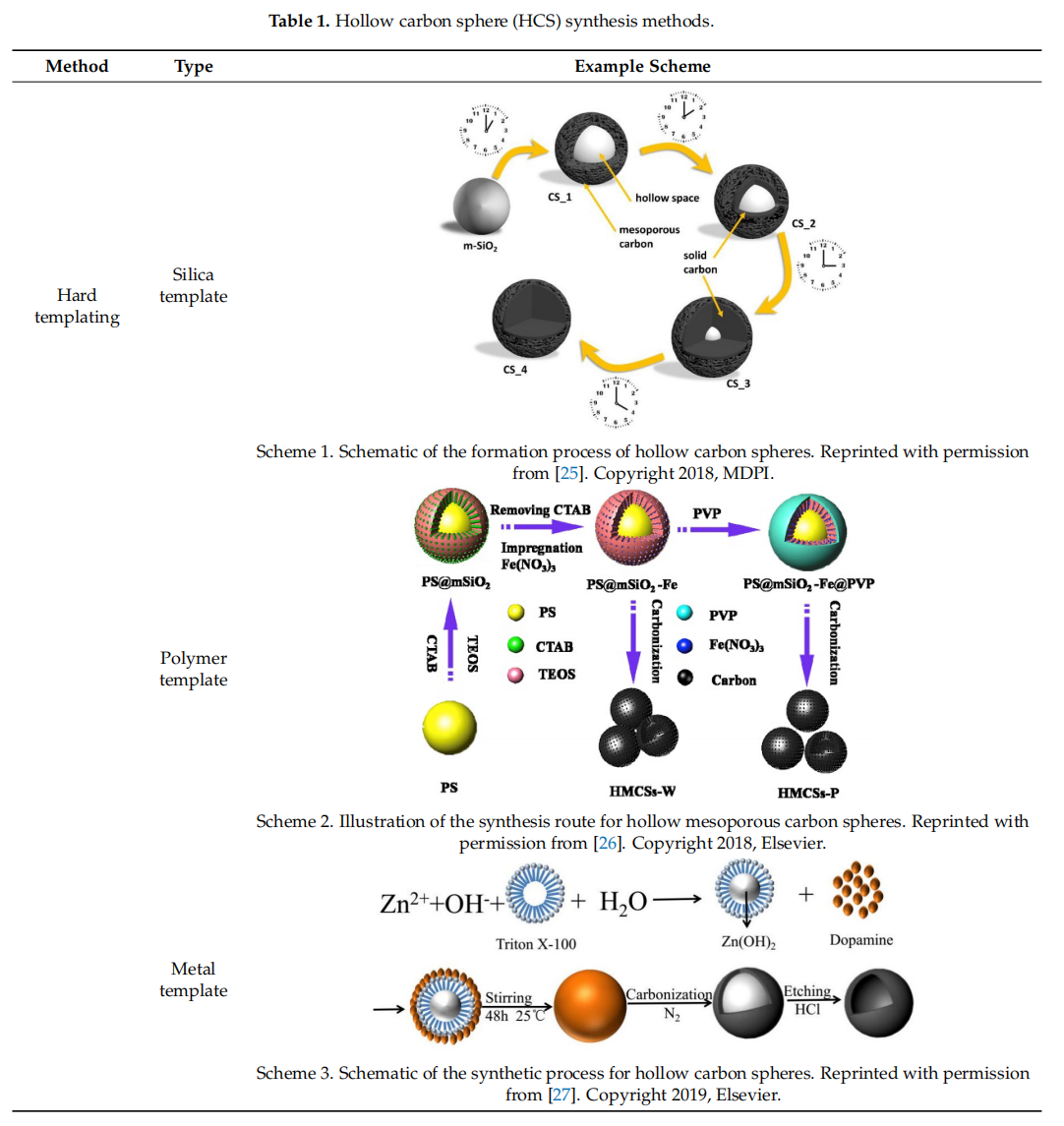
HCSs主要通过两种方法制造:硬模板法和软模板法,这两种方法使用不同类型的模板来创建中空球体(HS)。硬模板法采用特殊的硬质粒子作为“核心模板”来构建中空结构。在核心表面形成碳壳后,再移除核心。在硬模板法中,通常使用二氧化硅、聚合物和硬质金属粒子作为核心模板。而在软模板法中,中空结构是通过碳和其他有机化合物的自组装直接生成的。因此,核心模板是“软”的前体分子,它们在最终热解过程中容易分解。表1展示了通过硬模板(二氧化硅、聚合物和金属模板,分别对应示例方案1-3)和软模板(表面活性剂和有机添加剂模板,分别对应示例方案4和5)形成HCS的过程。这两种方法各有优缺点。硬模板法可以更好地控制HCS的性质,但在壳体形成后需要大量时间和不环保的过程来移除核心模板。软模板法中的模板容易分解[24];然而,通过软模板法更难以控制HCS的大小和形态。
表1. 中空碳球(HCS)合成方法。
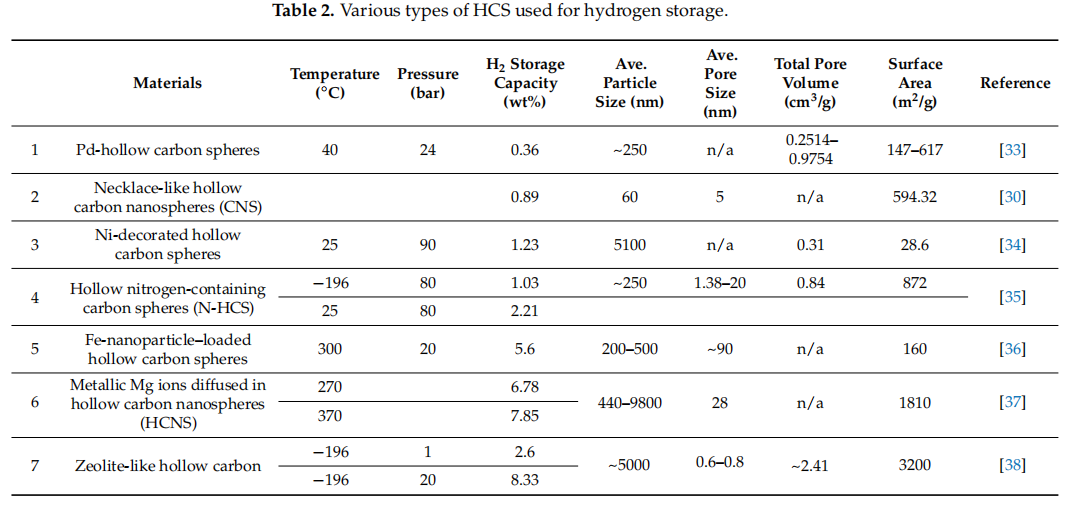
HCSs是用于氢气储存的绝佳材料。它们的介孔结构提供了高的Brunauer–Emmett–Teller (BET)值、空隙和中空空间,这些空间可以被氢气占据;因此,可以实现高的氢气容量。然而,HCS结构对氢气储存容量有显著影响。HCS的形状和大小在氢气在基材中的扩散中起着重要作用。当吸附能量高于释放能量时,氢气可以轻易占据活性位点,这强烈依赖于材料的形态。此外,氢气沉积到HCS孔隙中可以通过HCS的缺陷和薄壁促进;因此,层间空间可以释放出来,增加存储在HCS中的氢气量[30,31,32]。基于HCS的氢气储存已在几项研究中报道,部分呈现在表2中。
表2. 用于氢气储存的各种类型的HCS。
Wu等人成功合成了具有狭窄孔径分布的项链状中空碳纳米球(CNSs),使用了含有五边形的反应物。他们的电化学氢气储存实验结果表明,CNSs在200 mA/g的电流密度下具有242 mAh/g的容量,相当于0.89 wt%的氢气储存量,这比实心链碳球和多壁碳纳米管的电化学容量要高得多[30]。这证实了碳材料的结构和形态强烈影响电化学氢气储存。
将金属掺杂到中空碳材料中进行氢气储存被称为氢气溢流[39]。掺杂到碳材料上的金属可以增加氢气与孔壁之间的结合能。此外,氢气分子和掺杂的金属原子之间也可以发生结合[40]。因此,金属掺杂可以提高材料的氢气储存性能。在各种用于增强氢气储存的金属掺杂中空碳材料中,已报道钯(Pd)掺杂的碳材料改善了氢气储存性能[41,42,43]。氢气分子在Pd表面上容易解离,这限制了储存效率。因此,为了获得良好的催化性能并提高氢气储存容量,减少Pd的有效表面积以减小其活性表面积,将小颗粒的Pd掺杂到材料的多孔表面。
Michalkiewicz等人合成并评估了掺杂Pd纳米粒子到HCSs上的氢气储存性能[41]。他们的结果表明,Pd纳米粒子的大小和数量显著影响氢气储存容量,而大小比数量起着更重要的作用。Pd纳米粒子的小尺寸可以增强它们的累积表面积,从而增加溢流效应。直径为11 nm的Pd纳米粒子在40°C的温度和24 bar的压力下获得的容量为0.36 wt%,这是原始HCSs储存容量的两倍。
金等人和江等人分别报道了负载镍的中空碳球(HCSs)和含氮的HCSs。由于它们的物理吸附特性,掺杂镍或氮不会影响室温下的氢气吸收[44]。然而,结果显示,在室温下,负载镍的HCSs和含氮HCSs的氢气吸收容量分别为1.23 wt%和2.21 wt%[34,35]。这是因为在镍纳米粒子的存在下,氢气分子容易解离成原子氢,随后氢原子被吸附剂化学吸附,从而增强了储氢能力。此外,镍装饰提供的溢出反应也增强了储氢能力。对于掺氮HCSs,氮原子可以激活载体,产生更多缺陷位点,并增强碳表面上的氢-碳结合强度。因此,氢吸收机制从物理吸附变为物理化学吸附[35,45]。
哈立德等人制备了嵌入铂纳米颗粒的镁离子扩散中空碳纳米球(Mg/HCNS/Pt)。这种材料有望成为能量释放应用中的高效氢载体。在270、300、330和370°C的温度下,获得的氢气解吸容量分别为6.78、6.92、7.05和7.85 wt%。动力学实验表明,Mg/HCNS/Pt在370°C时仅需85.2秒即可释放最大7.85 wt%的氢气,而在270°C时释放最小6.78 wt%的解吸容量需168秒[37]。这项研究表明,尽管用金属元素掺杂可以增强HCSs的储氢能力,但这种复合材料的氢气吸附能力不适合在室温下应用。需要通过新材料或制造技术进行改进以克服这一限制。
除了金属和非金属掺杂外,通过提高HCSs的表面积也可以增强储氢能力。杨等人使用化学气相沉积成功合成了具有大表面积的类沸石碳材料。这种材料展示了表面积对储氢能力的影响,其在1巴的压力下的储氢容量为2.6 wt%,在20巴的压力下达到8.33 wt%。这种沸石碳材料的储氢容量被记录为迄今为止报道的HC材料中的最高值。
2.1.2 中空玻璃微球
中空玻璃微球,也称为微球或微泡,主要由硼硅酸盐和钠钙硅酸盐组成。中空玻璃微球的大小从100 nm到5 µm不等,壁厚范围从1.5到3 µm,孔径大小从100到500 nm[46,47]。中空玻璃微球的壁厚度强烈决定了它们的抗压强度;球体密度越高,抗压强度越大。由于它们出色的化学稳定性、耐化学性、强大的机械性能、低密度、高温操作、高耐水性、不燃性、不爆炸性、无毒性,特别是低成本生产,中空玻璃微球被视为具有高潜力的氢气运输和储存材料[32,33,48]。
中空玻璃微球必须在高压和高温下操作以增强氢气扩散进入中空玻璃微球。这是因为不仅气体分子的大小,而且温度都可以改变气体扩散性。在氢气分子被中空玻璃微球吸收后,必须将温度降至室温以降低扩散速率并保留在孔洞中的载氢分子。对于氢气释放过程,需要将中空玻璃微球加热至高温。氢气吸收和解吸的最佳温度都超过300°C[49,50]。
中空玻璃微球可以使用干凝胶或液滴方法制造。在这两种方法中,形成初始颗粒的高温炉起着重要作用。首先,发泡剂分解以释放干燥凝胶或液体中的气体。气态产物的快速生长导致气泡的出现和中空空心液滴的形成。此后,中空空心液滴从液态迅速冷却以形成中空玻璃微球[51]。关于中空玻璃微球的合成,王等人提出了一种基于传统制造方法、该材料行业经验和相关业务的新类型中空玻璃微球的基本配方。根据他们的建议,中空玻璃微球由石英砂、K2CO3、Na2B8O13.4H2O、Na2CO3、Ca(OH)2、NaAlO2、Li2CO3和H2O按重量百分比27、14.5、15、10、3.5、3、0.5和26.5%组成。因此,中空玻璃微球的主要化学成分为SiO2(68-75%)、Na2O(5-15%)、CaO(8-15%)、B2O3(15-20%)和Al2O3(2-3%)[52]。
Dalai等人提出了一种用于储氢的中空玻璃微球,它是使用尿素作为发泡剂,通过空气-乙炔火焰球化法合成的。该微球直径为10-200μm,壁厚为0.5-2μm,在常温和200℃下,压力为10bar时显示出储氢能力。结果表明,常温下的吸附能力低于200℃时的吸附能力[53]。这证实了温度越高,气体扩散性越好。在高温下,氢分子可以穿过中空玻璃微球壁进入空心孔中并被保留在其中。
中空玻璃微球较差的热导率限制了吸收和脱附过程中氢分子的加载,导致储氢能力较差[50]。研究发现,当中空玻璃微球中掺杂了光活性剂,如Ti、Cr、V、Fe、Zn、Mg和Co时,与传统加热炉方法相比,光照可以显著增强气体扩散速率[50,54,55,56]。图2展示了由于光吸收导致的掺钛(Ti)离子中空玻璃微球的光致放气现象[54]。特别地,本研究探讨了Ti掺杂对中空玻璃微球的气体保持能力和光致放气行为的影响。中空玻璃微球的气体保持能力对于储氢来说至关重要。本研究通过评估其压力半衰期(t1/2)和氘(D2)渗透率,研究了不同Ti浓度中空玻璃微球的气体保持性能。通过玻璃壳中空玻璃微球负载光活性金属实现光致氢扩散的发现,为填充、存储、运输和释放氢气的全新革命性方法铺平了道路。
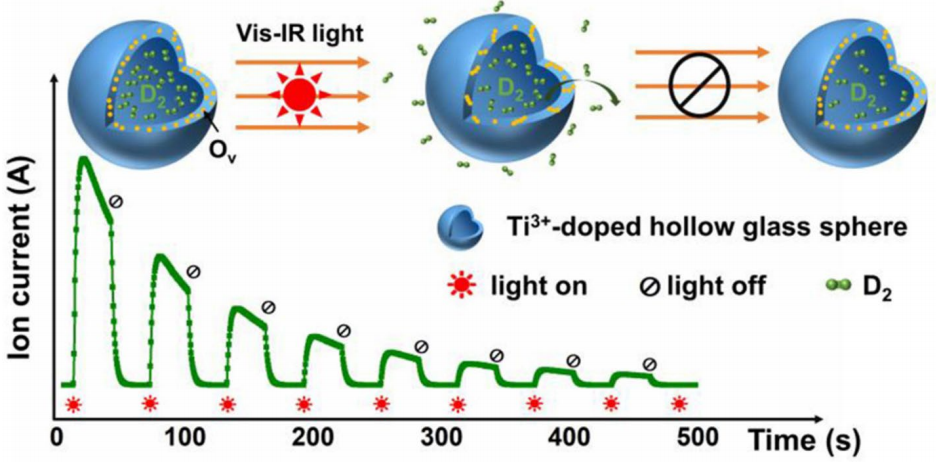
图2. Ti3+掺杂空心玻璃微球的光致气体释放。经许可转载自[54]。
Dalai等人合成了负载Fe和Mg的中空玻璃微球样品,以改善其热传导性能,从而提高其储氢能力。对于Fe掺杂,将原料玻璃粉末与一定量的氯化亚铁四水合物溶液和硝酸镁六水合物盐溶液混合,以在中空玻璃微球中分别获得0.2-2 wt%的Fe负载量和0.2-3.0 wt%的Mg负载量。对所有掺杂Fe和Mg的中空玻璃微球进行氢吸附实验,实验条件为10 bar和200℃,持续5小时。结果表明,在0.5 wt%的铁负载量下,Fe掺杂中空玻璃微球的氢吸收能力约为0.56 wt%。由于球化作用以及FeO/Fe块的阻碍,导致部分孔隙无法被利用,因此增加铁含量并不会提高氢吸收能力。这得到了在中空玻璃微球中掺杂2 wt% Fe时吸收能力为0.21 wt%的结果的证实。同时,随着Mg负载量从0增加到2.0 wt%,Mg掺杂样品的氢吸附量从1.23增加到2.0 wt%。这与Fe掺杂的现象类似;如果中空玻璃微球中Mg的含量超过2 wt%,则会出现可能封闭孔隙的MgO/Mg纳米晶体,从而降低储氢能力[57]。
Dalai等人还制备了负载Zn的中空玻璃微球,以改善其热导率。图3展示了掺入不同量Zn的中空玻璃微球的环境扫描电子显微镜图像。结果表明,Zn掺杂增加了中空玻璃微球的热导率和孔隙密度。当锌含量从0.5 wt%增加到2 wt%时,孔隙数量增加,但观察到孔隙宽度减小。当锌浓度增加到5 wt%和10 wt%时,大部分小孔被封闭,孔隙数量也减少,因为富含ZnO的层的沉积阻塞了中空玻璃微球中的孔隙[58]。

图3. 掺入不同量锌的中空玻璃微球的环境扫描电子显微镜图像:(a) 0.5%,(b) 2%,(c) 5%,和(d) 10%。经许可转载自[58]。
综上所述,金属掺杂可以增加中空玻璃微球的孔隙率,从而提高储氢能力。然而,金属浓度过高会导致金属氧化物层的形成或金属颗粒的团聚,这会封闭中空玻璃微球的孔隙,从而降低氢气的加载量。因此,掺杂金属浓度的优化对于获得中空玻璃微球的最高储氢能力至关重要。总的来说,我们在表3中总结了玻璃微球的一般特性。
表3. 玻璃微球(GMs)表征总结。

共负载的中空玻璃微球也已被制备出来[59,60]。结果表明,中空玻璃微球中的孔隙数量显著增加,且当钴浓度≤2 wt%时,储氢能力达到最大,约为2 wt%。当钴含量超过2 wt%时,能量色散光谱(EDS)分析证实,中空玻璃微球壁上形成了钴氧化物,这些氧化物占据了孔隙,阻止了氢气的扩散。
2.2. 物理吸附材料
物理吸氢过程涉及将氢气加载到材料表面上。这一过程的起源是电荷分布中的共振波动,这些波动被称为色散力或范德华力。氢气分子与其他材料之间的相互作用力相当弱,因此,物理吸附仅在温度低于0 °C时发生[61]。然而,由于物理吸附具有高效能[46]、高加载和卸载速率[46,62]以及良好的再加油时间[63]等优势,近年来得到了广泛应用。因此,为了满足物理吸附的要求,已经开发和改进了吸附材料。好的吸氢材料取决于两个因素:(1)氢气分子与材料之间的结合能,这直接影响储氢系统的操作温度;(2)单位体积内可用的平均表面积高[64]。最近,被认为适合氢气物理吸附的优质候选材料包括碳基材料,如活性炭(AC)、碳纳米管(CNT)、石墨纳米纤维(GNF)、石墨烯、沸石和金属有机框架(MOFs),这些材料将在以下部分中进一步讨论。
2.2.1. 碳基材料
碳是生物体和非生物体中最丰富的元素之一。碳材料可以轻易地制备成具有高孔隙率的粉末,并具有与气体分子相互作用的倾向。因此,碳是一种众所周知的能够吸收气体的介质,并已被用作解毒剂和净化剂。
由于具有高表面积、多种孔隙结构的高孔隙率、良好的化学稳定性、低重量和低成本等优势,碳基材料作为氢储存的潜力材料受到了广泛关注[65,66]。各种碳基材料被用于氢储存。在本综述中,我们重点关注活性炭(AC)、碳纳米管(CNT)、石墨纳米纤维(GNF)和石墨烯等材料在氢储存方面的应用,如表4所示。使用AC、CNT、GNF和石墨烯纳米复合材料进行氢储存的机制的例子分别如图6-9所示(表5)。
表4. 用于氢储存的碳基材料。

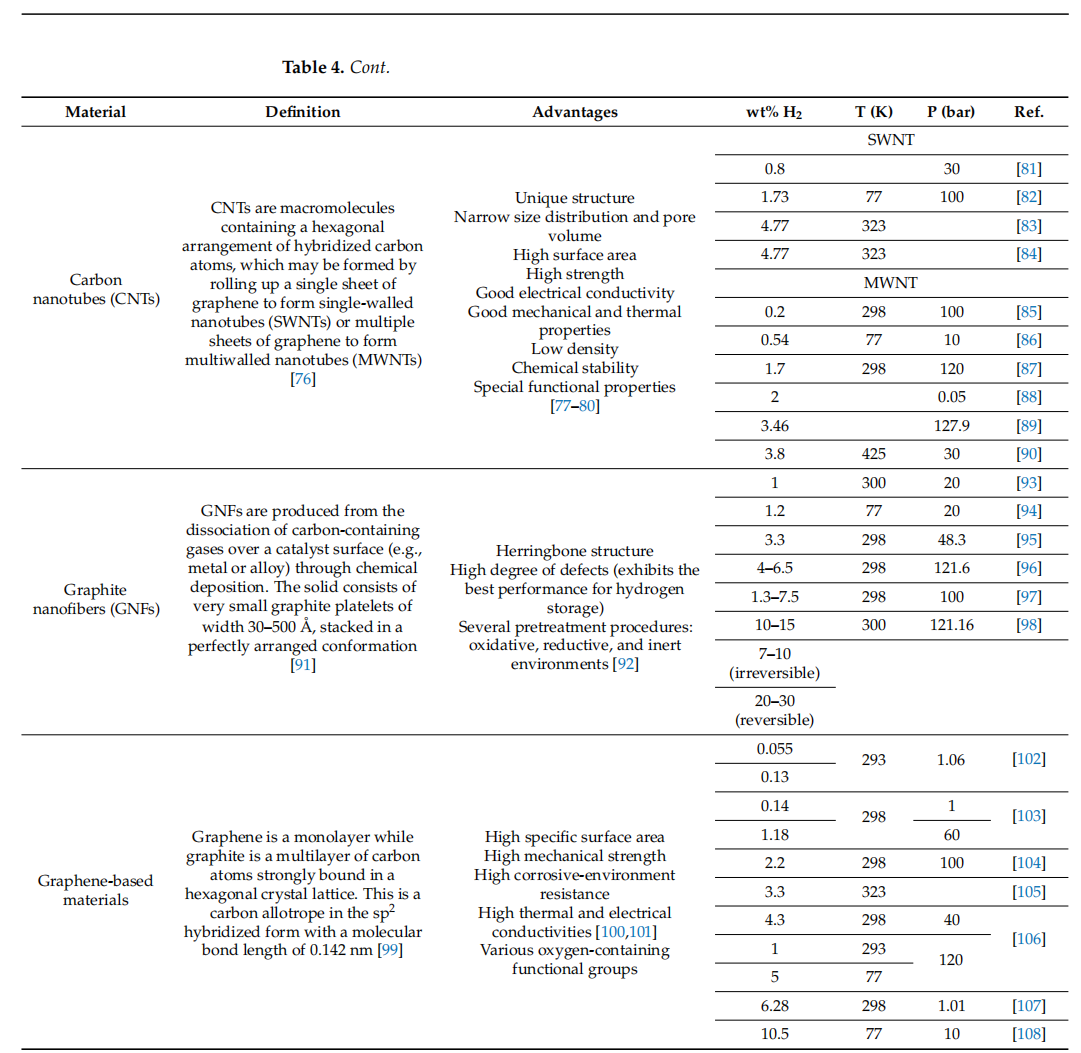
表5. 不同类型碳材料氢储存机制示例。
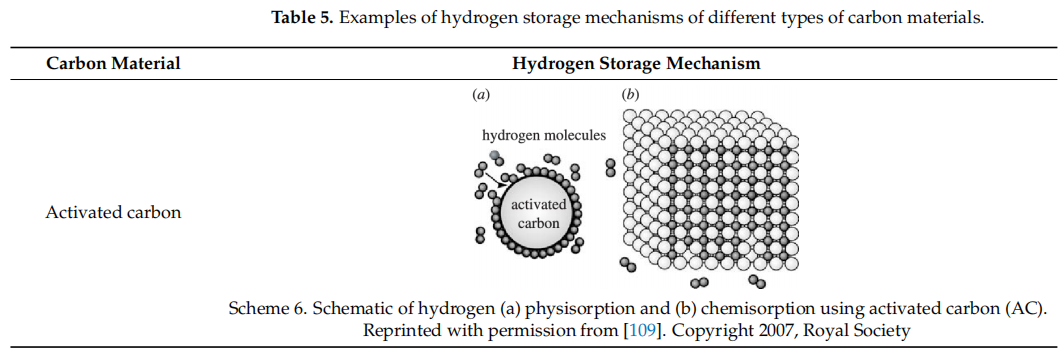
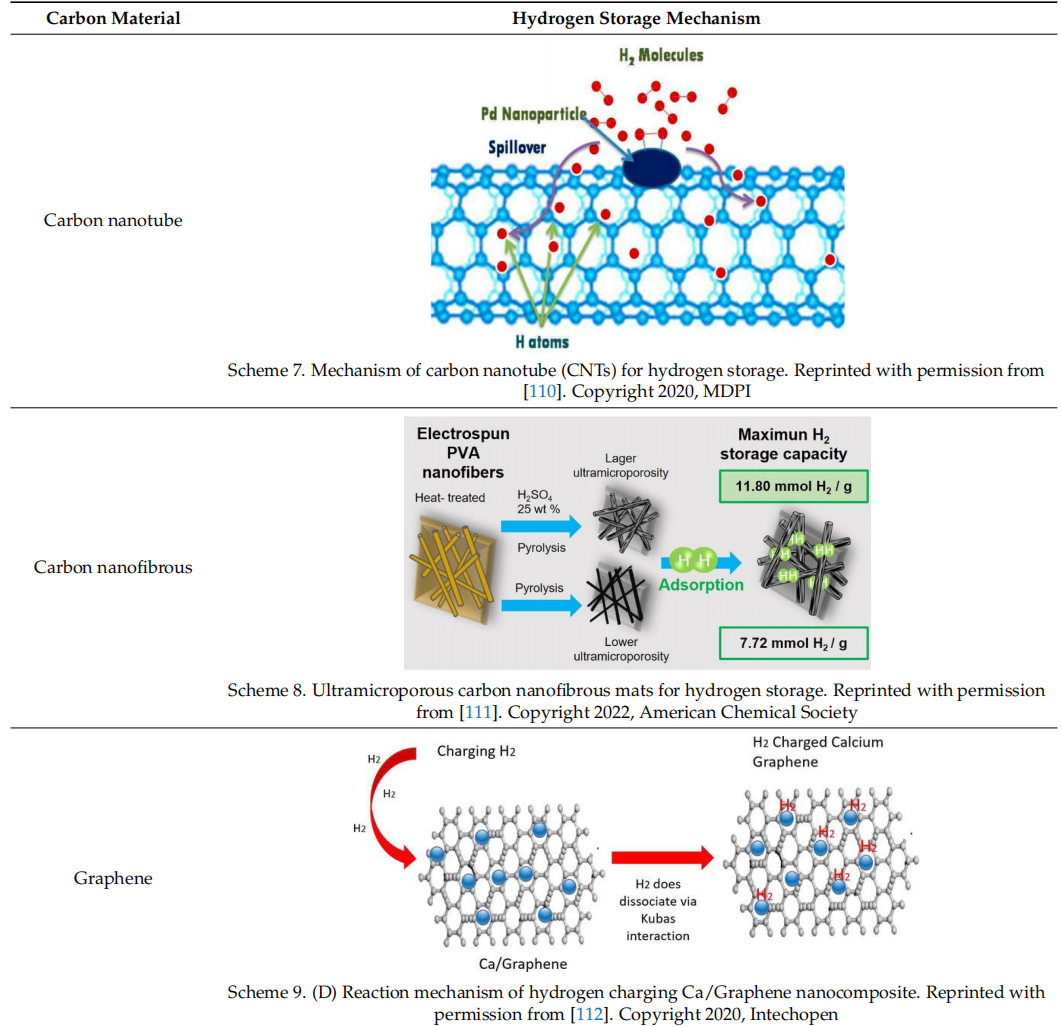
2.2.2 分子筛
分子筛是三维的、微孔的、高度结晶的铝硅酸盐材料。分子筛具有四面体框架结构,其中硅和铝原子通过共享氧原子呈四面体配位。分子筛是众所周知的材料,具有通道和笼状结构,阳离子、水和小分子可以驻留其中。此外,它们的高热稳定性和良好的离子交换能力使它们成为氢存储的巨大潜力介质[113,114]。
分子筛可分为天然和合成两类。天然分子筛在不同的环境中展现出改良的电阻率和热稳定性[115]。然而,它们含有不均匀晶体大小的杂质;因此,它们不能用于工业应用[116]。在这篇综述中,我们关注于在氢存储行业使用的合成分子筛材料。
分子筛可以使用各种原材料制造。为了满足经济效益的要求,原材料应该是容易获得的、相对纯净的、选择性好的、价格低廉的。如高岭土、稻壳灰、纸浆污泥、粉煤灰、高炉矿渣、锂矿渣和城市固体废物等原材料主要用于分子筛的制造。
分子筛可以通过不同的方法合成,包括溶剂热、水热、离子热、碱熔融和浸出、微波和超声能量法,这些方法已在先前的研究[116]中提出。在这些方法中,水热过程是最常用的,特别是用于合成分子筛膜[117]。
由于它们的卓越性能和多样的合成过程,分子筛被认为是优秀的氢气存储候选材料。董等人研究了不同分子筛的氢气存储能力,包括Na-LEV、H-OFF、Na-MAZ和Li-ABW。结果显示,在压力为1.6 MPa和温度为77 K的条件下,Na-LEV、H-OFF、Na-MAZ和Li-ABW的能力分别为2.07、1.75、1.64和1.02 wt%[114]。这一结果证实,体积更大、直径接近氢分子动力学直径的微孔在提高分子筛容量方面发挥着至关重要的作用。
最近,孙等人开发了蒙特卡洛模拟来预测在不同压力和温度条件下金属有机框架(MOFs)、超交联聚合物和分子筛的氢气装载量。关于压力值,元学习允许识别具有最高工作容量用于氢气存储的最佳温度。图4描述了用于气体吸附预测的元学习系统。根据这份报告,在压力为100 bar和温度为77 K的条件下,RWY型和AWO型分子筛展示出约7 wt%的氢气装载能力[118]。
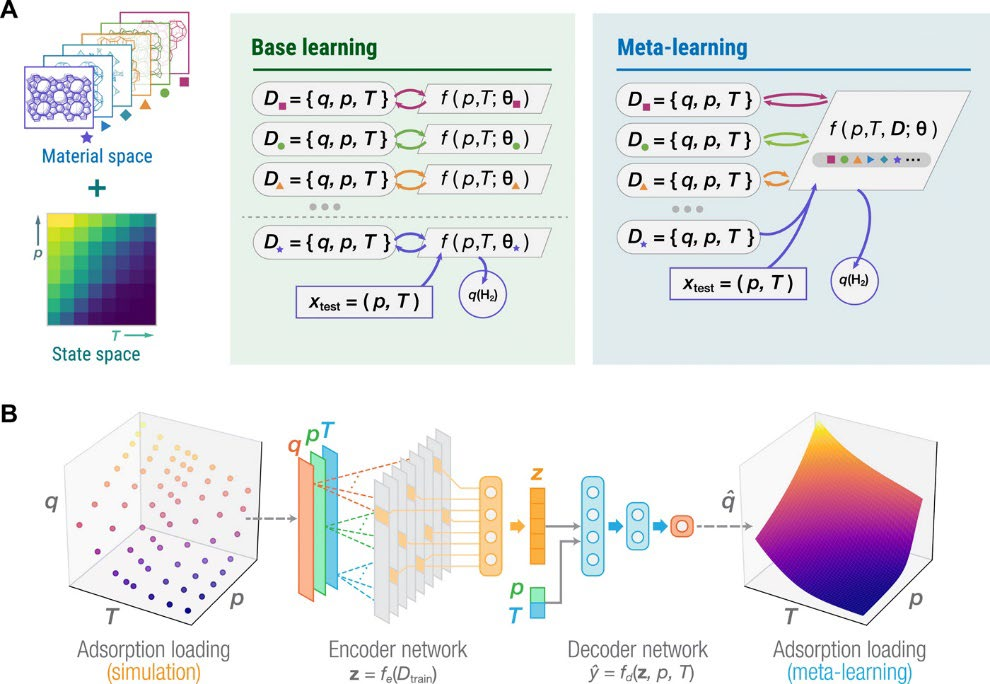
图4. 用于预测纳米孔材料中气体吸附装载量q的元学习。(A)元学习问题的设置。(B)用于气体吸附预测的元学习架构。经许可转载自[118]。版权所有2021,美国科学促进会。
2.2.3 金属有机框架(MOFs)
MOFs是一类广泛的结晶材料,包含金属离子、金属簇和有机连接器。常用的有机连接器如氮杂环(1,2,3-三唑、吡咯二唑等)、二羧酸(戊二酸、草酸、丁二酸、丙二酸等)和三羧酸(柠檬酸、均苯三酸等)通常用于MOF的制造[119,120]。除了控制金属/配体比率外,改变反应温度和修改有机连接器也是赋予MOF良好孔结构和高维框架的策略[121],这显著影响氢气存储容量。MOF的主要氢气存储机制与其他多孔材料如空心球、碳基材料或分子筛类似:氢分子占据并保持在它们的空穴(孔)中。分子筛和MOF的示意机制如图5所示。
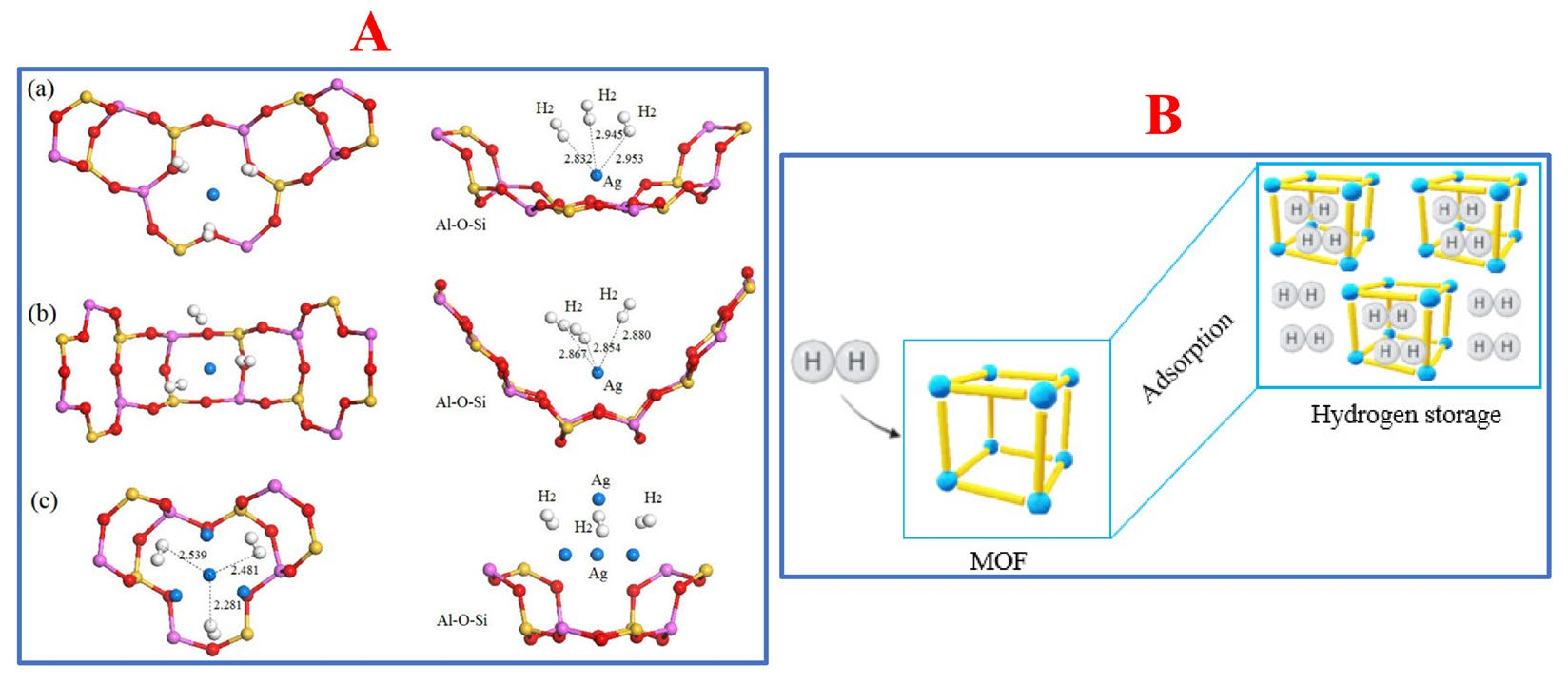
图5.(A)命名为(a)aAg0.29Li0.71-LSX,(b)bAg0.43Li0.57-LSX和(c)cAg0.29Li0.71-LSX的分子筛材料的氢气吸附。经许可转载自[122]。版权所有2019,MDPI;(B)MOF通过其吸附性质捕获氢气的方案。经许可转载自[123]。版权所有2022,MDPI。
MOF材料是清洁能源潜在应用的优秀候选者,例如作为氢气和甲烷等气体的存储介质,因为它们的高结晶度、大的内部表面积可达6000 m2/g,以及高达90%的自由体积的超高孔隙率[124]。此外,结构中金属和有机组分的可变性赋予了MOF良好的可设计性、可调结构和性质。然而,MOF的生产相当复杂,且MOF在常温下的氢气吸收效率低。因此,有必要改进MOF制造技术[125]。
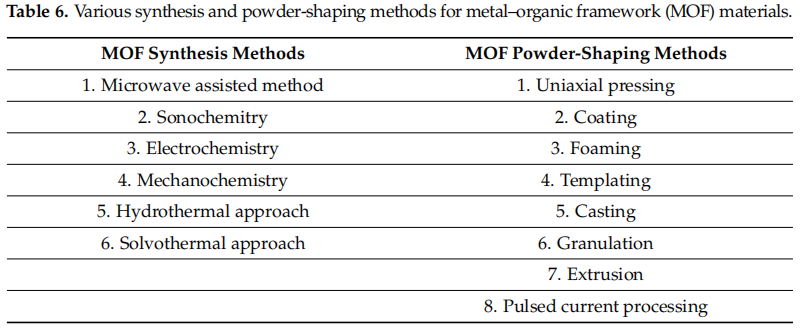
已经开发了一系列MOF合成过程,总结在表6中。合成后得到的MOF材料通常是粉末形式。将粉末纳入相关设备相当困难;这可能阻碍MOF在能源或气体存储应用中的使用[126]。例如,如果MOF作为松散粉末引入带有管接头的罐中,它们可能很容易被吹散到周围环境,造成处理困难和管接头污染。此外,它们的低堆积密度可能会损害管接头的体积容量。科学家们已经做出了巨大努力,使用表6中介绍的技术对MOF进行成型。成型技术的选择取决于MOF材料的制造方法和预期的纹理属性[127,128]。期望具有适当机械强度、低流动阻力以及完整或高的次级表面积和孔体积的成型MOF材料,以获得更好的氢气存储性能[126]。
表6. 金属–有机框架(MOF)材料的各种合成和粉末成型方法。
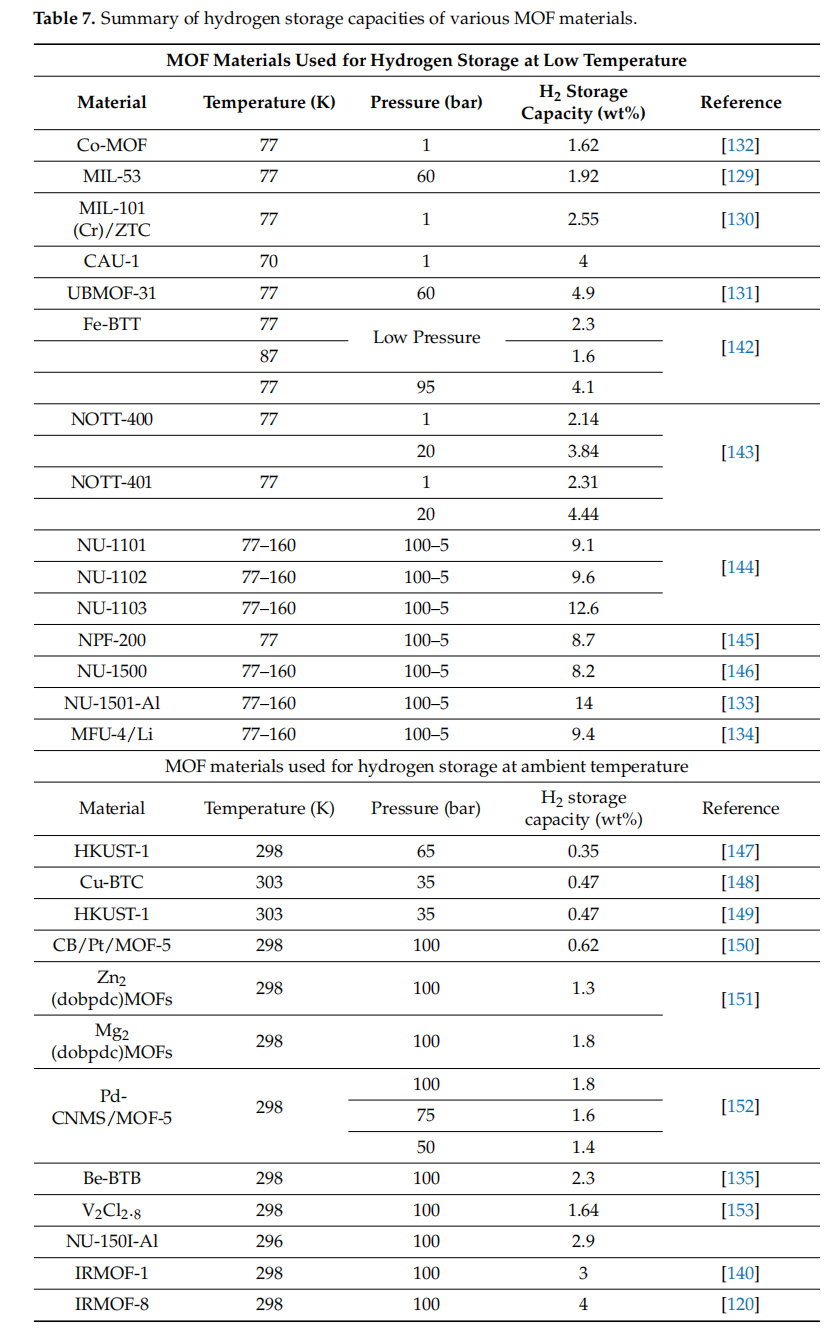
氢气分子具有低的极化率。此外,氢气与大多数MOFs之间的相互作用相对较弱。先前的研究显示,在高度多孔的MOFs中吸附的氢气的等位热大约为-5 kJ/mol,这是因为氢气分子的弱相互作用[125]。因此,低温对于在MOFs中获得合理的氢气容量至关重要。我们对一些储氢MOF材料进行了研究,并做了小规模统计,如表6所示。结果表明,MOF材料在低温下表现出良好的氢气储存能力。许多研究小组合成并研究了他们的MOF材料用于氢气储存,例如用钯负载活性炭改性的MIL-53 (Cr)(MIL-53 Cr)[129]、与沸石模板碳ZTC结合的MIL-101 (Cr)(MIL-101 (Cr)/ZTC)[130]、基于铁的MOF(Fe-BTT)[131]和基于钴的MOF(Co-MOF)[132]。他们获得的氢气储存容量不到5 wt%。随着材料成分和结构的改进,以及使用合适的压力,最近的MOF材料包括基于锆的MOFs(NU-1101, NU-1102, NU-1103)、基于铝的MOFs(NU-1501-Al)[133]和坚固的基于氮杂环的MOFs(MFU-4/Li)[134]分别实现了9.1、9.6、12.6、14和9.4 wt%的显著增加,在储氢容量方面。
然而,在环境温度下的储存仍然是一个挑战。为了克服在使用吸附式氢气储存技术的燃料电池车中驾驶范围的限制,研究人员一直在开发不同的方法来提高MOF材料在较高温度下的性能。例如,骨架中的开放金属位点可以作为氢气加载的强吸附位点,在环境温度下工作。Lim等人合成了具有开放金属位点的Be基MOF(Be-BTB)。该Be-BTB材料具有高达4400 m²/g的BET表面积,在298 K和100 bar的条件下呈现出2.3 wt%的氢气吸附容量,远高于之前研究的容量[135]。此外,通过金属离子掺杂或引入碳基材料可能会引发氢溢流效应(HSPE),这可以提高材料在室温下的氢气储存容量。HSPE是一种表面现象,其中由金属表面上的氢分子离解产生的活性氢原子迁移到支撑表面,并参与吸附在该位点的物质的催化反应[136,137]。确保HSPE发生的有两个条件。首先,存在能够吸附离解的氢以将氢分子转化为氢原子或氢离子的金属。其次,存在活性氢种类的受体以及反应性氢种类转移的通道和驱动器[138]。HSPE的发现为设计高效催化剂开辟了新策略。特别是,HSPE作为增强包括MOFs在内的多孔材料在环境温度下的氢气储存性能的最潜在技术之一,吸引了广泛关注。诱发氢溢出的材料的容量大约是原始MOFs的五倍[139]。Yang和同事将10 wt% Pt/AC催化剂掺杂到异构MOF(IRMOF)材料中,形成了碳桥和氢溢流之间的桥接溢流结构,从而显著提高了氢气储存性能。在298 K和100 bar的条件下,IRMOF-1和IRMOF-8的氢气储存容量分别从0.4增加到3 wt%和从0.5增加到4 wt%[140,141]。表7总结了一些MOF材料的氢气储存容量。
表7. 各种MOF材料的氢气储存容量汇总。
2.3 物理储氢材料的优势与劣势
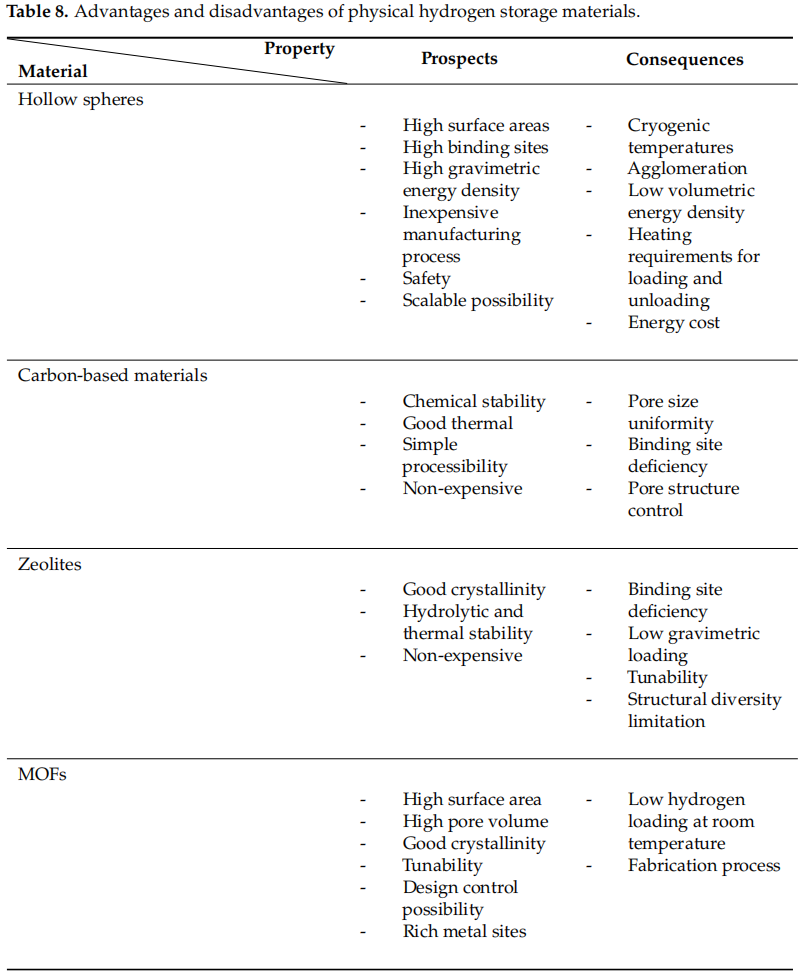
在“氢能经济”中,储氢技术扮演着极其重要的角色。为了促进氢能产业的发展,有必要不断改进和发展储氢材料。正如引言部分提到的,与化学储氢材料相比,物理吸附剂的突出性能(表8)以及它们不释放温室气体的事实,有助于全球能源转型有效进行,并更快实现全球“净零排放”目标。然而,每种物理材料都有其优势和弱点。表8中呈现的这些材料的局限性在实际储氢应用中仍然是挑战。
表8. 物理储氢材料的优势与劣势。
3. 结论与建议
物理储氢材料如空心球、碳基材料、沸石和MOFs在低温下显示出高氢气储存密度。由于它们的局限性,它们只能在相对较低的温度下使用;因此,与目前的化学储氢材料如氨硼烷复合物、液态有机氢和金属氢化物相比,物理储氢材料在实际应用场景中难以使用。已经做出了重大努力来克服这些限制。例如,某些碳基材料、沸石和改性MOFs在环境温度下显示出显著增强的氢气密度。然而,为了解决这些缺点并满足商业应用的需求,仍需进一步的研究和技术发展以获得更高的体积和重量氢气密度。尽管如此,开发下一代物理储氢材料的努力应继续进行,以实现快速安全的纯氢气储存。为了在未来开启基于氢能的时代,不可避免地需要各种方法组合,以及现有的化学储氢方法。届时,这种物理储氢材料及相关方法有望成为关注焦点,成为必不可少的基础构件。
https://blog.sciencenet.cn/blog-41174-1429130.html
上一篇:基因工程细菌制造出有色材料
下一篇:干细胞化CAR T复苏新策略