博文
微量氢气医学效应的发现【经典】
||
微量氢气医学效应的发现【经典】
作为大小同行和对氢健康产业开发和使用等兴趣朋友,需要准确把握和了解这个领域,阅读该领域经典的原始论文非常必要,但对许多英语不够熟练的中国读者来说,翻译为中文就显得很有价值和意义。氢思语这段时间将陆续把氢医学历史上最重要的论文整理翻译,供氢友们参考。当然要更准确把握要义,仍建议阅读原文。
2007年,日本医科大学老年病研究所太田成男教授课题组在《自然医学》发表论文,率先证明微量吸入(1-4%)氢气具有对抗脑缺血再关注损伤,这种作用和氢气选择性中和羟基自由基有关。这一研究论文启动了氢气作为一种新型生物抗氧化剂应用于疾病治疗和健康促进领域新方向,成为氢气医学领域的奠基性论文。
这篇论文其实比较容易理解,就是采用了溶液、细胞和动物脑缺血三种模式,证明氢气可通过选择中和羟基自由基,实现减少缺血再关注炎症类氧化损伤的效应。这种作用来自氢气化学活性,并没有考虑其他生物环境因素。随后后来的研究认为,氢气作用可能没有那么简单,似乎具有更重要更有价值的生物学地位,但这是后话。开始研究阶段,就是简单直白,氢气还原性弱,只能和羟基自由基反应,产生了选择性抗氧化效果,带来了意想不到的医学价值。
Ohsawa I, Ishikawa M, Takahashi K, Watanabe M, Nishimaki K, Yamagata K, Katsura K, Katayama Y, Asoh S, Ohta S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat Med. 2007 Jun;13(6):688-94.
论文摘要
急性缺血再灌注或炎症引起的氧化应激会对组织造成严重损害,而持续的氧化应激被认为是许多常见疾病包括癌症的原因之一。我们在这里展示,氢气(H2)在预防和治疗应用中具有抗氧化剂的潜力。我们通过三种独立的方法在培养细胞中诱导急性氧化应激。H2选择性地减少了最具细胞毒性的反应性氧物种(ROS)——羟基自由基(•OH),并有效地保护了细胞;然而,氢气并不与其他具有生理作用的ROS发生反应。我们使用了大鼠的急性模型,在该模型中,脑部因局部缺血再灌注而引起氧化应激损伤。吸入氢气气体显著抑制了脑损伤,缓解了氧化应激的影响。因此,氢气可以作为一种有效的抗氧化疗法;由于它能迅速穿透膜,它能够到达并与细胞毒性ROS发生反应,从而防止氧化损伤。
一、前言
氧化应激是由过量反应性氧物种(ROS)或自由基产生的强氧化潜力引起的1,2,3,4,5。大部分超氧阴离子自由基(超氧阴离子)是在线粒体中由电子传递链和三羧酸循环的电子泄漏产生的6。超氧阴离子也由代谢氧化酶产生,包括NADPH氧化酶和黄嘌呤氧化酶7。超氧化物歧化酶将超氧阴离子转化为过氧化氢(H2O2)8,后者被谷胱甘肽过氧化物酶或过氧化氢酶解毒为H2O。过量的超氧阴离子会还原过渡金属离子如Fe3+和Cu2+(参考文献2),其还原形式反过来可以与H2O2通过芬顿反应生成羟基自由基(•OH)。•OH是最强的氧化物质种类,并且无差别地与核酸、脂质和蛋白质发生反应。目前没有已知的解毒系统可以清除•OH;因此,清除•OH是关键的抗氧化过程9。
尽管超氧阴离子和H2O2具有细胞毒性效应,但它们在低浓度下发挥重要的生理作用:它们作为调节信号分子参与多种信号转导途径,并调节生物过程,如凋亡、细胞增殖和分化7,10。在较高浓度时,H2O2被髓过氧化物酶转化为次氯酸;次氯酸防御细菌入侵5。另一种ROS一氧化氮(NO•)作为神经递质发挥作用,并对血管扩张至关重要11。因此,必须中和像•OH这样的细胞毒素,同时不影响其他生理上有益的ROS的基本生物活性。我们在这里证明,氢分子(H2)可以减轻•OH引起的细胞毒性,而不影响其他ROS,并提出氢气具有作为预防和治疗应用的抗氧化剂的潜力。
二、研究结果
2.1氢气(H2)在培养细胞中选择性地减少•OH
氢气(H2)能够减少通过水辐射分解或光解产生的•OH12;然而,氢气是否能在活细胞中有效中和•OH尚未直接研究。由于自发生成的•OH对细胞造成的损伤不足以被检测到,我们在PC12培养细胞中诱导超氧阴离子产生。为此,我们用线粒体呼吸复合物III抑制剂抗霉素A(参考文献13)处理细胞;经过这样的处理,这些细胞中的超氧阴离子迅速转化为H2O2。加入抗霉素A后,通过MitoSOX氧化形式的荧光信号(图1a)和2′,7′-二氯二氢荧光素(H2DCF)(补充图1)分别判断超氧阴离子和H2O2水平的增加。我们按照方法中描述的方式将氢气和O2溶解到培养基中,并确认了氢气水平维持了长达24小时(补充图2在线)。溶解在培养基中的氢气没有降低细胞中的MitoSOX和DCF信号(图1a、b和补充图1)。此外,氢气没有降低NO•的稳态水平(补充图1)。相比之下,氢气处理显著降低了•OH水平,通过2-[6-(4′-羟基)苯氧基-3H-呫吨-3-酮-9-基]苯甲酸酯(HPF)氧化形式发出的荧光信号评估(参考文献14、15和图1c、d)。当我们在没有氢气的情况下将细胞暴露于抗霉素A(30μg/ml)时,HPF信号在核区域和细胞质中都增加,可能是因为H2O2从线粒体扩散出来产生•OH。值得注意的是,即使在核区域,氢气也降低了•OH水平(图1c)。
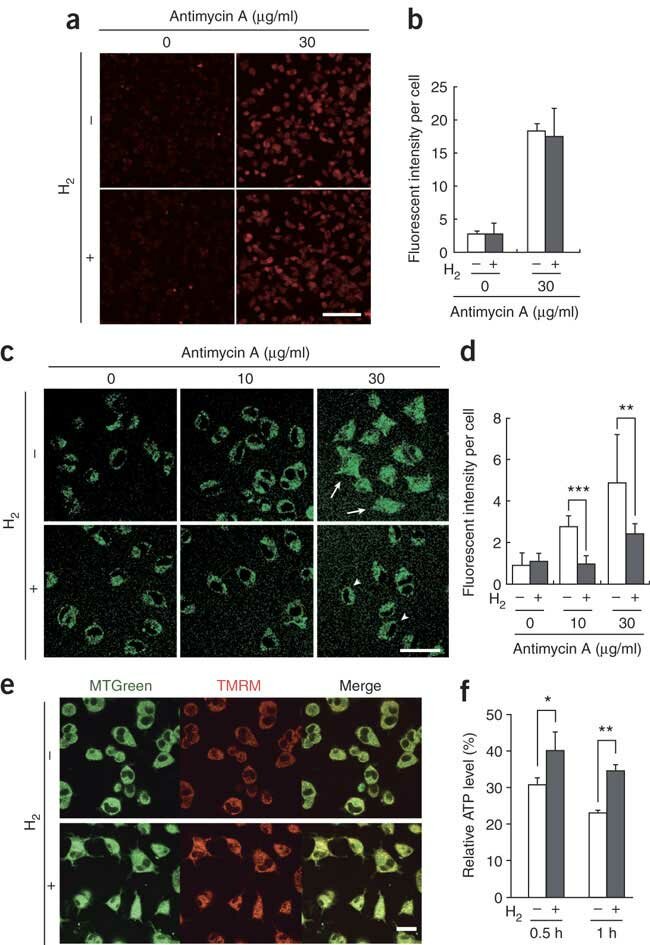
图1:溶解在培养基中的氢气在培养细胞中选择性地减少羟基自由基。
图1(a,b) PC12细胞在含有或不含有0.6 mM 氢气的培养基中孵育,并暴露于抗霉素A(30 μg/ml,30分钟)以诱导超氧阴离子产生。然后他们用0.5 μM MitoSOX处理。通过激光扫描共聚焦显微镜(奥林巴斯FV300)获取MitoSOX处理过的细胞的代表性荧光图像。从每个独立实验的100个细胞中定量MitoSOX荧光(n = 5)。(c) 在加入抗霉素A后30分钟,拍摄•OH标记物HPF的荧光的代表性激光扫描共聚焦图像。箭头和箭头分别表示核区域HPF信号的增加和减少。(d) 在有或没有0.6 mM 氢气的情况下用抗霉素A处理的细胞中定量HPF荧光,从100个细胞中进行(n = 4)。**P < 0.01, ***P < 0.001。(e) 在加入抗霉素A(10 μg/ml)有或没有氢气(0.6 mM)后30分钟,细胞与1 μM MTGreen和100 nM TMRM孵育10分钟,然后成像。两张图像叠加(合并)。(f) 细胞用4.5 g/l 2-脱氧-D-葡萄糖(糖酵解抑制剂)和1 mM丙酮酸预处理,然后在暴露于30 μg/ml抗霉素A后定量相对细胞ATP水平。未用抗霉素A处理的细胞的ATP水平设为100%(n = 3)。*P < 0.05, **P < 0.01。比例尺:a中为100 μm;c中为50 μm;e中为20 μm。直方图显示平均值±标准差。
在抗霉素A处理后,氢气(H2)防止了线粒体膜电位的下降,这一现象是通过依赖线粒体膜电位的四甲基罗丹明甲酯(TMRM)的荧光检测到的,而与膜电位无关的MitoTracker Green (MTGreen)的荧光水平未发生变化(图1e)。这表明氢气保护了线粒体免受•OH的伤害。经氢气处理的细胞看起来正常,而未经氢气处理的细胞萎缩并呈现异常的圆形(图1e)。伴随着这种保护效果,氢气还防止了线粒体合成的细胞内ATP水平的下降(图1f)。氢气保护了线粒体和核DNA的事实提供了证据,表明氢气穿透了大多数膜并扩散进入细胞器。
2.2溶解在培养基中的氢气保护培养细胞免受•OH的伤害
我们将PC12细胞置于含有氢气和O2的培养基中,并通过添加抗霉素A同时诱导氧化应激。在用抗霉素A诱导ROS产生后的24小时,我们观察到氢气似乎保护了核DNA免受氧化,如氧化鸟嘌呤(8-OH-G)水平降低所示(图2a,b及参考文献16)。此外,氢气还降低了4-羟基-2-壬烯醛(HNE)的水平,这是脂质过氧化物的最终产物(图2c,d及参考文献17),表明它保护了脂质免受过氧化。进一步,溶解在培养基中的氢气以剂量依赖的方式保护细胞免于死亡(图2e,f)。当我们从用氢气饱和的培养基中移除氢气时,保护效果消失了(图2f),这表明观察到的效果不是由于氢气与培养基的反应。此外,我们通过使用两种方法确认了氢气保护了细胞活力:改良的MTT测定法(WST-1测定法)和测量受损细胞释放的细胞乳酸脱氢酶(LDH)泄漏(补充图3在线)。为了排除氢气的保护效果是由于与抗霉素A反应的可能性,我们通过添加作用于线粒体复合物I的抑制剂——门冬氨酸,诱导ROS,并观察到氢气在这个系统中也保护了细胞(补充图3)。
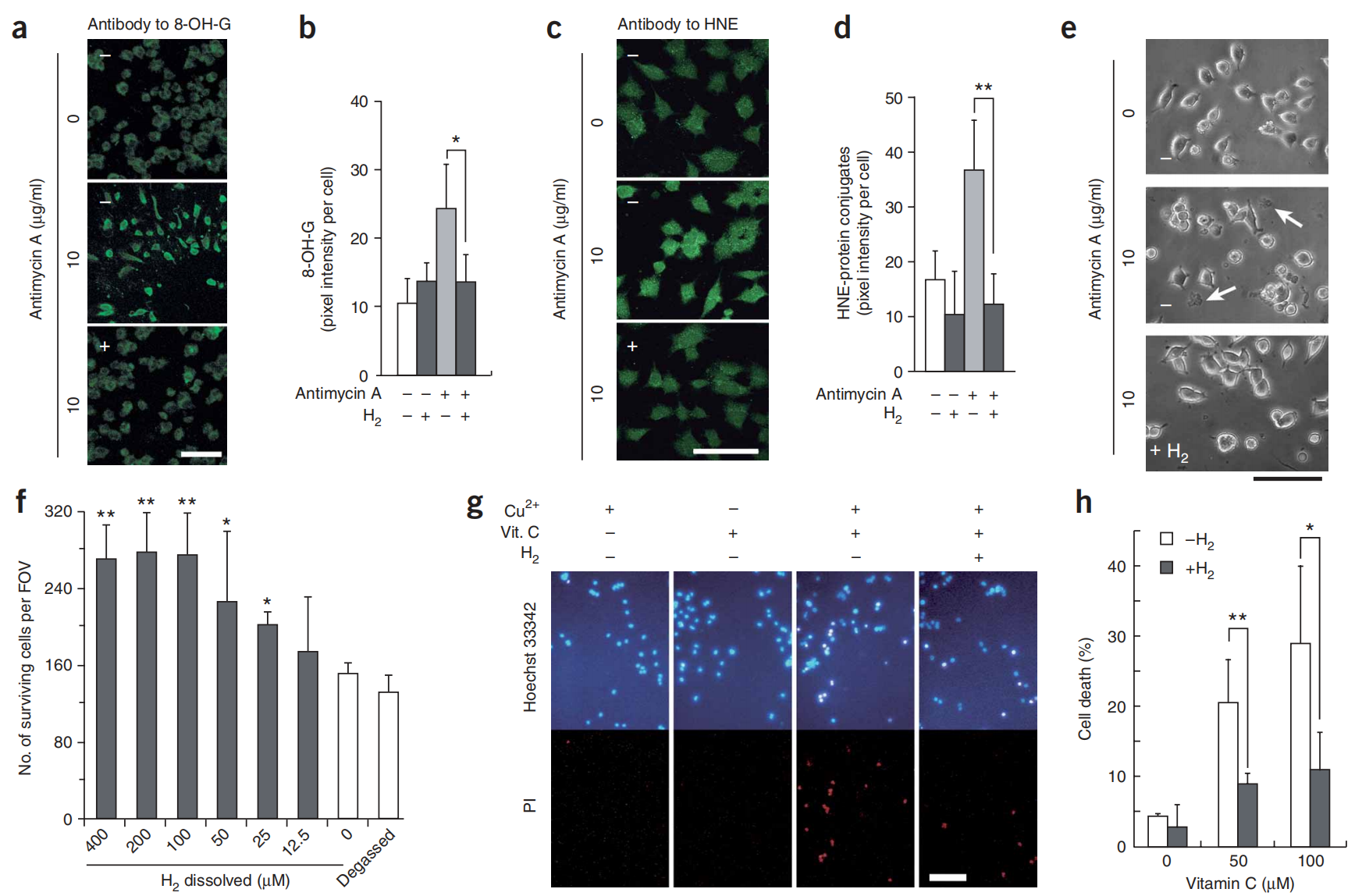
图2:氢气通过清除羟基自由基保护培养的PC12细胞。
图2(a–d) PC12细胞在含有10 μg/ml抗霉素A的封闭瓶中,加入(+)或不加入(−) 0.6 mM 氢气,维持24小时,并用8-OH-G或HNE的抗体进行免疫染色。使用每个独立实验的100个细胞定量8-OH-G和HNE的荧光信号(n = 4)。*P < 0.05, **P < 0.01。(e) 在暴露于抗霉素A 24小时后,有(+)或没有(−) 0.6 mM 氢气的PC12细胞的相差照片。箭头指示死亡细胞。(f) 通过手动计数细胞评估细胞存活情况(方法;n = 4)。*P < 0.05, **P < 0.01(与0 μM 氢气相比)。(g) PC12细胞暴露于由Fenton反应产生的细胞内•OH,有或没有0.6 mM 氢气。细胞先用1 mM CuSO4预处理,洗涤后,暴露于0.1 mM抗坏血酸(Vit. C)1小时,以减少细胞内Cu2+至Cu+(补充方法)。细胞用碘化丙啶(PI)(用于标记死亡细胞)和Hoechst 33342共染色以可视化细胞核。(h) 通过手动计数细胞评估细胞存活情况,如f所述(n = 5)。*P < 0.05, **P < 0.01。比例尺:a,c,e中为50 μm;g中为100 μm。直方图表示平均值±标准差。
为了验证氢气对抗•OH的保护作用,我们用Cu2+预处理细胞,然后让它们接触抗坏血酸,以将细胞内的Cu2+还原为Cu+,这反过来又催化了内源性产生的细胞H2O2产生•OH。这种处理主要在细胞内诱导•OH(通过芬顿反应),从而直接确认氢气保护细胞免受细胞•OH的伤害(图2g,h)。
2.3自旋捕获确定了被氢气还原的自由基种类
为了确定氢气还原的自由基种类,我们研究了氢气对电子自旋共振(ESR)信号的影响,这些信号来自自旋捕获剂。我们通过细胞芬顿反应产生了•OH,并通过使用5,5-二甲基-1-吡咯啉N-氧化物(DMPO)进行自旋捕获来半定量细胞内•OH水平。ESR测量表明,氢气处理确实降低了来自•OH的•DMPO-OH信号(图3a–c)。
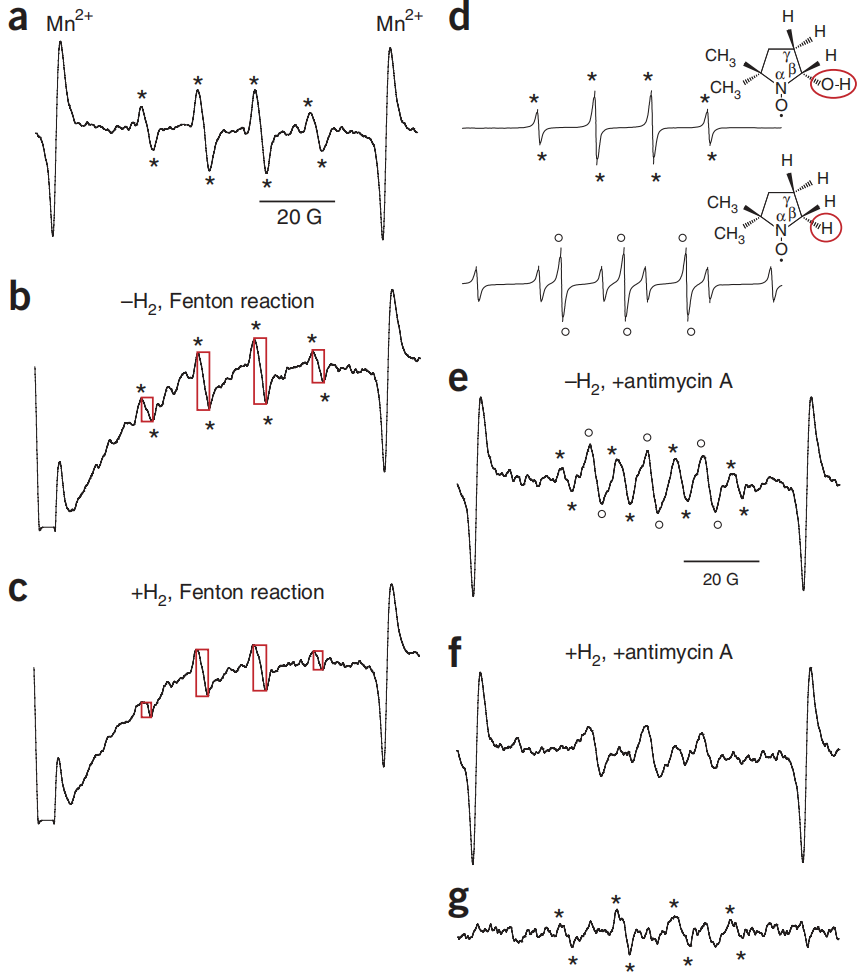
图3:自旋捕获确定了被氢气还原的自由基种类。
图3(a) 通过使用自旋捕获剂(DMPO;详细信息见补充方法)捕获•OH,获得了•DMPO-OH自由基的标准电子自旋共振(ESR)信号。(b,c) PC12细胞在37°C下用0.1 M DMPO和2 mM CuSO4预培养30分钟,有或没有0.6 mM 氢气。去除这个培养基后,细胞在23°C下用0.2 mM抗坏血酸和0.1 mM H2O2处理5分钟以产生•OH,然后刮入扁平的样品池中进行ESR测量。矩形高度反映信号强度。(d)•DMPO-OH和•DMPO-H自由基及其相应的ESR信号示意图。(e,f)PC12细胞在含有0.1 M DMPO和30 μg/ml抗霉素A的PBS中孵育7分钟,温度为23°C,有或没有0.6 mM 氢气,然后刮入扁平的样品池中进行ESR测量。(g)通过从e中的光谱中减去f中的光谱,获得差谱,以便观察氢气处理减少的信号。*表示来自•OH的•DMPO-OH信号。*和o分别表示•DMPO-OH和•DMPO-H信号(a, b, d, e和g)。
此外,当我们通过在DMPO存在下用抗霉素A处理细胞来诱导超氧阴离子产生时,我们观察到多个ESR信号。这些信号似乎包括来自•DMPO-OH和•DMPO-H自由基的信号(图3d–f)。•DMPO-H自由基源自氢自由基(H•),它可以由卟啉类化合物诱导。为了直观显示氢气减少的信号,我们获得了差谱。我们发现,只有由•OH衍生的信号被氢气处理减少(图3e)。这些结果强烈表明氢气处理选择性地还原了细胞中的•OH。
2.4在无细胞系统中氢气选择性地还原•OH和ONOO−
接下来,我们在纯溶液中确认了HPF荧光可以用来监测在芬顿反应持续产生•OH期间氢气对•OH的还原。在这种情况下,氢气以剂量依赖的方式抑制了HPF信号的增加(图4a–c)。但是,当我们将含有氢气的溶液与用•OH预氧化的HPF混合时,氧化HPF的荧光信号并没有减少(数据未显示),这支持了氢气直接与•OH反应的观点。
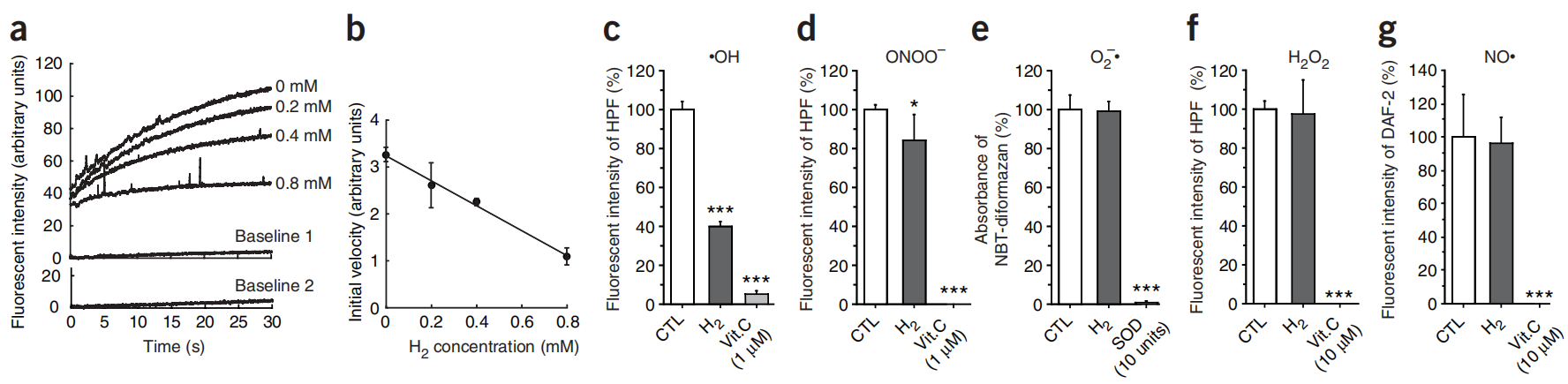
图4:在溶液中溶解氢气在无细胞系统中清除羟基自由基(23°C和pH 7.4条件下)。
图4(a,b) 通过在23°C下加入H2O2(最终浓度为5 μM)到封闭的样品池中并轻轻搅拌来启动芬顿反应,从而产生羟基自由基(补充方法)。在不同浓度的氢气溶解在溶液中的情况下,通过HPF荧光评估•OH的水平。(a)每种氢气浓度下的HPF荧光代表性时间过程曲线。基线1和2显示了在没有H2O2(基线1)和没有高氯酸亚铁(基线2)的情况下HPF的荧光(存在0.8 mM 氢气)。(b)HPF荧光增加初始速率的平均值±标准差(四个独立实验)。(c–g) 在23°C下与0.6 mM 氢气孵育后剩余的•OH和两种活性氮物种(RNS:NO•和过氧亚硝酸盐(ONOO−))水平(补充方法中有详细信息)。维生素C(Vit. C)和超氧化物歧化酶(SOD)被用作阳性对照。在没有氢气的情况下产生的信号(CTL)被设定为100%。数据代表平均值±标准差(n = 6)。*P < 0.05, ***P < 0.001。NBT-diformazan:硝基蓝四唑(NBT,一种超氧阴离子的检测器)的氧化形式。DAF-2:二氨基荧光素-2(一种•NO的检测器)。
接下来,我们检查了氢气与其他活性氧(ROS)或活性氮物种(RNS)的反应性。我们在无细胞系统中通过稀释相应的原液制备了H2O2和过氧亚硝酸盐(ONOO−),通过黄嘌呤氧化酶与黄嘌呤的酶促反应产生超氧阴离子,以及通过1-羟基-2-氧代-3-(N-甲基-3-氨基丙基)-3-甲基-1-三氮烯(NOC7)的自发反应产生NO•(补充方法在线)。氢气在某种程度上还原了ONOO−(图4d),但没有还原H2O2、NO•和超氧阴离子(图4e–g)。在无细胞实验中,我们检查了氢气是否还原了参与代谢氧化还原反应的生物分子的氧化形式。在室温和中性pH下,用氢气饱和的溶液并没有还原烟酰胺腺嘌呤二核苷酸(NAD+)、黄素腺嘌呤二核苷酸(FAD)或细胞色素C的氧化形式(数据未显示)。因此我们推断,氢气不影响涉及氧化还原反应的代谢或超氧阴离子、H2O2和NO•的水平,所有这些都在信号转导中起着至关重要的作用。
2.5氢气保护神经元免受体外缺血和再灌注的伤害
我们还在更生理条件下对新皮层细胞的原代培养物诱导了氧化应激。众所周知,从缺血状态迅速过渡到再灌注会导致氧化应激损伤。为了模拟缺血,我们在缺氧或氢气环境下使新皮层细胞经历60分钟的氧气葡萄糖剥夺(OGD),然后用含有O2和葡萄糖的培养基进行再灌注。
HPF荧光显示,在OGD完成后10分钟进行再灌注时,当没有氢气时•OH水平显著增加,但当存在氢气时减少了(补充图4在线)。在OGD和再灌注后24小时,氢气增加了神经元的存活率和活力(补充图4),表明氢气保护神经元免受氧化应激引起的细胞死亡。
2.6 吸入氢气气体通过减少再灌注伤害来保护脑损伤
为了检验氢气作为抗氧化剂的治疗适用性,我们使用了大鼠的缺血模型。在脑缺血和再灌注期间会产生活性氧(ROS),这是造成脑损伤的主要原因之一[21,22]。我们通过闭塞中脑动脉(MCA)90分钟,然后进行30分钟的再灌注,制造了大鼠的局部缺血(参考文献23)。在四种条件中的三种条件下,大鼠在整个120分钟的过程中吸入了混合有笑气(N2O)用于麻醉的氢气气体(氢气、O2和N2O的比例(体积比)分别为1%:30%:69%,2%:30%:68%,和4%:30%:66%);在第四种条件下,没有氢气(H2:O2:N2O的体积比为0%:30%:70%)。我们在实验过程中仔细监测了生理参数(方法),并未发现由于吸入氢气导致的显著变化(补充表1在线)。此外,对脑血流的影响也不显著,这是通过多普勒效应测量的(参考文献24和补充图5在线)。通过吸入氢气,动脉血中溶解的氢气量随吸入浓度的增加而增加;静脉血中溶解的氢气量少于动脉血,这表明氢气已经被组织吸收(图5a)。
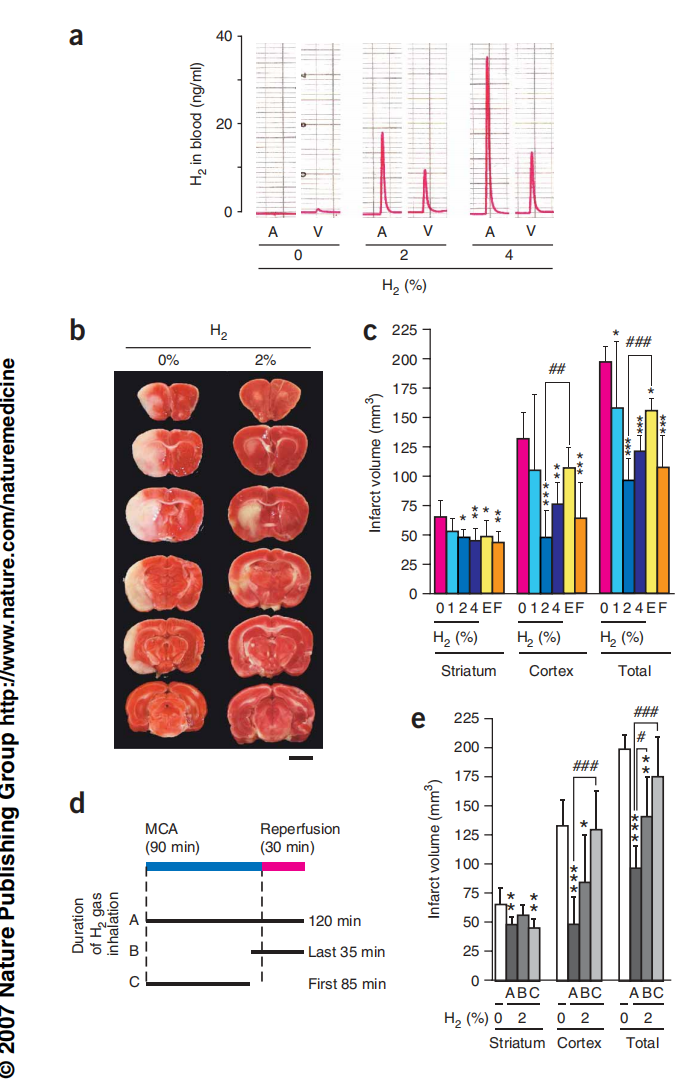
图5:吸入氢气可以防止缺血-再灌注伤害。
图5(a) 在笑气和氟烷麻醉下,大鼠吸入氢气和30% O2共1小时。采集动脉(A)和静脉(V)血,并通过气相色谱法检测氢气含量。(b) 大鼠经历了中脑动脉(MCA)闭塞。在120分钟的手术过程中,吸入了指示浓度的混合气体。MCA闭塞后一天,将大脑前部切成六个连续的冠状切片,并用线粒体呼吸底物TTC染色。标尺,5毫米。(c) 计算了脑切片中的梗死体积。E和F,用依达拉奉和FK506处理(n = 6)。*P < 0.05,**P < 0.01,***P < 0.001,与0% 氢气比较。##P < 0.01,###P < 0.001,与2% 氢气比较。(d) 三种不同持续时间吸入氢气(2%)的实验示意图。(e) 不同吸入持续时间的脑部梗死体积(如c所述)(n = 6)。*P < 0.05,**P < 0.01,***P < 0.001,与0% 氢气比较。#P < 0.05,###P < 0.001,与120分钟治疗比较。A、B和C代表不同持续时间的氢气气体吸入(如图d所示)。直方图表示平均值±标准差。
在MCA闭塞后的第1天,我们将大脑切片并用2,3,5-三苯基氯化四氮唑(TTC),一种线粒体呼吸底物染色(图5b)。我们通过评估大脑区域的染色情况估计了梗死体积(白色表示梗死,图5b,c),并发现梗死体积明显随氢气浓度的升高而减少,其中2-4%的氢气提供了最显著的效果(图5c)。我们还注意到,只有在再灌注期间吸入氢气时,氢气才会发挥效果;如果在缺血期间吸入氢气,则不会显著减少梗死体积(图5d,e)。作为对比,我们还测试了另外两种化合物:依达拉奉(在日本被批准用作治疗脑梗死的ROS清除剂[25])和FK506(在美国进行临床试验用于脑梗死[26])。氢气比依达拉奉更有效,并且和FK506一样有效,减轻氧化损伤(图5c)。这些结果表明了氢气作为治疗手段的潜力。
2.7吸入氢气气体抑制了损伤的进展
在MCA闭塞后1周,未处理和氢气处理大鼠之间的梗死体积差异增加了,与闭塞后1天相比(图6a,b)。根据神经学评分27对每只大鼠的行为进行评分,结果显示在缺血和再灌注期间吸入氢气改善了运动能力(图6c)。此外,尽管未经氢气处理的大鼠体重和体温逐渐下降,但经过氢气处理的大鼠最终恢复(图6d,e)。因此,氢气不仅抑制了最初的脑损伤,也抑制了其进一步的损伤。
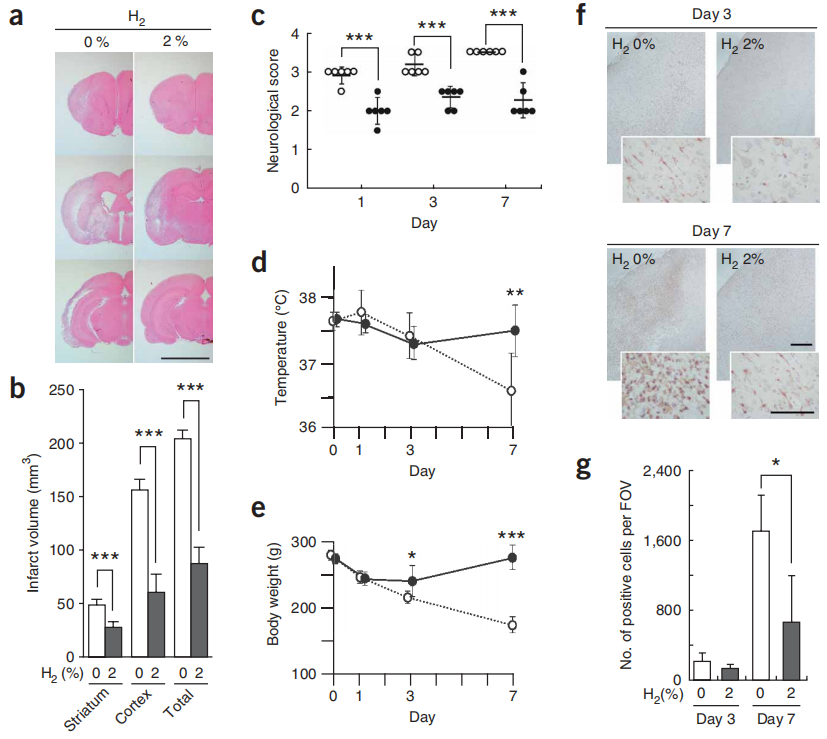
图6:吸入氢气气体在1周后改善了脑损伤。
图6大鼠在120分钟的缺血和再灌注过程中吸入2%的氢气,并维持1、3或7天。(a) MCA闭塞1周后,大脑被切片并用苏木精和伊红染色。显示了三个代表性的切片。比例尺,5毫米。(b) 计算了梗死体积(a中的浅粉色区域)(n = 6)。***P < 0.001。(c) 神经学评分按照先前描述的0到5的等级进行评分27:得分0,没有神经功能缺陷;1,未能完全伸展右前爪;2,向右转圈;3,向右倒;4,不能自发行走;5,死亡。当一只大鼠的神经学评分被判定为在1和2之间,2和3之间,或3和4之间时,评分分别设定为1.5,2.5和3.5。实心和空心圆分别代表有或无氢气的处理(n = 6)。***P < 0.001。(d,e) 监测了有无吸入2%氢气的体重和体温(实心圆为有,空心圆为无)(n = 6)。*P < 0.05,**P < 0.01,***P < 0.001。(f) 在MCA闭塞后的第3天或第7天,用抗Iba1抗体(一种微胶质细胞标记物)对颞皮质缺血核心区的冠状6μm切片进行染色。比例尺,200μm(插图中为100μm)。(g) 如f所示,在缺血核心区每个视野(FOV)计数Iba1抗体阳性细胞28(n = 6)。*P < 0.05。数据表示平均值±标准差。
我们在闭塞后的12小时、3天或7天检查了氢气介导的分子变化,通过用抗8-OH-G抗体对脑切片进行染色以评估核酸氧化程度(补充图6在线),并用抗HNE抗体评估脂质过氧化(补充图6)。对于这两种氧化标记物,与未经处理的大鼠相比,氢气处理的大鼠的染色明显减少。我们还用抗Iba1(参考文献28)和抗GFAP抗体对大脑的相同区域进行染色,这些抗体分别特异性地针对活化的小胶质细胞和星形胶质细胞(图6f,g和补充图6)。我们发现氢气依赖性的小胶质细胞积累减少,这表明了炎症和重塑。综合起来,这些结果表明氢气可以显著减少氧化应激并抑制脑损伤。
三、讨论
这项研究表明,氢气可以在体外选择性地减少ROS。由于•OH和ONOO−比其他ROS反应性更强(参考文献14),因此氢气将只与最强的氧化剂反应。这对于医疗程序来说是有利的,因为这意味着使用氢气不应该有严重的不良影响。氢气可能足够温和,不会干扰代谢氧化还原反应或破坏参与细胞信号传导的ROS——与一些具有强还原反应性的抗氧化补充剂不同,这些补充剂可能会增加死亡率,可能是通过影响必要的防御机制29。
作为一种潜在的抗氧化剂氢气有许多优点:它能有效地中和活细胞中的•OH,并且与大多数已知的抗氧化剂不同,这些抗氧化剂无法成功针对细胞器30,氢气具有有利的分布特性:它能穿透生物膜并扩散到细胞质、线粒体和细胞核中。尽管氢气的还原活性适中,但其快速的气体扩散可能使其在减少细胞毒性自由基方面非常有效。它保护核DNA和线粒体的能力表明,它可能降低生活方式相关疾病和癌症的风险。
氢气显著减少了氧化应激,并抑制了缺血和再灌注引起的脑损伤。吸入氢气气体比目前批准用于脑梗塞的治疗更为有效,并且还减轻了缺血和再灌注引起的肝损伤(K. Fukuda, S.A., M.I., Y. Yamamoto, I.O. 和 S.O.,未发表的数据)。这一发现表明,氢气的有益效果不特定于脑损伤,也可以用于其他器官的损伤。
这项研究表明,氢气通过清除•OH来保护细胞和组织免受强烈的氧化应激。然而,氢气也可能通过直接或间接减少活细胞中其他强氧化物质来保护免受压力。例如,氢气可能会诱导细胞保护因子;然而,我们没有发现氢气诱导的几个参与细胞保护或还原的基因表达的变化(K.N., M.I., I.O. 和 S.O.,未发表的数据)。进一步的研究将揭示氢气保护细胞和组织免受氧化应激的机制。
急性氧化应激可能由多种因素引起,包括炎症、剧烈运动、心脏病发作、血流停止和器官移植。对于治疗,溶解在盐水中的氢气可以很容易地通过血管内给药。对于预防保健,可以饮用饱和氢气的水进行。吸入氢气已经被用于预防潜水员的减压病,并且已经显示出良好的安全性31。值得注意的是,当氢气在空气中的浓度小于4.7%时,没有燃烧或爆炸的风险。我们提出,作为最知名的分子之一的氢气,可以作为一种安全有效的抗氧化剂,在医疗应用中广泛使用,副作用极小。
四、研究方法
4.1氢气和氧气测量。
我们使用氢电极(ABLE)和氧电极(Strathkelvin Instruments)分别测量溶液中溶解的氢气(H2)和氧(双氧,O2)。我们通过气相色谱法(Teramecs)确定了氢气浓度。为了测量血液中的氢气水平,我们用肝素预处理大鼠以避免血液凝固,在试管中收集动脉和静脉血(各5毫升),然后立即将血样注入含有30毫升空气的封闭铝袋中。在氢气气体完全从血液转移到封闭袋中的空气后,我们使用标准氢气气体对20毫升空气进行气相色谱分析,以定量氢气的量。
4.2细胞培养的氢气处理。
在2小时的时间内,我们在0.4 MPa的压力下将氢气溶解到超过饱和水平的DMEM培养基中。我们通过向第二个培养基中通入O2气体至饱和水平(42.5 mg/l)来溶解O2,通过向第三个培养基中通入CO2气体来溶解CO2。所有三种培养基都保持在大气压下。然后我们将这三种培养基(氢气培养基:O2培养基:CO2培养基)按75%:20%:5%的比例(体积比)混合,并添加胎牛血清(FBS)以达到最终1%的浓度。对于培养,我们将混合培养基放入培养瓶中,并立即用氢气或O2电极检查氢气或O2浓度。然后我们用由75% 氢气、20% O2和5% CO2组成的混合气体(体积比)填充培养瓶,并在封闭的培养瓶中培养细胞。我们通过在开放容器中搅拌已饱和氢气的培养基4小时,并用电化学氢传感器检查氢气浓度,制备了去气缺乏氢气的培养基。在关于氢气剂量依赖性的实验中(结果如图2f所示),我们用含有1% FBS并与含5% CO2的空气平衡的第四种培养基稀释混合培养基,以获得所需的氢气浓度;然后用与含5% CO2的空气稀释的混合气体填充培养瓶。
4.3通过抗霉素A和门冬氨酸诱导氧化应激。
我们在含有1% FBS的DMEM培养基中,在37°C下维持PC12细胞,有或没有0.6 mM 氢气,在充满上述混合气体的封闭瓶中。我们用门冬氨酸或抗霉素A处理细胞,这两种物质分别抑制线粒体电子传递链的复合物I或复合物III,从而产生超氧阴离子(通过加速电子泄漏)。在暴露于抗霉素A 24小时后,我们通过手动计数用1 μM碘化丙啶(死亡细胞标记为粉红色)和5 μM Hoechst 33342(死亡和存活细胞标记为蓝色)双重染色的细胞,在荧光显微镜下评估细胞存活率。为了检验氢气对线粒体的保护作用,我们先用4.5 g/l 2-脱氧-D-葡萄糖(糖酵解的抑制剂)和1 mM丙酮酸(氧化磷酸化的底物)预处理细胞30分钟,然后在有或没有0.6 mM 氢气的情况下暴露于抗霉素A,随后使用细胞内ATP测量试剂盒(TOYO B-Net.)定量细胞内ATP水平。
4.4脑梗塞模型。
动物协议由日本医科大学动物护理和使用委员会批准。我们用卤烷(诱导4%,维持1%)在笑气和氧气混合物(70%:30%,体积比)中麻醉体重为250-300克的雄性Sprague-Dawley大鼠。我们使用与直肠温度计探头连接的恒温加热毯维持温度(37.5 ± 0.5 °C),并同时监测生理参数(通过尾动脉插管),包括血气(pCO2和pO2)、pH值、血糖水平和血压。我们试图通过调节卤烷量和N2O:O2比例来维持pH和pO2的恒定水平。我们通过左中大脑动脉(MCA)腔内闭塞制造局灶性缺血,使用尖端圆润且远端有硅胶柱的尼龙单丝进行操作,如先前所述^23。大鼠经历90分钟的MCA闭塞,然后30分钟的再灌注;在整个过程中,除了对应于图5d,e的实验外,它们吸入氢气气体。我们使用最有效的浓度(参考文献25, 23和图5c)用依达拉奉和FK506治疗大鼠。在大鼠从麻醉中恢复后,将它们维持在23°C的环境中。
在MCA闭塞后24小时,我们在麻醉下取出大脑,并将其切成六个连续的冠状切面(厚2毫米)。我们用2,3,5-三苯基四唑氯化物(TTC)(3%)对切片进行染色,然后使用光学解剖图像分析系统(Mac SCOPE,Mitsuya Shoji)测量梗死和非梗死面积。我们勾画出梗死和非梗死组织的边界,并通过从对侧半球的非病变区域减去同侧半球的非病变区域来计算梗死面积。我们计算梗死体积为梗死面积×厚度。在MCA闭塞后12小时、3天或7天,我们在麻醉下迅速取出大脑,并用10%的福尔马林固定。我们将石蜡包埋的大脑切成一系列6微米的切片,并用苏木精和伊红(H&E)染色。然后我们用图形分析系统(Mac Scope)定量粉红色区域。为了免疫染色,我们根据供应商的说明使用VECTASTAIN ABC试剂对切片进行抗体染色。
4.5统计分析。
我们使用StatView软件(SAS Institute)进行统计分析。对于单一比较,我们执行不成对的双尾学生t检验;对于多重比较,我们使用方差分析(ANOVA),然后进行Fisher精确检验。我们以盲法进行定量实验。
https://blog.sciencenet.cn/blog-41174-1428887.html
上一篇:人工智能正进入科学教育领域,学生们的视角
下一篇:黄石公园巨型病毒的生命进化秘密