博文
启动心跳的光起搏器
||
植入式电动起搏器挽救了全世界数百万人的生命,但它们并不完美。一项概念验证研究表明,使用光来调节心跳可能是比现有策略更好的选择。
生命从心跳开始,没有心跳就结束了。这种有规律的节律是由身体的天然起搏器设定的:一组称为窦房结的细胞1.当这个淋巴结衰竭时,心脏病专家可以植入一个电动起搏器,以刺激一个人的心脏恢复到正常频率2.但标准心脏起搏器由寿命有限的电化学电池供电,并且设备容易出现电极故障和外部电磁场干扰 Li 等提出一种利用光的能量刺激心脏的技术,这可以为这些问题提供解决方案。
心肌由通过化学、机械和电信号系统相互作用的细胞组成。电耦合通过使电信号从单个刺激点快速传播来激发整个肌肉。其他类型的联轴器为标准电动起搏器的替代品提供了灵感。研究人员已经研究了靶向特定蛋白质的可能性,这些蛋白质可以通过机械或通过温度或光的变化传输所需的信号。这些传感器可以通过光或超声波非侵入性触发5,6.
然而,尽管付出了相当大的努力,这些方法仍未产生临床上可行的治疗方法。一个障碍是天然和基因工程分子传感器都不够灵敏。另一个问题是,现有的设备无法与人体组织很好地连接。事实证明,很难实现基因工程分子传感器向心脏的靶向和稳定递送。
另一种策略是植入生物相容性光电化学器件,将光的能量转化为电流。十多年前,一种基于硅的光电化学装置被提议作为视网膜受损患者的假体。与Li等人属于同一研究小组的成员。然后提出了一套设计原则,用于将此类设备与各种生物靶标连接起来8.
在本研究中,Li et al.生产了一种概念验证设备,该设备使用激光在设计用于植入心肌表面的硅设备中产生电流。作者在分离的心脏细胞以及从大鼠身上取出的完整心脏上测试了该装置。然后,他们证明他们可以使用该设备在体内刺激小鼠的心脏。最后,Li et al.证明他们的设备可以在心脏直视手术期间或内窥镜手术后可靠地起搏猪的心脏。
作为其设备表征的一部分,Li 等人绘制了心肌表面以下产生的电流的 3D 分布。电流对心脏的影响可以通过量化通过一组虚拟电极刺激心肌的“激活功能”来理解。作者的 3D 图可以计算这种激活函数,然后可用于优化临床应用所需的光的能量和波形特性。
植入式起搏器的主要挑战之一是它们会导致心脏的不同部分不同步收缩。与由身体传导系统刺激的健康心脏不同,由起搏器控制的心脏由通常植入右心房或心室的电极刺激(图 1a)。尽管电信号在整个器官中快速传播,但这种局部刺激会导致异步激发,导致不同步收缩。各种再同步装置增加了左心室电极,在这种情况下预防和减轻心力衰竭12.然而,这些设备要么只针对心脏的几个部位,要么需要在传导系统的特定点精确植入一个电极。
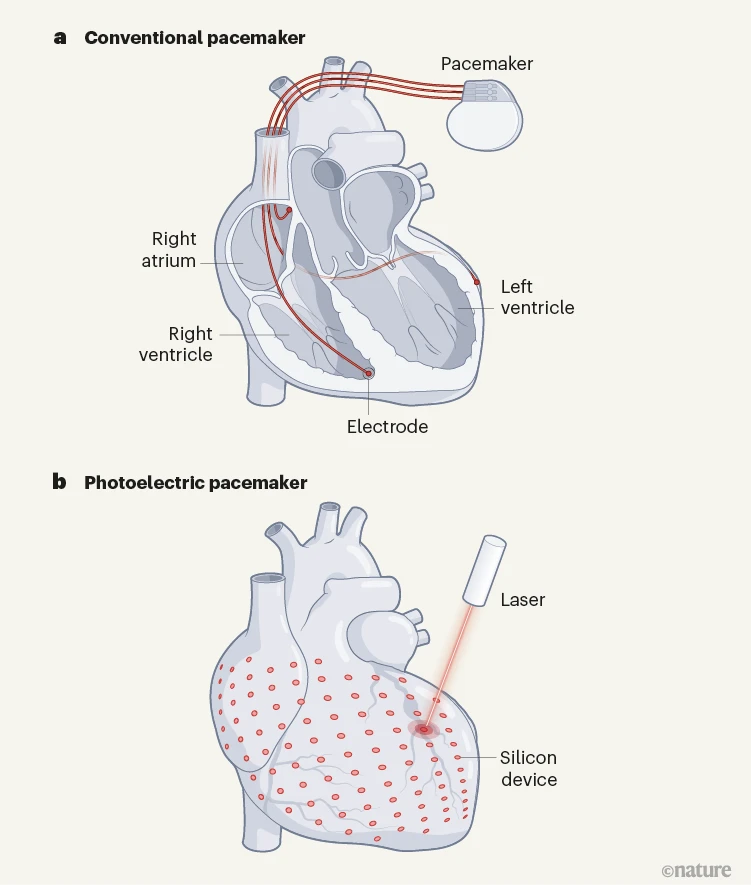
图 1 |用光改进起搏器设计。 a,在目前最好的传统起搏器中,该设备连接到电极,电极使用电刺激来加速右心房或左右心室的收缩。这种策略可能导致异步收缩,否则可能会由于电池寿命有限和电极不可靠而失败。 b, Li et al.4提出一种替代起搏器,可以使用光电硅无创地刺激多个部位的心脏,这意味着它可以将来自激光或发光二极管的光能转换为电流。作者的概念验证设计成功地在体内踱动了猪的心脏。
Li et al.说这个问题可以通过使用他们的硅器件网络刺激几个部位的心脏来克服(图 1b)。然而,目前尚不清楚这些设备将如何连接在一起,以及它们如何植入跳动的心脏中。还有其他工程挑战需要克服。首先,心脏被一层脂肪包围。植入是否涉及穿透这些脂肪并将设备固定在肌肉上?或者该设备及其光源会通过静脉输送到心脏内部吗?
其次,异物的植入可能会引起生理反应,这可能导致Li及其同事的设备被纤维组织包裹,就像早期的植入式电动起搏器一样13.第三,也许也是最重要的一点,目前尚不清楚作者计划如何向心脏输送光,因为肋骨和肺部使进入心脏变得复杂。
在作者的概念验证实验中,心脏暴露在外,提供了进入心脏表面的轻松光学通道。这使得用光刺激多个硅器件成为可能。但心脏通常覆盖着许多层组织,这些组织会散射光线。出于这个原因,Li及其同事的策略中使用的光要么必须由设备本身的发光二极管产生,要么通过光导从远程光源引导到心脏14.这两种方法都存在与传统电动起搏器相同的问题:设备可能会被身体排斥,或者以其他方式失效。理想情况下,如果有一种方法可以通过肋骨架刺激Li及其同事的设备,则可以将外部光源整合到可穿戴设备中。但是,该器件的灵敏度可能不足以满足此解决方案的需求。
由于所有这些障碍仍有待清除,因此很难预测何时或是否会证明光电刺激器(例如Li及其同事设计的光电刺激器)将比传统的电动起搏器更强大。然而,作者令人兴奋的概念验证显示了该技术的巨大潜力,并表明光电设备最终可以改变一系列疗法,包括那些需要神经、肌肉和心脏刺激的疗法。
Li, P., Zhang, J., Hayashi, H. et al. Monolithic silicon for high spatiotemporal translational photostimulation. Nature (2024). https://doi.org/10.1038/s41586-024-07016-9
基于电极的电刺激是多种临床生物电子设备的基础,包括深部脑刺激器1,2和心脏起搏器3.然而,无导线多位点刺激受到电极阵列的技术困难和空间访问限制的限制。光遗传学提供具有高时空能力的光学控制随机访问,但临床转化带来了挑战4,5,6.在这里,我们展示了使用基于半导体生物调节接口的非遗传平台对心脏系统的可调时空光刺激。通过光电化学电流的时空剖析,我们评估了四种无铅硅基单片光电化学器件中光刺激的幅度、精度、准确度和分辨率。我们通过靶向多个区域和空间范围的培养心肌细胞 (CM) 的光学超速起搏、Langendorff 装置中的分离大鼠心脏、缺血模型中的体内大鼠心脏和具有经胸光学起搏的体内小鼠心脏模型来展示设备的光电能力。据我们所知,我们还在体内对猪心脏进行了第一个光学覆盖起搏和多位点起搏。我们的系统很容易适应使用我们定制的内窥镜输送设备的微创临床程序,我们用它来演示闭胸手术和内窥镜光学刺激。我们的研究结果表明,无导线、轻量级和多位点光刺激平台作为心脏再同步化治疗 (CRT) 起搏器的临床潜力,其中导联放置并发症很常见。
https://blog.sciencenet.cn/blog-41174-1422614.html
上一篇:从宇宙起源到医学应用的氢
下一篇:慢性疲劳综合征的分子病理基础