博文
神经系统新进展GABA激活谷氨酸受体
|
经典神经生物学观点认为,大脑内神经元和神经元信号传导存在兴奋性和抑制性两类最基本的类型,中枢神经系统就是在兴奋和抑制的平衡稳态下维持基本功能。白天需要兴奋为主,两种类型的综合结果就以兴奋为主。晚上需要睡觉,则综合结合是抑制。一种最经典的兴奋性神经元释放兴奋性神经递质,神经兴奋性物质就是谷氨酸。负责传递谷氨酸信号的谷氨酸受体有多种类型,基本分类为离子通道和代谢型,但这些受体都是负责兴奋性信号的传递。最经典的抑制性神经递质是另外一种氨基酸,γ-氨基丁酸 (GABA) 。但是最新的研究结果非常意外,就是一种特殊类型的谷氨酸受体,竟然是用GABA作为递质。当然严格意义上,我们可以把这种结构上和谷氨酸受体类似的受体看成是GABA受体。这一发现,证明生物分子在执行功能时的灵活性和多样性。
An unexpected role for a glutamate receptor | Science
抑制可塑性的新介质
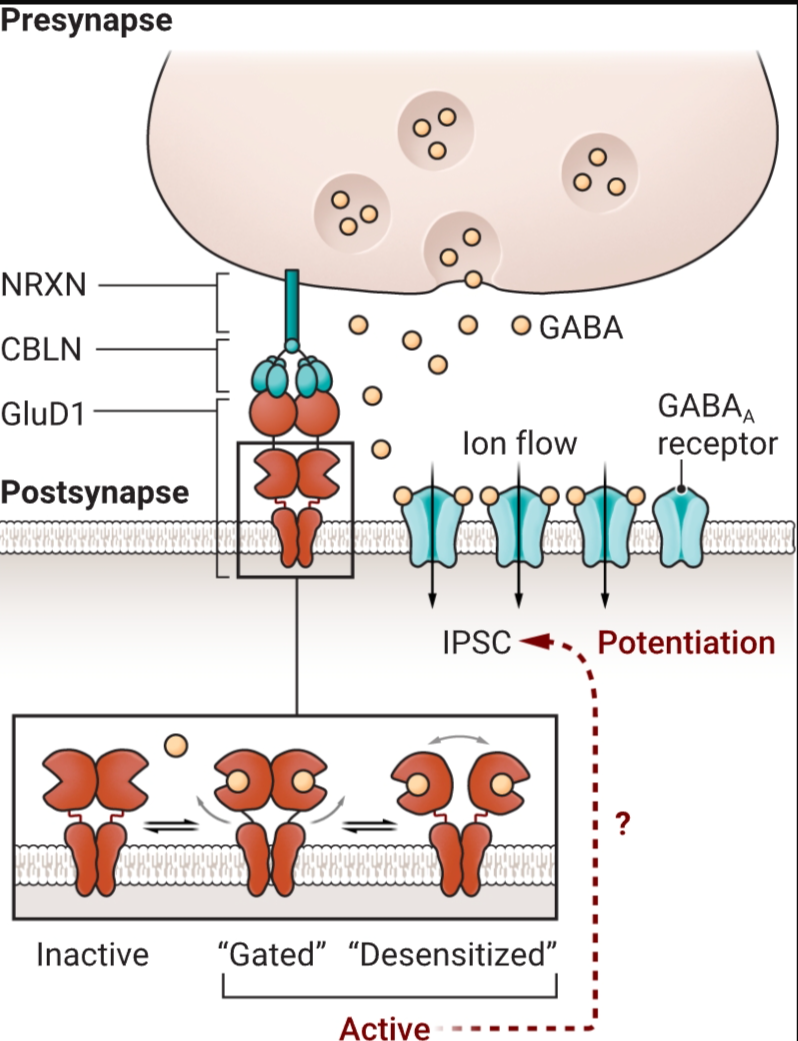
GluD1 受体形成跨突触复合物,包括小脑素 (CBLN) 和神经素 (NRXN)。在抑制性海马突触中,GluD1 可以结合 γ-氨基丁酸 (GABA),导致 A 型 GABA (GABA一个)受体介导的抑制性突触后电流(IPSC)。当 GluD1 结合 GABA(显示四个亚基中的两个)时,它可能会发生类似于导致其他离子型谷氨酸受体门控和脱敏状态的结构变化,但导致增强 IPSC 的机制尚不清楚。
由神经递质谷氨酸激活的离子通道是大脑神经元之间兴奋性信号传导的基础。在哺乳动物中,这些离子型谷氨酸受体 (iGluRs) 分别属于由 GluA、GluN 和 GluK 亚基形成的三个家族:α-氨基-3-羟基-5-甲基-4-异噁唑丙酸 (AMPA)、N-甲基-D-天冬氨酸 (NMDA) 和红藻氨酸受体 (1)。相比之下,第四个同源iGluR家族的受体(δ或GluD受体)对谷氨酸没有反应。尽管与其他 iGluR 具有相似的结构,包括跨膜孔,但 GluD 受体是否通过电流的问题一直存在争议 (2, 3)。相反,它们最广为人知的是突触组织蛋白 (2, 4)。在本期杂志的第 1389 页,Piot 等人 (5) 表明,一个 GluD 家族成员 GluD1 可以结合抑制性神经递质 γ-氨基丁酸 (GABA) 并触发 GABA 介导的突触电流的增强。这挑战了谷氨酸和GABA受体之间的教条区别,并将GluD1确定为抑制信号传导的调节因子。
GluD 家族成员 GluD1 和 GluD2 都可以在兴奋性突触中找到。它们通过小脑蛋白家族的接头蛋白与神经素家族的突触前粘附分子连接,形成跨突触复合体,在突触组装和活动驱动的突触修饰中发挥关键作用 (6)。GluD2 在发育中的小脑中由颗粒细胞平行纤维与浦肯野细胞形成的突触中首次发现这些作用,其中 Bergmanglia 释放的 d-丝氨酸结合通过促进 AMPA 受体内化来长期抑制兴奋性传递 (7)。GluD1 同样与跨突触相互作用有关,这些相互作用已被证明会影响兴奋性突触的形成 (8) 以及 AMPA 受体和 NMDA 受体介导的信号转导的平衡 (9)。然而,在 iGluR 中,GluD1 也被发现在 GABA 释放抑制性突触中,特别是在生长抑素阳性中间神经元和皮质锥体神经元之间的突触中。GluD1 与小脑素和神经素的相互作用,以及 d-丝氨酸或甘氨酸的结合,可触发调节抑制性突触后组装的细胞内信号 (10)。
在这些发现的提示下,Piot 等研究了GABA对GluD1受体的作用。他们使用在非洲爪蛙 (非洲爪蟾) 卵母细胞中表达的重组受体,记录了来自原位开放的 GluD1 和 GluD2“Lurcher”突变体的电流 (11)。作者发现,d-丝氨酸和GABA增强了GluD1电流,它们竞争相同的结合位点。GABA与d-丝氨酸一样有效,尽管效力要低得多。相比之下,GluD2电流受到d-丝氨酸的抑制,但不受GABA的影响,这表明GluD1和GluD2之间存在多种功能差异,至少在它们的Lurcher形式上是这样。Piot 等人。使用分离的 GluD1 配体结合域的 X 射线晶体学可视化 GABA 与 GluD1 的结合,这确定了结合的关键分子决定因素由 GABA 和 d-丝氨酸共享,与观察到的竞争作用一致。对于他们随后的实验至关重要的是,作者还发现了GluD1中的点突变,这些突变能够消除GABA结合,同时保持d-丝氨酸结合基本完好无损。
为了解决GABA是否可以通过突触处的野生型(非Lurcher)GluD1受体发出信号的问题,Piot等人。从小鼠急性海马切片中的CA1锥体神经元记录,并电刺激腔隙层(CA1锥体神经元的树突所在的位置)神经元释放GABA,这是GluD1表达强烈的区域。高频突触刺激的爆发或 d-丝氨酸的应用增强了 A 型 GABA 介导的抑制性突触后电流 (IPSC) 的幅度(GABA一个)受体(见图)。这些作用被基于短发夹 RNA 的 GluD1 表达下调所阻断。此外,通过引入缺乏特异性信号转导能力的 GluD1 突变体,作者表明 GABA 结合和小脑相互作用是增强 IPSC 振幅所必需的,但离子通过 GluD1 通道不是必需的。
脑小脑素的四种亚型中哪一种 (4) 参与 Piot 等人描述的抑制性可塑性仍有待确定。以及 GluD1 的这种“非离子性”作用是否需要小脑素与突触前神经素结合。这是一个关键问题。GABA能中间神经元是众所周知的异质性,这种相互作用可能有望决定可塑性的细胞特异性。在腔隙-鼹鼠层中发现或与腔隙-鼹鼠层接壤,其中最突出的是神经胶质细胞 (12)。它们形成非典型突触,与大多数其他中间神经元不同,它们的激活导致GABA升高延长,达到相对较低的峰值浓度。鉴于此,GluD1对GABA的明显低亲和力特别有趣。
GluD1如何调整iGluR浇注机制以产生明显的非离子效应?值得注意的是,钙离子通过稳定二聚体构象中的受体配体结合结构域,大大降低了 d-丝氨酸在 GluD2-Lurcher 受体上的效力 (13),这可能决定了配体结合最终是进入门控或脱敏样状态。Piot等人获得的GluD1配体结合结构域结构。含有在二聚体界面结合的钙离子;这些离子的功能影响是否与GluD2相似,以及这如何影响GABA对GluD1的突触作用,是重要的问题。其中一些问题可以通过使用冷冻电子显微镜在存在和不存在GABA和钙离子的情况下可视化完整的GluD1受体来解决。
除了 GluD1“激活”的直接机制之外,尚不清楚哪些下游效应蛋白和信号通路最终是 IPSC 增强的关键,也不知道这种增强如何与其他形式的抑制可塑性相互作用。GABA的低亲和力,因此,假定的GluD1信号的短暂性(即使在高频突触刺激期间),表明GluD1与其效应子之间存在紧密联系。先前的无偏倚蛋白质组学筛选发现了几种潜在的 GluD1 相互作用蛋白 (10),但它们在新描述的 GABA 诱导的可塑性中的作用仍有待确定。有趣的是,最近人们认识到选择性剪切可以产生具有不同羧基末端细胞浆尾部的 GluD1 同工型 (14)。这增加了不同队列的 GluD1 结合伴侣的可能性,从而增加了可能取决于突触类型或发育阶段的不同信号通路的参与。
在人类中,已经鉴定出编码 GluD1 (GRID1) 的基因的许多变体。这些拷贝数和错义变异与多种神经系统疾病有关,包括精神分裂症、自闭症、智力障碍和癫痫发作 (15)。GluD1依赖性抑制可塑性的破坏是否在疾病相关GRID1变异的影响中起作用是未来研究的重要问题。
https://blog.sciencenet.cn/blog-41174-1415400.html
上一篇:溶解氢气二氧化碳的冷水浸泡促进运动后恢复
下一篇:神经外科协助阐明体细胞突变