博文
肝硬化血液巨噬细胞代偿现象
|
肝脏内巨噬细胞簇代偿现象
肝脏位于肠道和体循环之间的界面可防止血源性感染(1,2)。 为此,肝脏使用密集的狭窄的肝窦血管网络,允许受污染的血液缓慢流过组织。这些血管中充斥着库普弗细胞,这是一种肝脏的常驻巨噬细胞,专门从循环中捕获病原体,这些细胞在血液重新进入体循环之前清洁血液(3)。然而,在慢性肝病和相关纤维化中,这种细胞屏障系统受到干扰,构成病原体全身传播的严重风险(4)。Peiseler等人最近在《科学》杂志(5)报告了纤维化肝脏的一个显着特征,即肝外的血液循环巨噬细胞被招募到器官中并形成超三胞胎以清除血源性病原体。在这样做的过程中,这些超集群保留了肝脏作为过滤器的作用,即使在患肝硬化时也是如此。
健康肝脏中,库普弗细胞嵌入星状细胞、肝细胞和肝窦内皮细胞中,统称为库普弗细胞生态位。这些生态位细胞共同在库普弗细胞上印记肝脏特异性功能(6),包括通过涉及细胞表面受体的过程在正窦上扩展丝状伪足并吞噬血源性病原体的能力,例如补体免疫球蛋白受体[(CRIg)也称为补体受体V-set和免疫球蛋白结构域含蛋白4(VSIG4)(3)].CRIg在人和小鼠库普弗细胞上表达,表明CRIg介导的细菌捕获是这些细胞的进化保守功能(7)。在稳定状态下,库普弗细胞区室保持自身,独立于循环单核细胞(8),但在库普弗细胞丢失时,例如在慢性肝损伤期间,招募的单核细胞重新填充库普弗细胞池(6,9)。 由于单核细胞的组织特化为常驻巨噬细胞需要数月时间,并且一旦完成,似乎对变化有抵抗力(10),因此组织巨噬细胞身份的印记被认为是不可逆的。
Peiseler等人报告说,在纤维化小鼠肝脏中,常驻库普弗细胞去分化并失去了许多稳态属性,包括CRIg的表达。因此,它们有效地失去了肝脏特异性和专门的病原体捕获能力。鉴于包括星状细胞在内的小块细胞在库普弗细胞身份印记中的重要作用,作者提出,纤维化肝脏中库普弗细胞和星状细胞之间接触面积的丧失是这种身份丧失的基础。Peiseler等人表明,库普弗细胞在纤维化小鼠肝脏中失去了库普弗细胞身份主转录因子肝脏X核受体α(Nr1h3)(6,11)的表达。库普弗细胞中Nr1h3的表达是由来自正弦内皮细胞的Notch信号和来自星状细胞的骨形态发生蛋白9(BMP9)[也称为生长分化因子2(GDF2)]信号传导的组合诱导的(6)。这表明库普弗细胞中的Notch-BMP9信号在纤维化肝脏中发生了改变。
目前尚不清楚库普弗细胞中 Nr1h3 的下调表达及其随后肝脏特异性身份的丧失是否是纤维化的影响,直接限制了星状细胞和 库普弗细胞之间的接触,从而限制了它们对 BMP9 的访问,或者星状细胞和/或正弦内皮细胞是否改变了它们的基因表达谱并停止产生印记库普弗细胞身份的因子。值得注意的是,Peiseler等人发现在纤维化肝脏中发育的单核细胞来源的库普弗细胞缺乏CRIg,这表明库普弗细胞生态位在纤维化中被破坏。
无论确切的分子机制如何,Peiseler等人报告说,小鼠纤维化肝脏由库普弗细胞填充 - 常驻库普弗细胞和单核细胞来源的库普弗细胞 - 缺乏CRIg的表达和相关的特殊病原体捕获能力。这凸显了肝脏结构在受伤时维持病原体捕获功能的局限性。然而,肝脏捕获血源性病原体的整体能力仅略有减弱。
为了理解这种差异,Peiseler等人研究了巨噬细胞在小鼠肝脏中的位置。在健康的肝脏中,库普弗细胞仅位于肝窦附近,与先前的观察结果一致(6)。然而,在纤维化肝脏中,巨噬细胞也在较大的小静脉和侧支血管内形成大的多细胞聚集体。这些聚集体或合胞体几乎完全由单核细胞衍生的巨噬细胞组成。合胞巨噬细胞似乎采用了肝脏特异性病原体捕获机制,CRIg的高表达证明了这一点,并从循环中捕获了血源性病原体。此外,在健康肝脏中相邻的星状细胞靠近纤维化肝脏中的小静脉和侧支血管(见图)。
Peiseler等人提出的一个假设是星状细胞迁移以将病原体捕获功能印记在合胞巨噬细胞上。然而,一种相反的机制,即星状细胞的迁移先于合胞体形成,也可以解释这些发现。如果是这样,疾病早期的星状细胞迁移可能导致正弦邻近的库普弗细胞的功能丧失。无论如何,这些发现提出了一个问题,即肝脏生态位是否以协调的方式对损伤做出反应,或者在损伤时,各种生态位细胞是否以脱节的方式做出反应和迁移,从而打破稳态生态位并可能建立新的炎症生态位。
Peiseler等人还确定了合胞巨噬细胞上存在的两种粘附分子 - CD44和血小板糖蛋白4(CD36) - 作为超团簇形成的关键参与者。Hyalyronan是CD44的配体,在纤维化肝小静脉和侧壁上高度表达,因此允许表达CD44的单核细胞粘附,分化成前合体巨噬细胞。CD36对于这种早期粘附是可有可无的,但单核细胞和随后的巨噬细胞需要融合成合胞体。值得注意的是,尽管CRIg表达增加,但缺乏CD36的募集巨噬细胞未能形成合胞体或捕获血源性病原体。因此,合胞体对病原体的有效摄取似乎是正确引发的巨噬细胞与巨噬细胞超簇形成之间的相互作用。合胞巨噬细胞的长期命运尚不清楚。事实上,是否有可能完全恢复解剖学和功能性肝脏,或者这些合胞体是否呈现持久的变化尚不清楚。
Peiseler等人的观察揭示了受损小鼠肝脏的显着适应,以维持其清除循环病原体的能力。作者还在患病的人肝脏中发现了巨噬细胞合胞体,这表明了一种进化保守的机制。在组织炎症的背景下,任何组织中的组织驻留巨噬细胞身份和功能是否是可逆的 - 就像肝脏的库普弗细胞一样 - 尚不清楚。如果是这样,这种去分化可能会影响各种损伤环境中的组织驻留巨噬细胞,并可能具有很大的临床相关性。
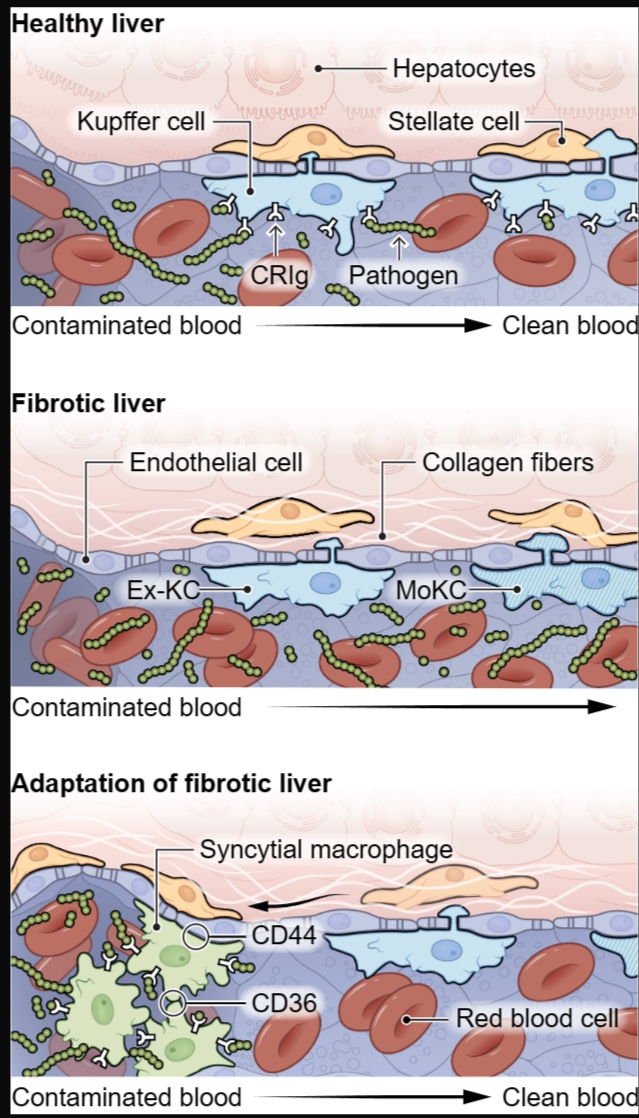
纤维化肝脏的适应
在健康的肝脏(顶部)中,库普弗细胞被星状细胞,内皮细胞和肝细胞印记,以使用补体免疫球蛋白受体(CRIg)捕获血源性病原体。在纤维化肝脏中,印迹失败,导致前库普弗细胞(前KCs)和单核细胞来源的库普弗细胞(moKCs)缺乏CRIg,因此无法吞噬病原体(中)。肝脏通过形成表达CRIg的巨噬细胞簇或合胞体来适应(底部),从而保持过滤能力。这些巨噬细胞与血小板糖蛋白4(CD36)相互附着,并与CD44附着在小静脉或侧支内皮细胞上。
Kupffer cell–like syncytia replenish resident macrophage function in the fibrotic liver | Science
论文摘要
介绍
局部环境对于确定给定器官内巨噬细胞的表型至关重要。在肝脏中,常驻巨噬细胞在由肝细胞、内皮细胞和星状细胞组成的生态位中接收指导性线索。这些线索激活特定的转录因子,赋予这些巨噬细胞酷氏细胞(KC)“身份”。KCs通过专门的受体(包括补体受体CRIg)执行从血液中捕获病原体的关键功能。肝纤维化和肝硬化是各种慢性肝病的常见终末期,导致受影响个体的大量发病率和死亡率。尽管病因不同,但进展相似,肝细胞死亡和肝窦周围胶原沉积,导致血流重新分配到新的和扩大的肝内和肝外侧支血管。
理由
目前尚不清楚生态位环境的纤维化重塑如何影响KC隔室。在这项研究中,我们使用各种谱系追踪模型和活体显微镜来可视化、跟踪和功能评估纤维化肝脏环境中的单核细胞和 KC。
结果
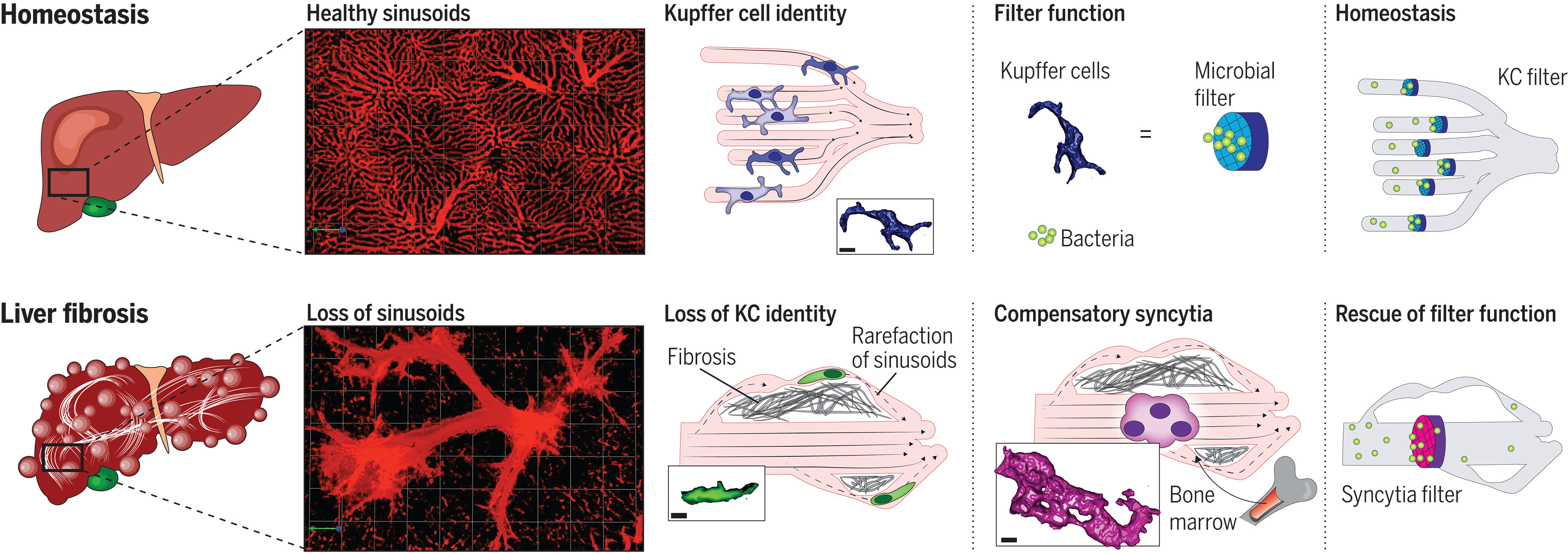
使用最常见的肝纤维化小鼠模型 - 四氯化碳毒性 - 我们观察到肝脏的深刻结构变化。这种重塑包括侧支血管和正弦周围胶原蛋白沉积的大量增加,这导致KCs与周围环境失去联系。这反过来又导致关键转录因子和膜蛋白(如CLEC4F,CRIg和TIM-4)的下调,它们共同决定了KC身份。尽管这些变化导致KC功能受损,尽管KC身份丧失,肝脏仍继续充当血源性细菌的主要过滤器。
肝脏从血液招募大量的单核细胞,由于肠道微生物群驱动的内皮细胞粘附性增加,这些细胞主要通过CD44粘附到大的肝内血管上。单核细胞在侧支血管内形成大簇并开始表达KC标志物。这些单核细胞构成了一系列结构,从单个细胞簇到融合的多核巨细胞,这些巨细胞共同表现为KC样合胞体。虽然单个KCs无法捕获在较大血管内流动的细菌,但KC样合胞体能够捕获大量循环细菌。使用转录组学分析,我们将CD36确定为合胞体融合的关键分子,并降低了对感染的易感性。表达CRIg的血管内巨噬细胞合胞体也见于不同病因的人肝硬化。
结论
与纤维化生态位中的实质细胞失去接触会导致正常驻留的KC失去身份和功能。由于正常的KC补充几乎没有用处,因此单核细胞遵循绕过肝窦的侧支血管的形成,在那里它们形成KC样合胞体,具有从血液中捕获细菌的能力。因此,在改变的纤维化生态位环境中的KC适应不良被形成KC样合胞体的单核细胞拯救以捕获细菌。这些细胞结构可能发挥关键的进化作用,使哺乳动物能够承受肝脏中的严重慢性损伤。
https://blog.sciencenet.cn/blog-41174-1402086.html
上一篇:诺贝尔医学奖的预热:胰高血糖素样肽-1
下一篇:脑雾可能是凝血功能亢进的后果