博文
蛋白水解药物开发新赛道
|
本文所介绍的日本一家公司的药物开发新模式是蛋白降解,这是药物开发领域的新火热赛道,其火热起始于2019年底行业领头羊Arvinas的ARV-110安全性和PK数据的披露,大大增强了行业对于这种新型成药形式的信心。2020年,Nurix、Kymera和C4这几家元老级的蛋白降解药物研发公司的陆续上市,及2020年底Arvinas的ARV-471的临床有效性数据披露更是推波助澜,将蛋白降解的热潮推至顶峰。据动脉网不完全统计,截至2021年7月,已有近50亿美元的一二级市场的投资涌入蛋白降解领域的各个生物技术公司。这尚不包括各大国际大药企和头部TPD生物技术公司的广泛合作,合作规模之大、深度及费用体量都凸显了大药企对此条赛道的期望程度之高。
蛋白降解领域赛道持续升温,将迎来更多技术突破|高特佳Insights (baidu.com)
蛋白降解技术以其在突破不可成药靶点、克服现有靶点耐药突变等方面的巨大潜力和优势,吸引了众多科研机构和研发药企的大力投入,也获得了资本的青睐,成为小分子药物突围的一个风口。蛋白降解技术逐步完成了从早期偶然发现到理性设计为主导的蜕变,随着研究的进一步深入,蛋白降解技术将迎来更多突破。通常,细胞内的蛋白质通过泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)和自噬-溶酶体(Autophagy-lysosome)两条途径进行降解。泛素化是一种多功能的蛋白质翻译后修饰过程,是由3种酶催化的级联反应,泛素分子首先通过与E1泛素活化酶连接使其激活,然后转移到E2泛素结合酶中,最终通过E3连接酶将活化的泛素分子转移至靶蛋白,从而使靶蛋白形成多聚泛素链,多聚泛素化之后的靶蛋白会被26S蛋白酶体特异性识别并被降解。基于泛素-蛋白酶体途径设计的蛋白降解剂包括了蛋白降解靶向嵌合体(Proteolysis targeting chimera,PROTAC)和分子胶(Molecular Glues)。PROTAC作为一种双功能小分子,由目标蛋白配体和E3泛素连接酶配体通过Linker连接得到,利用泛素-蛋白酶系统识别、结合并降解疾病相关的靶蛋白。分子胶是一类可以诱导或稳定蛋白质间相互作用的小分子化合物。当其中一种蛋白质分子为泛素连接酶时,分子胶可以引起另外一个蛋白质发生泛素修饰,并通过蛋白酶体途径发生降解,与PROTAC过程类似。
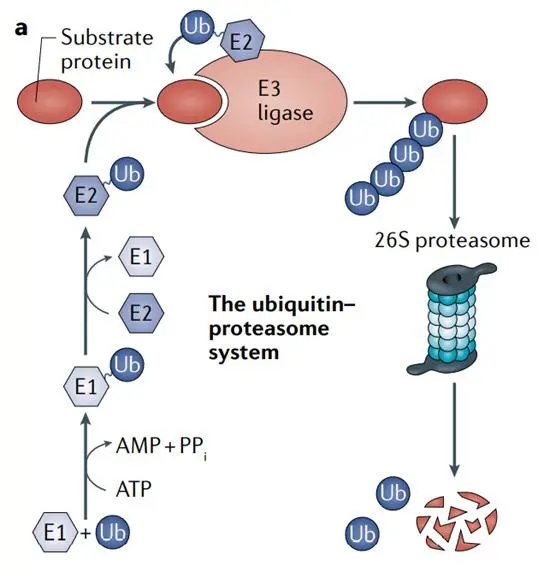
许多药物通过结合并暂时关闭蛋白质效应发挥疾病治疗作用。但是,大约80%的人类蛋白质传统上被认为是“不可成药的”,因为它们缺乏常规药物需要有效的合适结合口袋。日本安斯泰来制药公司(Astellas Pharma Inc.)使用的一种新策略,是利用人体自身的分子垃圾处理系统来解决有问题的蛋白质。由于药物降解蛋白质,这种新方法被称为靶向蛋白质降解,现在使制药公司能够以选择性,有效和潜在持久的方式禁用此类蛋白质。
Novel cancer-drug strategy could hit notorious proteins (nature.com)
一个众所周知的难以给药的靶点是蛋白质KRAS,其编码基因在大约25%的癌症中发生突变。KRAS在细胞生长和分裂中起着关键作用,这些过程在肿瘤中变得失调,导致细胞增殖不受控制。
不幸的是,KRAS基本上没有治疗分子可以依偎的口袋和缝隙,因此它的大多数突变形式 - 包括最普遍的,称为G12D的变体(其中第12个氨基酸,通常是甘氨酸(G),被天冬氨酸(D)取代) - 已被证明对经典药物发现范式具有抵抗力,尽管世界领先的制药公司在过去几十年中尽了最大努力。
现在,由于蛋白质降解剂的独特性质,只需要与靶标的弱结合,安斯泰来制药的科学家创造了一种有效的候选药物,可以选择性地破坏这种癌症驱动因素的G12D突变形式。这种名为ASP3082的研究药物是第一种针对G12D突变KRAS的降解剂,在世界许多地方进入人体试验。
在分子水平上,ASP3082具有哑铃状结构,由细系绳连接的两个结合端。一端锁定在KRAS的G12D突变位点上,而另一端则抓住一种特殊类型的“标记”酶E3连接酶。一旦所有东西都捆绑在一起,酶就会将蛋白质标签泛素添加到目标蛋白质中,向细胞的垃圾清除机制发出信号,以摆脱这种讨厌的蛋白质。
由于蛋白质降解剂在不与靶蛋白结合的情况下起作用以抑制其功能,因此在确定合适的候选药物时,蛋白质中没有清晰的结合口袋或结合亲和力差将不再是限制。因此,蛋白质降解剂有可能带来化学合成药物的范式转变。(这种方法也可以作为信号通路研究的有力武器!)
ASP3082 的首次人体试验研究,于 2022 年 7月在美国各地的癌症医院启动。
在实验室实验中,该公司位于筑波的尖端实验室的研究人员发现,ASP3082强力诱导蛋白质降解,随后抑制下游信号通路,对非突变KRAS蛋白的影响最小。该药物还钝化了携带G12D突变胰腺癌细胞的小鼠的肿瘤生长,有证据表明靶蛋白水平持续降低。“它显着耗尽了目标蛋白质,”安斯泰来靶向蛋白质降解负责人Masahiko Hayakawa说。
在临床试验中,在确定适当的剂量水平后,安斯泰来计划开始单独使用ASP3082,并与其他药物联合使用,包括一种名为西妥昔单抗的抗EGFR抗体。希望根据癌症的类型,同时使用ASP3082和其他药物治疗可以最大限度地提高益处,以帮助对抗胰腺,结肠和其他器官的肿瘤。
独特的方法
来自竞争对手制药商的十几种其他实验降解剂目前正在进行临床试验,几乎所有实验降解剂都针对与癌症生长相关的各种蛋白质。安斯泰来候选药物的与众不同之处在于其独特的靶标,以及构成其构成的专有分子片段。“我们拥有差异化的技术和资产,使我们在该领域处于领先地位,”早川说。
Hayakawa指出了该公司开发的用于靶向不同感兴趣蛋白质的分子库。安斯泰来及其合作伙伴也在努力开发能够募集具有疾病或组织特异性特征的各种类型的E3连接酶的粘合剂。例如,有些优先在肿瘤内工作,而另一些则只在受疾病影响的器官中工作。
由于蛋白质降解剂具有不同寻常的化学性质,并具有双功能设计特征,安斯泰来科学家可以混合和匹配其武器库中的各种工具,以设计最佳化合物 - 就像他们对ASP3082所做的那样。该降解剂只需要五个月优化,然后是一年的临床前研究,然后公司准备开始对患者进行临床试验。
Hayakawa和他的同事们遵循了类似的策略,采用了几种下一代方法,除了G12D突变形式外,降解KRAS的其他突变体以及与癌症和自身免疫性疾病有关的其他蛋白质。
只是一个开始
再加上该公司在药物化学、人工智能、分子合成、计算建模和最先进的机器人制造方面的能力和专业知识,可以想象降解剂平台可以帮助消除各种有害蛋白质。
“我们看到了这项技术在处理许多不可成药的目标分子方面的巨大潜力,”负责监督安斯泰来药物发现研究组织的首席科学官Yoshitsugu Shitaka说。他解释说,与标准小分子药物相比,蛋白质降解剂的其他优点包括更高的靶向精度,治疗效果应该更持久。
该公司的首批程序,如ASP3082,采用模块化方法,提供即插即用的设计灵活性。但安斯泰来也在研究使用其他机制的降解剂。这些包括更紧凑的分子胶,可以更深入地渗透到组织中并带来其他药理学益处。“我们在所有这些新模式中都非常活跃,”Shitaka说,并指出安斯泰来也是细胞疗法和其他尖端药物设计的开拓者。
“在不久的将来,靶向蛋白质降解将成为药物发现中更标准的一部分,”Shitaka说。“由于我们的团队致力于行业领先的靶向蛋白质降解,我们准备通过这种创新科学改变患者的生活。
https://blog.sciencenet.cn/blog-41174-1379839.html
上一篇:只有爸爸没有妈妈的小鼠出生并存活【突破】
下一篇:大气微量气体的微生物氧化