博文
[转载]hLife | 复旦崔杰研究团队解码衰老与人内源性逆转录病毒——从基因组化石到衰老调节因子
||
人类基因组中内源性逆转录病毒(Human Endogenous Retroviruses, HERVs)是远古外源性逆转录病毒感染祖先宿主并整合入生殖细胞基因组后遗留下的“分子化石”,深刻记录了病毒与宿主漫长的协同演化史。这些古老的病毒元件约占人类基因组的8%,曾长期被视为无功能的“垃圾DNA”。然而,近年来累积的研究证据揭示,HERVs在胚胎发育、免疫稳态调节、抗病毒防御以及多种疾病的发生发展中扮演着关键角色。鉴于免疫衰老等衰老相关病理生理过程的重要性,深入探究HERVs与衰老进程的关联性不仅具有理论迫切性,也为阐释衰老的分子机制提供了崭新视角。
近日,复旦大学感染与健康研究院崔杰研究团队在hLife发表了题为“Aging and human endogenous retroviruses”观点文章(图1),系统总结了当前HERVs与衰老领域的研究进展并进行了前瞻性展望。

图1 论文标题及作者信息
HERVs的典型结构包含四个核心基因:gag、pro、pol 和env,分别编码病毒核心蛋白、蛋白酶、逆转录酶/整合酶以及包膜糖蛋白。其基因组两端由长末端重复序列(Long Terminal Repeats, LTRs)包裹,后者主要发挥转录调控功能。在漫长的进化历程中,绝大多数HERVs因经历截断、插入、缺失及点突变等遗传变异而丧失了形成感染性病毒颗粒的能力。然而,其核心基因组元件,特别是LTRs,仍可作为替代性启动子或增强子元件,显著影响宿主细胞的基因表达与功能活动。
近年来,HERVs与衰老关系的研究取得了显著进展。现有研究表明,表观遗传重编程是衰老的核心特征之一,可导致HERVs的异常再激活(Reactivation)。这种现象已在多种衰老相关疾病中被广泛观察到。例如,在免疫衰老进程中,HERVs的再激活与免疫细胞功能失调密切相关,表现为免疫细胞活性下降以及炎症反应失衡。在神经退行性疾病(如阿尔茨海默病和帕金森病)中,HERVs再激活可能通过损害神经元功能及加剧神经炎症反应而加速疾病进展。此外,HERVs的再激活亦与肿瘤发生发展高度相关,其表达的病毒蛋白可能促进细胞异常增殖、抑制凋亡,且呈现一定的病种特异性。值得注意的是,当前研究仍存在局限:HERVs再激活的具体分子机制尚未完全阐明,且多数研究聚焦于特定疾病模型,缺乏系统性和跨组织的综合分析。因此,未来亟需整合多学科方法,以全面解析HERVs在衰老中的作用网络及其潜在干预靶点。
目前,关于HERVs促进细胞衰老的机制,较为主流的观点聚焦于表观遗传失调。在衰老相关的整体性DNA低甲基化及组蛋白修饰改变(如去乙酰化)作用下,原本受抑制的HERV序列得以转录,产生大量病毒RNA片段。这些异常转录本主要通过触发炎症级联反应和免疫激活来加剧细胞损伤与衰老进程。具体而言,其激发固有免疫反应的机制主要包括两种途径:1) 散在的单链RNA片段可相互结合形成双链RNA(dsRNA),通过激活细胞内RNA感受器(如MDA5/RIG-I)及其下游信号通路(如干扰素反应)诱导炎症;2) 部分病毒RNA可被逆转录为富含互补序列的单链DNA,进而退火形成双链DNA(dsDNA)或染色体外环状DNA(extrachromosomal circular DNA, eccDNA)。这些异常核酸分子可被胞质DNA感受器cGAS识别,激活cGAS-STING信号通路,导致慢性炎症反应和基因组不稳定性,共同驱动衰老表型(图2)。
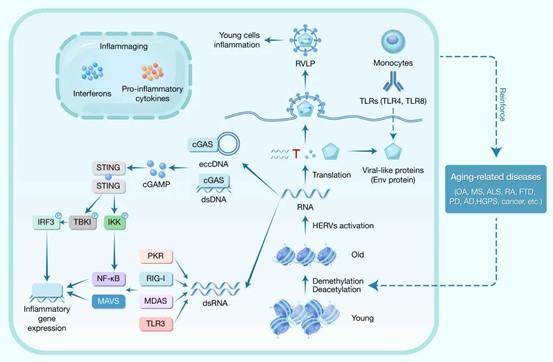
图2 人内源性逆转录病毒引发炎症衰老并加剧与衰老相关的疾病机制
特别值得注意的是,最新研究发现HERV-K家族成员保留了相对完整的病毒基因组结构,具有形成有感染性的类病毒颗粒(Retrovirus-like particles, RVLPs)的能力。这类RVLP在衰老的间充质祖细胞等特定衰老细胞类型中大量产生,并可能通过旁分泌途径感染邻近年轻细胞,激活其cGAS-STING通路,诱导“衰老样”表型扩散。此外,某些HERV编码的膜蛋白亦可被免疫细胞模式识别受体(Pattern Recognition Receptors, PRRs)识别,直接触发衰老相关的炎症反应。
针对HERVs异常激活的干预策略,目前主要沿两个方向探索:应用抗逆转录病毒药物直接抑制病毒转录本或蛋白表达;以及利用表观遗传调控手段(如DNA甲基化酶或组蛋白去乙酰化酶抑制剂)重新沉默HERVs。此外,新兴的基因编辑技术(如CRISPR-Cas9靶向沉默HERVs)及免疫调节策略(如靶向阻断HERV激活的炎症通路)也为抑制HERVs活化及其促衰效应提供了新的干预思路,有望为延缓衰老或治疗衰老相关疾病开辟新途径。
展望未来,基因编辑技术、单细胞组学、空间转录组学及免疫疗法等前沿技术的快速发展,为深入解析HERVs在衰老中的功能及其调控网络提供了前所未有的机遇。这有望极大深化我们对HERVs介导的免疫衰老等核心机制的理解,并助力发现衰老相关疾病的新型治疗靶点。同时,HERVs的特定转录本或蛋白产物亦有可能发展成为评估个体生物衰老状态或预测衰老相关疾病风险的新型分子标志物,为衰老及相关疾病的精准防控奠定基础。
作者简介
徐辰泽 博士后
第一作者
机构:复旦大学生命科学学院
研究方向:内源性逆转录病毒在衰老过程中的作用机制
崔杰 研究员
通讯作者
机构:复旦大学感染与健康研究院
研究方向:病毒演化、病毒组、内源性逆转录病毒
引用格式: Xu CZ, Zhu F, Cui J. Aging and human endogenous retroviruses. hLife 2025;
https://doi.org/10.1016/j.hlife.2025.07.002.期刊简介
hLife 由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife 聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊;2024年5月被DOAJ收录;2024年8月被Scopus收录;2024年10月入选“首都科技期刊卓越行动计划——重点英文科技期刊支持项目”;2025年6月入选北京市科委“2025年度支持高水平国际科技期刊建设-强刊提升”项目;2025年8月入选中国科学引文数据库(CSCD)核心库。
hLife实行高标准与高效率并重的同行评审机制:
投稿至给出“是否送审”决定⏰1天
投稿至给出“首轮审稿”决定⏰28天
投稿至给出“是否录用”决定⏰61天
2026年前hLife接收的稿件免收文章处理费(APC)。
https://www.sciencedirect.com/journal/hlife
https://blog.sciencenet.cn/blog-3552961-1507312.html
上一篇:[转载]hLife | 王军研究团队评述AI将点亮微生物研究的未知领域
下一篇:[转载]喜讯 | hLife入选中国科学引文数据库(CSCD)核心库