博文
[转载]hLife Community 研究进展 | 高山教授团队揭示mRNA非编码功能 重塑癌基因传统定义(Molecular
||

高山 教授
hLife 编委
东南大学首席教授,博导,英国牛津大学医学肿瘤学博士,hLife、科学通报和Science Bulletin编委。研究方向聚焦在肿瘤驱动突变鉴定、调控和免疫逃逸。以通讯作者在Mol Cell (2026), Proc Natl Acad Sci U S A (2025、2023、2022、2020), J Clin Invest (2026), Nat Commun (2025、2024), Sci Bull (2025、2024), J Exp Med (2024), Cancer Res (2025、2021、2019)等杂志发表40多篇论文。公开专利23项(3个国际PCT),获得授权11个(2个国际PCT)。
生命科学中心法则认为,DNA转录生成信使 RNA(mRNA),mRNA翻译为蛋白质,蛋白质执行生物学功能,这是生命活动的基本运行框架。相较之下,非编码RNA(ncRNA)因不编码蛋白而被长期视为主要承担调控功能。然而,近年来的大规模转录组与蛋白组联合分析发现,在生理及疾病状态下,mRNA表达水平与其对应蛋白丰度之间普遍存在显著不一致性。这一现象提示,mRNA的生物学效应并不必然完全依赖其翻译产物,传统以“蛋白功能”为核心的静态功能分类体系,可能系统性地忽视了 mRNA本身发挥独立功能的可能性。
细胞间黏附分子 1(Intercellular Adhesion Molecule 1,ICAM1)是一种经典跨膜蛋白,在肿瘤发生、发展及免疫调控中具有重要作用。既往研究表明,ICAM1在多种癌症中与肿瘤侵袭、转移和免疫逃逸密切相关,但其在不同癌种中既可表现为促肿瘤因子,也可呈现抑肿瘤效应,其功能差异背后的分子机制长期未明。
近日,东南大学生命科学与技术学院高山教授研究团队在Molecular Cell杂志发表题为“ICAM1 mRNA entraps ILF2/ILF3 to inhibit transcription of EIF4E and global protein synthesis”的研究论文(图1)。该研究突破了“mRNA仅作为蛋白翻译模板”的传统认知,首次提出并系统阐明了mRNA通过形成内源性双链RNA,作为功能性分子直接参与肿瘤调控的新机制。

图1 论文标题及作者信息
研究人员在实验中发现,利用CRISPR–Cas9技术完全敲除ICAM1蛋白可显著抑制肿瘤细胞增殖;而通过shRNA下调ICAM1 mRNA表达,却反而促进细胞生长。值得注意的是,ICAM1蛋白缺失与ICAM1 mRNA降低导致了截然相反的肿瘤表型,提示ICAM1 mRNA可能具有独立于其编码蛋白之外的生物学功能。进一步的功能实验直接证实,ICAM1 mRNA本身具有非编码抑癌作用。
机制研究表明,ICAM1 mRNA可与其顺式反义转录本ICAM1-AS在细胞核内形成稳定的内源性长双链RNA(dsRNA),并以长度依赖的方式结合具有dsRNA结合能力的转录调控复合物ILF2/ILF3。该dsRNA结构充当“分子陷阱”,阻止ILF2/ILF3与染色质DNA的相互作用。
当ICAM1 mRNA或ICAM1-AS被敲低时,ILF2/ILF3更易结合至翻译起始关键因子EIF4E的启动子区域,显著增强其转录活性,从而提升细胞整体蛋白合成水平。多项实验结果表明,ICAM1 mRNA缺失会导致全局翻译效率升高,并伴随c-MYC、CDK2等多种致癌蛋白上调;相反,维持ICAM1/ICAM1-AS形成的dsRNA结构,可抑制EIF4E介导的翻译程序,从而限制肿瘤细胞增殖。
在临床肺癌组织样本中,研究团队观察到ICAM1蛋白普遍高表达,而ICAM1 mRNA及ICAM1-AS却协同下调,呈现出显著的RNA–蛋白表达不一致性。这一现象提示,肿瘤细胞可能通过削弱ICAM1 mRNA的抑癌性非编码功能,同时保留甚至增强ICAM1蛋白的促肿瘤作用,从而获得生长优势。此外,ICAM1-AS的低表达还与ICAM1靶向抗体药物偶联物(ADC)的治疗敏感性密切相关。
综上,该研究首次提出并系统阐明了一条“mRNA–反义RNA–转录调控因子-蛋白翻译”的全新调控轴,揭示mRNA可通过形成内源性双链RNA,直接调控转录因子活性和全局蛋白合成,从而独立于其编码蛋白参与肿瘤发生发展(图2)。
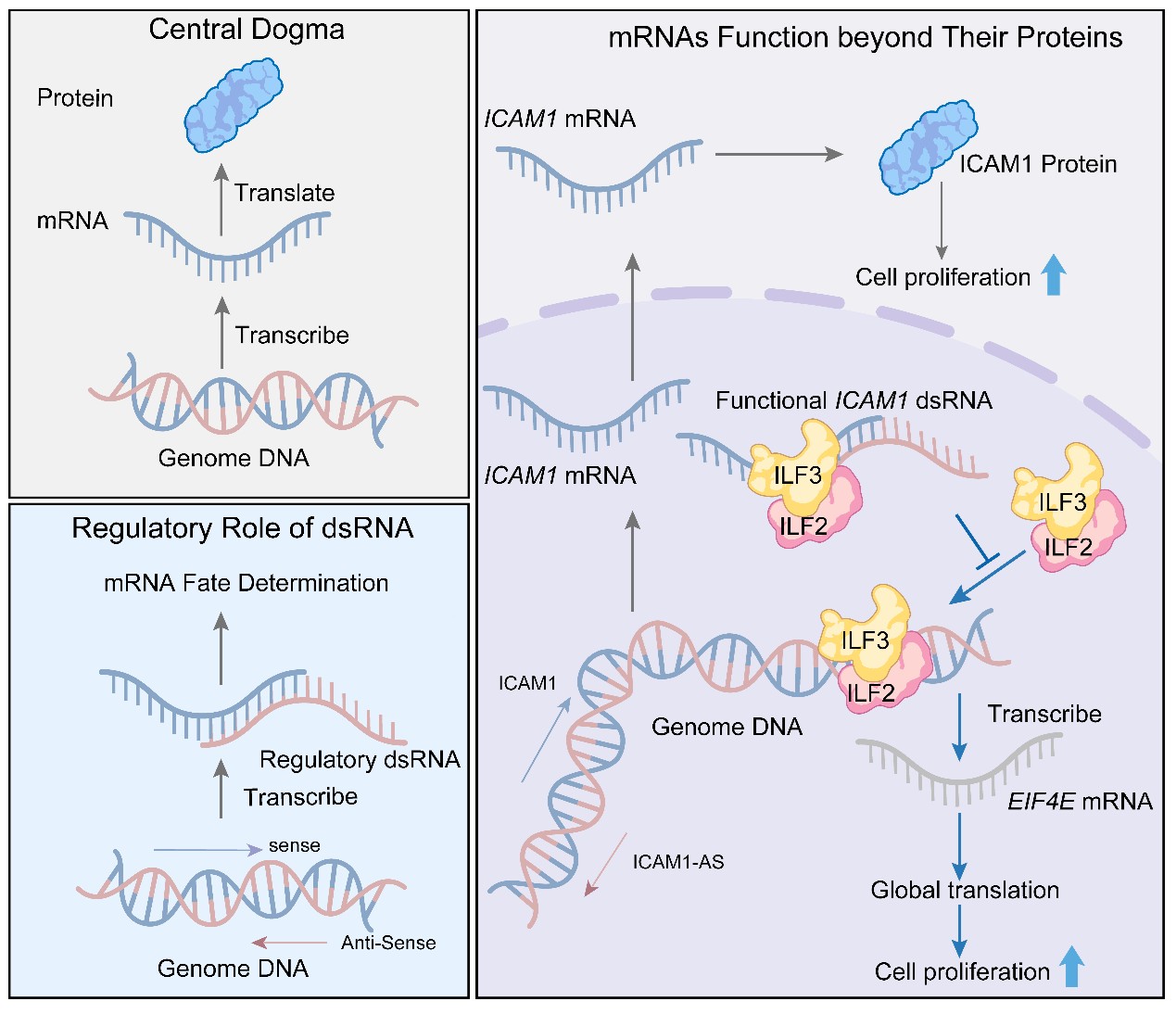
图2 ICAM1 mRNA以功能性RNA调控ILF3-EIF4E信号通路模式图
研究进一步指出, ICAM1蛋白是癌蛋白,而ICAM1 mRNA则表现为抑癌基因功能,这一发现挑战了传统癌基因的定义,也提示shRNA/siRNA介导的RNA降解策略并不能简单等同于蛋白功能缺失。该工作为理解mRNA的非编码化功能提供了全新范式,并对经典中心法则提出了重要补充与拓展。
本论文第一作者为东南大学医学院蒋思远副教授,通讯作者为东南大学生命科学技术学院高山教授。
期刊简介
hLife 由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife 聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊;2024年5月被DOAJ收录;2024年8月被Scopus收录;2024年10月入选“首都科技期刊卓越行动计划——重点英文科技期刊支持项目”;2025年6月入选北京市科委“2025年度支持高水平国际科技期刊建设-强刊提升”项目;2025年8月入选中国科学引文数据库(CSCD)核心库;2025年10月被收录为“中国科技核心期刊”(CSTPCD);2025年11月首次入选《中国英文科技期刊海外媒体传播影响力报告》并获评生物医学领域与临床医学领域Top10。hLife实行高标准与高效率并重的同行评审机制:
投稿至给出“是否送审”决定⏰1天
投稿至给出“首轮审稿”决定⏰28天
投稿至给出“是否录用”决定⏰61天
2026年前hLife接收的稿件免收文章处理费(APC)。
https://www.sciencedirect.com/journal/hlife
https://blog.sciencenet.cn/blog-3552961-1521848.html
上一篇:[转载]hLife | 精准诊断真菌感染:从技术突破到临床融合
下一篇:[转载]hLife | Call for Papers: Phage Therapy in Clinical Practice