博文
CIMB 北京理工大学董磊/夏琴课题组:基于FGFR1的药理学与生物学癌症靶向治疗
||
文章摘要与综述背景
人类成纤维细胞生长因子家族由22种因子和5种跨膜受体组成。成纤维细胞生长因子受体 (FGFR) 家族由四个主要成员组成:FGFR1、FGFR2、FGFR3和FGFR4。这些受体在脊椎动物物种中高度保守,在发育和生理过程中具有重要作用。每个FGFR都有一个细胞外结构域,包含三个免疫球蛋白样 (Ig样) 亚结构域 (D1、D2和D3)、一个跨膜螺旋和一个细胞质酪氨酸激酶结构域。与其他酪氨酸激酶受体类似,FGFR包含双叶激酶折叠,由两个主要叶组成,即N叶和C叶,它们由ATP和底物结合的裂缝隔开,从而在受体的激酶活性和调节中起关键作用。
近年来研究发现,FGFR1与胶质母细胞瘤等多种肿瘤的发生发展密切相关。FGFR1作为成纤维细胞生长因子受体家族的重要成员,介导如RAS-MAPK和PI3K-AKT等关键信号通路,对于调节细胞增殖、分化和存活等基本过程至关重要。FGFR1的变异可导致信号通路的组成性激活,从而通过促进不受控制的细胞分裂、抑制细胞凋亡并增强癌细胞的转移潜能来驱动肿瘤发生。文章回顾了FGFR1的激活机制和信号通路,并详细阐述了FGFR1异常的类型。此外,文章还对目前针对癌症中FGFR1异常的疗法进行了全面概述,为将来基于FGFR1的癌症靶向治疗提供新的视角。
文章亮点
1. 详细叙述FGFR1的激活机制与下游信号转导通路;
2. 对FGFR1的点突变、基因扩增和基因融合等变异类型进行梳理;
3. 详细综述对FGFR1变异驱动的肿瘤有良好疗效的TKI、pan-FGFR抑制剂和抗体类药物等;
4. 展望FGFR1靶向药物的未来研究方向。
文章内容
1.FGFR1的信号转导通路
FGFR1的细胞外免疫球蛋白样结构域II和III以及结构域之间的连接区域调节FGFs的配体结合特异性。例如,细胞外免疫球蛋白样结构域I和II之间的酸性氨基酸序列——酸盒 (AB) 已被证明能够共同抑制FGFR与其具有结构域I的受体的结合。细胞内结构域具有TK活性。在缺乏FGF的情况下,受体以单体形式存在,TK结构域保持磷酸化状态。在FGF存在的情况下,FGFR1二聚化形成功能性2FGF:2FGFR1复合物,激活激酶并形成转磷酸化,从而导致TK的激活和下游信号传导。
在FGFs和肝素/Klotho的存在下,FGFR1激酶以活跃的DFG Asp-in构象形成二聚体。FGF结合到FGFR的细胞外结构域,特别是D2和D3结构域及其连接区域,稳定FGF–FGFR–肝素硫酸盐复合物并促进受体二聚化。二聚化后,FGFR的激酶结构域从无活性构象 (DFG-Dout) 转变为活性构象 (DFG-Din),其中DFG基序中的天冬氨酸残基面向激活位点,促进ATP和底物的结合。随后,激活区域中的多个酪氨酸残基 (例如Y653和Y654) 发生磷酸化,进一步增强激酶活性。同时,FGFR结构域内的分子刹车 (由NEK三联体——天冬酰胺、谷氨酸和赖氨酸组成) 被释放,打破氢键网络,使激酶结构域能够采用活性构象。αC螺旋从αCout构象转变为αCin构象,其中αC螺旋中的谷氨酸与β3链中的赖氨酸形成盐桥,稳定激酶的活性位点。调节脊 (R-Spine) 的排列和催化脊 (C-Spine) 的稳定性确保ATP的结合并参与催化反应。这种构象变化使其摆脱自我抑制并使自磷酸化成为可能。激活的激酶启动下游信号级联反应,涉及细胞质适配蛋白并激活细胞内通路,如RAS-MAPK、PI3K-AKT、磷脂酶Cγ (PLCγ) 和STAT (图1)。
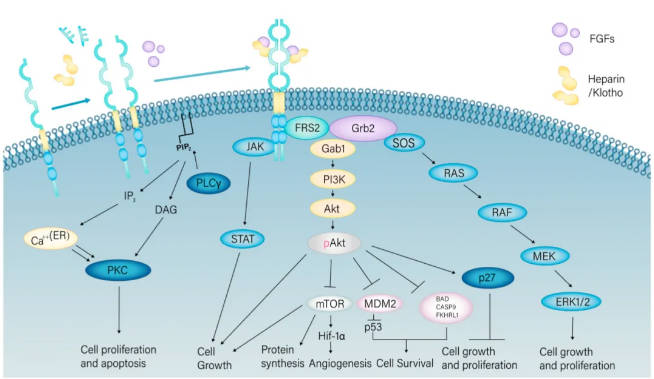
图1. FGFR1激活、信号转导通路及其分子效应。
2.FGFR1的畸变类型
FGFR1突变主要包括点突变、基因扩增、蛋白质过表达以及融合和/或重排 (图2)。点突变主要涉及激酶结构域的突变,如N546K、V561M、D647N、K656E和R661P,这些突变已在非小细胞肺癌 (NSCLC)、头颈部鳞状细胞癌和膀胱癌中观察到。FGFR1基因扩增可能导致FGFR1蛋白的过表达,但是蛋白质的过表达并不一定仅由扩增引起,FGFR1的扩增和过表达主要见于乳腺癌和胃癌。FGFR1基因融合分为I型和II型,导致FGFR1的持续激活,并在鳞状细胞癌、白血病和胶质瘤中频繁观察到。I型融合涉及用融合蛋白替代N端的非受体型蛋白;而II型融合可以进一步细分为IIa型和IIb型,IIa型融合涉及用融合蛋白替代N端的受体型蛋白,IIb型融合则涉及用融合蛋白替代C端的受体型蛋白。
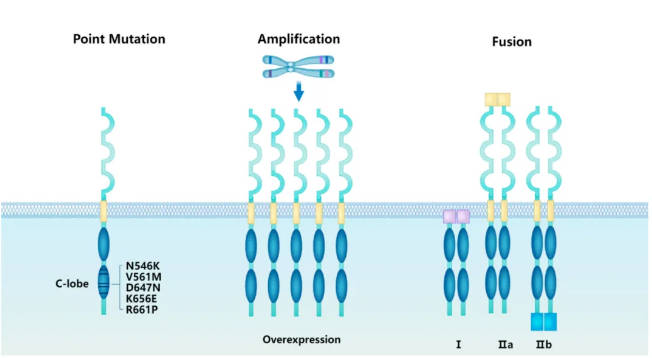
图2. FGFR1变异类型。
3.FGFR1靶向治疗和肿瘤耐药性
FGFR1相关药物可分为两大类:细胞内结构域靶向药物和细胞外结构域靶向药物 (图3)。细胞内结构域靶向药物以共价或非共价方式与FGFR1结合,与ATP竞争结合位点并抑制FGFR1活性 (表1、表2)。细胞外结构域靶向药物主要阻止FGFR1与FGF或辅因子相互作用或组织FGFR1二聚化,导致FGFR1失活。这两类靶向疗法都通过抑制FGFR1来破坏相关信号通路,最终导致肿瘤细胞死亡。临床前数据和相应的临床观察表明,旁路信号通路激活和继发性FGFR改变的发生是导致对FGFR靶向治疗产生耐药性的重要因素。
表1. 对FGFR1畸变具有疗效非选择性酪氨酸激酶抑制剂。
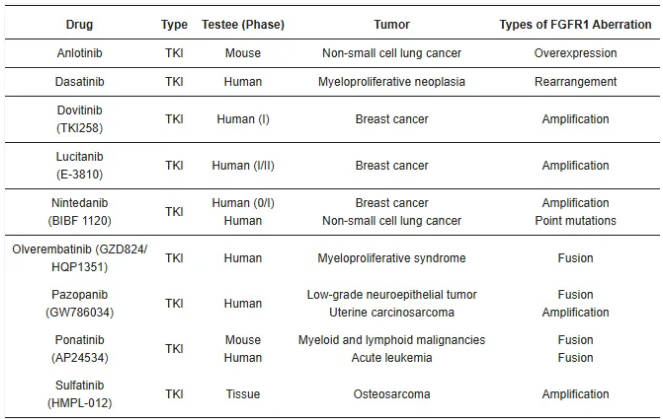
表2. 对FGFR1畸变具有疗效的选择性酪氨酸激酶抑制剂。
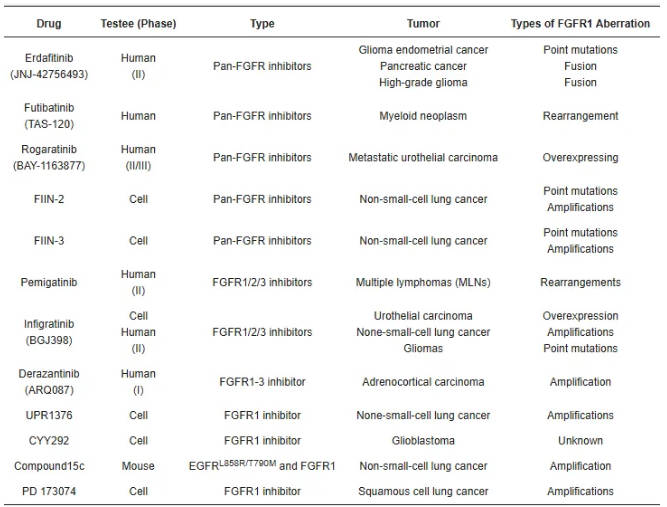
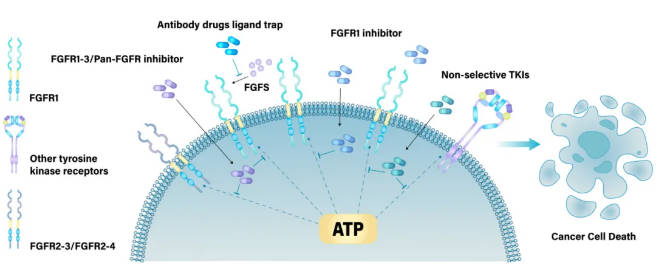
图3. 靶向FGFR1的药物种类及其作用机制。
原文出自 CIMB 期刊:https://www.mdpi.com/1467-3045/46/11/783
期刊主页:https://www.mdpi.com/journal/cimb
CIMB 期刊介绍
主编:Madhav Bhatia, University of Otago, New Zealand
期刊主题涵盖生物化学、分子和细胞生物学、分子生物物理学、分子医学, 以及化学分子研究的各个方面。
2023 Impact Factor:2.8
2023 CiteScore:2.9
Time to First Decision:15.8 Days
Acceptance to Publication:2.6 Days


https://blog.sciencenet.cn/blog-3516770-1468044.html
上一篇:Geomatics 期刊正式被Scopus收录
下一篇:Applied Sciences 论文选题灵感:材料科学与工程研究方向