博文
2024 年诺贝尔化学奖得主在 Frontiers for Young Minds 上的发文  精选
精选
||
当地时间 10 月 9 日,瑞典皇家科学院揭晓了 2024 年诺贝尔化学奖得主名单, 将 2024 年诺贝尔化学奖授予 David Baker,以表彰其在计算蛋白质设计方面的贡献,另一半则共同授予 Demis Hassabis 和 John M.Jumper,以表彰其在蛋白质结构预测方面的贡献。
早在去年,Demis Hassabis 和 John M.Jumper 曾共同为 Frontiers for Young Minds 撰文,试图向青少年解释自己所从事的蛋白形状预测工作。Frontiers for Young Minds 编辑部翻译了这篇文章,希望与更多的中国青少年一起跟随科学家的视角,走进诺奖研究。
欢迎点击链接,查看原文:
摘要
当我们十多年前开始研究人工智能(AI)时,很多人怀疑,在可预见的未来,这项技术能否能发展到产出有用成果的程度。但我们始终相信,AI 有潜力造福人类。我们通过训练 AI 系统玩国际象棋、围棋和 Atari(计算机游戏)等游戏,使其变得更聪明、更有能力。2016年,我们利用这些智能系统,尝试解决一个已经困扰科学界 50 年的生物学基本问题——蛋白质折叠问题。这就是 AlphaFold 诞生的过程。它是一种 AI 系统,可以根据蛋白质的氨基酸序列预测其三维结构。在本文中,你将了解 AlphaFold 的成就,这些成就展示了 AI 加速科学发现并造福社会的强大能力。
德米斯·哈萨比斯(Dr. Demis Hassabis)和约翰·琼珀(Dr. John Jumper)因开发了AlphaFold系统而获得 2023 年加拿大盖尔德纳国际奖。这一 AI 解决方案被认为解决了困扰科学界 50 年的蛋白质结构预测难题。AlphaFold 被用于构建人类蛋白质组最完整且最精确的图谱——人类体内所有蛋白质的集合,这具有巨大潜力推动生物学和医学研究的进展。
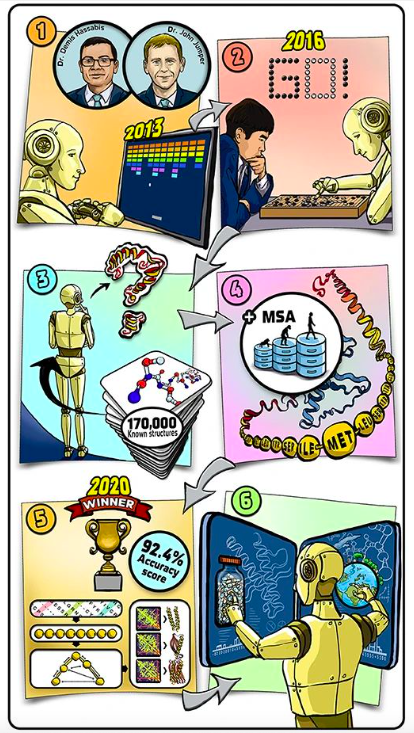
图文摘要
1. 2013 年开始,我们训练 AI 系统通关经典的电脑游戏。
2. 接着,我们让 AI 与真人进行更复杂的游戏对战,并在 2016 年,我们的系统在围棋比赛中战胜了当时的世界冠军。
3. 不久之后,我们开始着手解决蛋白质折叠问题,并训练AI系统学习已知的蛋白质结构。
4. 为了进一步训练系统,我们引入了包含蛋白质在各种群演化信息的数据库。
5. 到 2020 年,我们的系统在预测蛋白质三维结构时的平均准确率达到了 92.4%。
6. 我们希望这一系统能帮助开发新药物、解决气候变化问题的工具,并帮助科学家理解这些参与生命构造的分子机器。
小小的生命机器
你知道吗?我们体内几乎所有的过程都是由一种叫做蛋白质的小型生物机器完成的。蛋白质帮助我们视物、移动、消化食物、对抗疾病,以及完成许多其他维持我们生存和健康的基本动作。目前,科学界已经发现了超过 2 亿种蛋白质,并且新蛋白质不断被发现。
蛋白质是由叫做氨基酸的“小积木”构成的。你可以把蛋白质想象成一串珠子,其中氨基酸就是那些珠子。蛋白质是在细胞内的“工厂”——核糖体中制造的。在核糖体中,DNA 中的遗传信息会被翻译成氨基酸链。然后,令人惊叹的事情发生了——这些氨基酸链会折叠成复杂的三维结构,这些结构决定了蛋白质能够执行的功能。
50 年来的问题
自 20 世纪 60 年代初以来,科学家们一直在试图理解氨基酸链的特定序列是如何影响蛋白质三维结构的形成。这就是所谓的蛋白质折叠问题 [1]。由于蛋白质对生物体至关重要,蛋白质折叠问题被认为是生物化学中最重要的问题之一。研究任何蛋白质时,科学家可以很容易地确定该蛋白质含有哪些氨基酸,甚至可以精确到氨基酸的排列顺序。但是,多年来一直难以确定氨基酸链折叠成的最终三维结构,而这些形状才是形成有效蛋白质的关键。毕竟,蛋白质的体积太小,无法用显微镜直接观察其形状。
为了弄清蛋白质的三维结构,科学家们使用的传统方法是一种叫做 X 射线晶体学的技术(图 1)。这涉及将蛋白质结晶,即将许多相同的蛋白质“冻结”成重复的三维图案。然后使用大型机器将高能 X 射线射向结晶的蛋白质 (图 1A)。最后,研究人员通过分析 X 射线产生的图案并进行复杂的数学运算来解释结果,从而确定蛋白质的实际结构。每种蛋白质的这一过程可能需要数年时间!过去 50 年间,使用诸如 X 射线晶体学、冷冻电子显微镜和核磁共振分析等方法,已经确定了大约 20 万种蛋白质的结构,这些结构数据被存放公开数据库(蛋白质数据银行)。
尽管这个过程很成功,但显然速度太慢且成本过高,尤其是当我们想要找出超过 2 亿种已知蛋白质的结构时,这个数字是我们目前已确定结构的 1000 多倍!
那么,为什么确定蛋白质的最终三维形状如此困难呢?就像一根鞋带一样,氨基酸链可能有无数种折叠方式。即使是由 150 个氨基酸组成的小蛋白质,其可能的折叠构型也多达 10^300 种(10^300 是 1 后面有 300 个零——比宇宙中的恒星还多!)。有如此多的可能折叠方式,科学家如何在不进行诸如 X 射线晶体学那样耗时且昂贵的实验的情况下知道哪一种是正确的呢?
因此,在谷歌 DeepMind,我们决定利用人工智能的力量解决蛋白质折叠问题:计算机从示例中学习并发展出足以解决复杂问题的能力。这种方法已被证明非常有效,节省了大量时间、金钱和人力,同时还为我们提供了有关蛋白质工作方式的新见解(图1B)。
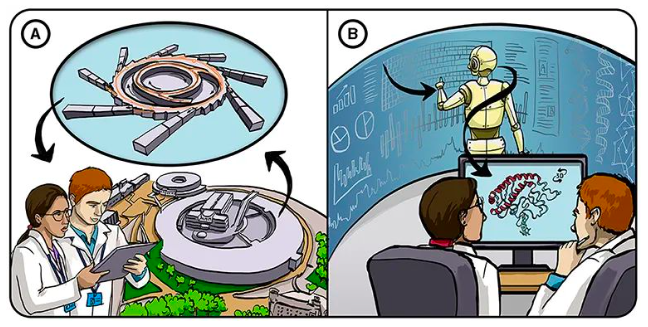
图1- 解决蛋白质折叠问题。
(A) 传统上,蛋白质的结构是通过实验确定的,这些实验利用大型昂贵的设备将 X 射线打在晶体化的蛋白质上(X 射线晶体学),然后通过复杂的数学方法解释结果。
(B) 我们在 DeepMind 的做法是利用先进的人工智能系统,使用已知的蛋白质结构和蛋白质数据库,学习预测尚未经过实验测试的蛋白质结构。此方法节省了大量时间和资源。
从游戏获胜到解决科学问题
我们在谷歌 DeepMind 的方法是将我们对人工智能的热情与对科学的热情相结合,寻找人工智能帮助人类的方法。起初,我们通过教计算机游戏规则并让其通过经验进行改进,教会了我们的系统如何玩简单的计算机游戏。我们的下一个目标是让这些系统赢得更复杂的游戏,作为解决现实世界难题的跳板。这包括训练一个 AI 模型去玩围棋,这是一种非常复杂的棋类游戏,可能的棋盘配置超过 10^170 种(比已知宇宙中的原子还多!)。几年间,我们在游戏情境中开发并测试了 AI 系统,以观察其表现并不断训练其变得更强大。2016 年,我们的系统之一 AlphaGo 击败了围棋世界冠军李世石 —— 这一成就此前被认为是不可想象的。这是一个重要的里程碑,证明我们的 AI 系统足够智能,能够应对复杂问题。
谷歌 DeepMind 在科学研究领域有着自豪的根基,因此蛋白质折叠问题对我们来说是自然而然的下一步(图 2)。在 AlphaGo 于 2016 年取得成就后不久,我们组建了一个团队,开始致力于根据蛋白质的氨基酸序列预测其结构。这个新的 AI 系统被称为 AlphaFold(图 2A)。AlphaFold 的设计目的是从公开数据库(如蛋白质数据银行)中发布的蛋白质结构信息中学习。总体上,我们可以使用大约 17 万个已知蛋白质结构来训练我们的 AI 系统。我们设计的 AlphaFold 采用类似于人脑处理信息的方式,即使用计算机科学中的一种概念 -- 人工神经网络,(想了解更多关于人工神经网络和机器学习的内容,可以阅读 Frontiers for Young Minds 的这篇文章)。像人脑一样, AlphaFold 可以通过经验学习来提升其表现。我们提供给它的蛋白质结构例子越多,它在预测新蛋白质结构时的表现就越好。
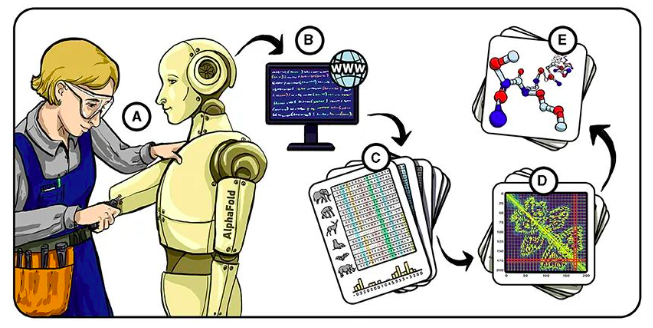
图 2 - 预测蛋白质折叠的阶段。
(A) 2016 年,我们开始构建 AlphaFold——一个解决蛋白质折叠问题的AI系统。
(B) AlphaFold 使用来自蛋白质数据库的信息训练自己,从氨基酸序列中预测蛋白质的三维结构。
(C) 我们还使用了 MSA(多个序列比对)训练 AlphaFold,MSA 是基于不同生物体中具有相似功能的蛋白质的氨基酸序列比对集合,这些具有相似功能的蛋白质理论上应该具有相似的结构。那些在序列之间“共同演化”的氨基酸(彩色列)携带着关于哪些氨基酸在三维结构中可能相近位置的重要信息。
(D) 使用这些输入信息,AlphaFold 预测每两个氨基酸之间的距离和角度。
(E) 最后,AlphaFold 将这些距离和角度转换为蛋白质的三维结构预测。
然而,即便有 17 万个例子,仍然不足以达到我们所追求的高水平性能——我们需要更多信息来训练 AlphaFold。因此,我们使用了包含蛋白质序列的开放数据库(图 2B)来构建我们所称的多序列比对(MSA,图 2C)。MSA 包含与 AlphaFold 要预测的蛋白质在演化相关的序列上相关的序列,这些序列一同包含关于结构的线索。蛋白质的形状决定了它们能执行的功能,许多生物体必须执行相同的生物功能,如在血液中携带氧气。这意味着不同生物体中所有携氧蛋白质在进化过程中可能保持相似的三维结构,即使它们的基础氨基酸序列发生了变化。为了实现这一点,意味着每当一个氨基酸在蛋白质中某个位置发生变化,另一个与它在三维结构中最接近的氨基酸也必须相应地变化,以维持原有的形状。我们将这类氨基酸称之为共同演化的氨基酸,通过将这些信息输入到 AlphaFold 中,我们让系统能够检测到氨基酸之间的隐藏关系。
一旦我们向 AlphaFold 输入了足够的信息,系统就能够预测关于蛋白质形状的基本信息,包括每两个氨基酸之间的距离(图 2D)和角度,以及预测的可信度(即预测的可靠性)。这些信息在系统内多次“循环”使用,每一轮 AlphaFold 都会改进其预测。最后,它使用关于蛋白质形状的基本概念来预测蛋白质结构中每个原子的三维位置(图 2E)。在一开始,我们测试了 AlphaFold 对已知结构的蛋白质的预测,并让 AlphaFold 通过从错误中学习不断改进自己,直到其预测变得更准确。经过训练后,我们使用相同的网络来对未知结构进行预测。
AlphaFold的进化
在 AlphaFold 的旅程中,一个令人激动的里程碑发生在 2018 年,当时 AlphaFold 在两年一度的蛋白质结构预测竞赛 CASP 中获得了第一名。AlphaFold在最难的蛋白质上得到了约 60 分(满分 100 分)[2],这比之前的最佳得分(约 40 分)有了巨大的飞跃。这让我们对AlphaFold的能力更加充满信心,并决定在下次评估中进一步改进系统。在我们下一版的系统 AlphaFold 2中,我们将更多关于氨基酸链物理和几何的科学知识整合进了系统的学习过程中,并将其与我们对蛋白质折叠问题的理解结合起来。基本上,我们教会了 AlphaFold 2 如何进行 MSA 分析,然后利用改进的 MSA 分析更好地理解蛋白质折叠(从而理解氨基酸链的物理和几何特性)。这种信息的往返流动提升了AlphaFold 2 的性能。
在 2020 年的 CASP14 结构预测竞赛中,AlphaFold 2 以惊人的 92.4 分(满分 100 分)赢得了比赛[3]。这几乎接近通过实验(如 X 射线晶体学)确定蛋白质结构的准确性,但没有高时间成本和费用。因此,AlphaFold 2 被公认为解决了一个 50 年未解的蛋白质折叠问题。
尽管这是一个伟大的成就,但这仅仅是开始。2020 年,我们发布了约 33 万个蛋白质的预测结构,到 2022 年,这一数字已超过 2 亿。随着时间的推移,我们从这些结构中获得的知识将使我们更好地理解蛋白质生物学以及蛋白质在细胞中的协作工作。这一能力将帮助许多人,从开发新药和疫苗,到通过设计新的食塑酶应对气候变化[4,5]。像 AlphaFold 2 这样的AI系统还可以加速科学发现的进程。想象一下,如果我们利用 AI 系统的强大学习能力来解决各个科学和工程领域中的难题,科学的发展速度将会有多快。这是一个非常激动人心的时代,我们鼓励大家保持关注,与我们一同踏上利用 AI 解开世界最有趣谜团的旅程!
参考文献
[1] Dill, K. A., Ozkan, S. B., Shell, M. S., and Weikl, T. R. 2008. The protein folding problem. Annu. Rev. Biophys. 37:289–316. doi: 10.1146/annurev.biophys.37.092707.153558
[2] Senior, A. W., Evans, R., Jumper, J., Kirkpatrick, J., Sifre, L., Green, T., et al. 2019. Protein structure prediction using multiple deep neural networks in the 13th Critical Assessment of Protein Structure Prediction (CASP13). Proteins 87:1141–8. doi: 10.1002/prot.25834
[3] Jumper, J., Evans, R., Pritzel, A., Green, T., Figurnov, M., Ronneberger, O., et al. 2021. Applying and improving AlphaFold at CASP14. Proteins 89:1711–21. doi: 10.1002/prot.26257
[4] Thornton, J. M., Laskowski, R. A., and Borkakoti, N. 2021. AlphaFold heralds a data-driven revolution in biology and medicine. Nat. Med. 27:1666–9. doi: 10.1038/s41591-021-01533-0
[5] Callaway, E. 2022. What’s next for the AI protein-folding revolution. Nature 604:234–8. doi: 10.1038/d41586-022-00997-5
致谢
感谢诺亚·塞格夫(Noa Segev)为本文基础进行采访并共同撰写文章,感谢伊里斯·加特(Iris Gat)提供图表。
术语表
蛋白质:微小的生物机器,负责在我们体内执行大部分功能。
氨基酸:构成蛋白质的基本单元。
蛋白质折叠问题:1960 年代提出的一个科学问题,探讨如何根据蛋白质的氨基酸序列预测其三维结构。
X 射线晶体学:一种利用 X 射线确定蛋白质三维结构的实验方法。
人工智能:计算机像人脑一样学习并模仿人类智能的能力。
多序列比对(MSA):来自不同生物体的蛋白质的氨基酸序列,这些蛋白质由于具有相似的功能,应该具有相似的结构。
利益冲突声明:DH 和 JJ 受雇于 Google DeepMind。
上下滑动阅读更多内容
少年审稿人介绍
GO TEAM,年龄:15岁
我们的评审团队叫做 GO TEAM,由来自多个教育中心的 15 岁青少年组成。他们充满活力,渴求知识,热爱科学。他们的爱好包括足球和游泳等运动。
NEEL,年龄:12岁
嗨,我叫 Neel。我的爱好是学习和制作飞机和汽车模型。我将来想成为一名航空航天工程师。
UMA,年龄:15岁
嗨,我叫 Uma。我的爱好是跆拳道和钩针编织。我将来想成为一名工程师。
作者介绍
Demis Hassabis
Demis Hassabis 是 Google DeepMind 的联合创始人兼首席执行官,DeepMind 是全球领先的人工智能研究团队之一。自2010年成立以来,始终处于该领域的前沿,推出了诸如AlphaGo、AlphaFold等具有里程碑意义的研究突破。AlphaGo 是第一个击败围棋世界冠军的程序,而AlphaFold 解决了持续 50 年的蛋白质折叠这个重大挑战。Demis 在国际象棋和编程方面是天才,13岁时达到大师水平,17 岁时编写了经典的AI模拟游戏《主题公园》。他以是双重一级荣誉从剑桥大学计算机科学专业毕业,创立了创新的视频游戏公司 Elixir Studios,并在UCL完成了关于记忆和想象过程的认知神经科学博士学位。他的作品被引用超过 10 万次,并在《科学》杂志的年度十大突破中出现过五次。他是英国皇家学会和皇家工程院的院士。2017 年,他被列入《时代》百大影响力人物榜单,2018 年被授予大英帝国司令勋章。
JOHN JUMPER
在 DeepMind,John Jumper 领导开发将机器学习应用于蛋白质生物学的新方法。John 在芝加哥大学获得化学博士学位,期间开发了用于模拟蛋白质动力学的机器学习方法。在此之前,他在 D.E. Shaw Research 从事蛋白质动力学和过冷液体的分子动力学模拟工作。他拥有剑桥大学的物理学硕士学位,以及范德堡大学的物理和数学学士学位。2021年,他被《自然》杂志评为推动科学发展的10位人物之一。John 和 Demis Hassabis 共同获得了2023年生命科学突破奖。
活动预告
11 月初,我们将开启 Frontiers for Young Minds 首批中国地区少年审稿人的招募。如果您或您身边的 8-15 岁青少年有意参加,请一定要留意我们最近的推送哦。
关于 Frontiers for Young Minds
Frontiers for Young Minds 期刊于 2013 年创刊。截止目前,有 30 位诺贝尔奖得主参与文章撰写,大约 8,000 名青少年审稿人参与评审,约 650 名科学导师指导他们的审稿流程。这些经青少年审阅发布的文章,收获了来自 230 余个国家/地区超 3900 万次浏览。

Frontiers for Young Minds 发布的所有研究都基于坚实的循证科学研究,包含神经科学与心理学、地球科学、天文与物理、人体健康、生物多样性、数学与经济、化学与材料、工程与技术等多个版块。
END
Frontiers 总部位于瑞士,是全球领先的开放获取(Open Access)出版商,致力于使科学在全球范围内更加开放,其发布的研究文章已被浏览和下载超过 28 亿次。欲了解更多详情,欢迎访问 Frontiers 官方网站:www.frontiersin.org.
https://blog.sciencenet.cn/blog-3465500-1458026.html
上一篇:退休不退脑!三个探索防控痴呆症的前沿专刊
下一篇:新文速递 | Frontiers in Plant Science 最新发表文章速览(一)
